La metformina es un antidiabético oral frecuentemente utilizado en el tratamiento de la diabetes mellitus tipo 2. En un 5-20% de los pacientes provoca trastornos gastrointestinales inespecíficos. Son mucho más raros otros efectos secundarios de mayor envergadura, como la acidosis láctica. Se han documentado algunos casos aislados de hepatotoxicidad por este fármaco. Presentamos el caso de un paciente con síndrome constitucional y alteración de la bioquímica hepática atribuible a hepatotoxicidad por metformina, tras descartarse mediante múltiples estudios una etiología tumoral y observarse una resolución completa del cuadro con la suspensión del fármaco.
Metformin is an oral antidiabetic agent frequently used to manage type II diabetes. This drug produces nonspecific gastrointestinal symptoms in 5-20% of patients and, more rarely, has also been associated with severe adverse effects such as lactic acidosis. Only a few isolated cases of hepatotoxicity due to this drug have been documented. We report the case of an 83-year-old man with constitutional syndrome and hepatic biochemical alterations, which were attributed to metformin after ruling out an oncologic etiology and observing complete clinical and biochemical resolution after withdrawal of the drug.
La metformina es un antidiabético oral de la familia de las biguanidas, utilizado frecuentemente para el control glucémico de los pacientes con diabetes mellitus tipo 2. Actúa disminuyendo la gluconeogénesis hepática, así como potenciando la acción periférica de la insulina. Entre sus efectos secundarios más frecuentes se encuentran los trastornos gastrointestinales (5-20%), como náuseas, vómitos, anorexia o diarrea. Mucho menos común, pero de mayor relevancia clínica, es el déficit de absorción de vitamina B12, el desarrollo de insuficiencia renal o la producción de acidosis láctica1. Se han descrito de manera excepcional reacciones hepatotóxicas por este fármaco2–7 que parecen responder a un mecanismo idiosincrásico. Presentamos el caso clínico de un varón de 83 años de edad, con diabetes mellitus tipo 2 de reciente comienzo, que desarrolló un cuadro de toxicidad hepática secundario al tratamiento con metformina. El paciente, que consultó por un notorio síndrome constitucional, presentaba alteraciones en el perfil hepático de predominio colestásico; además, en el estudio iniciado a causa del síndrome constitucional destacaba un antígeno carbohidrato Ca 19-9 elevado, lo que afianzó la sospecha de un cuadro neoplásico subyacente. Sin embargo, tras descartar una enfermedad tumoral, y una vez comprobada la resolución clínica y analítica del cuadro con el abandono de la metformina, se pudo establecer la reacción de hepatotoxicidad por dicho fármaco.
OBSERVACIÓN CLÍNICAVarón de 83 años de edad, con antecedentes de diabetes mellitus recientemente diagnosticada, cardiopatía hipertensiva y fibrilación auricular crónica, que acudió a su médico de atención primaria por un cuadro de 3 meses de evolución de astenia, hiporexia, pérdida de 10 kg de peso y alteración del ritmo intestinal. A su tratamiento habitual (acenocumarol, digoxina, torasemida, irbesartán, atenolol y simvastatina) se había añadido metformina (850 mg/12 h) 14 semanas antes.
El paciente negaba la aparición de dolor abdominal, fiebre o vómitos. Describía un aumento de su número habitual de deposiciones, aproximadamente 5-6 al día, de consistencia blanda y color amarillento sin productos patológicos. No había presentado acolia, coluria, prurito ni datos de diátesis hemorrágica.
No había realizado viajes recientemente, ninguno de sus familiares presentaba sintomatología similar y no había recibido otros fármacos distintos de los antes indicados, ni productos de herbolario o sustancias tóxicas. En la exploración física destacaba un tinte ictérico en las escleróticas. La auscultación cardíaca era arrítmica, con un soplo sistólico en foco aórtico; la auscultación pulmonar era rigurosamente normal. El abdo- men era blando, depresible, sin organomegalias, no doloroso a la palpación superficial ni profunda. Las extremidades inferiores no presentaban edemas ni datos de insuficiencia venosa o de trombosis.
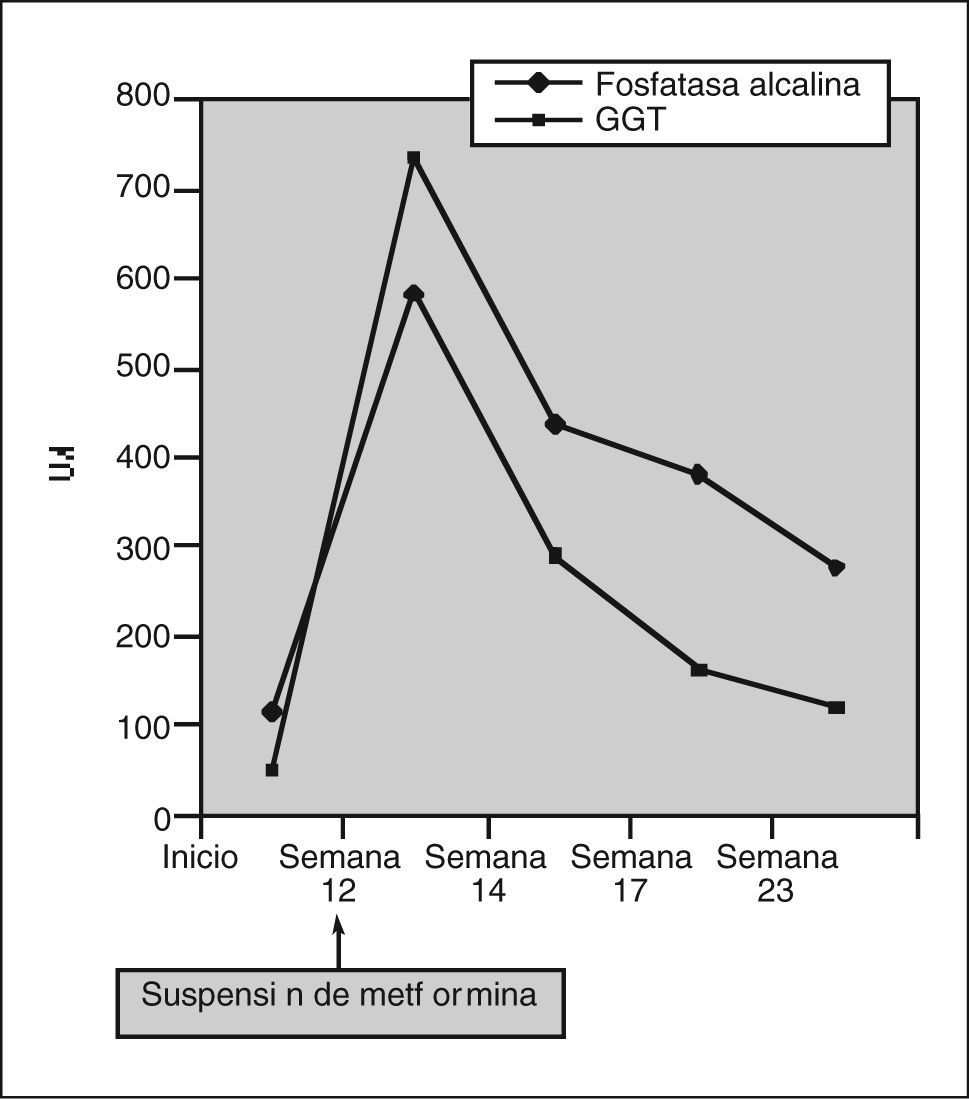
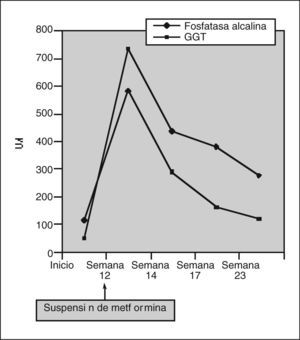
Se detectó un perfil hepático alterado con patrón de colestasis: GOT 36 U/l (valores normales, 4-50), GPT 47 U/l (5-40), bilirrubina total 2,30 mg/dl (0,20-1,20), GGT 740 U/l (10-50), fosfatasa alcalina 586 U/l (53- 128). El hemograma era normal, y la coagulación mostraba un índice normalizado internacional alargado, como correspondía a su tratamiento con acenocumarol, con un fibrinógeno elevado: 978 mg/dl (150-400).
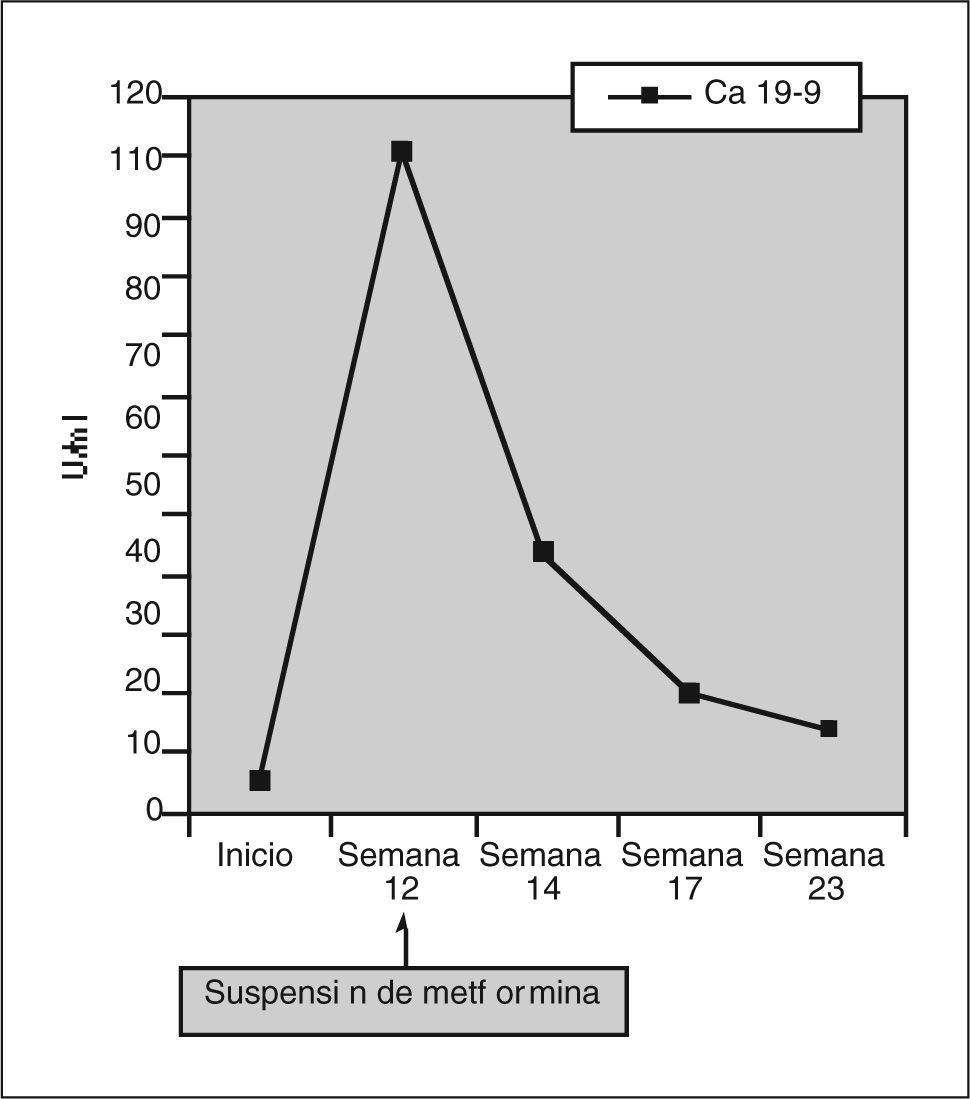
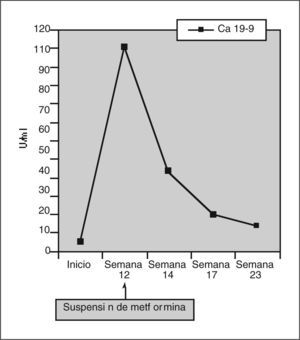
Destacaba una ferritina de 1.027 ng/ml (14-179), un antígeno carcinoembrionario de 7,7 ng/ml (valor normal hasta 3,4, y en fumadores o enfermedades digestivas benignas hasta 10), y un Ca 19-9 de 110,8 U/ml 0-37). El proteinograma, la transferrina y el hierro sérico, el cobre y la ceruloplasmina estaban en los límites normales. Los anticuerpos antinucleares (ANA) y los no organoespecíficos (ANOE), así como los virus hepatotropos fueron negativos.
En la ecografía de abdomen se puso de manifiesto una esteatosis hepática difusa de grado I, sin demostrarse lesiones focales, y una vesícula escleroatrófica con vía biliar intra/extrahepática y porta normales. El páncreas no se visualizaba correctamente.
Dada la reciente presentación diabética, el cuadro constitucional, el perfil hepático de colestasis y la elevación de ferritina y marcadores tumorales, se inició un amplio estudio para valorar un proceso oncológico subyacente como primera posibilidad diagnóstica.
En la tomografía computarizada (TC) abdominal no se encontraron hallazgos patológicos. En la colangiorresonancia magnética, el hígado, la vesícula, la vía biliar y el páncreas se mostraban sin alteraciones destacables.
Se solicitó una colonoscopia (debido a los cambios en el ritmo intestinal), en la que únicamente se detectaron 2 pequeños pólipos sésiles que se extirparon con asa de polipectomía. En el estudio anatomopatológico se describieron como adenomas tubulares.
Dos semanas después de la primera visita el paciente fue revisado en la consulta, encontrándose ya asintomático: su ritmo intestinal había vuelto a la normalidad, había recuperado el apetito y había desaparecido la intensa astenia y el malestar general. Reconoció haber dejado de tomar la metformina 10 días antes, a pesar de lo cual había mantenido un control aceptable de las cifras de glucemia sólo con tratamiento dietético. El paciente fue controlado en nuestra consulta durante los 4 meses siguientes, manteniéndose asintomático con una progresiva normalización de las alteraciones de la bioquímica hepática, así como de los marcadores tumorales hasta alcanzar los rangos de referencia habituales (figs. 1 y 2)
DISCUSIÓNEl paciente describía claramente cómo sus síntomas habían comenzado apenas 10 días después de iniciar el tratamiento con metformina. No se habían realizado otras modificaciones terapéuticas y negaba haber tomado hierbas medicinales. Se insistió especialmente en los productos de herbolario (como el Copalchi, conocido entre muchos pacientes diabéticos por sus propiedades hipoglucemiantes) ya que, a pesar de que la población en general los considera inocuos, se han descrito múltiples reacciones hepatotóxicas a este producto e incluso necrosis hepáticas masivas8.
El cuadro constitucional y el predominio de enzimas de colestasis, junto con la discreta elevación de marcadores tumorales (fundamentalmente el Ca 19-9), provocaron que inicialmente se orientara el estudio hacia una enfermedad oncológica, y dada la reciente presentación diabética, se pensó en una neoplasia pancreática.
El hecho de que distintas técnicas de imagen (ecografía, TC, resonancia magnética) descartaran organicidad, y la sorprendente evolución clinicoanalítica del paciente coincidiendo con el abandono del tratamiento antidiabético, hizo que se replanteara el estudio.
El primer paso para poder establecer el diagnóstico de hepatotoxicidad por un fármaco es la sospecha clínica. El argumento cobrará fuerza si previamente se han descrito reacciones similares con dicho fármaco. Para averiguar esto se realizó una revisión de la literatura médica en Pubmed bajo los términos «metformin», «hepatotoxicity » y «holestasis», en la que se encontraron 6 casos de hepatotoxicidad por metformina publicados desde 19912– 7. Se trata de 5 hepatitis colestásicas y una colestasis leve7; las alteraciones del perfil hepático se manifestaron entre 2 y 6 semanas tras la introducción del fármaco y en todos los casos se resolvieron con la suspensión de la metformina.
Otro requisito para establecer la hepatotoxicidad es una secuencia temporal compatible. En el caso de las reacciones idiosincrásicas lo habitual es que se manifiesten entre una semana y 3 meses tras la administración del fármaco, como sucedió en el paciente de nuestro caso clínico. Asimismo, la rápida mejoría del perfil hepático tras la suspensión del fármaco es muy sugestiva de hepatotoxicidad9,10. Una premisa fundamental es la exclusión de otros cuadros que justifiquen las alteraciones del perfil hepático. En este caso las principales causas de hepatopatía se descartaron con la obtención de serologías negativas para virus hepatotropos, los valores normales de hierro, cobre, ceruloplasmina, alfa 1-antitripsina y ANA y ANOE, y con las distintas pruebas de imagen realizadas10. Dada la buena evolución del cuadro, no se consideró necesaria la realización de biopsia hepática.
Hay varias escalas generales diseñadas para evaluar la probabilidad de una determinada reacción adversa medicamentosa. Una de las más conocidas es el algoritmo de Naranjo11, según la cual nuestro caso clínico sumaría 7 puntos, lo que convierte la reacción adversa en «probable ». Sin embargo, esta escala tiene escasa reproducibilidad, y no se considera válida para evaluar la hepatotoxicidad12. Por el contrario, la escala de CIOMS/RUCAM (Council for the International Organization of Medical Sciences/Roussel Uclaf Causality Assessment Method)13, que fue creada específicamente para evaluar la causalidad en hepatotoxicidad, se considera actualmente de elección14. Aplicando dicha escala, obtendríamos 9 puntos, lo que convierte a la reacción adversa hepatotóxica en «altamente probable o definida».
El antígeno carbohidrato Ca 19-9 es un marcador tumoral con elevada sensibilidad (79%) y especificidad (82%) en el diagnóstico y el seguimiento de neoplasias pancreáticas15. Su elevación (valores por encima de 40 U/ml) en el contexto de un cuadro clínico compatible, como el de nuestro paciente, obligan a descartar la presencia de dicho tumor. Hay que tener en cuenta que la colestasis en sí (aun siendo de origen no maligno) modifica su valor. Por ello, deberían interpretarse con cautela las elevaciones moderadas de este marcador tumoral en caso de colestasis concomitante16. Se considera que en dichas situaciones el punto de corte para obtener una especificidad aceptable (87%) sería en torno a 300 U/ml15.
El descenso del Ca 19-9 que experimentó nuestro paciente, de forma paralela a la normalización del perfil hepático tras la suspensión de la metformina, permite interpretar su elevación como un falso positivo en relación con la colestasis.
La metformina es un fármaco muy utilizado para el tratamiento de la diabetes mellitus tipo 2. Hasta ahora sólo se habían publicado 6 casos de hepatotoxicidad atribuidos a este fármaco, ninguno de ellos en España, por lo que nos parece de especial interés la comunicación de este nuevo caso.