El aborto recurrente es un síndrome de importancia creciente en la práctica clínica. Su frecuencia es de un 1–5% en la población general. Un estudio cuidadoso y sistemático que incluya las diferentes etiologías es clave para su investigación y tratamiento. Aún no se conocen todas las posibles etiologías. Un grupo importante de ellas está todavía en fase inicial de investigación y comprensión. En este artículo se presenta una revisión de las diferentes etiologías, haciendo énfasis en su diagnóstico y enfrentamiento clínico.
Recurrent miscarriage represents a medical dilemma now recognized as a syndrome. The actual prevalence of this condition is between 1–5% of the general population. A careful and systematic approach to evaluate the different etiologies plays a key role in their clinical identification and treatment. Today we do not know all the possible etiologies, Many of them are still in the preclinical definition phase. We present a review of the current understanding of the different etiologies with emphasis in their diagnosis and clinical significance. We propose a stepwise clinical approach.
En Chile, se define aborto como la pérdida de un embarazo antes de las 22 semanas de gestación o antes que el feto alcance 500g de peso (en otros países se considera hasta las 20 semanas) (1). Se estima que el 30% de todos los embarazos termina en aborto. Un 20% ocurre en forma subclínica (antes de evidenciarlo con ecografía) y un 10% luego de su detección clínica. La pérdida reproductiva recurrente es una entidad menos comprendida, en parte por definiciones aún variables. Clásicamente, se define Aborto Recurrente (AR) como la pérdida de tres o más embarazos clínicamente reconocidos en forma consecutiva. Se excluyen embarazos ectópicos y embarazos molares. Esto ocurre en aproximadamente un 1% de la población. Sin embargo, otros lo consideran como dos o más abortos, esta forma es más frecuente y le ocurrirá aproximadamente a un 5% de la población (2,3). Al respecto, existen dos estudios que incluyeron un número superior al millar de pacientes, en los cuales se subdividió a las pacientes en grupos, de acuerdo a su etiología y al número de abortos y se observó en forma clara que ésta no se modifica según se estudien parejas con dos, tres o más de tres abortos. Esto ha hecho que cada vez más grupos consideren que el estudio del AR debe ser iniciado con la historia de dos abortos consecutivos (4,5). Esto es muy relevante en parejas en que la mujer tiene más de 35 años o dificultades para embarazarse, en quienes un enfrentamiento precoz y oportuno puede salvar el embarazo. Hoy, la escuela americana define como Aborto Recurrente a dos abortos consecutivos, en tanto, la europea considera tres abortos consecutivos para referirse a la condición de recurrencia y por ende, susceptible de investigación clínica etiológica (2,3,6). La Organización Mundial de la Salud (OMS), lo define como la pérdida espontánea de dos o más embarazos clínicos y es la definición que consideramos más apropiada (7). En la actualidad hasta en un 60% de las veces la causa es desconocida (2,3).
Factores epidemiológicosLa edad materna-paterna y el número de abortos previos son los factores más poderosos de riesgo de aborto. La edad materna avanzada (llega a un 51 % para el intervalo de 40–44 años) ha sido asociada a una deficiencia en el número y calidad de los ovocitos. La edad del padre es importante en parejas en que ambos son mayores de 35 años de edad o cuando la edad paterna es mayor de 40 años. La historia reproductiva previa es un predictor independiente. En la medida que aumenta el número de abortos previos, el riesgo de un siguiente aborto aumenta, llegando a aproximadamente un 40% luego de tres abortos consecutivos (6). La participación de otros factores de riesgo es controversial dada la dificultad para aislar la presencia de variables confundentes. Si bien el tabaco, la cafeína y el alcohol han sido vinculados a aborto en forma dosis-dependiente, la evidencia ha sido considerada aún insuficiente (6). Estudios recientes, han vinculado la obesidad con un mayor riesgo de aborto recurrente: [(0.4%[IMC 30 o más] versus 0.1% [IMC 25–29]); razón de oportunidad (OR): 3.51; intervalo de confianza (IC) 95%, 1.03–12.01)] (8).
Anomalías citogenéticasHan sido asociadas a aborto. Al realizar un cariograma al tejido embrionario en pacientes con abortos esporádicos, se observa que un 45% de ellos (IC 95% 38–52) presenta anormalidades. En cambio, en pacientes con AR, sólo un 39% (IC 95% 29–50) de las veces existe una anormalidad. De ellas, alrededor de un 85–90% corresponden a aneuploidias, que se relacionan con una edad materna avanzada. Estas anormalidades ocurren más frecuentemente durante la gametogénesis o desarrollo embrionario temprano. Sin embargo, la frecuencia de anormalidades cromosómicas es menor, a medida que aumenta el número de abortos, invocándose otras etiologías.
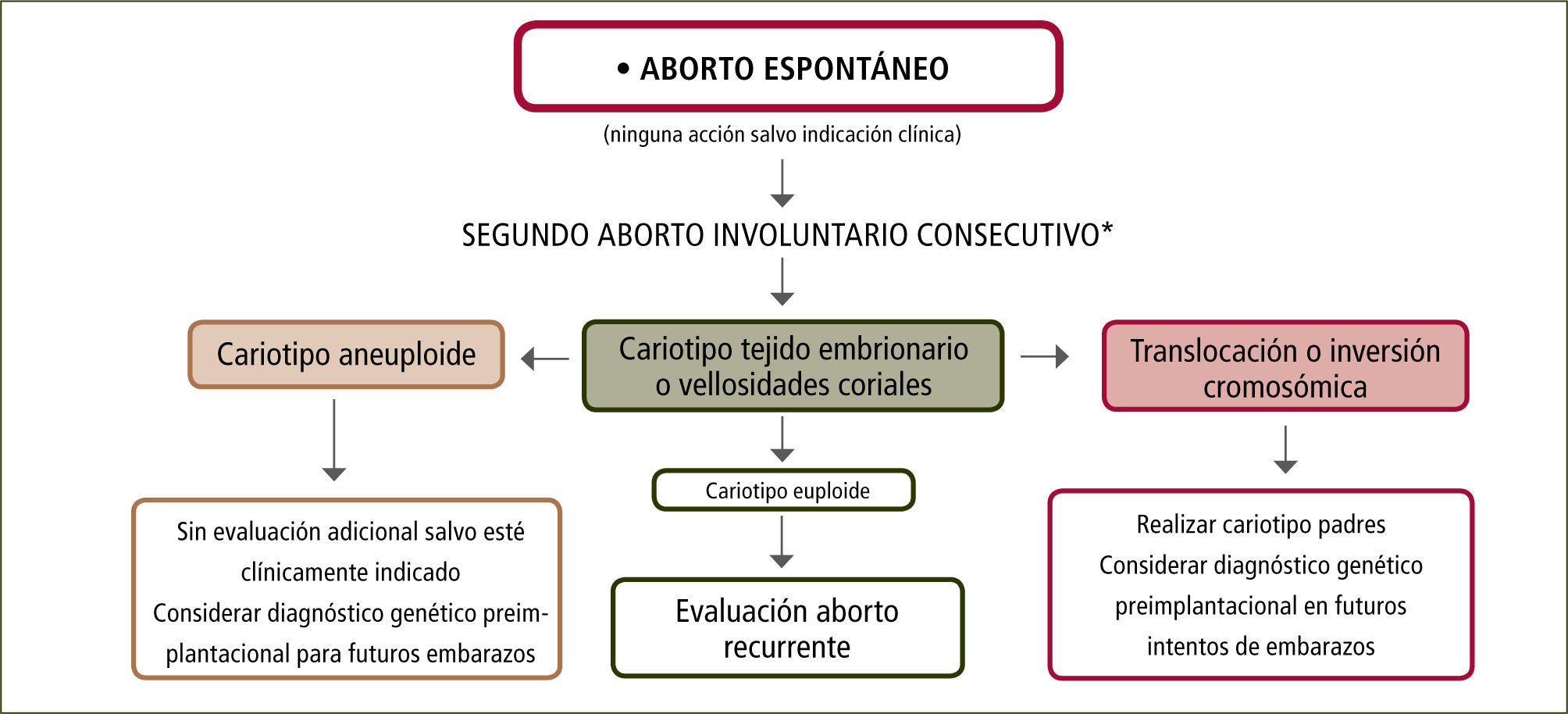
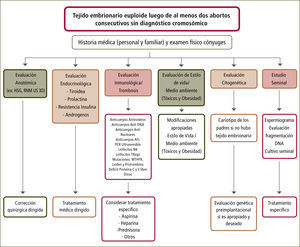
En general, la alteración cromosómica se presenta en el AR temprano (<10sem) (9). Su evaluación es importante puesto que dependiendo de si el cariograma evidencia euploidia, aneuploidia o translocaciones, el esquema para seguir avanzando en el estudio sufrirá modificaciones (figura 1). No debe olvidarse que siempre existe la opción de contaminación con tejido materno al encontrar un cariograma 46, XX normal (falso negativo). Si se detectan translocaciones en el tejido embrionario, ambos progenitores deben ser evaluados, para saber quién es el portador, dado que las translocaciones recíprocas balanceadas o las Robertsonianas (que involucran cromosomas acrocéntricos homólogos o no homólogos respectivamente), se observan en un 2–5% de las parejas con AR. Existen translocaciones no letales que resultan en personas con discapacidad (9–11). Esto depende del cromosoma involucrado y de la cantidad de material genético translocado. El consejo genético es importante para el manejo clínico. Asimismo existen opciones para el diagnóstico fetal de la condición de ”portador”, con análisis de tejido placentario o líquido amniótico. También se pueden considerar otras opciones de tratamiento que involucran diagnóstico genético pre-implantacional en el embrión, para transferir embriones sanos, o bien se puede considerar el reemplazo o ”donación” de gametos para aquel progenitor afectado. Los resultados de estas aproximaciones no han sido reportados en profundidad. Existen además, otras causas genéticas no cromosómicas. El empleo de hibridación genómica comparativa (que no detecta las translocaciones por lo que no excluye al cariograma), permitirá ampliar las categorías diagnósticas y establecer manejos específicos (10). Hoy, su empleo adiciona un 5% de anormalidades a las detectadas por el cariograma por lo que, se deben esperar avances tecnológicos y una mejor documentación de las alteraciones descritas, antes de considerar su utilización. Cuando hay aneuploidias en forma reiterada, el diagnóstico cromosómico pre-implantacional ha sido sugerido como una manera de reducir su ocurrencia (figura 1).
Anomalías congénitas y patología uterinaDiferentes revisiones sistemáticas indican una prevalencia de anormalidades estructurales congénitas uterinas en la población general de un 4.3% (2.7–16.7%). En contraste, en pacientes con AR se ha reportado un porcentaje mayor, 12.6% (1.8–37.6%) (3).
Aquellas de mayor relevancia incluyen al útero unicorne, didelfo, bicorne, septado o arcuato. Son en general detectados con ecografía transvaginal y confirmadas con histerosalpingografía, ultrasonido 3D, o resonancia nuclear magnética. Al respecto, sólo se informan los resultados de embarazos con tratamiento de útero septado en el que la tasa de recién nacido vivo es de un 83.2% (77.4–90.9%). Sin embargo, no existen estudios prospectivos aleatorizados y controlados con esta patología corregida. Recientemente se han reportado dos estudios. El primero, en una cohorte de 665 pacientes con AR, se evidenció una frecuencia de 13,1% de anomalías uterinas congénitas, con diagnóstico hecho por histerosalpingografía y confirmación con laparoscopía-histeroscopía. La mayor frecuencia correspondió a útero septado (53%), arcuato (33%) y bicorne (11%). Al comparar pacientes con AR con y sin anomalías uterinas, se vio que aquellas con anomalías uterinas tienen tasas de aborto preclínico mucho menores (10 vs 30%). Estas anomalías se asocian con aborto de segundo trimestre (12,13). Estudios retrospectivos muestran que sólo un 50% de los embarazos en mujeres con anomalías uterinas no tratadas llegan a término. Esta tasa se relaciona directamente con el grado de anormalidad de la cavidad uterina. Por ello, la mayor parte de los centros, recomiendan una evaluación de la cavidad uterina en pacientes con AR. Se debe tener presente que este subgrupo de pacientes puede presentar además anormalidades vasculares uterinas, que limiten la adecuada implantación o bien puede existir una incompetencia cervical primaria, por lo que se sugiere un seguimiento ultrasonográfico de las características del cérvix y de la perfusión uterina en el embarazo. Respecto de otras anomalías estructurales como Síndrome de Asherman (sinequias uterinas), miomas y pólipos hay controversia; la recomendación es realizar el tratamiento de aquellas condiciones de la cavidad uterina que sean consideradas significativas. En el contexto de AR asociado a una anomalía uterina no corregible, se puede considerar la surrogación uterina, tratamiento controversial que no se realiza en forma universal. Recientemente el transplante de útero ha sido sugerido como una forma de tratamiento de esta condición.
Factores infecciososEs conocida la asociación entre viremia, bacteremia y aborto, pero no es tan claro su rol en la génesis del AR. Hay datos que sugieren algún rol sólo en el 4% de las pacientes con AR, ya que se requiere de una persistencia asintomática de la infección en el tracto genital. Tampoco hay evidencia definitiva para TORCH o listeria. Respecto de vaginosis o infección cervico vaginal, gérmenes como Mycoplasma Urealitycum, Hominis o Clamidia han sido reportados como factor de riesgo de aborto en el segundo trimestre y parto prematuro. En abortos tempranos la evidencia no es consistente. No hay datos en población con AR previo, de segundo trimestre. En un reciente metaanálisis de 12 estudios y 3.200 pacientes la vaginosis bacteriana se asoció con un riesgo significativamente mayor de aborto preclínico (Riesgo Atribuible, RA 2.36, IC 95%: 1.24–4.51), pero no se encontró mayor frecuencia de aborto en el primer trimestre (RA 1.20, IC 95%: 0.53–2.75) (14). Al estudiar vaginosis bacteriana en otra cohorte de alrededor de 2.000 pacientes, a las 10 semanas de gestación, los resultados mostraron que hay una asociación con aborto de segundo trimestre (Riesgo Relativo, RR) de 2.49, IC 95% 1.13–5.48. Niveles bajos o ausencia de flora vaginal normal (Lactobacillus sp), también aumentaron el riesgo de aborto en el segundo trimestre, RR 1.32, IC 95% 1.10–1.64; y 2.30, IC 95% 1.09–4.85 respectivamente, lo que enfatiza el rol de la flora vaginal normal en el control o prevención de las infecciones vaginales (15). Aún falta información respecto de población conAR evaluadas en forma sistemática para este subgrupo etiológico.
Factores endocrinosAnormalidades tiroideasHan sido asociadas con AR. El hipotiroidismo clínico, pero también aquel subclínico sin tratamiento, han sido relacionados con resultado obstétrico adverso (incluyendo AR y preeclampsia), así como una mayor mortalidad perinatal. Estos resultados se podrían revertir con una suplementación tiroidea adecuada. Esto en el contexto de mujeres sanas con anticuerpos antitiroideos elevados o mujeres sin anticuerpos presentes pero con altos niveles de Hormona Estimuladora de Tiroides (TSH). Sin embargo, no hay una relación título-dependiente entre los niveles de anticuerpos y la presencia de AR. Revisiones sistemáticas recientes indican que la existencia de anticuerpos anti-peroxidasa aumenta el riesgo de aborto esporádico, RA 3.73 (IC 95% 1.8–7.6) y recurrente RA 2.3 (IC 95% 1.5–3.5) en forma significativa. Asimismo cuando los niveles de TSH en el primer trimestre del embarazo están sobre 2.5mIU/L se dobla el riesgo de aborto. Sin embargo, el real significado de la disfunción tiroidea y su reversión en la prevención del AR no está plenamente establecida (16,17).
Ovario poliquísticoHa sido asociado a AR en un 8–10%. Su mecanismo es posiblemente múltiple pues convergen elevados niveles de Hormona Luteinizante (LH) y andrógenos, una maduración inadecuada de ovocitos, resistencia a la insulina, obesidad y anormalidades vasculares funcionales, que limitan la implantación. Su tratamiento es fundamentalmente preconcepcional con énfasis en establecer un Índice de Masa Corporal adecuado, compensar el trastorno metabólico y la resistencia a la insulina, para luego estimular la ovulación. En mujeres resistentes a citrato de clomifeno y con LH elevada, se recomienda el uso de hormona folículo estimulante recombinante en dosis bajas, con controles seriados para evitar el desarrollo de múltiples folículos, la hiperestimulación ovárica y el embarazo múltiple resultante (17).
Deficiencia de fase lúteaDesde hace largo tiempo la deficiencia de fase lútea ha sido relacionada con AR. Sin embargo, la evidencia es escasa. Se consideraba que el cuerpo lúteo producía menos progesterona. Hoy se atribuye la insuficiencia lútea a una maduración folicular inadecuada con baja producción de hormonas por las células de la granulosa y secundariamente formación de un cuerpo lúteo inadecuadoo disfuncional, con baja producción de progesterona y estrógeno. El tratamiento debe ser corregir o estimular la ovulación más que simplemente suplementar con progesterona exógena (17,18). Actualmente la evidencia sólo apoya ese mecanismo en el contexto de un ovario poliquístico con elevados niveles de hLH. Sin embargo, al normalizar la LH usando análogos de GnRH no aumenta la frecuencia de embarazo y existe el riesgo potencial de un síndrome de hiperestimulación ovárica. Por otro lado, los cambios histológicos del endometrio utilizados como criterios diagnósticos de insuficiencia lútea, no han mostrado ser reproducibles y los niveles normales de progesterona plasmática varían considerablemente de persona a persona y no se relacionan con otros marcadores de función endometrial. Habrá que esperar una redefinición de los cambios fisiológicos del endometrio durante la fase lútea. Información reciente utilizando microarrays de DNA está generando información de utilidad. La historia sin embargo, vuelve sobre este tema debido a que los datos con la suplementación de progesterona evidencian un menor número de abortos. La evaluación (tres ensayos) en un subgrupo de pacientes que habían presentado AR, suplementadas en el embarazo con progesterona, muestran que la suplementación reduce el riesgo de aborto comparado con placebo o no tratamiento. RA 0.38 (IC 95% 0.2–0.7) (6). Se ha señalado que la Hormona Gonadotrofina Coriónica (hCG) puede tener un rol en la prevención del AR, al mejorar la ovulación y estimular la función del cuerpo lúteo. Una revisión reciente asoció el uso de hCG a una disminución de abortos en mujeres con historia de AR pero no hay evidencia contundente para su uso durante el embarazo para prevenir abortos en mujeres con AR de causa inexplicada (19). Donde sí se evidencia su utilidad al igual que la suplementación con progesterona es en ciclos de reproducción asistida, en que se ve un aumento de la tasa de embarazo. Lo interesante es que en forma paralela se han conocido otros efectos de la progesterona, que pueden ser de utilidad para entender su rol en el embarazo. En el endometrio-decidua, la progesterona modifica el patrón de citoquinas expresado por los linfocitos deciduales desde uno Th1 o pro-inflamatorio a uno Th2 o antiinflamatorio, esto favorece la implantación mejorando la adaptación inmune de la interface materno-fetal, lo que es clave para la transformación vascular de las arterias uterinas y la implantación. Más adelante se profundizará en este aspecto con detención.
Diabetes/Resistencia a la insulinaAnormalidades en el metabolismo de la glucosa y diabetes han sido claramente relacionadas con AR. El control metabólico (evaluado como niveles de hemoglobina glicosilada) claramente se correlaciona con el resultado perinatal y la frecuencia de aborto. Respecto de la resistencia a insulina, existe evidencia que también la vincula con AR. Un metaanálisis reciente indica que pacientes con AR comparadas con pacientes normales tuvieron niveles de insulina en ayuno más elevados y un índice HOMA > de 4.5 fue más frecuente en las pacientes con AR que en las normales (RA 3.36, 95%CI: 1.72–6.57, p<0.01) (20). Aún no existen estudios randomizados en los que se muestre que el tratamiento de esta condición reduzca la frecuencia deAR.
HiperprolactinemiaExiste una asociación epidemiológica entre AR y elevados niveles de prolactina. El mecanismo involucrado en la generación de AR es poco claro pero se sabe que niveles elevados de prolactina pueden asociarse a AR, debido a una anormalidad en la maduración de los ovocitos y/o defectos en la fase lútea. La evidencia muestra, en cohortes pequeñas, que el tratamiento de la hiperprolactinemia con agonistas dopaminérgicos aumenta la tasa de nacidos vivos (18).
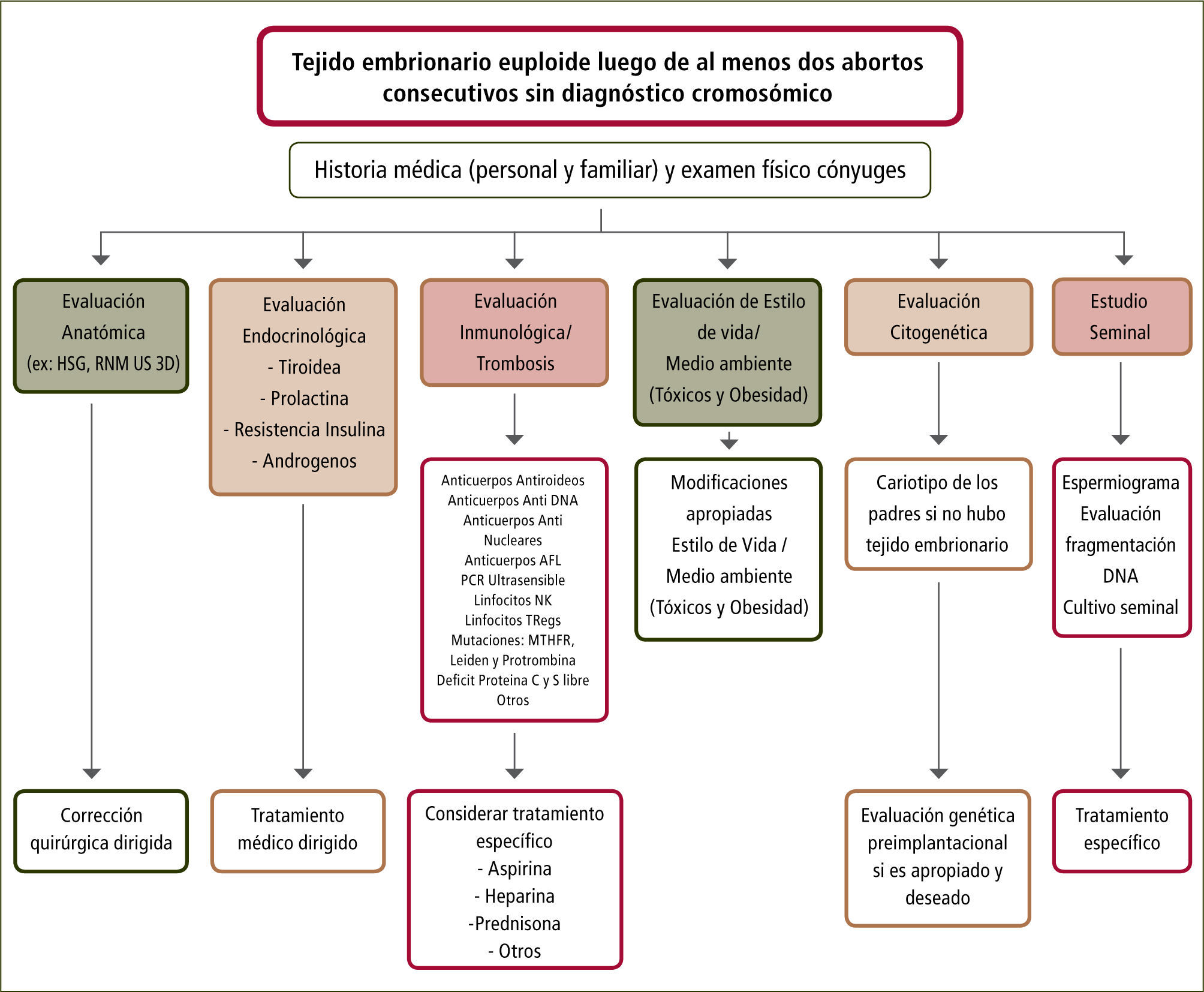
Factor masculinoEl estudio de las parejas con Aborto Recurrente (AR) debe considerar el componente paterno. Anteriormente, se mencionó la investigacion paterna en relación con la presencia de translocaciones o inversiones cromosómicas. El espermatozoide no es sólo el vehículo que entrega el complemento genético paterno al ovocito. La integridad del núcleo del espermatozoide es fundamental para lograr la fecundación y el adecuado desarrollo embrionario. La experimentación en animales ha proporcionado evidencia sobre el desarrollo embrionarioy la presentación de enfermedades en la descendencia cuando el ADN presenta algún daño en la línea germinal paterna. Este daño puede ocurrir en el testículo, en el epidídimo o después de la eyaculación. Los espermatozoides con fragmentación en las cadenas de ADN son normalmente eliminados durante la espermatogénesis pero pueden persistir en el eyaculado debido a una falla en el proceso de apoptosis o un exceso de Especies Reactivas del Oxígeno (ERO) (generados por múltiples mecanismos en los que destacan ausencia de antioxidantes, tóxicos ambientales, infecciónes del tracto reproductor masculino o isquemia testicular inducida por un varicocele), lo que podría resultar en una fecundación con desarrollo embrionario anormal y posterior muerte del embrión. Esto puede ocurrir aún en presencia de parámetros clásicos de recuento, movilidad y morfología espermática normales. Un reciente metaanálisis que incluyó 16 estudios, evidenció una relación significativa entre los niveles de daño del DNA espermático y aborto en parejas (alrededor de 3.000) en las cuales el hombre tenía altos niveles de daño en el DNA comparados con aquellos normales. [RR: 2,16. IC 95% (1,54–3,03) p<0,00001). Esto refuerza la necesidad de un diagnóstico y manejo de esta condición en pacientes con AR. (16,21) (figura 2).
Evaluación aborto recurente
Flujograma para la evaluación de una paciente con aborto recurrente. Es importante considerar que las evaluaciones están determinadas por el contexto clínico de los abortos previos, su edad gestacional, el informe histopatológico y la historia personal y familiar de ambos cónyuges. Modificado de referencia número 11.
Define a un grupo de pacientes con una tendencia a desarrollar fenómenos de trombosis arterial o venosa recurrentes, espontáneas o con mínima provocación, a edades menores a las habituales y en territorios poco comunes. Existen condiciones congénitas y adquiridas. En los últimos 15 años han sido asociadas a complicaciones obstétricas tanto en la gestación tardía como temprana, incluido el Aborto Recurrente. El mecanismo subyacente sugerido es la generación de trombosis en la circulación uteroplacentaria, específicamente en los vasos deciduales. El riesgo es variable y aún en controversia. En general, información de series aún reducidas, registran un aumento del riesgo de AR entre 1.5 y 3 veces. Se sugiere que el estudio debe focalizarse en pacientes con historia familiar de trombofilia y trombosis venosa o personal con el sólo antecedente de trombosis venosa, fundamentalmente para prevenir futuros episodios de trombosis materna (6,22). Posiblemente sea razonable también en aquellas personas en las cuales la histopatología de sus abortos indique fuertemente la existencia de patología trombótica. Es importante destacar, que la ausencia de efectos beneficiosos o protectores, del tratamiento con heparina de bajo peso molecular, observada en pacientes con aborto recurrente de causa no explicada, no es un argumento en contra de su uso, dado que se incluyen en este grupo una serie de trastornos no vinculados fisiopatológicamente a elementos de inflamación y trombosis por lo tanto, no hay un genotipo común. Actualmente existe un ensayo clínico terminado, ”Prevention of Unexplained Recurrent Miscarriage by Enoxaparin Study” (ClinicalTrials. gov number, NCT00740545) que responderá si pacientes con AR y sin trombofilias conocidas se benefician del tratamiento con heparina de bajo peso molecular.
Otro aspecto corresponde al manejo clínico de pacientes con síndrome antifosfolípidos, una trombofilia adquirida, caracterizada por la presencia de anticuerpos anticardiolipina, anticoagulante lúpico y anti β2 glicoproteína I entre otros, que requiere para su diagnóstico de criterios clínicos y de laboratorio bien definidos. En pacientes con AR la frecuencia de estos anticuerpos se estimó en alrededor de un 15% (7–25%) de los pacientes. La frecuencia de anticuerpos en población general está entre 1–5%. En esta condición los anticuerpos producen efectos sobre el trofoblasto y vasos sanguíneos que impiden el establecimiento de una circulación uteroplacentaria adecuada, interfiriendo con la penetración de los vasos espiralados por el trofoblasto intermedio. Esto limita la reducción de la resistencia vascular uterina y el consecuente aumento del flujo sanguíneo a la placenta por las arterias uterinas. Sin tratamiento, se estima que alrededor del 90% de los embarazos vuelven a presentar AR (52% abortos tempranos y 38% pérdidas tardías). El tratamiento de elección hoy es la administración de heparina y aspirina. Los resultados indican una reducción de aproximadamente un 54% [RA 0.46 (IC95% 0.29–0.71)] en el riesgo de presentar un nuevo aborto. Aún no ha sido definido el tratamiento óptimo en término de dosis y régimen (3,6,22).
Una mención especial merecen las anormalidades en el metabolismo del ácido fólicoDurante mucho tiempo se ha considerado a estas condiciones en el subgrupo de las trombofilias congénitas y su asociación con un aumento de los niveles de homocisteina, el factor vinculante con enfermedad trombótica no reproductiva y reproductiva. Sin embargo, datos recientes han debilitado esta hipótesis tanto para enfermedad coronaria como para enfermedad reproductiva. No obstante esta historia tiene otros matices. El ácido fólico es un nutriente importante, su suplementación se ha asociado a una reducción del riesgo de malformaciones del tubo neural, pero también de Síndrome de Down, Autismo y parto prematuro. Los mecanismos son múltiples e involucran modificaciones en la metilación del DNA en lo que se ha denominado epigenética. El ácido fólico se ingiere en forma inactiva y para ejercer su función debe ser activado por varios sistemas enzimáticos. El de mayor atención hasta ahora ha sido el de la Metilen Tetrahidrofolato Reductasa (MTHFR). Diversos metaanálisis evidencian una asociación entre polimorfismos de la MTHFR A1298C y C677T materno y la frecuencia de aborto. Por tal motivo, la evaluación de esos polimorfismos o bien la suplementación con dosis de ácido fólico equivalentes a aquel subgrupo con defectos previos del tubo neural (4mg) ha sido sugerido (5,22).
Conflicto inmuneAlgunas anormalidades en la respuesta inmune se han asociado con dificultades en los procesos de ovulación, fertilización, implantación y embarazo. La forma en que la madre acoge inmunológicamente al embrión y la placenta para evitar el rechazo inmune que supone la presencia de proteínas extrañas derivadas del genoma paterno, ha sido objeto de estudio (6,16,23,24). Defectos en esos mecanismos se han propuesto como causa de AR en los pacientes con etiología desconocida. En aproximadamente un 70% de este subgrupo se ha descrito:
- (a)
Elevación de auto-anticuerpos circulantes (antinucleares-anti DNA-anti tiroideos-anti fosfolípidos) o
- (b)
Una respuesta inmune celular anormalmente elevada, caracterizada por un aumento en el número/citotoxicidad de los linfocitos Natural Killer (NK), de la proporción de células T que producen TNF-α, y del porcentaje de células T con un patrón de citoquinas con alta relación Th1/Th2
- (c)
Reducción de la funcionalidad de los linfocitos T reguladores, que establecen tempranamente la tolerancia de la madre al embrión, entre otras (25). Se revisará brevemente los mecanismos propuestos, aunque los marcadores específicos son aún parte de estudios en curso.
Fisiológicamente la tolerancia al embarazo, que se inicia en el tracto genital inducida por el líquido seminal, está mediada por los linfocitos T reguladores (T regs) y es modulada positivamente por estrógenos y progesterona. A los T regs, los antígenos le son presentados por las células dendríticas (célula inmune derivado de monocito) que orienta la diferenciación y proliferación de linfocitos T hacia T regs y no hacia otros subtipos (linfocitos T helper: Th1, Th2 o Th17, ver mas adelante). Una vez activados, los T regs interactúan con su entorno celular (linfocitos Th1, 2 y 17 y células dendríticas) para generar y amplificar la supresión de la respuesta al antígeno extraño y además participan en la inmunorregulación. Estos cambios son tempranos en la gestación (primeros días) e incluso las primeras fases ocurren previo a la implantación, lo que refuerza su rol central en el embarazo inicial. Más tarde, estas células se ubican en la decidua en gran cantidad atraídas por varios mediadores, entre ellos gonadotrofina coriónica (βHCG) (23,24). En pacientes con AR se ha evidenciado una menor capacidad de inducir proliferación/diferenciación/funcionalidad de T regs dada por menor cantidad/deficiencia funcional de los T regs. En estos pacientes el rol del factor estimulante de colonias de granulocitos es importante, pues está vinculado a la diferenciación de los Linfocitos T hacia T regs y datos preliminares indican que su administración en pacientes con AR sin etiología conocida aumenta la probabilidad de obtener un recién nacido vivo. (33% vs 13%, p<0.01) (26).
Los linfocitos T helper (Th), pueden (según el patrón de citoquinas producido) clasificarse en Th1 y ejercen un rol en inmunidad celular; o Th2 y ser importantes en la inmunidad humoral. Inicialmente se consideraba que en la gestación normal existía un delicado balance Th1/Th2 en el que el sistema Th1 era aquel encargado de generar un rechazo inmune y daño celular y el Th2 encargado de producir tolerancia, y por lo tanto clave en las adaptaciones fisiológicas del embarazo. Actualmente, el esquema se ha expandido para incluir a los linfocitos Th17 y T regs. Los linfocitos Th17 son centrales en la producción de inflamación y daño celular en condiciones autoinmunes y rechazo inmune; en tanto los T regs promueven la producción de tolerancia e inmunorregulación promoviendo la:
- (a)
Inhibición de la actividad citotóxica de los NK
- (b)
Producción de inmunoglobulinas por Linfocitos B
- (c)
Maduración de células dendríticas
- (d)
Reduciendo la proliferación y producción de citoquinas por linfocitos CD4+ y CD8+
El embarazo normal requiere entonces, un delicado balance entre estos subtipos celulares, que es necesario para una implantación exitosa, pero en el que un exceso produce la pérdida del embarazo. Este rol controladorde los T regs, es además relevante en impedir que el sistema HLA-C expresado en el trofoblasto invasor, sea una fuente de activa estimulación de linfocitos T (23,24,27).
Otra característica importante del embarazo es la gran cantidad de células NK que se acumulan en la interface materno-fetal. Componen alrededor del 70% de los linfocitos en la decidua temprana. Interactúan con otras células a través de múltiples receptores. Hay varios subtipos de NK que producen patrones específicos de citoquinas, además pueden presentar diferentes receptores en su superficie los que le confieren características específicas, los más representativos son los receptores toll like (confiere selectividad para microorganismos), KIR (Killer Inmunoglobulin like Receptors) importantes en el reconocimiento del sistema HLA y el sistema natural de receptores citotóxicos (importante en control de virus y tumores). Estas células NK reconocen el sistema HLA C, E y G. Además, su acumulación en el útero es influenciada por progesterona, βHCG, prolactina y el sistema receptor soluble HLA-G1 de manera subtipo específica. No se conoce exactamente el rol de las células NK, en particular su subtipo que expresa intensamente el marcador CD56 en la génesis del AR, pero han sido propuestos dos mecanismos generales:
1.- Modifica la invasividad del trofoblasto a las arterias espiralesEsto a través de la secreción de citoquinas que estimulan la invasividad del trofoblasto intermedio y de la producción de factores angiogénicos que modifican la diferenciación del musculo liso arteriolar. Deficiencia en este rol (ya sea por exceso o disfuncionalidad) promueve una menor perfusión del espacio intervelloso y stress oxidativo a la placenta produciendo isquemia y aborto.
2.- Modifica la toleranciaSe ha propuesto que los NK también regulan la tolerancia, antagonizando las células Th17. Este es un efecto mediado por la secreción de una citoquina, el interferón gamma (INFγ). De esta manera son capaces de controlar la inflamación en forma local. En situaciones de inflamación severa y en AR, el fenotipo de las células NK se modifica. Esto ocasiona una pérdida del control inflamatorio. En estas condiciones algunas citoquinas como interlukina-6 y interleukina 1β son capaces de atraer linfocitos Th17, lo que genera una pérdida de la tolerancia fetal y aumenta la inflamación. Esta es una situación análoga a lo que ocurre en pacientes con AR, en enfermedades autoinmunes y en el rechazo a trasplantes (24,27).
De esta manera, aún cuando nuestra comprensión del rol del conflicto inmune en pacientes con AR es inicial, algunas estrategias inmunomoduladoras han sido sugeridas. Sin embargo, el potencial inconveniente con estas estrategias es que recién iniciamos la comprensión de los fenómenos subyacentes al AR por lo que la selección apropiada de pacientes con una etiología inmune, utilizando los marcadores adecuados es una labor aún pendiente. Al respecto ha sido propuesto (con evidencia aún preliminar pero prometedora) el uso de gamma globulinas por vía IV, factor estimulante de colonias de granulocitosy de bHCG (28,26,19).
Rol de otros anticuerposEn pacientes con AR ha sido descrito con mayor frecuencia la presencia de AnticuerposAntinucleares (ANA), es decir, anticuerpos anti DNA, RNA y proteínas nucleares) y anti tiroideos (ATA). Respecto de los ANA, la evidencia no es definitiva. Sin embargo, los estudios con mayor número de pacientes y con grupo control evidencian una asociación entre títulos de ANA de 1:80 y una mayor frecuencia de aborto. Si bien no se conoce le mecanismo involucrado es posible que sean marcadores de actividad inmune anormal o bien que esos anticuerpos (especialmente los anti-centrómero) pueden inducir anormalidades en la maduración del ovocito y el desarrollo del embrión (29). En este contexto, algunos han sugerido el empleo de aspirina y prednisona sin embargo, a la fecha no se han reportado estudios controlados, prospectivos y aleatorizados (30). Respecto de los ATA han sido asociados con aborto recurrente y parto prematuro (31). Su mecanismo no es claro pero ha sido propuesto que estos anticuerpos o bien el mecanismo que los estimula podría activar la migración de NK citotóxicos al endometrio.
Aproximación clínicaConsiderando lo expuesto, el enfrentamiento clínico frente a una pareja con AR debe considerar aspectos que deben ser realizados en tres fases diferentes:
- (a)
Al momento del diagnóstico del aborto cuando ello sea posible
- (b)
Al momento de realizar el vaciamiento
- (c)
Al momento de la definición etiológica
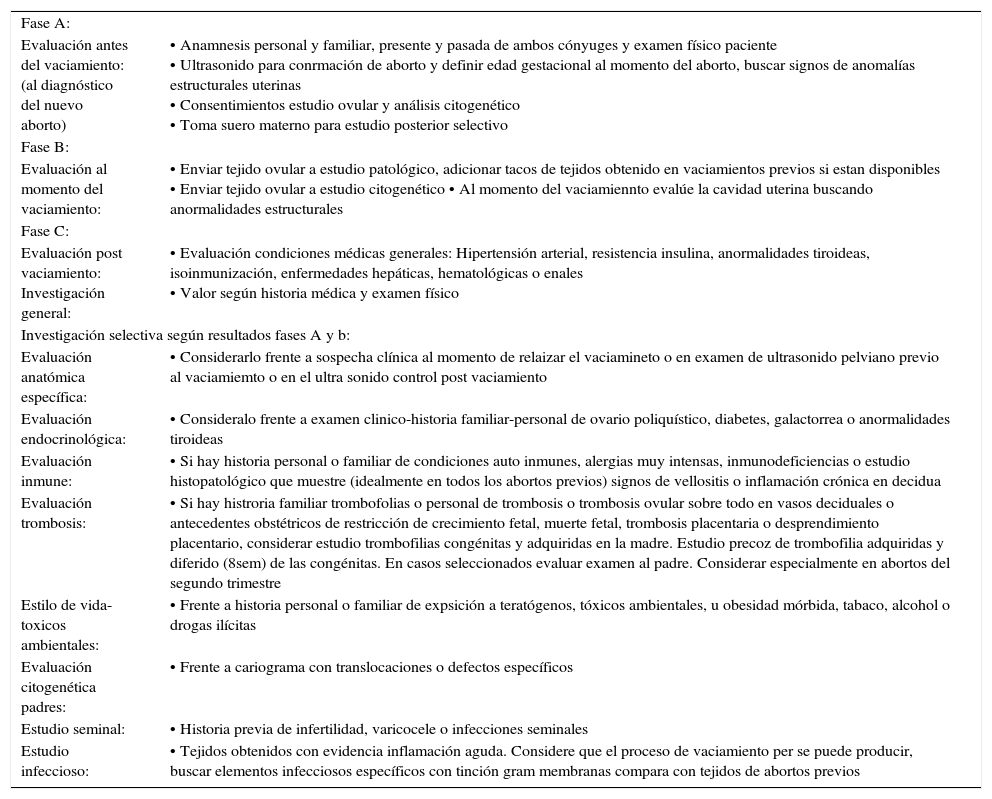
Algunas pacientes solicitan consejo médico luego que las fases (a) y (b) han sido completadas en otros lugares. En la definición etiológica, las fases (a) y (b) son importantes porque orientarán al clínico respecto de la evaluación requerida (tabla 1). En esta aproximación, hay dos aspectos relevantes que definirán la estrategia de estudio. La historia clínica personal y familiar de ambos cónyuges que orientarán a condiciones transmisibles de origen genético que puedan ser verificadas (ej: translocaciones o trombofilias) y otras como la existencia de un conflicto inmune frente a una historia de enfermedades producidas por autoanticuerpos. Además, debe considerarse el estudio del tejido ovular que incluya el análisis histopatológico y citogenético. En este aspecto, es importante la revisión conjunta de tejidos de abortos previos de manera de reconocer lesiones fundamentales comunes (ej: trombosis, inflamación aguda-crónica) en los diferentes tejidos obtenidos (vellosidades-decidua-vasos sanguíneos) que puedan orientar hacia etiologías específicas. Esto es particularmente relevante para causas infecciosas, trombóticas y de conflicto inmune, en las cuales, en ocasiones este análisis es el punto de inicio para el estudio específico.
evaluación clínica aborto recurrente.
| Fase A: | |
| Evaluación antes del vaciamiento: (al diagnóstico del nuevo aborto) | • Anamnesis personal y familiar, presente y pasada de ambos cónyuges y examen físico paciente • Ultrasonido para conrmación de aborto y definir edad gestacional al momento del aborto, buscar signos de anomalías estructurales uterinas • Consentimientos estudio ovular y análisis citogenético • Toma suero materno para estudio posterior selectivo |
| Fase B: | |
| Evaluación al momento del vaciamiento: | • Enviar tejido ovular a estudio patológico, adicionar tacos de tejidos obtenido en vaciamientos previos si estan disponibles • Enviar tejido ovular a estudio citogenético • Al momento del vaciamiennto evalúe la cavidad uterina buscando anormalidades estructurales |
| Fase C: | |
| Evaluación post vaciamiento: Investigación general: | • Evaluación condiciones médicas generales: Hipertensión arterial, resistencia insulina, anormalidades tiroideas, isoinmunización, enfermedades hepáticas, hematológicas o enales • Valor según historia médica y examen físico |
| Investigación selectiva según resultados fases A y b: | |
| Evaluación anatómica específica: | • Considerarlo frente a sospecha clínica al momento de relaizar el vaciamineto o en examen de ultrasonido pelviano previo al vaciamiemto o en el ultra sonido control post vaciamiento |
| Evaluación endocrinológica: | • Consideralo frente a examen clinico-historia familiar-personal de ovario poliquístico, diabetes, galactorrea o anormalidades tiroideas |
| Evaluación inmune: | • Si hay historia personal o familiar de condiciones auto inmunes, alergias muy intensas, inmunodeficiencias o estudio histopatológico que muestre (idealmente en todos los abortos previos) signos de vellositis o inflamación crónica en decidua |
| Evaluación trombosis: | • Si hay histroria familiar trombofolias o personal de trombosis o trombosis ovular sobre todo en vasos deciduales o antecedentes obstétricos de restricción de crecimiento fetal, muerte fetal, trombosis placentaria o desprendimiento placentario, considerar estudio trombofilias congénitas y adquiridas en la madre. Estudio precoz de trombofilia adquiridas y diferido (8sem) de las congénitas. En casos seleccionados evaluar examen al padre. Considerar especialmente en abortos del segundo trimestre |
| Estilo de vida-toxicos ambientales: | • Frente a historia personal o familiar de expsición a teratógenos, tóxicos ambientales, u obesidad mórbida, tabaco, alcohol o drogas ilícitas |
| Evaluación citogenética padres: | • Frente a cariograma con translocaciones o defectos específicos |
| Estudio seminal: | • Historia previa de infertilidad, varicocele o infecciones seminales |
| Estudio infeccioso: | • Tejidos obtenidos con evidencia inflamación aguda. Considere que el proceso de vaciamiento per se puede producir, buscar elementos infecciosos específicos con tinción gram membranas compara con tejidos de abortos previos |
Diagrama propuesto para la evaluación sistemática de parejas con AR. Se enfatizan las acciones que deben realizarse en diferentes momentos. Se describen los indicadores que deben tomarse en consideración al momento de estudiar las diferentes etiologías.
A partir de estas dos primeras fases debe diseñarse una metódica de evaluación que considere las diferentes etiologías, luego de lo cual se plantean tratamientos específicos (figura 2).
SíntesisDe esta forma es claro que le AR es un síndrome complejo, por lo que la sistematización en evaluar las diferentes etiologías tanto maternas como paternas, congénitas o adquiridas, resulta de la mayor importancia en el enfrentamiento clínico de esta condición.
Los autores declaran no tener conflictos de interés, en relación a este artículo.