La dieta mediterránea puede tener un papel en la prevención del desarrollo y progresión del cáncer de próstata (CaP). La expresión de ciclooxigenasa-2 (COX-2) se asocia con proliferación celular aumentada, previene la apoptosis y favorece la invasión tumoral. Se intenta clarificar si el resveratrol y otros polifenoles del vino inhiben de forma efectiva la actividad de COX-2 e inducen apoptosis en la línea celular PC-3 de cáncer hormonorrefractario.
Material y métodoCélulas PC-3 fueron cultivadas y tratadas con diferentes concentraciones de ácido gálico, ácido tánico, quercetina y resveratrol en presencia del éster de forbol PMA (50μg/ml) que induce la expresión de COX-2. Se extrajo ARN total y se analizó la expresión de COX-2 mediante cuantificación relativa por PCR a tiempo real (método ΔΔCt). La actividad COX-2 se determinó mediante detección de PGE-2 por ELISA. Se empleó ensayo de luminiscencia Caspasa 3/7 para evaluar la apoptosis. La transfección transitoria con plásmidos short human COX-2 (phPES2 –327/+59) y p5xNF-kβ-Luc determinó la actividad del promotor de COX-2 y de forma particular la dependiente de NF-kβ.
ResultadosLa expresión de COX-2 no se modificó en ausencia de PMA. No obstante, bajo la inducción con PMA, ácido tánico (2,08±0,21), ácido gálico (2,46±0,16), quercetina (1,78±0,14), y especialmente resveratrol (1,15±0,16) inhibieron significativamente la expresión de COX-2 respecto al control (3,14±0,07), causando una reducción del 34, 23, 46 y 61%. La inhibición en los niveles de PGE-2 siguió un patrón similar. Todos los compuestos estudiados indujeron apoptosis a las 48h, aunque en diferente proporción. PMA causó un aumento de la actividad de 7,4±0,23 veces phPES2 –327/+59 y 2,0±0,1 veces p5xNF-kβ-Luc a 6h sobre los niveles basales. El resveratrol suprimió estos efectos 17,1±0,21 y 32,4±0,18 veces, respectivamente. De forma similar, aunque en menor medida, el resto de polifenoles evaluados disminuyeron el efecto inductor de PMA sobre la actividad de ambos promotores.
ConclusionesLos polifenoles inhiben la actividad transcripcional del promotor de COX-2 mediada por NF-kβ. Este efecto podría explicar, al menos en parte, la inducción in vitro de apoptosis por estas sustancias en CaP resistente a la castración.
Mediterranean diet may play a role in the prevention of prostate cancer (PCa) development and progression. Cyclooxygenase-2 (COX-2) expression is associated with increased cellular proliferation, prevents apoptosis and favors tumor invasion. We intend to clarify whether resveratrol and other polyphenols effectively inhibit COX-2 activity and induce apoptosis in hormone-resistant PC-3 cell line.
Material and methodPC-3 cells were cultured and treated with different concentrations of gallic acid, tannic acid, quercetin, and resveratrol in presence of phorbol myristate acetate (PMA; 50μg/ml) that induces COX-2 expression. Total RNA was extracted and COX-2 expression was analyzed by relative quantification real-time PCR (ΔΔCt method). COX-2 activity was determined by PGE-2 detection using ELISA. Caspase 3/7 luminescence assay was used to disclose apoptosis. Transitory transfection with short human COX-2 (phPES2 -327/+59) and p5xNF-kβ-Luc plasmids determined COX-2 promoter activity and specifically that dependant of NF-kβ.
ResultsCOX-2 expression was not modified in media devoid of PMA. However, under PMA induction tannic acid (2.08±.21), gallic acid (2.46±.16), quercetin (1.78±.14) and resveratrol (1.15±.16) significantly inhibited COX-2 mRNA with respect to control (3.14±.07), what means a 34%, 23%, 46% and 61% reduction, respectively. The inhibition in the levels of PGE-2 followed a similar pattern. All compounds studied induced apoptosis at 48h, although at a different rate. PMA caused a rise in activity 7.4±.23 times phPES2 -327/+59 and 2.0±.1 times p5xNF-kβ-Luc at 6h compared to basal. Resveratrol suppressed these effects 17.1±.21 and 32.4±.18 times, respectively. Similarly, but to a lesser extent, the rest of evaluated polyphenols diminished PMA inductor effect on the activity of both promoters.
ConclusionsPolyphenols inhibit transcriptional activity of COX-2 promoter mediated by NF-kβ. This effect could explain, at least in part, the induction of apoptosis in vitro by these substances in castration resistant PCa.
Los estudios epidemiológicos proporcionan evidencia bastante consistente de que una dieta con un alto contenido en frutas y verduras reduce el riesgo de varios tipos de cáncer1. Sin embargo, los componentes de estos nutrientes que ejercen este efecto protector y el mecanismo preciso por el cual ejercen estos efectos no se conocen con certeza. El cáncer de próstata (CaP) sigue siendo un gran problema de salud para los hombres de todo el mundo. Hay una gran cantidad de literatura dedicada a describir el potencial quimiopreventivo o efecto quimioterapéutico de ciertos fitoquímicos en los polifenoles del vino tinto, incluyendo la apoptosis mejorada, la detención del crecimiento, la modificación del ciclo celular, la inhibición de la síntesis de ADN y la expresión de modulación de enzimas, como las ciclooxigenasas o sintasa de prostaglandina H2 (COX)2–5.
Los compuestos polifenólicos constituyen uno de los grupos más grandes y ubicuos de fitoquímicos. Estos compuestos, especialmente los flavonoides y ácidos fenólicos, son una parte importante de la dieta humana1,3. Las propiedades bioquímicas, ingesta y biodisponibilidad de diferentes compuestos polifenólicos han sido revisadas, ya que este tema es de particular interés en la quimioprevención del cáncer de próstata y/o modulación de terapias6–8.
Hay 2 isoformas de COX que catalizan la formación de prostaglandinas (PG) a partir del ácido araquidónico. Mientras que el COX-1 es un gen house keeping que se expresa constitutivamente y es generalmente responsable de la producción de PG en condiciones fisiológicas, el COX-2 es un gen altamente inducible por diferentes estímulos. Por otra parte, se cree que el COX-2 es la isoforma responsable de la producción de PG pro-inflamatorias y es muy importante para la tumorigénesis9.
La ciclooxigenasa-2 (COX-2) se considera un objetivo potencial para la terapia del cáncer, porque los niveles de COX-2 son elevados en la mayoría de los tumores humanos en comparación con los tejidos normales correspondientes. Hay diferentes mecanismos posibles que podrían explicar la relación entre la COX-2 y el cáncer. El aumento de los niveles de PG y la actividad de la COX-2 se han detectado en múltiples cánceres epiteliales (por ejemplo, de pulmón, de colon, de próstata)10,11 y, especialmente, de PGE-2, pueden afectar y aumentar la proliferación celular y la invasividad, promoviendo la angiogénesis e inhibiendo la apoptosis en células malignas.
Los ésteres de forbol, tales como forbol 12-miristato 13-acetato (PMA) funcionan como promotores de tumores y se ha notificado que modulan diversas respuestas celulares incluyendo crecimiento celular, muerte celular programada, diferenciación y transcripción de genes. Se ha establecido que, además de PMA, las citocinas y lipopolisacáridos también regulan al alza la expresión de la COX-212–14. Hemos demostrado que la regulación de la transcripción del receptor de andrógenos (RA) media el efecto antiproliferativo de resveratrol y otros polifenoles del vino en línea celular de LNCaP sensible a los andrógenos15,16. Ahora tenemos la intención de estudiar in vitro los efectos de estos compuestos en el CaP resistente a la castración y los mecanismos implicados.
Materiales y métodosMaterialesPMA y los compuestos polifenólicos (ácido tánico, ácido gálico, quercetina y resveratrol) fueron adquiridos de Sigma-Aldrich (St. Louis, MO, EE. UU.) y se disolvieron en etanol a concentración de reserva y se almacenaron a –20°C. Las concentraciones finales utilizadas para diferentes experimentos se prepararon diluyendo la solución madre con RPMI antes de su uso. El plástico para cultivo se obtuvo de Corning-Costar (NY, EE. UU.). La mediana de RPMI-1.640 con 100U/ml de penicilina G, 0,1mg/ml de estreptomicina, 50μg/ml de gentamicina y 2mM de L-glutamina eran de Gibco BRL (Paisley, Reino Unido). El suero bovino fetal (SBF), solución salina tamponada con fosfato (PBS) y el tetraacetato de etilendiamina-tripsina (EDTA) del 0,025% eran de Biological Industries (Beit-Hamek, Israel), Amresco (Solon, OH, EE. UU.) y Gibco BRM (Paisley, Reino Unido), respectivamente. La MMLV transcriptasa inversa era de Sigma-Aldrich (St. Louis, MO, EE. UU.).
Cultivo celular y tratamientosLa línea celular PC-3 insensible a los andrógenos se obtuvo de American type cultura collection (ATCC, Rockville, MD). Las células se mantuvieron en RPMI 1640 (Gibco BRL, España) complementado con 5% de suero bovino fetal inactivado por calor (FCS, Linus, España). Las células fueron cultivadas en una atmósfera humidificada de 95% de aire y 5% de CO2 a 37°C y crecieron hasta una confluencia del 60-70%, tripsinizadas con 0,05% de tripsina-2mM EDTA (Gibco BRL, España) y se colocaron para uso experimental. Para los experimentos las células fueron tratadas con o sin PMA (50μg/ml) y 10μM de ácido tánico, ácido gálico, quercetina y resveratrol o vehículo (0,01% etanol) durante 24h para la expresión de ARNm y ensayo de transfección y 48h para estudiar el efecto de los polifenoles sobre la secreción de PGE-2 y la apoptosis en células PC-3.
La extracción de ácido ribonucleico y reacción en cadena de la polimerasa en tiempo real para las expresiones de ciclooxigenasa-2El ARN total de las muestras de células se obtuvo utilizando RNeasy® Mini Kit, de Qiagen (Valencia, CA, EE. UU.) siguiendo las instrucciones del fabricante. El rendimiento del ARN se determinó espectrofotométricamente a 260/280nm y se midieron las ratios de densidad (OD260/OD280) para garantizar la calidad del ARN aislado usando espectrofotómetro ND-100 (Nanodrop Technology). La ratio media fue de 1,8 a 2,1 para todas las muestras. Para RT se utilizo una alícuota que contenía 1-2μg del ARN total de cada muestra para cADN de primera línea en un volumen final de 20-40μl utilizando 0,75μl (0,5mg) de cebadores aleatorios (Promega, Madison, WI) y 0,5μl (12,5mmol/l) mezcla de dNTP (Ecogen, España), se incubó a 70°C durante 10min y se enfrió inmediatamente en hielo para evitar la renaturalización. La siguiente mezcla de RT se preparó en 10-20μl para cada muestra: tampón de 4-8μl de MMLV RT (5x) (Sigma), 0,5μl (20U) de inhibidor de RNasa (RNasin, Promega) y 1μl (100U) de virus de la leucemia murina Moloney (MMLV) de transcriptasa inversa y se incubó a 25°C durante 5min y 37°C durante 50min. Se detuvo la reacción a 95°C durante 5min para inactivar la RT. La PCR en tiempo real se realizó utilizando un TaqMan® PCR kit protocol estándar en un termociclador de temperatura de fluorescencia, iCycler (Bio-Rad Laboratories, Hercules, CA, EE. UU.). Los 20μl de PCR incluyeron 0,1ng de cADN, 2μl de TaqMan® Universal PCR Master Mix (Applied Biosystems), 1μl de una mezcla de cebadores de PCR no descritos (COX-2 or 18S rRNA) y sonda de Taqman MGB (TaqMan® Assays, Applied Biosystems, Madrid, España). Las reacciones se incubaron en una placa de 96 pocillos a 95°C durante 10min, seguido por 40 ciclos de 95°C durante 15 arena 60°C durante 1min. Todas las reacciones se realizaron por triplicado. El ciclo umbral (CT) se define como el número de ciclo fraccional al que la fluorescencia pasa el umbral fijado. Para determinar la expresión relativa del RA en cada muestra los resultados se normalizaron a 18S (utilizado como un estándar interno) y se utilizó el método comparativo de CT (Boletín usuario # 2 [2001], Applied Biosystems, Madrid, España).
Determinación de la actividad de la caspasa 3/7Las células se cultivaron en placas de 6 pocillos a una densidad de 1×105 células por pocillo y se trataron con las dosis más altas de cada polifenol usado en el estudio de proliferación. A las 24 y 48h de tratamiento se aspiró el medio y se lavaron las células una vez con PBS. Luego añadimos M-PER reactivo de extracción de proteínas de mamíferos (Pierce, Rockford, IL, EE. UU.) con cóctel fresco de inhibidor de la proteasa (Boehringer Mannheim, Alemania). Las células se mezclaron suavemente durante 5min y el lisado se recogió en un tubo de microfuga. El lisado se aclaró por centrifugación a 13.000rpm durante 10min y el sobrenadante se utilizó o se almacenó inmediatamente a –80°C. La concentración de proteína se determinó mediante ensayo de proteína BCA usando el protocolo del fabricante (Pierce, Rockford, IL, EE. UU.). Para la cuantificación de la apoptosis se utilizó un ensayo luminiscente que mide las actividades de la caspasa-3 y -7 (Caspase-Glo 3/7 Assay. Promega, Madison, WI, EE. UU.). Brevemente, el ensayo proporciona un sustrato proluminescente para la caspasa 3/7 en un reactivo optimizado para la actividad de la caspasa, la actividad de luciferasa y la lisis celular. La adición de los resultados de reactivos en la lisis celular, la escisión de la caspasa del sustrato y la generación de una señal luminiscente «de tipo brillo» producida por la luciferasa. La luminiscencia es proporcional a la cantidad de actividad de la caspasa presente. Para este ensayo hemos utilizado la proteína 1μg para cada determinación.
Mediciones de PGE-2Las células fueron tratadas como se describe en la determinación de la actividad de la caspasa 3/7. Los niveles de PGE-2 liberados por las células se midieron por el inmunoanálisis de la enzima de acuerdo con las instrucciones del fabricante. Las tasas de produccion de PGE-2 se normalizaron a concentraciones de proteína (R&D Systems, Minneapolis, EE. UU.)
Plásmidos reporteros y experimentos de transfección transitoriaLos plásmidos reporteros utilizados fueron 5×NF-kβ-luc (Stratagene, La Jolla, CA, EE. UU.) y el plásmido reportero basado en la luciferasa correspondiente a la región reguladora flanqueante 5’ de tipo humano COX-2 (phPESs-327/+59). Estos 2 vectores de expresión se transfectaron en células PC-3 utilizando Megafectin-20 (Qbiogene, Carlsbad, CA). Brevemente, las células PC-3 se cultivaron en placas de 24 pocillos al 60-80% de confluencia. A continuación, el medio de cultivo se reemplazó por medio del vehículo, es decir, medio libre de suero complementado con 0,1% de albúmina de suero bovino (BSA), durante 18-20h. Entonces, las células PC-3 fueron lipotransfectadas con la mezcla consistente en 3-4μg de los plásmidos mencionados anteriormente incubados a temperatura ambiente durante 15min con 0,1μl de potenciador, 3μl de Hepes y 2μl de Megafectin-20 en un medio vehículo. Después de la incubación la mezcla de transfección se añadió a los cultivos celulares durante 4h a 37°C en RPMI-1460 que contiene 5% de FCS pero sin liposomas antibióticos. Posteriormente, la mezcla de transfección se reemplazó por medio de vehículo fresco que contiene los diferentes compuestos a probar. A las 24h las células PC-3 se extrajeron con 1_Reporter Lysis Buffer (Promega, Madison, WI, EE. UU.) para el análisis de la expresión del gen reportero. La actividad de luciferasa se expresó como unidades de luciferasa relativa/mg de proteína.
Análisis estadísticoLos resultados se expresan como media±s.e.m. ANOVA unidireccional con el análisis post hoc; el t-test de Dunnett se utilizó para comparar el análisis de expresión ARNm entre los grupos tratados y de control. Las comparaciones con respecto a la actividad de la caspasa 3/7 se llevaron a cabo con la prueba «t» de Student independiente. Se alcanzó el nivel de significación cuando p<0,05.
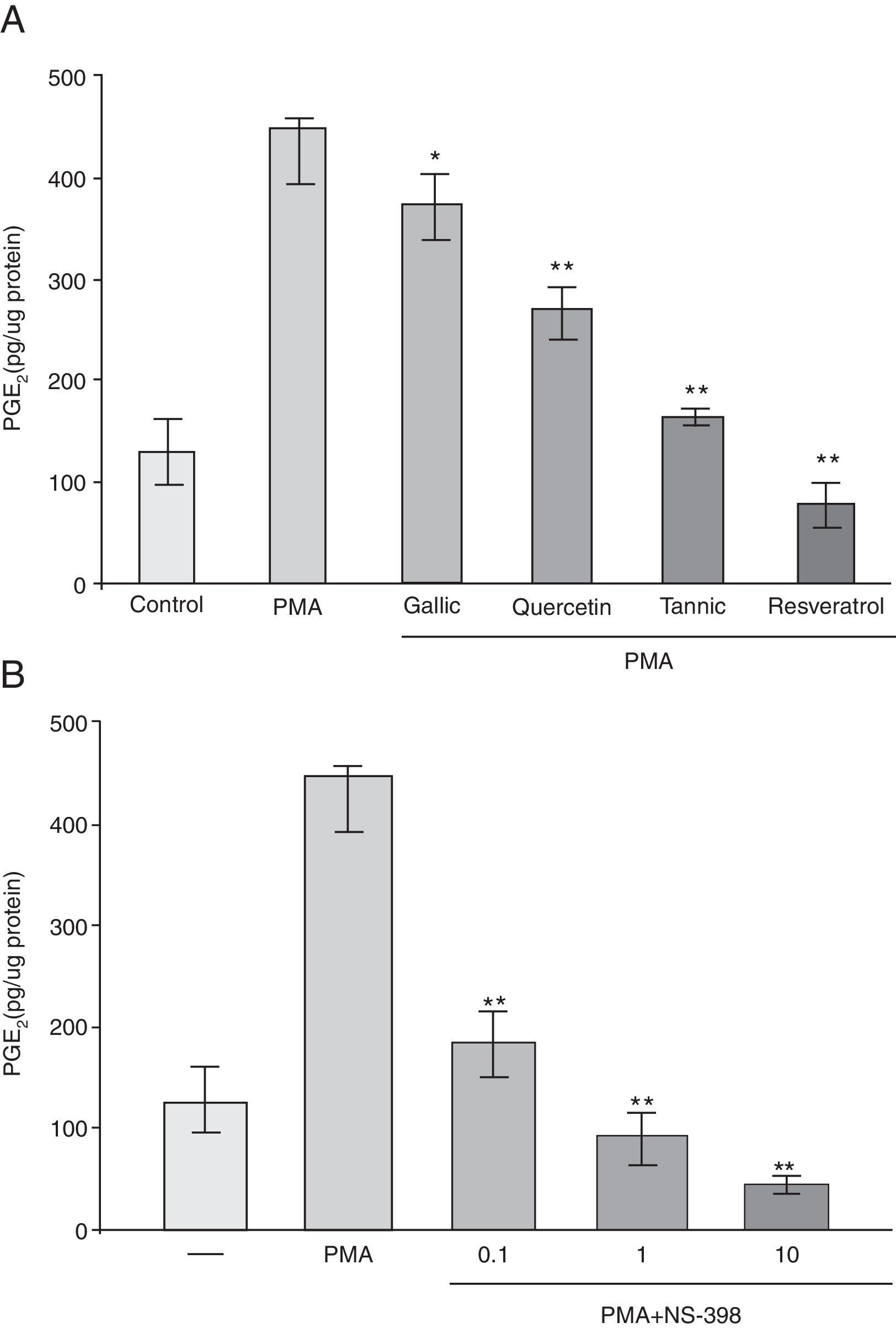
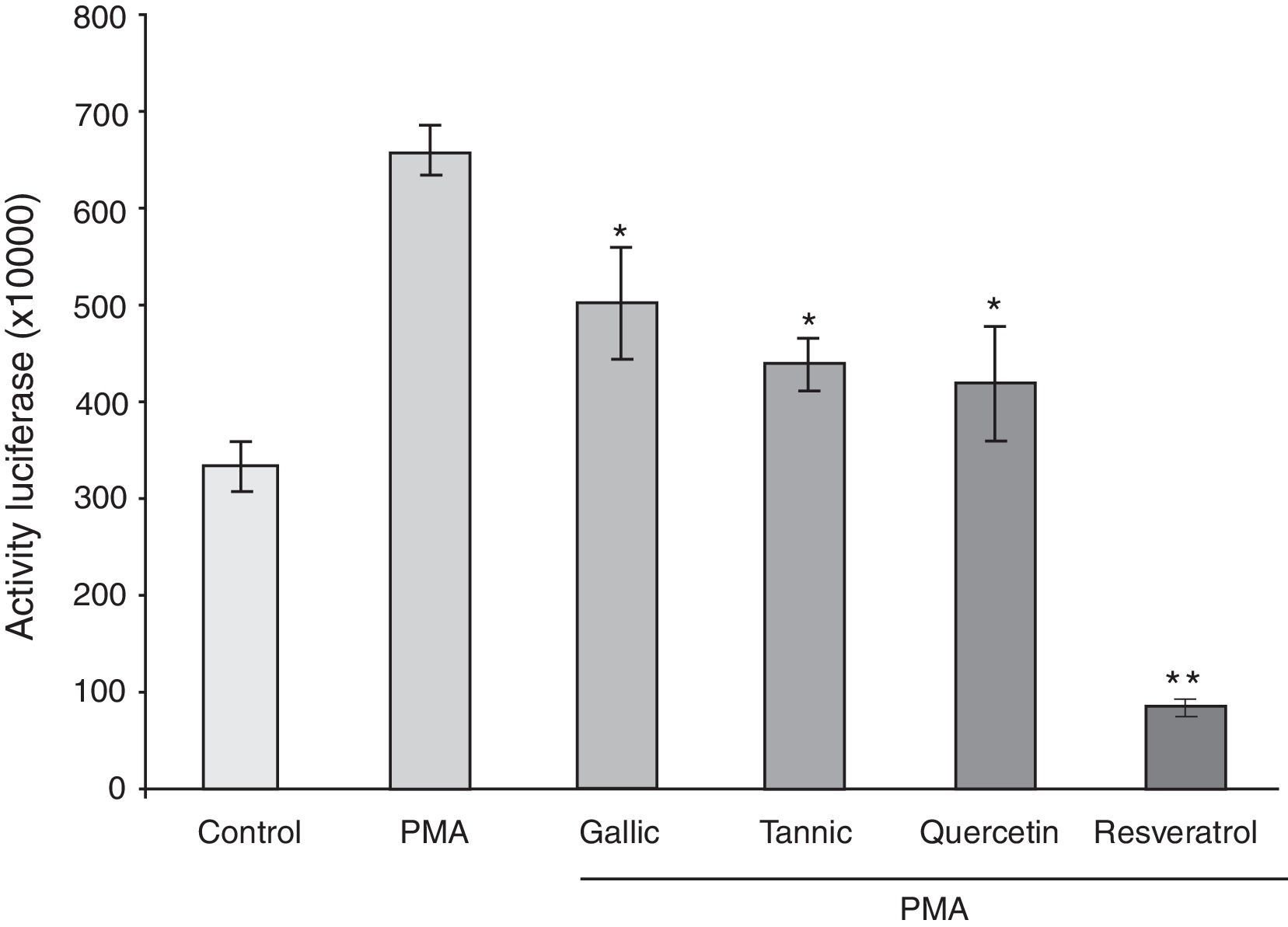
ResultadosLos polifenoles suprimen el aumento mediado por forbol 12-miristato 13-acetato en la producción de PGE-2En estos experimentos 4 polifenoles fueron probados con respecto a su efecto sobre la producción de PGE-2 para determinar los efectos antiinflamatorios de estos polifenoles: el resveratrol estilbeno, la quercetina flavonol, el ácido tánico tanino y el ácido gálico ácido benzoico (fig. 1). Los ésteres de forbol son potentes inductores de COX-2, por lo que determinamos el efecto del tánico, gálico, quercetina y resveratrol sobre la síntesis de PG por células PC-3 en el que COX-2 se indujo por PMA. Como se muestra en la figura 2 A, PMA causó un aumento de alrededor de 4 veces en la síntesis de PGE-2. Este efecto fue notablemente suprimido por el tratamiento con resveratrol (82%), ácido tánico (64%) y quercetina (41%) y fue inhibido con ligereza por el ácido gálico (17%). Para evaluar si la inhibición de la síntesis de PGE-2 era debida a la inhibición de COX-2 o COX-1 se compararon los efectos de NS-398, un inhibidor selectivo de COX-2. El pretratado de células con NS-398 (0,1-10μM) inhibió la síntesis de PG a menos del 10% del nivel de control estimulado del PMA (fig. 2 B). Este resultado significa que más del 90% de actividad de COX estimulada por PMA en células PC-3 era debido a la isoforma de la COX-2. No se encontró ningún cambio en los niveles de síntesis de PGE-2 en ausencia de PMA (datos no presentados).
Los polifenoles suprimen el éster de forbol mediado elevado en la producción de PGE-2. Las células PC-3 fueron tratadas con o sin PMA (50μg/ml) y 10μM de ácido gálico y tánico, quercetina, resveratrol y vehículo (0,01% de etanol) (A) o NS398 (0-10μM) (B) durante 48h. El medio se recogió para determinar la tasa de síntesis de PGE-2. La producción de PGE-2 se determinó mediante inmunoanálisis enzimático.
*p<0,05; **p<0,01 vs. tratamiento con PMA.
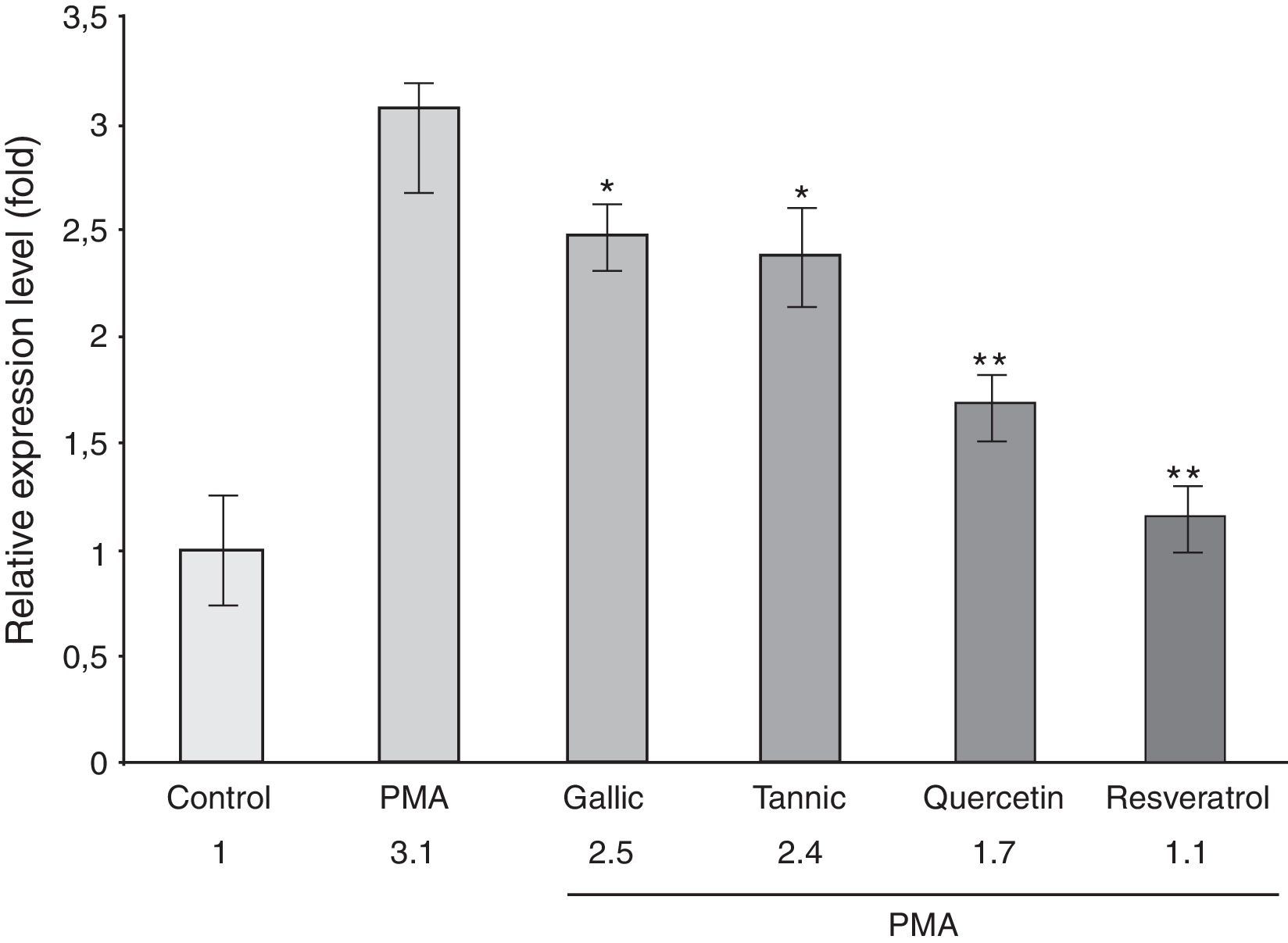
Para determinar si los efectos anteriores sobre la producción de PGE-2 podrían estar relacionados con las diferencias en los niveles de ARNm de la COX-2, se realizó RT-PCR de ARN total en tiempo real. La figura 3 muestra que el tratamiento con PMA resultó en un marcado aumento (3 veces) en los niveles de la expresión de ARNm de la COX-2 frente a las células no tratadas (p≤0,01). Este efecto fue parcialmente suprimido por los polifenoles. El resveratrol y la quercetina inhibieron la expresión de COX-2 un 63 y 47%, respectivamente. Sin embargo, los ácidos tánico y gálico inhibieron la expresión de ARNm de la COX-2 en menor medida (20-25%). Estos datos indicaron que estos polifenoles inhibían la expresión de COX-2 en los niveles de transcripción, siendo el resveratrol y la quercetina los inhibidores más potentes. No se encontró ningún cambio en los niveles de ARNm de la COX-2 en ausencia de PMA (datos no mostrados).
Efecto de los polifenoles sobre niveles de ARNm de COX-2 inducida por PMA en los niveles de ARNm de células PC-3 tratadas con o sin PMA (50μg/ml) y 10μM de ácido gálico y tánico, quercetina, resveratrol o vehículo (0,01% etanol) durante 24h. El ARN total celular fue aislado y analizado por tiempo RT-PCR en tiempo real para la expresión de COX-2. El gen 18S ARNr se amplificó como un control interno. Se observó una disminución significativa en la expresión de ARNm de la COX-2 para todos los polifenoles. El resveratrol era el más potente.
*p<0,05; **p<0,01 vs. tratamiento con PMA.
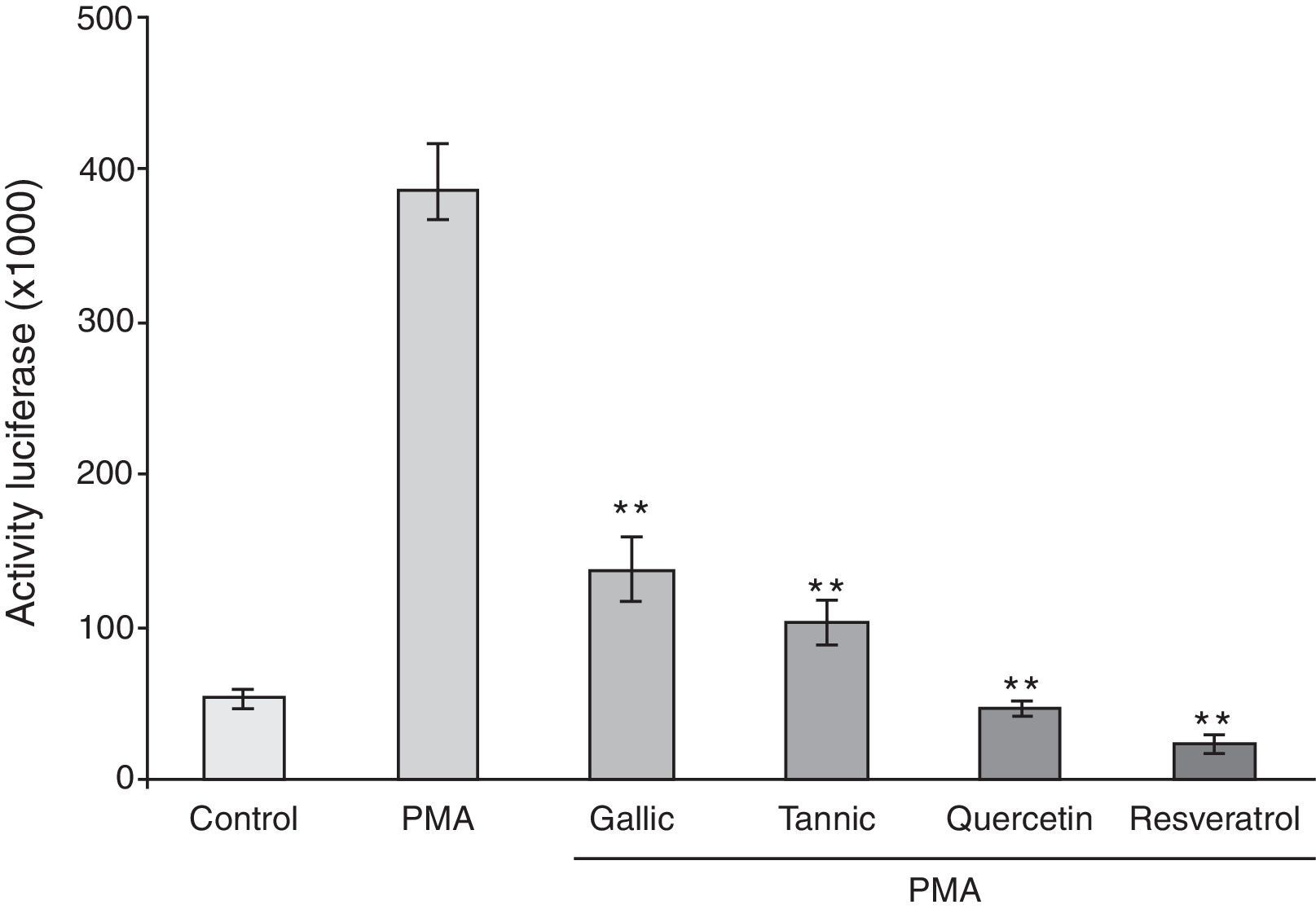
Para investigar más la importancia de PMA y polifenoles en la modulación de la expresión de la COX-2, las transfecciones transitorias se realizaron utilizando un plásmido reportero que lleva el promotor de la COX-2 humano corto (-327/+59 pb). Como en el ARNm, el tratamiento con PMA durante 24h aumentó significativamente la actividad del constructo promotor basado en luciferasa sobre>7 veces. Todos los polifenoles causaron la inhibición de la inducción mediada por PMA de la actividad del promotor de la COX-2 (fig. 4).
Efecto de los polifenoles sobre actividad promotora de la COX-2 inducida por PMA. Las células PC-3 fueron transfectadas transitoriamente con 3-4μg de plásmido phCOX-2 (–327/+59)-luc. Después de la transfección las células se trataron con vehículo (columna blanca), PMA (50μg/ml, columna negra), o PMA y polifenoles (10μM, resto de columnas). La actividad reportera se midió en extractos celulares 24h después. La actividad de la luciferasa representa los datos que se han normalizado con la concentración de proteína.
*p<0,05; **p<0,01 frente a tratamiento con PMA.
Debido a que la activación de NF-kβ es crítica para la inducción de la COX-2 por ésteres de forbol, también estudiamos si uno de los principales factores de transcripción implicados en la respuesta inflamatoria, NF-kβ, es inhibido en la vía de transducción de señales que conduce a la expresión de COX-2 causada por PMA. Para este fin se determinó la actividad basal de transcripción NF-kβ-dependiente en PC-3 transfectada transitoriamente con p5×NF-kβ-luc. La estimulación de las células con PMA durante 24h tiene como resultado un aumento del doble de la actividad de la luciferasa NF-kβ. Esta estimulación fue parcialmente suprimida por gálico (24%), tánico (33%) y quercetina (37%) (fig. 5). El resveratrol era el más potente y era capaz de inhibir casi completamente (>90%) la actividad del promotor de NF-kβ, incluso con respecto a condiciones basales, en ausencia de PMA (>90% de inhibición).
Efecto de polifenoles sobre actividad promotora de NF-kβ inducida por PMA. Las células PC-3 fueron transfectadas transitoriamente con 3-4μg de plásmido phCOX-2 (–327/+59)-luc. Después de la transfección las células se trataron con vehículo (columna blanca), PMA (50μg/ml, columna negra), o PMA y polifenoles (10μM, resto de columnas). La actividad reportera se midió en extractos celulares 24h después. La actividad de luciferasa representa los datos que se han normalizado con la concentración de proteína.
*p<0,05; **p<0,01 frente a tratamiento con PMA.
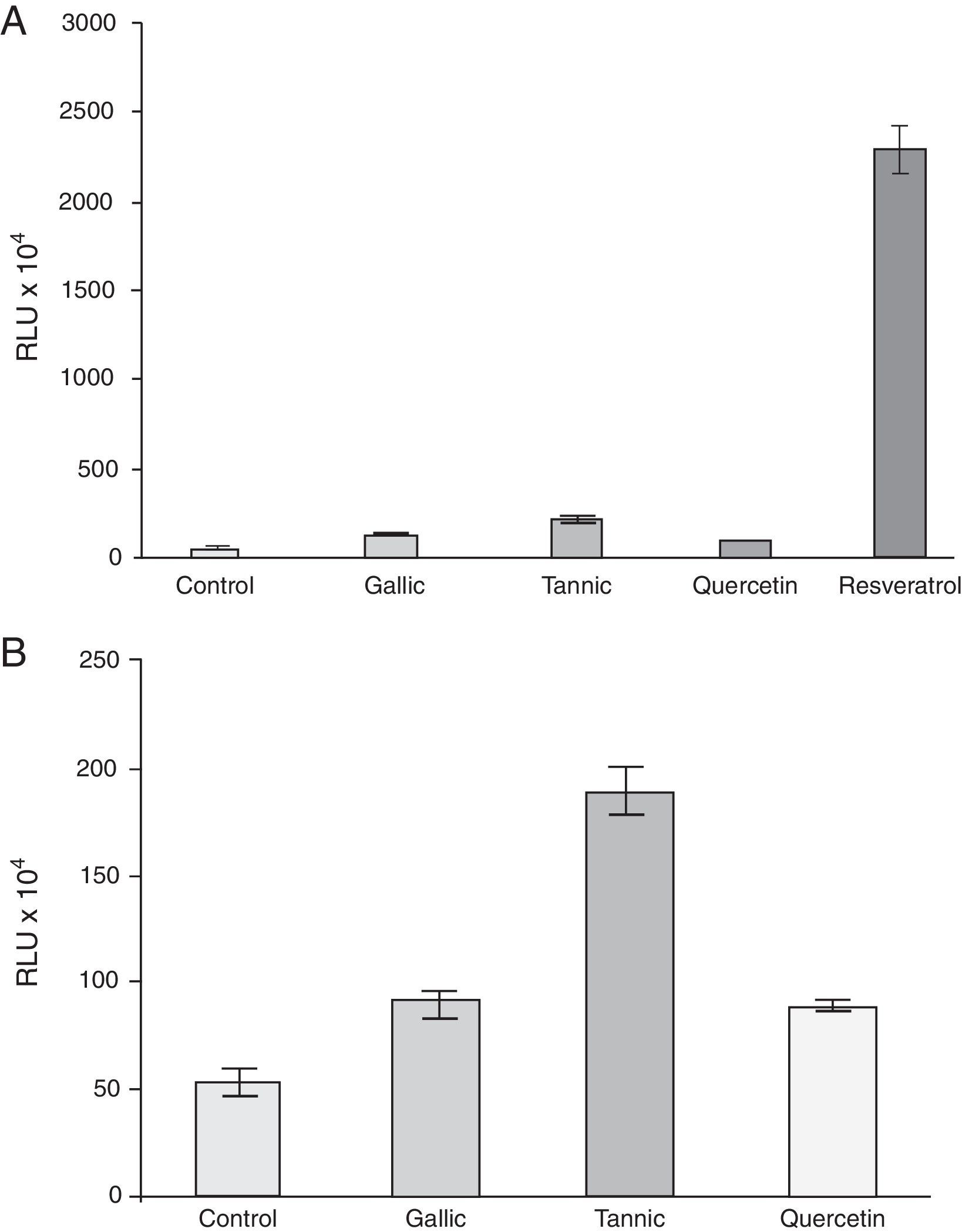
La actividad de caspasa 3/7 en el control y células tratadas con polifenoles era determinar para evaluar si la inhibición del metabolismo de la COX-2 (expresión y secreción de PGE2) puede causar inducción de la apoptosis. Las células PC-3 fueron tratadas durante 24 y 48h en presencia de diferentes polifenoles (10μM), se lisaron y se midió la presencia de caspasa activa 3/7 con el ensayo de caspasa-Glo 3/7. La actividad de la caspasa 3/7 se incrementó notablemente por todos los polifenoles probados con respecto a control a las 48h, aunque a un ritmo diferente: quercetina 1,6, ácido gálico 1,7, ácido tánico 3,5 y resveratrol 42,5 veces en comparación con el control (fig. 6 A). Las pequeñas diferencias pueden ser percibidas mejor en detalle en la figura 6 B.
Inducción de la apoptosis por los polifenoles en las células de PC-3 determinadas por la actividad de la caspasa 3/7 en las células de control y tratadas. Todos los compuestos indujeron la apoptosis a las 48h, aunque a un ritmo diferente: ácido tánico 3,5, ácido gálico 1,7, quercetina 1,6 y resveratrol 42,5 veces en comparación con el control (A). Las pequeñas diferencias se pueden apreciar en detalle (B).
El resveratrol es una fitoalexina que se encuentra en altas concentraciones en las uvas y se ha demostrado que inhibe carcinógenos químicos en varios modelos17. Este compuesto natural se ha propuesto de potencial terapéutico en modelos preclínicos, animales y estudios en humanos en varias malignidades18. Ha surgido interés específico por el cáncer de próstata, ya que el resveratrol ha demostrado regresión transcripcional de la expresión de RA, degradación acelerada de RA y modulación de coactivadores de RA16,19–21. El resveratrol en la dieta suprime de forma espontánea desarrollar tumores de próstata en el modelo Transgenic Adenocarcinoma Mouse Prostate (TRAMP) a través de la subregulación de fosfo-ERK, un efector descendente del receptor de esteroides sexuales y de señalización del factor de crecimiento22. Las altas concentraciones de resveratrol también han resultado en inhibición significativa dependiente de la dosis de fosforilación de PKB/Akt, tanto en líneas celulares PC- 3 como en LNCaP23,24. La inhibición de PI3K mediada por resveratrol puede estar mediada en parte por la inhibición de la fosforilación de supresión tumoral de la familia FOXO, permitiendo así los objetivos proapoptóticos como TRAIL o p2725.
En el adenocarcinoma mamario se ha demostrado que el resveratrol inhibe la enzima COX-2, isoforma inducible de las enzimas limitantes de la velocidad que convierten el ácido araquidónico en prostaglandinas proinflamatorias, que se incrementa después de la estimulación de mitógenos como el éster de forbol18,26. Esta inhibición que se manifiesta en diferentes niveles, que incluyen la actividad enzimática directa, ARNm y la síntesis de proteínas, el elemento de respuesta a AMP cíclico y la expresión génica mediada por AP-126,27. El resveratrol también ha confirmado suprimir la actividad promotora de la COX-2 en células de cáncer de colon humano DLD-128. En cuanto a la próstata, la COX-2 se regula al alza en la atrofia inflamatoria proliferativa (AIP) de la próstata, pero no en el CaP29, aunque se ha defendido que promueve la progresión del cáncer de próstata30. Las catequinas presentes en el té verde inhiben la COX-2 sin afectar a la expresión de la COX-1 en ARNm y los niveles de proteína, tanto en LNCaP que responde a los andrógenos como en PC-3 refractario a los andrógenos. Esta acción se ha demostrado tanto in vitro como in vivo usando el modelo TRAMP de ratón31,32. También los efectos de los polifenoles del té verde en el CaP son sinérgicos con los inhibidores de la COX-233.
La vía inflamatoria de la COX-2 es considerada un objetivo potencial en la neoplasia epitelial y también específicamente en el CaP. La activación de NF-kβ se considera crítica para la inducción de la COX-2 por ésteres de forbol34. Es más, la COX-2 sobreexpresada es secundaria a la sobreexpresión de NF-kβ35. Hussain et al. demostraron que el componente de té verde epigalocatequina-3-galato inhibe selectivamente la COX-2 en células de carcinoma de próstata humano, tanto LNCaP como PC-336. Esta acción es la misma que demostramos que se ejerce por el resveratrol y otros polifenoles en el vino tinto, todo abundante en la dieta mediterránea37.
NF-kβ es un factor de transcripción a menudo sobreexpresado que regula diferentes actividades celulares, incluyendo la inflamación, la inmunidad y la muerte celular. La regulación a la baja de NF-kβ se sabe que desencadena efectos apoptóticos y antiproliferativos, y se considera un mecanismo que puede prestar beneficios para la salud del consumo de los polifenoles del té verde38. Sin embargo, la realidad es muy compleja, ya que los polifenoles del té verde se dirigen a muchos otros mecanismos diferentes, incluyendo la detención del ciclo celular, las enzimas de desintoxicación, IGF, la apoptosis inducida por TRAIL, las quinasas MAP, Hh (señalización hedgehog), PI3K-Akt (señalización de rapamicina) y PKC39,40. De acuerdo con nuestros resultados, los polifenoles del vino tinto también se dirigen a las vías inflamatorias y podrían ser responsables del efecto antiproliferativo in vitro de resveratrol, quercetina, ácido gálico y ácido tánico en la línea celular PC- 3. Esta señalización aparece totalmente diferente de la de la RA observada en la línea celular LNCaP16. La inhibición de la señalización de NF-kβ en ratones TRAMP activa la apoptosis a través de un aumento de la relación Bax/Bcl-241. Este efecto también se ha demostrado para el zumo de granada de la fruta Punica granatum42; la delfinidina, una importante antocianina presente en muchas frutas y verduras pigmentadas43, y también recientemente α-tomatina, la principal saponina presente en el tomate (Lycopersicon esculentum)44,45. Es muy comprensible que el mecanismo que describimos para el resveratrol y otros polifenoles del vino tinto en la línea celular PC-3 refractario a andrógenos siga una lógica muy similar.
En este estudio se muestra que diferentes polifenoles presentes en el vino tinto inhiben la estimulación con PMA de la expresión de COX-2, la actividad promotora de la COX-2 y la liberación de PGE2 en carcinoma de próstata humano PC-3 insensible a los andrógenos que conduce a aumento de la apoptosis. A pesar de la gran experiencia acumulada in vitro, se han realizado muy pocos ensayos clínicos que utilizan las concentraciones exactas de compuestos quimiopreventivos probables. En este sentido, un estudio aleatorizado de fase ii ha demostrado recientemente que el extracto de granada se asocia con más de 6 meses de aumento del tiempo de duplicación del PSA en hombres con recurrencia bioquímica después de la terapia local; sin embargo, no se utilizó ningún brazo de control46.
Definitivamente no hay evidencia para considerar el resveratrol un agente antineoplásico terapéutico. Sin embargo, se ha considerado que mejora la sensibilidad a la radiación en varias malignidades, incluyendo la de próstata47,48. Posiblemente en un futuro podría encontrarse algún papel beneficioso como complemento en el tratamiento de la enfermedad resistente a la castración, o al menos ser beneficioso para atenuar la progresión del CaP. En la actualidad tenemos que admitir que, desde el punto de vista clínico, el efecto de los antioxidantes de la dieta sobre el cáncer de próstata aún no está definido49.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
FinancianciónEste trabajo ha sido financiado por la Beca Fundación para la Investigación en Urología (FIU) de la Asociación Española de Urología.