Examinar la relación entre la fuente de financiación de los análisis coste-efectividad de intervenciones sanitarias publicados en España y las conclusiones de los estudios.
DiseñoEstudio descriptivo transversal.
EmplazamientoBases de datos de literatura científica (hasta diciembre de 2014).
Participantes (unidad de análisis)Cohorte de análisis coste-efectividad de intervenciones sanitarias publicados en España entre 1989-2014 (n=223) que presentaran como medida de resultado los años de vida ajustados por calidad (AVAC).
Mediciones principalesSe establecieron relaciones entre las conclusiones cualitativas de los estudios y el tipo de fuente de financiación utilizando la prueba exacta de Fisher en tablas de contingencia. Se exploraron las distribuciones de las estimaciones de las razones coste-efectividad incremental por fuente de financiación en relación a umbrales hipotéticos de disposición a pagar entre 30.000-50.000€ por AVAC.
ResultadosUn total de 136 (61,0%) estudios fueron financiados por la industria. Los estudios financiados por la industria eran menos propensos a presentar conclusiones desfavorables o neutrales que los estudios no financiados por la industria (2,2% frente al 23,0%; p<0,0001), fundamentalmente en los estudios que evaluaban fármacos (0,9% frente al 21,4%; p<0,0001). Las razones coste-efectividad incremental en los estudios financiados por la industria eran más propensas a situarse por debajo de los umbrales hipotéticos de disposición a pagar de 30.000€ (73,8% frente al 56,3%; p<0,0001) y 50.000€ (89,4% frente al 68,2%; p<0,0001) por AVAC.
ConclusionesEl presente estudio revela un potencial sesgo de patrocinio en los análisis coste-efectividad. Los estudios financiados por la industria podrían estar favoreciendo el perfil de eficiencia de sus productos.
To examine the relationship between the funding source of cost-effectiveness analyses of healthcare interventions published in Spain and study conclusions.
DesignDescriptive cross-sectional study.
LocationScientific literature databases (until December 2014).
Participants (analysis units)Cohort of cost-effectiveness analysis of healthcare interventions published in Spain between 1989-2014 (n=223) presenting quality-adjusted life years (QALYs) as the outcome measure.
Main measurementsThe relationship between qualitative conclusions of the studies and the type of funding source were established using Fisher's exact test in contingency tables. Distributions of the incremental cost-effectiveness ratios by source of funding in relation to hypothetical willingness to pay thresholds between €30,000-€50,000 per QALY were explored.
ResultsA total of 136 (61.0%) studies were funded by industry. The industry-funded studies were less likely to report unfavorable or neutral conclusions than studies non-funded by industry (2.2% vs. 23.0%; P<.0001), largely driven by studies evaluating drugs (0.9% vs. 21.4%; P<.0001). The incremental cost-effectiveness ratios in studies funded by industry were more likely to be below the hypothetical willingness to pay threshold of €30,000 (73.8% vs. 56.3%; P<.0001) and €50,000 (89.4% vs. 68.2%; P<.0001) per QALY.
ConclusionsThis study reveals a potential sponsorship bias in cost-effectiveness analyses of healthcare interventions. Studies funded by industry could be favoring the efficiency profile of their products.
La práctica clínica y los servicios de salud cuentan con recursos limitados para obtener los mayores beneficios en salud para la población. Se piensa que esta realidad está contribuyendo a la consolidación generalizada de los criterios de eficiencia en diversos países de nuestro entorno1-3. Sin embargo, la utilización explícita de la razón coste-efectividad incremental2, como un factor determinante en la financiación pública de tecnologías sanitarias, sigue dándose en un número relativamente reducido de países entre los que destacan las experiencias del Pharmaceutical Benefits Advisory Committee (PBAC) en Australia, el Common Drug Review (CDR) en Canadá y el National Institute for Health and Care Excellence (NICE) en el Reino Unido4.
La evaluación de tecnologías sanitarias que incorpora el análisis coste-efectividad es importante, ya que puede ayudar a clínicos, gestores, planificadores sanitarios y pacientes a tomar mejores decisiones informadas sobre la adopción de tratamientos, programas y servicios que compiten en condiciones de incertidumbre y limitación de recursos1-4. Los análisis coste-efectividad bien realizados y que presentan bajo riesgo de sesgos proporcionan evidencia científica de calidad sobre los costes y los efectos de las intervenciones sanitarias. En los últimos años se ha observado un aumento en el número de publicaciones de evaluaciones económicas de intervenciones sanitarias5, muchas de ellas llevadas a cabo o patrocinadas por los fabricantes de las tecnologías evaluadas6,7. Aunque en investigación clínica existen evidencias que indican la existencia de una asociación positiva y estadísticamente significativa entre las fuentes de financiación y los resultados de los estudios8-11, el denominado «sesgo de patrocinio» (sponsorship bias) ha recibido menor atención en otras áreas científicas como la economía de la salud12. Estudios previos internacionales han identificado indicios de sesgos de patrocinio en los análisis coste-efectividad de intervenciones dirigidas a prevenir, controlar y tratar patologías de alto impacto social13,14 como son el cáncer15,16, las enfermedades cardiovasculares17 y los trastornos mentales18. Sin embargo, hasta la fecha no se ha realizado ningún estudio sobre el potencial sesgo de patrocinio en los análisis coste-efectividad que evalúan intervenciones sanitarias en España. Conocer esta información es de gran relevancia, ya que puede ayudar a conocer el estado de la investigación sobre la eficiencia (coste-efectividad) de las intervenciones sanitarias a nivel del Sistema Nacional de Salud, ámbito donde la integridad de las evaluaciones es poco o menos conocida, a pesar de ser donde se definen las líneas prioritarias de investigación, se identifican las necesidades de atención sanitaria y se prestan servicios con cargo a fondos públicos. En este contexto, el presente estudio tiene como objetivo examinar la relación entre la fuente de financiación de los análisis coste-efectividad de intervenciones sanitarias publicados en España y las conclusiones de los estudios.
Material y métodosSe realizó un análisis transversal extrayendo la información procedente de la cohorte de análisis coste-efectividad de intervenciones sanitarias publicados en España durante el período 1989-2014. Las estrategias de búsqueda de la literatura, la selección de los estudios y el proceso de extracción de la información de los estudios identificados se presentan en detalle en un trabajo previo19. Brevemente, a partir de una revisión sistemática llevada a cabo en PubMed y otras bases de datos adicionales (SCOPUS, ISI Web of Science, bases de datos del Centre for Reviews and Dissemination de la Universidad de York, Índice Médico Español, Índice Bibliográfico Español en Ciencias de la Salud, e informes de evaluación de tecnologías sanitarias) se llevó a cabo la evaluación de la fuente de financiación y de las conclusiones de los análisis coste-efectividad que presentaran los años de vida ajustados por calidad (AVAC) como medida de resultado en salud.
Para cada estudio incluido, dos revisores extrajeron de manera independiente la siguiente información: nombre del autor, año y revista de publicación, factor de impacto de la revista (de acuerdo con el Journal Citation Report 2014), filiación y país del primer autor, fuente de financiación, tipo de intervención (prevención, diagnóstico, tratamiento, rehabilitación), enfermedades estudiadas (utilizando las categorías propuestas en el proyecto de la carga global de enfermedad que se basa en el sistema de clasificación internacional de enfermedades, 10.ª edición)13,14, las razones coste-efectividad incremental (expresadas en euros [€] por AVAC ganado) y las conclusiones cualitativas del estudio. La fuente de financiación de cada análisis coste-efectividad se presentó atendiendo a dos categorías: financiado por la industria o no financiado por la industria. Un estudio se consideró financiado por la industria privada si todo o parte del apoyo financiero procedía de la industria farmacéutica (o de tecnologías sanitarias), y se consideró no financiado en el resto de situaciones (p.ej., financiación pública, no financiado o con fuente de financiación desconocida). Las conclusiones cualitativas presentadas en los estudios se definieron como: favorables si la intervención evaluada era claramente la opción recomendada (p.ej., se menciona como «coste-efectiva», «rentable», «reduce costes», «ahorra costes», «es una opción asequible»); desfavorables o en contra si las conclusiones fueron claramente negativas (p.ej., «no es coste-efectiva», «poco probable que sea rentable», «produce mayores costes», «es económicamente poco atractiva» o «supera los umbrales convencionales de coste-efectividad»), y neutrales o no concluyentes cuando la intervención de interés no era superior al comparador o cuando las conclusiones se expresaron con elevado grado de incertidumbre. Para cada estudio también se extrajeron todas las razones coste-efectividad incremental (expresadas en € por AVAC ganado) en el análisis del caso basal y se analizaron en un análisis exploratorio. La razón coste-efectividad incremental es una medida del coste adicional por unidad de ganancia en salud producida por una intervención sanitaria en comparación con un comparador. En otras palabras, la razón coste-efectividad incremental permite comparar los costes adicionales que supone una intervención con los resultados incrementales que proporciona con relación a una alternativa2. Se convirtieron a € de 2014 los valores expresados en otra unidad monetaria (p.ej., pesetas, dólares americanos) aplicando tasas oficiales disponibles en el momento de la extracción de la información. Debido a que un artículo puede incluir a menudo distintos escenarios en el caso basal (p.ej., se diferencian subgrupos de pacientes por edad y sexo, se presentan varias perspectivas como el sistema sanitario y la sociedad), cada estudio puede haber contribuido a los análisis con más de una razón coste-efectividad incremental.
Se llevó a cabo un análisis descriptivo mediante recuento de frecuencias y porcentajes. Se establecieron relaciones entre las conclusiones cualitativas de los estudios y el tipo de fuente de financiación utilizando la prueba exacta de Fisher en tablas de contingencia (diferencias entre dos proporciones). Se consideró un valor de p<0,05 (dos colas) para establecer el nivel de significación estadística frente a la hipótesis nula. También se presentaron estadísticos descriptos (mediana, media, desviación estándar, cuartiles 25 y 75) y gráficos de puntos (dot-plots) que exploran las distribuciones de las estimaciones de las razones coste-efectividad incremental por fuente de financiación con relación a umbrales hipotéticos de disposición a pagar entre 30.000 y 50.000€ por AVAC ganado. Todos los cálculos se realizaron utilizando Stata (versión 13, StataCorp LP, College Station, TX, EE.UU.).
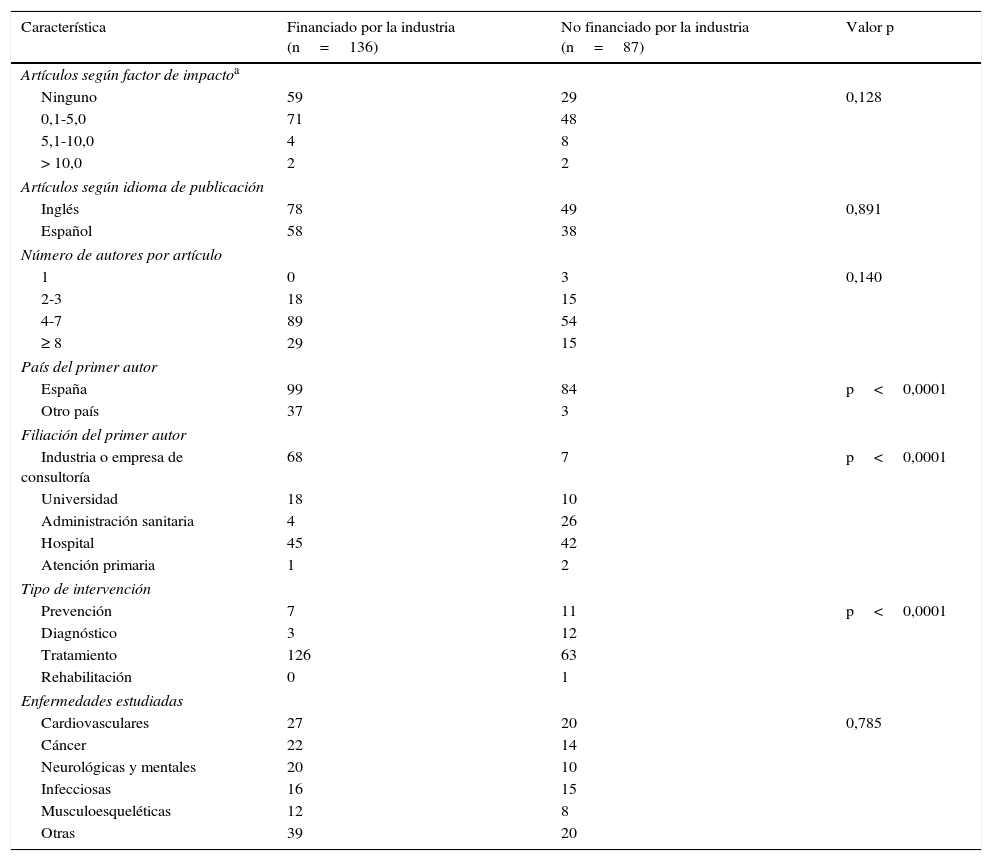
ResultadosDe los 223 estudios procedentes de la cohorte de análisis coste-efectividad de intervenciones sanitarias publicados en España (véanse el diagrama del estudio y el listado de trabajos en el material complementario), 136 (61,0%) fueron financiados por la industria privada. En la tabla 1 se presentan las características descriptivas de los estudios analizados según el tipo de financiación. Los trabajos financiados por la industria privada fueron publicados por primeros autores internacionales (37/136 [27,2%] frente a 3/87 [3,4%]) y con filiación privada (68/136 [50,0%] frente a 7/87 [8,3%]). Las intervenciones terapéuticas fueron las más evaluadas, si bien destacaban significativamente entre los estudios financiados por la industria privada (126/136 [92,6%] frente a 63/87 [72,4%]). El factor de impacto de la revista, el idioma de la publicación, el número de autores por artículo y la enfermedad estudiada no se relacionaron con el tipo de financiación.
Características de los análisis coste-efectividad incluidos
| Característica | Financiado por la industria (n=136) | No financiado por la industria (n=87) | Valor p |
|---|---|---|---|
| Artículos según factor de impactoa | |||
| Ninguno | 59 | 29 | 0,128 |
| 0,1-5,0 | 71 | 48 | |
| 5,1-10,0 | 4 | 8 | |
| > 10,0 | 2 | 2 | |
| Artículos según idioma de publicación | |||
| Inglés | 78 | 49 | 0,891 |
| Español | 58 | 38 | |
| Número de autores por artículo | |||
| 1 | 0 | 3 | 0,140 |
| 2-3 | 18 | 15 | |
| 4-7 | 89 | 54 | |
| ≥ 8 | 29 | 15 | |
| País del primer autor | |||
| España | 99 | 84 | p<0,0001 |
| Otro país | 37 | 3 | |
| Filiación del primer autor | |||
| Industria o empresa de consultoría | 68 | 7 | p<0,0001 |
| Universidad | 18 | 10 | |
| Administración sanitaria | 4 | 26 | |
| Hospital | 45 | 42 | |
| Atención primaria | 1 | 2 | |
| Tipo de intervención | |||
| Prevención | 7 | 11 | p<0,0001 |
| Diagnóstico | 3 | 12 | |
| Tratamiento | 126 | 63 | |
| Rehabilitación | 0 | 1 | |
| Enfermedades estudiadas | |||
| Cardiovasculares | 27 | 20 | 0,785 |
| Cáncer | 22 | 14 | |
| Neurológicas y mentales | 20 | 10 | |
| Infecciosas | 16 | 15 | |
| Musculoesqueléticas | 12 | 8 | |
| Otras | 39 | 20 | |
AVAC: años de vida ajustados por calidad.
Los valores representan el número de publicaciones.
En general, los estudios financiados por la industria privada eran menos propensos a presentar conclusiones desfavorables o neutrales que los estudios no financiados por la industria (3/136 [2,2%] frente a 20/87 [23,0%]; p<0,0001) (tabla 2). Cuando se evaluaban intervenciones farmacológicas, la proporción de estudios con conclusiones desfavorables o neutrales fue del 0,9% (1/109) para los estudios financiados por la industria privada frente al 21,4% (9/42) para los estudios no financiados por la industria (p<0,0001). No se encontraron diferencias estadísticamente significativas para los estudios que no evaluaban intervenciones farmacológicas (2/27 [7,4%] frente a 11/45 [24,4%], respectivamente; p=0,112).
Conclusiones y fuente de financiación de los estudios
| Conclusiones del estudio | Financiado por la industria | No financiado por la industria | p |
|---|---|---|---|
| Estudios sin intervenciones farmacológicas (n=72) | |||
| A favor de la intervención | 25 | 34 | 0,112 |
| En contra de la intervención/neutral | 2 | 11 | |
| Estudios con intervenciones farmacológicas (n=151)a | |||
| A favor de la intervención | 108 | 33 | p<0,0001 |
| En contra de la intervención/neutral | 1 | 9 | |
| Total (n=223) | |||
| A favor de la intervención | 133 | 67 | p<0,0001 |
| En contra de la intervención/neutral | 3 | 20 | |
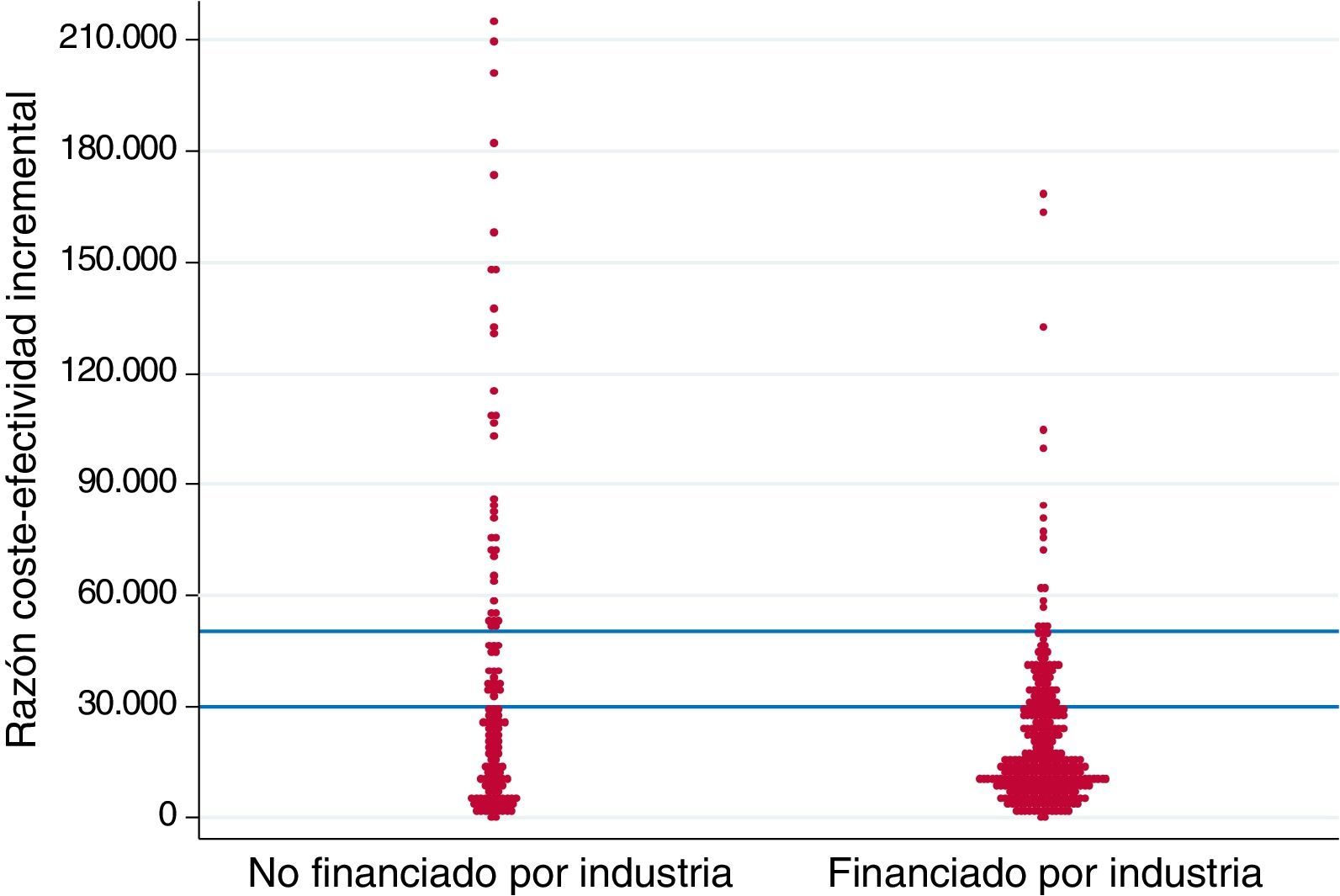
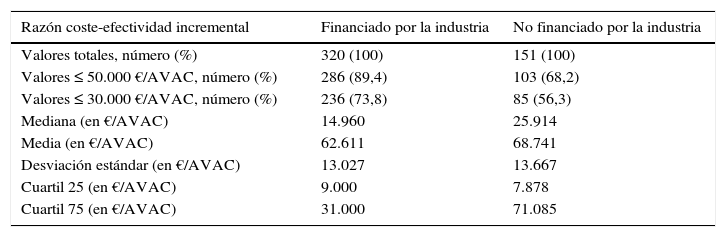
Se obtuvo un total de 471 razones coste-efectividad incremental a partir de los 223 estudios incluidos (tabla 3). La figura 1 muestra la variabilidad de los resultados de las razones coste-efectividad incremental expresadas en € por AVAC ganado en relación a la fuente de financiación. En general, las razones coste-efectividad incremental presentadas en los estudios financiados por la industria privada eran más propensas a situarse por debajo de los umbrales hipotéticos de disposición a pagar de 30.000 € por AVAC (236/320 [73,8%] frente a 85/151 [56,3%]; p<0,0001) y 50.000 € por AVAC (286/320 [89,4%] frente 103/151 [68,2%]; p<0,0001) (tabla 3, figura 1).
Razón coste-efectividad incremental y fuente de financiación de los estudios
| Razón coste-efectividad incremental | Financiado por la industria | No financiado por la industria |
|---|---|---|
| Valores totales, número (%) | 320 (100) | 151 (100) |
| Valores ≤ 50.000 €/AVAC, número (%) | 286 (89,4) | 103 (68,2) |
| Valores ≤ 30.000 €/AVAC, número (%) | 236 (73,8) | 85 (56,3) |
| Mediana (en €/AVAC) | 14.960 | 25.914 |
| Media (en €/AVAC) | 62.611 | 68.741 |
| Desviación estándar (en €/AVAC) | 13.027 | 13.667 |
| Cuartil 25 (en €/AVAC) | 9.000 | 7.878 |
| Cuartil 75 (en €/AVAC) | 31.000 | 71.085 |
Valores en euros (€) por año de vida ajustado por calidad (AVAC). Mediana y media de las razones coste-efectividad incremental con menor valor se interpretan como intervenciones más eficientes.
Gráfico de puntos (dots-plot) de razones coste-efectividad incremental y fuente de financiación de los estudios.
Cada punto representa una razón coste-efectividad incremental expresada en euros (€) por años de vida ajustados por calidad (AVAC) ganados. Las líneas horizontales (en azul) representan dos umbrales hipotéticos de disposición a pagar (30.000 y 50.000€/AVAC, respectivamente).
Los resultados de este trabajo han permitido observar una asociación estadísticamente significativa entre la fuente de financiación y las conclusiones de los análisis coste-efectividad de intervenciones sanitarias publicados en España. Generalmente, los estudios publicados que fueron financiados por la industria privada fueron menos propensos a presentar conclusiones desfavorables o neutrales en comparación con los que no fueron financiados por la industria. Cuando se evaluaban intervenciones farmacológicas, la mayoría de los trabajos financiados por la industria privada concluyeron que el medicamento correspondiente tenía una relación coste-efectividad favorable. Los resultados del análisis indican que las razones coste-efectividad incremental presentadas en los estudios patrocinados por la industria privada eran más propensas a situarse por debajo de umbrales hipotéticos de disposición a pagar situados entre 30.000 y 50.000€ por AVAC.
El presente trabajo es el primero que examina la relación entre la fuente de financiación de los análisis coste-efectividad de intervenciones sanitarias publicados en España y sus conclusiones. Estudios recientes han evaluado otros aspectos relevantes de los análisis coste-efectividad publicados en España, como son el establecimiento de prioridades6, las redes de colaboración científica7, la calidad metodológica19, la comunicación de conflictos de intereses20 y la definición de umbrales de disposición a pagar21,22. En general, los resultados de este trabajo concuerdan con los de otros estudios internacionales que han identificado que la mayoría de análisis coste-efectividad suelen presentar razones coste-efectividad favorables12,15-18, y que los estudios financiados por la industria privada son más propensos a presentar valores por debajo de umbrales hipotéticos de disposición a pagar. Por ejemplo, Bell et al.12 publicaron en el año 2006 un análisis del sesgo de patrocinio a partir de una muestra de 533 análisis coste-efectividad realizados principalmente en Estados Unidos. Los autores identificaron que dos terceras partes de las publicaciones presentaban razones coste-efectividad por debajo de los 50.000dólares ($) por AVAC y solamente el 21% se situaba por encima de los 100.000$ por AVAC, siendo más favorables los resultados presentados en los estudios financiados por la industria privada12.
En caso de que los resultados del presente trabajo se puedan explicar por sesgos de patrocinio, tomar decisiones clínicas y de planificación sanitaria basadas exclusivamente en evaluaciones económicas financiadas por la industria podría llevar a prácticas cuestionables, generando potenciales ineficiencias a los servicios de salud, impactando negativamente en la salud de la población (cuando las conclusiones son incorrectas) y, en definitiva, limitando el valor científico de la evaluación de tecnologías sanitarias. Los mecanismos mediante los cuales los autores y patrocinadores de los estudios pueden obtener resultados de coste-efectividad más favorables han sido poco explorados, pero se han sugerido diversas causas12,15-18,23-25. Es posible que la existencia de sesgos de publicación no haya posibilitado la identificación de algunos estudios no publicados con resultados desfavorables o no concluyentes. En general, la planificación de la investigación y publicación por parte de la industria farmacéutica puede verse influenciada por intereses económicos y comerciales que podrían afectar a la decisión sobre qué estudios llevar a cabo, su diseño y enfoque analítico, y las estrategias de diseminación de los resultados de investigación (p.ej., elaboración de manuscritos, publicación completa frente a publicación selectiva e incompleta). Las evaluaciones económicas que presentan sesgos pueden generar confusión sobre el verdadero valor terapéutico añadido de las tecnologías sanitarias, llevando a problemas como la falta de credibilidad en los análisis publicados por parte de clínicos, gestores y planificadores sanitarios que puede limitar la implementación del conocimiento riguroso en la práctica clínica. Un ejemplo puede ser el caso de algunos medicamentos nuevos con precios elevados, donde los análisis coste-efectividad financiados por la industria privada pudieran ser diseñados para sugerir un perfil de coste-efectividad favorable17,25, aun cuando existen importantes incertidumbres en el momento de la comercialización (p.ej., sobre eficacia comparada, seguridad, efectividad a medio-largo plazo e impacto económico real)26,27.
Algunas limitaciones pueden señalarse en este trabajo. El análisis presentado no está exento de la posible no identificación de algún análisis coste-efectividad utilizado en la toma de decisiones que pueda no haber sido publicado (sesgo de publicación). Otra limitación es que la información utilizada procede de la cohorte de análisis coste-efectividad de intervenciones sanitarias publicados en España que presentaron AVAC como medida de efectividad19. En este sentido, podría ser interesante en futuras investigaciones explorar si el empleo de otro tipo de medidas de resultados de salud (o de beneficio económico) permite confirmar las relaciones encontradas. No es descartable que diferencias entre estudios en cuanto a las patologías evaluadas, la tecnología empleada y las alternativas comparadas, o las características de la población del estudio, puedan influir en el potencial sesgo de patrocinio. Tampoco se ha evaluado la relación entre el potencial sesgo de patrocinio y la calidad en la presentación de métodos y resultados de los trabajos, si bien el factor de impacto de la revista (como variable proxy de calidad de la publicación) no se relacionó con el tipo de financiación. Sin embargo, en la revisión sistemática previa que examinó los métodos y resultados de los análisis coste-efectividad realizados en España se observaron una serie de problemas metodológicos graves19. Por ejemplo, solo el 5% de los trabajos indicaron la existencia de un protocolo de investigación, mientras que solo el 18% presentaron estimadores de eficacia (o efectividad) de las intervenciones utilizando para ello síntesis de la mejor evidencia a partir de revisiones sistemáticas y metaanálisis, el 19% describieron de manera completa los métodos de cálculo para los AVAC y solo el 47% de los trabajos presentaron una descripción adecuada de las características de las poblaciones estudiadas. Por último, es posible que el potencial sesgo de patrocinio observado en el presente trabajo esté subestimado, ya que las publicaciones de análisis coste-efectividad que no presentaron la fuente de financiación se clasificaron como estudios no financiados por la industria privada.
En resumen, como se ha mencionado anteriormente, el análisis presentado sugiere que los análisis coste-efectividad de intervenciones sanitarias financiados por la industria privada podrían estar favoreciendo el perfil de eficiencia de sus productos. Parece necesaria una mayor transparencia e independencia en los análisis coste-efectividad, reduciendo potenciales sesgos, lo cual podría contribuir a que la información generada se pueda utilizar en la práctica clínica y en la atención sanitaria. Si las autoridades sanitarias desean que los análisis coste-efectividad se conviertan en una herramienta útil (y creíble) para apoyar su propia toma de decisiones, deberán definir una agenda prioritaria de evaluación de tecnologías, potenciar las actuales estructuras de evaluación de los servicios de salud y financiar la realización de análisis coste-efectividad independientes que realmente informen la toma de decisiones en el Sistema Nacional de Salud. Las guías de publicación de la investigación o las propuestas de estandarización metodológica pueden ayudar a presentar la información de las futuras evaluaciones económicas de una manera rigurosa, clara y coherente28,29. Debe ser prioritario estimular una nueva cultura de relación entre investigadores, expertos y promotores de los estudios basada en la transparencia, y donde posibles conflictos de interés (de tipo económico, personal, etc.) se presenten con suficiente nivel de detalle para un riguroso escrutinio público20,30. Por último, autores, revisores y editores de revistas científicas pueden ayudar a reducir el potencial sesgo de publicación cuando los artículos son valorados por su rigor metodológico, y no tanto en función de la presunta importancia (significación estadística) de los resultados encontrados.
- •
Los análisis coste-efectividad de intervenciones sanitarias pueden servir para guiar la toma de decisiones sobre la elección de programas, servicios y tecnologías en condiciones de recursos limitados.
- •
El número de publicaciones de evaluaciones económicas ha aumentado en los últimos años, siendo muchas de ellas patrocinadas por los fabricantes de las tecnologías evaluadas.
- •
Hasta la fecha, ningún trabajo ha examinado el potencial sesgo de patrocinio de los análisis coste-efectividad realizados en España.
- •
En España, los análisis coste-efectividad publicados presentan una capacidad muy limitada para identificar intervenciones que no fueron coste-efectivas.
- •
Los estudios financiados por la industria fueron menos propensos a presentar conclusiones desfavorables o neutrales, con razones coste-efectividad incremental que se sitúan a menudo por debajo de los umbrales hipotéticos de eficiencia (30.000-50.000€ por AVAC).
- •
Parece necesario desarrollar e implantar estrategias que ayuden a reducir potenciales sesgos en los análisis coste-efectividad publicados.
FC-L ha recibido ayudas de la Generalitat Valenciana (PROMETEOII/2015/021). MR ha recibido ayudas de la Red de Investigación en Servicios de Salud en Enfermedades Crónicas (REDISSEC) del Instituto de Salud CarlosIII.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.