En medicina, el desarrollo de vacunas es uno de los sectores que mayor expansión está teniendo y va a tener en el futuro.
Las novedades principales en este campo se centran en la aparición de una nueva vacuna nonavalente frente al virus de papiloma humano y una nueva vacuna inactivada frente al herpes zóster.
En esta edición se hace especial hincapié en las vacunas del viajero, teniendo en cuenta el auge de los viajes por motivos laborales o por ocio.
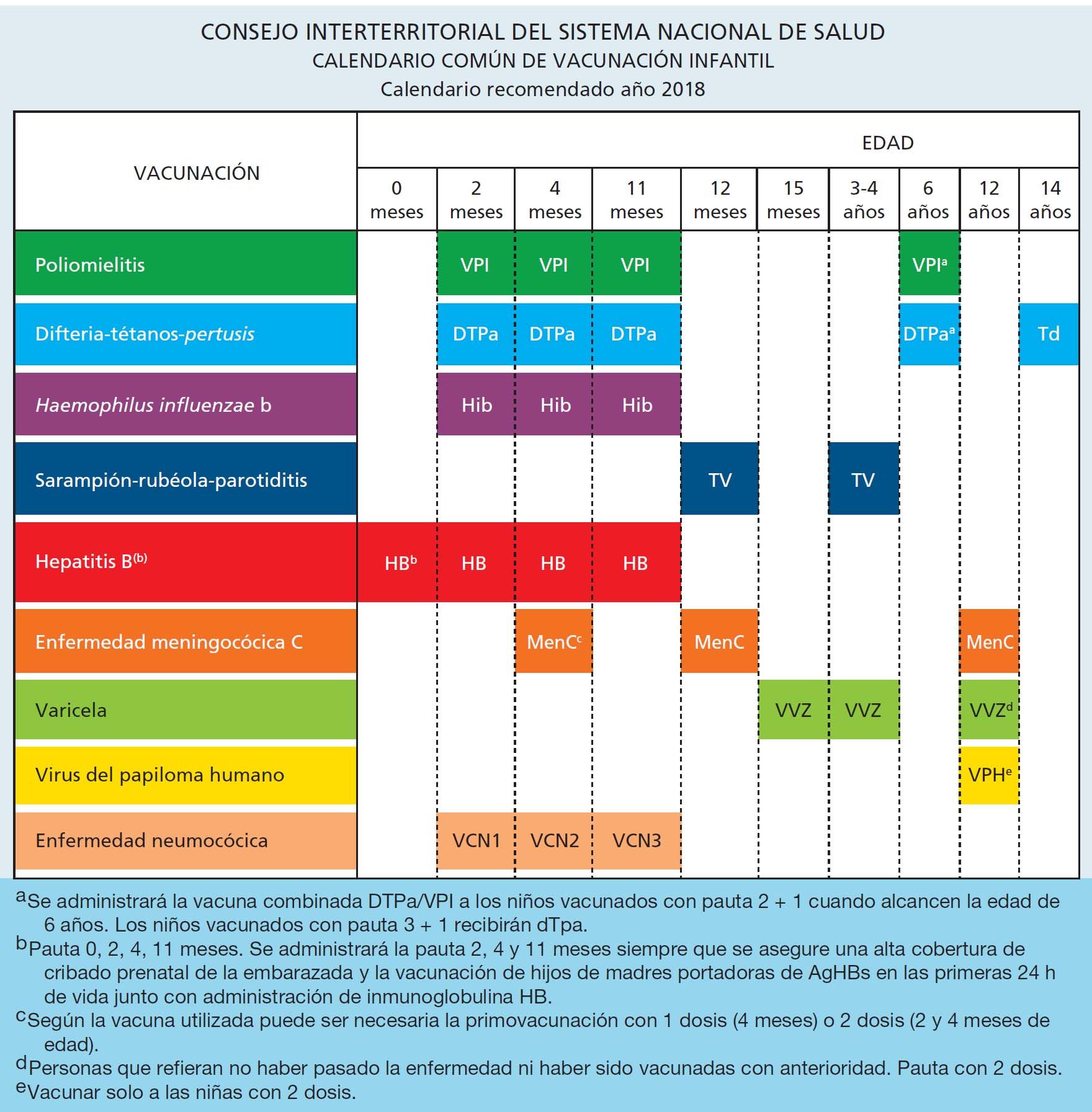
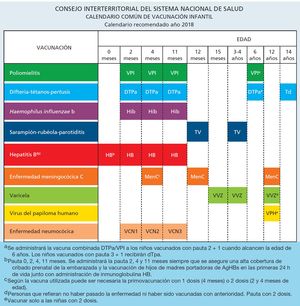
Calendario sistemático común de vacunación infantil
El calendario de vacunación común infantil del Sistema Nacional de Salud recomendado para el año 2018 y acordado por la Comisión de Salud Pública el día 16 de noviembre de 2017 se refleja en la figura 1.
Modelo compartido entre atención primaria y oncología. Adaptada del Cancer Care Manitoba. UPCON - Uniting Primary Care and Oncology. Disponible en: http://www.cancercare.mb.ca/home/health_care_professionals/information_for_health_care_professionals/upcon
Véase tabla 1. Comprobar siempre antecedentes vacunales.
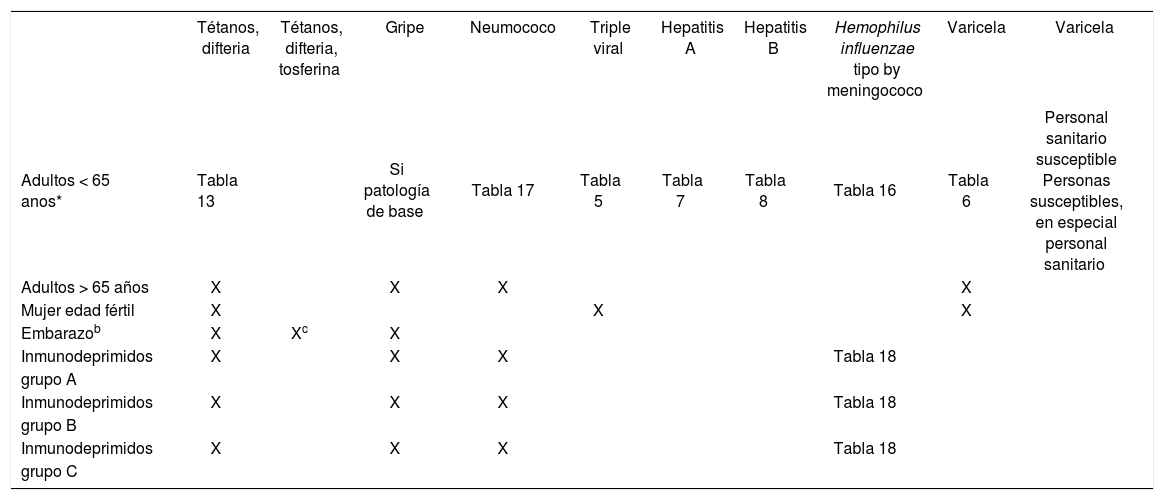
Calendario vacunal del adulto
| Tétanos, difteria | Tétanos, difteria, tosferina | Gripe | Neumococo | Triple viral | Hepatitis A | Hepatitis B | Hemophilus influenzae tipo by meningococo | Varicela | Varicela | |
|---|---|---|---|---|---|---|---|---|---|---|
| Adultos < 65 anos* | Tabla 13 | Si patología de base | Tabla 17 | Tabla 5 | Tabla 7 | Tabla 8 | Tabla 16 | Tabla 6 | Personal sanitario susceptible Personas susceptibles, en especial personal sanitario | |
| Adultos > 65 años | X | X | X | X | ||||||
| Mujer edad fértil | X | X | X | |||||||
| Embarazob | X | Xc | X | |||||||
| Inmunodeprimidos | X | X | X | Tabla 18 | ||||||
| grupo A | ||||||||||
| Inmunodeprimidos | X | X | X | Tabla 18 | ||||||
| grupo B | ||||||||||
| Inmunodeprimidos | X | X | X | Tabla 18 | ||||||
| grupo C |
Contraindicaciones y precauciones generales de las vacunas (en cursivo la actitud recomendada)
| Contraindicaciones |
| Precauciones |
|
Falsas contraindicaciones a la vacunación
|
Véase tabla 4.
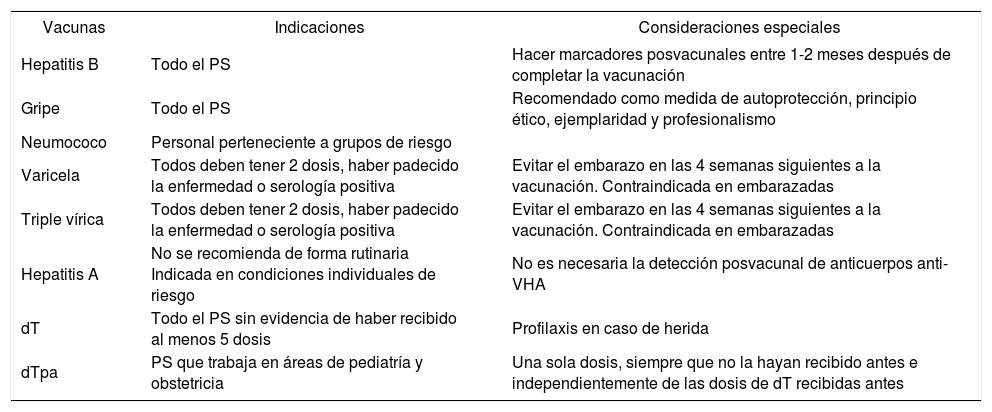
Vacunas recomendadas en el personal sanitario (PS)
| Vacunas | Indicaciones | Consideraciones especiales |
|---|---|---|
| Hepatitis B | Todo el PS | Hacer marcadores posvacunales entre 1-2 meses después de completar la vacunación |
| Gripe | Todo el PS | Recomendado como medida de autoprotección, principio ético, ejemplaridad y profesionalismo |
| Neumococo | Personal perteneciente a grupos de riesgo | |
| Varicela | Todos deben tener 2 dosis, haber padecido la enfermedad o serología positiva | Evitar el embarazo en las 4 semanas siguientes a la vacunación. Contraindicada en embarazadas |
| Triple vírica | Todos deben tener 2 dosis, haber padecido la enfermedad o serología positiva | Evitar el embarazo en las 4 semanas siguientes a la vacunación. Contraindicada en embarazadas |
| Hepatitis A | No se recomienda de forma rutinaria Indicada en condiciones individuales de riesgo | No es necesaria la detección posvacunal de anticuerpos anti-VHA |
| dT | Todo el PS sin evidencia de haber recibido al menos 5 dosis | Profilaxis en caso de herida |
| dTpa | PS que trabaja en áreas de pediatría y obstetricia | Una sola dosis, siempre que no la hayan recibido antes e independientemente de las dosis de dT recibidas antes |
dT: difteria, tétanos; VHA: virus de la hepatitis A.
Se considera personal sanitario a los profesionales sanitarios y a cualquier personal que pueda estar en contacto con pacientes, con materiales potencialmente infecciosos o expuesto a infecciones transmitidas hacia y desde los profesionales sanitarios: personal de limpieza, seguridad, administrativo, estudiantes, mantenimiento, voluntarios, etc.
Vacuna triple vírica: sarampión, rubéola y parotiditisVéase tabla 5.
Recomendaciones de vacunación con triple vírica
|
Es una vacuna de virus vivos atenuados, segura e inmunógena, que produce seroconversión en el 95-100% de los vacunados a los 28 días tras la vacunación.
El sarampión es una enfermedad viral extremadamente contagiosa, que puede ocasionar graves complicaciones, como neumonía y encefalitis, con secuelas graves y alta mortalidad. Los flujos migratorios y el aumento de la movilidad de las personas han propiciado la circulación del virus. En España, el Plan Nacional de Eliminación del Sarampión se inició en 2001. En la actualidad, todas las regiones de la Organización Mundial de la Salud (OMS) tienen objetivos establecidos para su eliminación en 2020.
Respecto a la rubéola, la incidencia en España se encuentra en niveles de eliminación gracias a las altas coberturas alcanzadas con la vacuna triple vírica. El mayor riesgo de esta enfermedad se centra en su teratogenicidad, ya que cuando afecta a una gestante puede provocar en el feto el síndrome de rubéola congénita.
La incidencia de la parotiditis ha ido en aumento desde 2011, con ondas epidémicas como consecuencia de la menor efectividad de la vacuna empleada en la década de 1990, cuyo componente antiparotiditis, la cepa Rubini, tiene una protección evanescente en el tiempo. Desde 2001, la vacuna administrada contiene la cepa Jeryl Lynn o su derivada, la RIT 4385, que proporciona una seroconversión por encima del 95% con una sola dosis y se recomienda una nueva dosis con esta cepa a los individuos que recibieron la vacuna con la cepa Rubini.
Vacuna frente a la varicelaLa varicela es una enfermedad producida por el virus varicela-zóster. La primoinfección provoca la varicela; una vez infectado el organismo, el virus permanece latente durante años y puede producir, en algunos casos, un segundo cuadro clínico, que es el herpes zóster.
En las comunidades autónomas en las que se ha introducido la vacunación sistemática en niños, la incidencia ha disminuido un 93% (tasa de 56/100.000 habitantes/año). La incidencia de la varicela en las cohortes vacunadas de forma sistemática a los 15 meses y 3 años de edad se ha reducido un 98,5% entre los años 2006 y 2012.
Las personas inmunodeprimidas y las embarazadas presentan un mayor riesgo de varicela grave.
Vacunas disponibles frente a la varicelaExisten 2 vacunas monovalentes disponibles.
Indicación-pauta vacunalGrupos de riesgo para la varicela
|
Las vacunas son intercambiables, aunque se recomienda completar la pauta con el mismo preparado.
Está indicada en las personas que no hayan pasado la enfermedad o vacunadas incorrectamente, y que presenten un riesgo importante de sufrir un cuadro grave o complicaciones de la enfermedad, o que pudieran suponer un riesgo para los demás por la posibilidad de contagio. El estado de no protección se comprobará mediante prueba serológica.
En estos grupos de mayor riesgo se vacunará a partir de los 12 meses de edad y a partir de 9 meses, solo en casos excepcionales (tabla 6).
Vacuna frente al herpes zósterActualmente, solo hay una vacuna frente al herpes zóster comercializada en España. Es de virus atenuados de la misma cepa que la varicela, pero con más cantidad de antígeno.
Existe otra vacuna inactivada comercializada en algunos países, y que próximamente lo estará en el nuestro para los mayores de 50 años. Está pendiente de aprobación en Europa.
Indicación-pauta vacunalEstá indicada para la prevención del herpes zóster y la neuralgia posherpética en personas de 50 años o más. A diferencia de la vacuna de la varicela, solo debe administrarse una dosis:
- •
Eficacia protectora global: 51%.
- •
Reducción de la incidencia en personas de 70 años o más: 38%.
Los estudios de seguimiento de esta vacuna han demostrado que su nivel de protección disminuye progresivamente con el paso del tiempo, de forma más significativa a partir de los 5 años de la vacunación.
Hepatitis A y BVéanse tablas de la 7 a la 11.
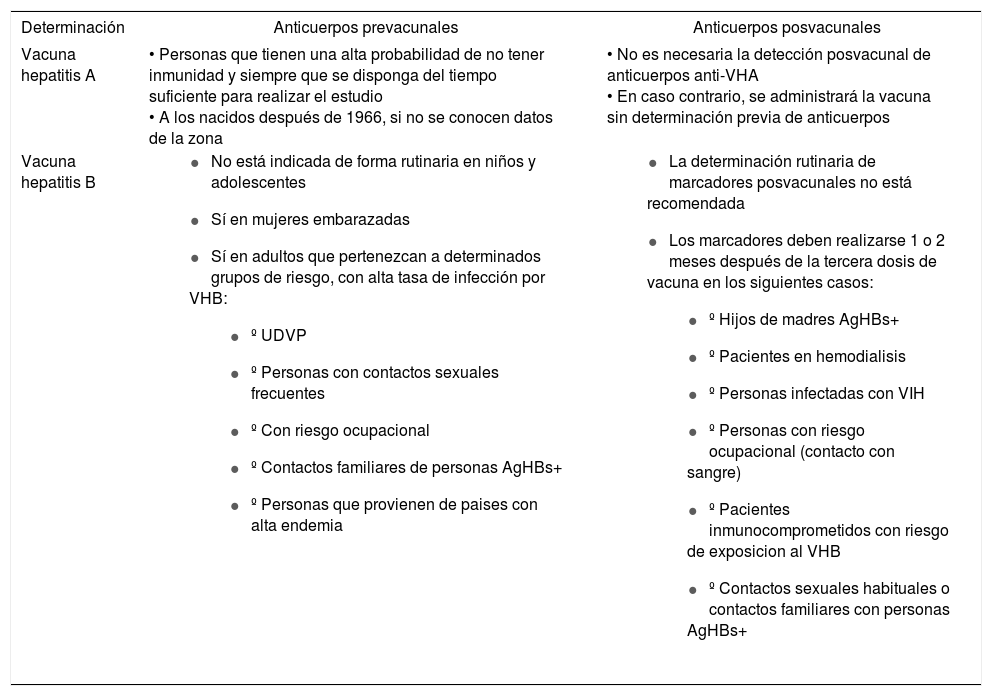
Criterios para la determinación de serologías pre y posvacunales de las hepatitis A y B
| Determinación | Anticuerpos prevacunales | Anticuerpos posvacunales |
|---|---|---|
| Vacuna hepatitis A | • Personas que tienen una alta probabilidad de no tener inmunidad y siempre que se disponga del tiempo suficiente para realizar el estudio • A los nacidos después de 1966, si no se conocen datos de la zona | • No es necesaria la detección posvacunal de anticuerpos anti-VHA • En caso contrario, se administrará la vacuna sin determinación previa de anticuerpos |
| Vacuna hepatitis B |
|
|
AgHBs: antigeno de superficie de la hepatitis B; UDVP: usuarios de drogas por vía parenteral; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VIH: virus de la inmunodeficiencia humana.
Indicaciones de la vacuna de la hepatitis A
|
UDCV: usuarios de drogas por cualquier vía; VIH: virus de la
Indicaciones de la vacuna antihepatitis B
|
AgHBs: antígeno de superficie de la hepatitis B; UDVP: usuarios de drogas por vía parenteral; VHB: virus de la hepatitis B; VIH: virus de la inmunodeficiencia humana.
* Se recomienda el cribado del VHB durante el embarazo para prevenir la transmisión prenatal del VHB, así como la vacunación y administración de inmunoglobulina específica en recién nacidos de madres infectadas por el VHB.
Indicaciones de la vacuna combinada antihepatitis A y B
|
Profilaxis posexposición de hepatitis B en persona expuesta
| No vacunado ni inmunizado | 1 dosis de IgHBb y serie completa de vacunación anti-VHBc | Serie completa de vacunación anti-VHBc | Serie completa de vacunación anti-VHBc |
| Vacunación incompleta | 1 dosis de IgHBb y completar vacunación anti-VHBc | Completar vacunación anti-VHBc | Completar vacunación anti-VHBc |
| Vacunado respondedord | No precisa profilaxis posexposición | No precisa profilaxis posexposición | No precisa profilaxis posexposición |
| Vacunado con 3 dosis no respondedord | 1 dosis de IgHB y segunda serie completa de vacunación anti-VHBc | Segunda serie completa de vacunación anti-VHBc | Segunda serie completa de vacunación anti-VHBc, si se sospecha alto riesgo de la fuente tratar como AgHBs+ |
| Vacunado con 6 dosis no respondedor | IgHB más 2.a dosis de IgHB al mes | No precisa profilaxis posexposición | No precisa profilaxis posexposición. Si se sospecha alto riesgo de la fuente tratar como AgHBs+ |
| Vacunado con respuesta | Realizar anti-HBs: | Realizar anti-HBs: | Realizar anti-HBs: |
| de anticuerpos desconocida | • Si anti-HBs > a 10 U/l, no hacer nada | • Si Anti-HBs > a 10 U/l no hacer nada | • Si anti-HBs > a 10 U/l no hacer nada |
| • Si anti-HBs < 10 mUI/ml, 1 dosis de IgHB + 1 dosis de vacuna anti-VHB | • Si anti-HBs < 10 mUI/ml, 1 dosis de vacuna anti-VHB | • Si anti-HBs < 10 mUI/ml 1 dosis de vacuna anti-VHB. Si se sospecha alto riesgo de la fuente tratar como AgHBs+ |
IgHB: inmunoglobulina antihepatitis B; VHB: virus de la hepatitis B.
Véase tabla 12.
Indicaciones y pautas de la vacuna del virus del papiloma humano (VPH)
|
El virus del papiloma humano (VPH) es un virus de transmisión sexual, y puede producir lesiones en la piel y las mucosas, tanto genitales y anales como orofaríngeas. La prevalencia de la infección está en relación inversa con la edad (el 29% a los 20-25 años frente al 7% en mayores de 60 años) y en relación directa con el número de parejas sexuales. La prevalencia global se estima en un 14%.
Los tipos 16 y 18, de alto riesgo oncogénico, se han relacionado con el 70% de los cánceres de cérvix en el ámbito mundial (en España con el 72,4%). Los tipos 31, 33, 45, 52 y 58, también de alto riesgo, causan un 20% adicional. Además, los tipos 16 y 18 causan el 90% de cáncer anal, así como una parte importante de cáncer de orofaringe, vulva, vagina y pene. Los tipos 6 y 11, de bajo riesgo oncogénico, están relacionados con el 90% de verrugas anogenitales o condilomas.
Existen 3 tipos de vacunas desarrolladas para prevenir la infección por el VPH y sus enfermedades relacionadas:
- •
Vacuna bivalente, frente a 2 tipos de alto riesgo oncogénico: 16 y 18.
- •
Vacuna tetravalente, frente a 2 tipos de alto riesgo (16 y 18) y 2 de bajo riesgo (6 y 11).
- •
Vacuna nonavalente, añade a los 4 anteriores otros 5 de alto riesgo (31, 33, 45, 52 y 58).
Existe beneficio global en la reducción de cánceres y lesiones premalignas al vacunar frente al VPH, tanto a varones como a mujeres. El beneficio absoluto directo en varones es menor que en mujeres debido a la menor carga de enfermedad por VPH en ellos. Esto hace que la vacunación en varones sea menos coste-efectiva, en el contexto de coberturas vacunales elevadas en mujeres.
Vacuna antitetánicaEl tétanos puede afectar a cualquier persona no vacunada, independientemente de la edad o clase social, con elevada tasa de mortalidad, incluso en nuestro ámbito. La vacunación no conlleva inmunidad de grupo, por lo que la indicación de vacunar frente al tétanos es universal.
En España se comercializa como vacuna combinada. Para el adolescente y adulto se administra la Td con baja carga antigénica de toxoide antidiftérico (d) o la tribacteriana (dTpa), a la que se añade el componente antitosferina, también de baja carga antigénica (pa) (tablas 13-15).
|
Td: vacuna tétanos-difteria.
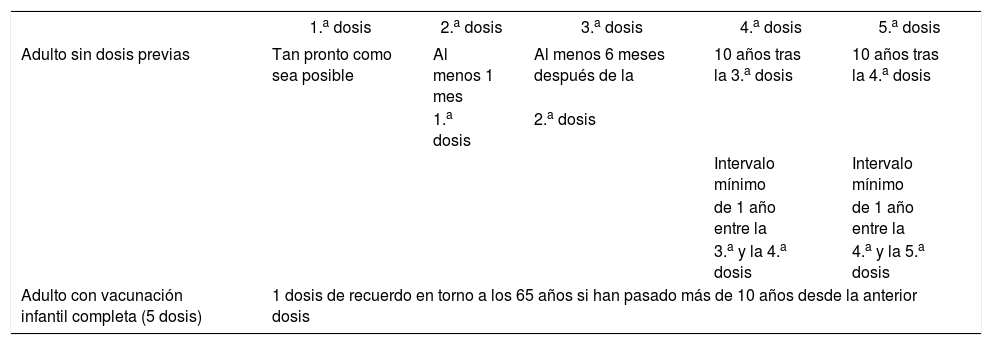
Pauta de vacunación de tétanos-difteria del adulto
| 1.a dosis | 2.a dosis | 3.a dosis | 4.a dosis | 5.a dosis | |
|---|---|---|---|---|---|
| Adulto sin dosis previas | Tan pronto como sea posible | Al menos 1 mes | Al menos 6 meses después de la | 10 años tras la 3.a dosis | 10 años tras la 4.a dosis |
| 1.a dosis | 2.a dosis | ||||
| Intervalo mínimo | Intervalo mínimo | ||||
| de 1 año entre la | de 1 año entre la | ||||
| 3.a y la 4.a dosis | 4.a y la 5.a dosis | ||||
| Adulto con vacunación infantil completa (5 dosis) | 1 dosis de recuerdo en torno a los 65 años si han pasado más de 10 años desde la anterior dosis | ||||
Recomendaciones para la prevención del tétanos en caso de herida
| Antecedentes de vacunacióna | Herida limpia | Herida tetanígenab,c | ||
|---|---|---|---|---|
| Vacuna (Td) | IGTd | Vacuna (Td) | IGTd | |
| < 3 dosis | Sí (completar vacunación) | No | Sí (completar vacunación) | Sí |
| 3 o 4 dosis | No (si hace más de 10 años desde la última dosis, administrar 1 dosis) | No | No (si hace más de 5 años desde la última dosis, administrar 1 dosis) | Noc |
| 5 o más dosis | No | No | No (si hace más de 10 años desde la última dosis, valorar la administración de una única dosis adicional en función del tipo de herida) | Noc |
IGT: inmunoglobulina antitetánica; Td: vacuna tétanos-difteria.
En inmunodeprimidos y usuarios de drogas por vía parenteral se administrará 1 dosis de inmunoglobulina en caso de heridas tetanígenas, independientemente del estado de vacunación.
Heridas potencialmente tetanígenas: heridas o quemaduras con un importante grado de tejido desvitalizado; úlceras crónicas, gangrenosas; herida punzante (particularmente en la que ha habido contacto con suelo o estiércol), las contaminadas con cuerpo extraño, fracturas con herida, mordedura, congelación, las que requieran intervención quirúrgica y que esta se retrasa más de 6 h, y las que se presenten en pacientes que tienen sepsis. Se han descrito casos asociados a tatuajes y piercings.
En países industrializados, la enfermedad es excepcional y afecta a personas mal vacunadas. La experiencia demuestra que, tras la importación de casos, no se han mantenido cadenas de transmisión si la cobertura de vacunación infantil es elevada. El último caso de difteria en España se declaró en mayo de 2015 y afectó a un niño no vacunado (tabla 14).
Vacuna antipertussis o tosferinaEn España, como en los países industrializados, a pesar de mantener elevadas coberturas de vacunación infantil, se observan ciclos epidémicos de tosferina cada 3-5 años, con un aumento sostenido de casos desde el año 2010. Afectan a niños menores de 1 año, sobre todo a lactantes menores de 2 meses que todavía no han recibido la vacuna. La evidencia disponible muestra que las vacunas acelulares frente a la tosferina son efectivas para prevenir la enfermedad, aunque solo proporcionan una protección a corto plazo. Últimamente se asiste al problema de desabastecimiento de algunas vacunas y, conctretamente con esta, a la escasez en la fabricación del componente pertussi acelular. El Ministerio y las sociedades científicas recomendamos dirigir los esfuerzos a prevenir las hospitalizaciones y los fallecimientos en niños menores de 3 meses de edad, manteniendo el actual esquema de vacunación al lactante con un recuerdo a los 6 años de edad y vacunar a la embarazada en el último trimestre de su gestación. La efectividad de estas medidas es elevada y está en función de las coberturas de vacunación alcanzadas. En el embarazo depende también de la semana de gestación al vacunar. No se han observado problemas de seguridad en la gestación, en el parto, ni en el neonato.
La vacuna se administrará en cada embarazo, independientemente de su estado previo de vacunación
Grados de recomendación: toxoides antidiftérico y antitetánico: grado de recomendación A, nivel 1.
- •
El antecedente de una primovacunación con 3 dosis a intervalos mínimos correctos posee el mayor valor predictivo de protección frente a las formas graves de tétanos.
- •
Una serie completa de vacunación con 5 dosis (primovacunación 0, 1, 7 meses y 2 dosis de recuerdo a lo largo de la vida) con la vacuna adecuada y respetando los intervalos mínimos entre dosis, hace innecesaria la revacunación cada 10 años.
Vacunas antipertussis acelulares: la revisión de la OMS, aplicando el sistema GRADE evidencia su eficacia al compararlas con controles placebo o no vacunado (disponible en: http://www.who.int/immunization/position_papers/PertussisGradeTable1.pdf)
GripeLas epidemias anuales de gripe se asocian a una importante tasa de hospitalizaciones, mortalidad y aumento de la demanda de recursos en salud. Hay relación entre la infección de gripe y procesos como infarto de miocardio o ingresos hospitalarios en grupos de riesgo para la vacunación, como los diabéticos.
Existen varias vacunas de la gripe: trivalentes (con 2 cepas de virus A y 1 del B) y tetravalentes (con 2 cepas de virus A y 2 del B); fraccionadas y de subunidades; de subunidades adyuvadas con MF59™ o con virosomas, y de subunidades para su administración intradérmica. Inactivadas o atenuada intranasal. Fabricadas en cultivos sobre huevos de ave, o recombinante libre de huevo. La disponibilidad y el uso de unas u otras están sujetos a las compras y recomendaciones de las autoridades sanitarias.
Las vacunas de la gripe deben modificarse año a año, y su composición debe adaptarse a las cepas que se prevé que van a circular en la temporada siguiente. La eficacia/efectividad de la vacuna antigripal, con frecuencia menospreciada, está sujeta a factores como la concordancia anual de la vacuna con los virus circulantes, el nivel de inmunidad y la cobertura vacunal de la población, las características personales de los pacientes (como edad, enfermedades de base, vacunaciones antigripales previas, etc.), el diseño de los estudios sobre resultados de la vacunación o los indicadores a los que se aplica (p. ej., gripe confirmada por laboratorio, ingresos hospitalarios, ingresos en unidades de cuidados intensivos o mortalidad). En consecuencia, se debería considerar su efectividad aplicándola para un objetivo concreto y como el promedio de los resultados obtenidos en sucesivas epidemias de gripe estacional.
A pesar de estas limitaciones, la vacuna de la gripe es el medio más eficaz disponible para prevenir las consecuencias graves o mortales de la gripe en grupos riesgo con morbilidades subyacentes o grupos de edad más susceptibles de padecerlas. En mayores de 60 años reduce la gripe confirmada por laboratorio y sus hospitalizaciones. Es efectiva para prevenir la infección y sus complicaciones en niños y en mujeres embarazadas, tanto para la madre como para el recién nacido hasta los 6 meses de edad. Ha demostrado reducción de eventos cardiovasculares (infarto de miocardio, accidente cerebrovascular) relacionados con la infección gripal.
La vacuna es segura; está contraindicada es caso de reacción alérgica grave previa a la vacuna, en menores de 6 meses de edad y en alérgicos a excipientes contenidos en la vacuna. La tradicional contraindicación por alergia al huevo, ha pasado a ser una precaución para la administración de la vacuna en función de los síntomas previos ocurridos. También ha cambiado la indicación en mujeres gestantes: está indicada en cualquier trimestre del embarazo.
La vacuna antigripal, en cualquiera de sus presentaciones, no puede causar enfermedad gripal.
Los grupos de riesgo para los que se recomienda la vacuna antigripal aparecen en la tabla 1.
Vacunas antimeningocócicasLa enfermedad meningocócica invasiva (EMI) (sepsis o meningitis) es letal hasta en un 10-14% de los casos, aunque su tasa de incidencia es baja y su tendencia en España en las últimas temporadas, descendente.
Los serogrupos A, B, C, W135, X e Y son los principales responsables de la EMI, ya sea esporádica o en brotes. En los países industrializados, en los que predominan los serogrupos B y C, tras la introducción de la vacuna frente al serogrupo C en el calendario de vacunación sistemática infantil, el serogrupo B se ha convertido en el principal responsable.
Los grupos más vulnerables son los lactantes, niños de 1-4 años y adolescentes de 15-19 años. Se estima una presencia de portadores asintomáticos en torno al 10%. Después de la infección, así como tras el estado de portador, se suele producir inmunidad específica de grupo de duración desconocida (tabla 16).
Grupos de riesgo con indicación de vacunación frente a meningococo
| Monovalente C |
|
| Monovalente C y monovalente B (no administrar conjuntamente en el mismo acto vacunal) |
|
| Tetravalente ACWY |
|
EMI: enfermedad meningocócica invasiva.
Se dispone de 5 vacunas conjugadas, 3 monovalentes frente al serogrupo C y 2 multivalentes frente a los serogrupos A, C y W135Y. Todas tienen capacidad de producir anticuerpos circulantes desde los primeros meses, memoria inmunológica y protección de grupo. Las vacunas son inactivadas y el antígeno es el oligosacárido/polisacárido capsular de los diferentes serogrupos unido a una proteína transportadora. También se dispone de una sexta vacuna recombinante multiantigénica frente al serogrupo B.
Pauta de vacunación• Meningococo C. En adultos y adolescentes se recomienda una dosis única intramuscular en el deltoides.
- •
Meningococo B. La pauta sería de 2 dosis separadas al menos 1 mes, pero en estos momentos la epidemiología no justifica la inclusión de esta vacuna en el calendario sistemático. Las autoridades sanitarias valorarán su utilización en brotes y casos aislados de enfermedad meningocócica por el serogrupo B. No hay datos para adultos mayores de 50 años de edad. Se desconoce la efectividad de la vacuna y la persistencia de los niveles protectores de anticuerpos a medio y largo plazo. No se dispone de datos de administración concomitante con las vacunas antimeningocócicas conjugadas de serogrupo C ni con las vacunas antineumocócicas conjugadas de 10 y 13 serotipos.
- •
Las vacunas tetravalentes (ACWY) deberían ser de elección en el viajero a zonas endémicas. Se administran en dosis única o como dosis de recuerdo de otras vacunas antimeningocócicas. La necesidad y dosis de recuerdo las define cada país en función de la epidemiología.
- •
Se vacunará a los contactos de casos de meningitis en brotes cuando esté disponible para el serogrupo confirmado del caso índice, como complemento a la quimioprofilaxis, según las recomendaciones de la autoridad sanitaria. En los contactos de casos esporádicos se recomienda vacunar solo a los contactos cercanos con factores de riesgo, pero no a los contactos sanos.
Reacciones locales leves (enrojecimiento e hinchazón en el punto de inyección) hasta en un 50% de los vacunados.
ContraindicacionesLas generales de las vacunas.
Vacunas antineumocócicasStreptococcus pneumoniae o neumococo es un patógeno del que se han identificado más de 90 serotipos. Produce patología a cualquier edad; su incidencia y gravedad son más importantes en los 2 extremos de la vida. En niños se manifiesta como otitis media aguda, neumonía, bacteriemia-sepsis y meningitis. En adultos, la manifestación clínica más frecuente es la neumonía no bacteriémica (75%), la neumonía bacteriémica, la sepsis y la meningitis. En España es el patógeno más frecuente identificado en la neumonía adquirida en la comunidad (NAC), y produce casi un tercio de estas, con una mortalidad que alcanza cifras del 10-30% en la neumonía bacteriémica del anciano. La edad aumenta la incidencia y la gravedad del cuadro. Se han identificado diferentes situaciones de base que predisponen a sufrir la enfermedad, como estados de inmunosupresión, tabaquismo, enfermedad pulmonar obstructiva crónica y diabetes. La tasa aproximada de incidencia en la población general de NAC es de 3 casos/100.000 habitantes/año, que se multiplica por 5 en mayores de 85 años.
Vacunas disponibles- •
Vacuna antineumocócica 23v. Recomendada en personas de 2 años de edad o mayores que presenten un mayor riesgo de morbilidad y mortalidad por la enfermedad neumocócica. Está incluida en el calendario vacunal de las diferentes comunidades autónomas desde el año 2003 para la vacunación de adultos. Es una vacuna inactivada de polisacáridos capsulares que contiene 23 serotipos, y cubre un 60-70% de los serotipos circulantes causantes de la enfermedad. No erradica la colonización nasofaríngea ni produce efecto rebaño. Produce una respuesta inmunitaria basada en la producción de inmunoglobulinas por linfocitos B, que decae con el tiempo y en pocos años desaparece. No produce memoria inmunológica. Induce el fenómeno de tolerancia inmune o hiporrespuesta con las revacunaciones, por lo que los refuerzos no son eficaces.
- •
Vacuna antineumocócica 13v conjugada. Incluye 13 serotipos. No existe protección cruzada, por lo que su nivel de protección depende de los serotipos circulantes. Produce memoria inmunológica. La inmunidad se mantiene varios años. Tiene capacidad parar erradicar la bacteria de la nasofaringe y produce efecto rebaño. La debilidad de esta vacuna radica en que produce reemplazo de serotipos, con lo que, con los años, los serotipos que producen enfermedad son diferentes a los incluidos en la vacuna, y pierde su capacidad de protección. Los últimos datos publicados en Gran Bretaña indican que se ha producido un rápido reemplazo y, como consecuencia, la vacuna apenas cubre un tercio de los serotipos productores de enfermedad. Además, puede seleccionar serotipos resistentes a antibióticos. Se puede utilizar en adultos.
- •
Vacuna conjugada 10v. Vacuna frente a 10 serotipos utilizada para la prevención de enfermedad invasora y otitis media aguda causada por neumococo en lactantes y niños desde las 6 semanas hasta los 5 años de edad.
Consultar los siguientes enlaces:
Pauta. Vía de administraciónVéase tabla 17.
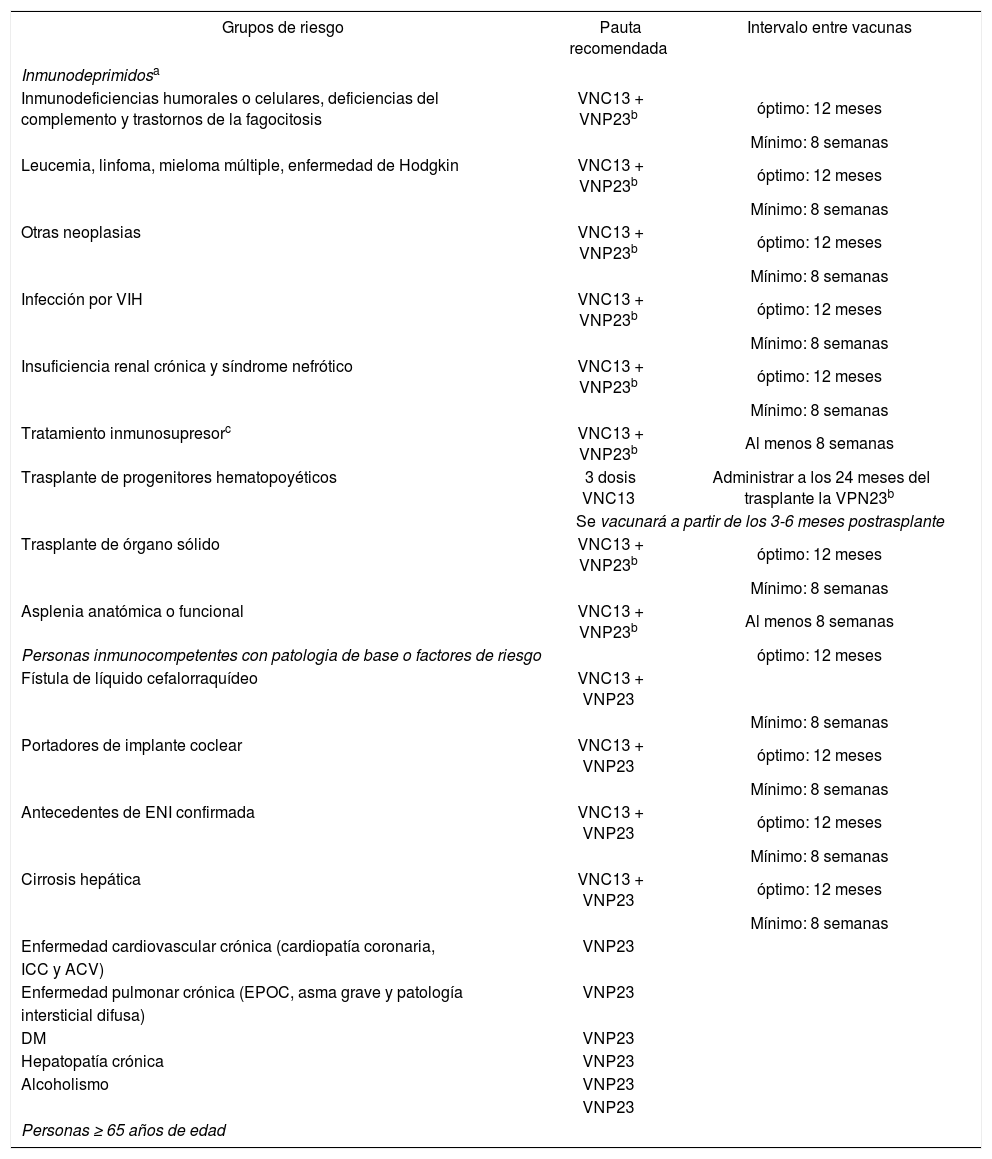
Pautas de vacunación antineumocócica en adultos
| Grupos de riesgo | Pauta recomendada | Intervalo entre vacunas |
|---|---|---|
| Inmunodeprimidosa | ||
| Inmunodeficiencias humorales o celulares, deficiencias del complemento y trastornos de la fagocitosis | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Leucemia, linfoma, mieloma múltiple, enfermedad de Hodgkin | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Otras neoplasias | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Infección por VIH | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Insuficiencia renal crónica y síndrome nefrótico | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Tratamiento inmunosupresorc | VNC13 + VNP23b | Al menos 8 semanas |
| Trasplante de progenitores hematopoyéticos | 3 dosis VNC13 | Administrar a los 24 meses del trasplante la VPN23b |
| Se vacunará a partir de los 3-6 meses postrasplante | ||
| Trasplante de órgano sólido | VNC13 + VNP23b | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Asplenia anatómica o funcional | VNC13 + VNP23b | Al menos 8 semanas |
| Personas inmunocompetentes con patologia de base o factores de riesgo | óptimo: 12 meses | |
| Fístula de líquido cefalorraquídeo | VNC13 + VNP23 | |
| Mínimo: 8 semanas | ||
| Portadores de implante coclear | VNC13 + VNP23 | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Antecedentes de ENI confirmada | VNC13 + VNP23 | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Cirrosis hepática | VNC13 + VNP23 | óptimo: 12 meses |
| Mínimo: 8 semanas | ||
| Enfermedad cardiovascular crónica (cardiopatía coronaria, | VNP23 | |
| ICC y ACV) | ||
| Enfermedad pulmonar crónica (EPOC, asma grave y patología | VNP23 | |
| intersticial difusa) | ||
| DM | VNP23 | |
| Hepatopatía crónica | VNP23 | |
| Alcoholismo | VNP23 | |
| VNP23 | ||
| Personas ≥ 65 años de edad | ||
ACV: accidente cerebrovascular; DM: diabetes mellitus; ENI: enfermedad neumocócica invasiva; EPOC: enfermedad pulmonar obstructiva crónica; ICC: insuficiencia cardíaca congestiva.
a En el caso de haber recibido con anterioridad una/s dosis de VNP23, se aplicará la misma pauta pero dejando al menos 12 meses de intervalo entre la última dosis de VNP23 y el inicio de la pauta secuencial. Si han recibido 2 dosis de VNP23 antes de los 64 años, recibirán una tercera a partir de los 65 años siempre que hayan transcurrido 5 o más años desde la dosis anterior.
bRevacunación con VNP23 al menos 5 años después.
cIncluye tratamiento con esteroides a dosis inmunosupresoras o con agentes biológicos.
Toda mujer en edad fértil debería tener al día su calendario vacunal y planear un embarazo estando inmune frente al tétanos, para la prevención del tétanos neonatal, frente a la rubéola, para evitar el síndrome de rubéola congénita, y frente a la hepatitis B, pero sobre todo frente a las enfermedades inmunoprevenibles con vacunas atenuadas: varicela, sarampión y parotiditis, cuya administración está contraindicada durante el embarazo.
La decisión de vacunar a una mujer embarazada se debe basar en la valoración de la probabilidad real de infección, del riesgo que supone la enfermedad para la madre y el feto y de los efectos de la vacuna sobre ellos, y poder inmunizar al recién nacido a través de la vacunación de la madre hasta que el lactante inicie su calendario vacunal.
Las vacunas de gérmenes muertos o inactivados, toxinas o polisacáridos se pueden administrar durante el embarazo, aunque se recomienda preferentemente que sea durante el segundo y el tercer trimestres, debido a la falta de estudios en el primer trimestre, y para evitar la asociación coincidente con el aborto espontáneo, que ocurre más frecuentemente al inicio de la gestación.
Están contraindicadas las vacunas de gérmenes vivos atenuados, que deben evitarse incluso durante las 4 semanas previas a la concepción, aunque no se han evidenciado efectos adversos para la gestación o para el feto en el caso de la administración inadvertida y no justifica la interrupción del embarazo.
La vacuna de la gripe se debe recomendar a todas las embarazadas en las que la gestación coincida con el período epidémico, por un mayor riesgo de complicaciones por gripe en el embarazo. Asimismo, los anticuerpos maternos protegerán al recién nacido durante los 6 primeros meses de vida, en los que aún no puede aplicarse la vacuna antigripal.
Para proteger al recién nacido frente a la tosferina antes de que inicie su vacunación, se debe vacunar a partir de la semana 27 de gestación (preferentemente entre la 28 y la 32) a todas las embarazadas con una dosis de Tdpa, independientemente de las dosis previas contabilizadas de Td o de Tdpa y en cada embarazo.
El puerperio es un momento idóneo para completar la inmunización que no pudo realizarse en el período gestacional.
En el período de lactancia materna se puede administrar cualquier tipo de vacuna de nuestro calendario, tanto a la madre como al niño. Se puede administrar cualquier vacuna de gérmenes vivos atenuados a los convivientes de las embarazadas.
Vacunación en pacientes inmunocomprometidosLos pacientes inmunocomprometidos tienen una mayor susceptibilidad a las infecciones y una respuesta inmunitaria inferior. Las pautas vacunales se deben individualizar y adaptar. En general, las vacunas inactivadas, toxoides y de polisacáridos se administran con las mismas recomendaciones. Las vacunas atenuadas (varicela, triple vírica, polio oral, fiebre tifoidea oral, cólera oral, fiebre amarilla, herpes zóster y gripe intranasal) están contraindicadas en inmunodepresión grave.
Es preferible vacunar en fases tempranas de la enfermedad, de 2 a 4 semanas antes del inicio del tratamiento inmunosupresor o de 1 a 6 meses después si la inmunodepresión es transitoria.
Se aconseja revisar la respuesta por serología a las 4-6 semanas con el objetivo de programar dosis de refuerzo si fuesen necesarias.
El personal sanitario que atiende a estos pacientes, los cuidadores y los convivientes deberían ser inmunes a la hepatitis A, la polio, la varicela, el sarampión, la parotiditis, la triple vírica, la tosferina y la gripe.
Recomendaciones de vacunación según el grado de inmunodepresiónVéase tabla 18.
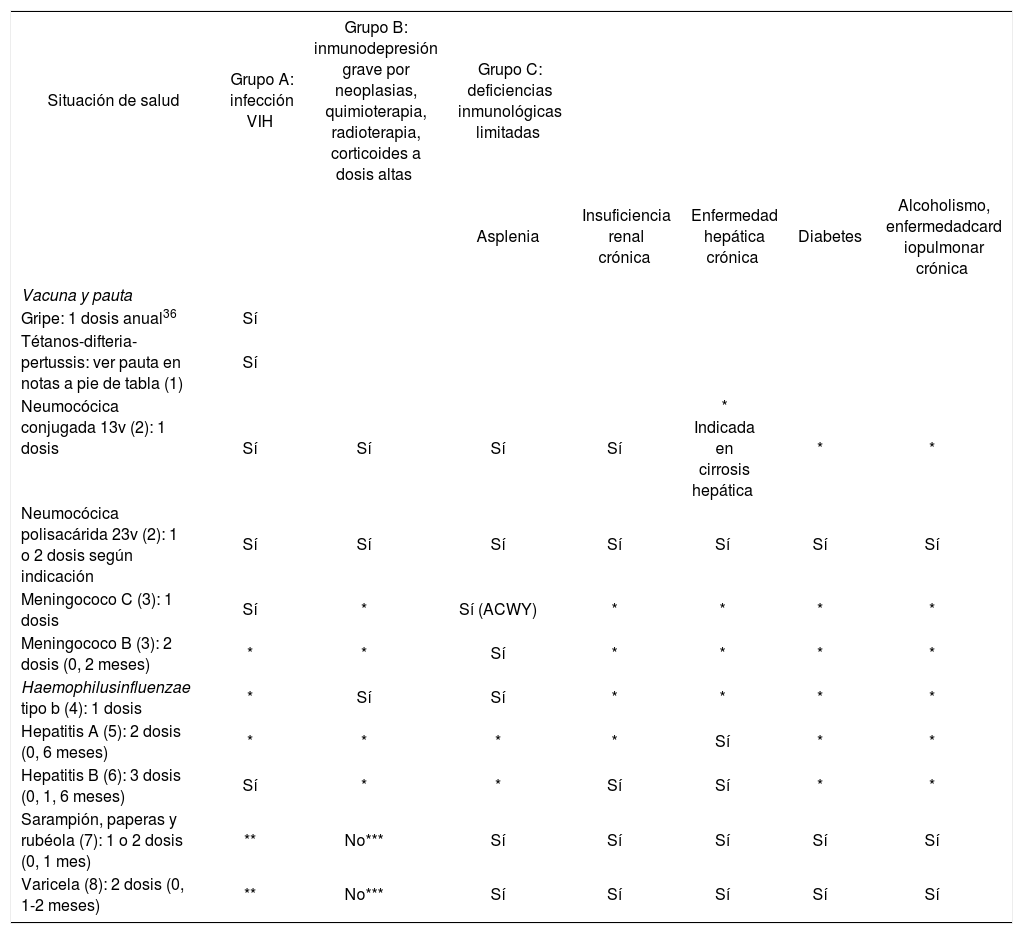
Recomendaciones de vacunación en adultos inmunodeprimidos según el estado de salud.
| Situación de salud | Grupo A: infección VIH | Grupo B: inmunodepresión grave por neoplasias, quimioterapia, radioterapia, corticoides a dosis altas | Grupo C: deficiencias inmunológicas limitadas | ||||
|---|---|---|---|---|---|---|---|
| Asplenia | Insuficiencia renal crónica | Enfermedad hepática crónica | Diabetes | Alcoholismo, enfermedadcard iopulmonar crónica | |||
| Vacuna y pauta | |||||||
| Gripe: 1 dosis anual36 | Sí | ||||||
| Tétanos-difteria-pertussis: ver pauta en notas a pie de tabla (1) | Sí | ||||||
| Neumocócica conjugada 13v (2): 1 dosis | Sí | Sí | Sí | Sí | * Indicada en cirrosis hepática | * | * |
| Neumocócica polisacárida 23v (2): 1 o 2 dosis según indicación | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Meningococo C (3): 1 dosis | Sí | * | Sí (ACWY) | * | * | * | * |
| Meningococo B (3): 2 dosis (0, 2 meses) | * | * | Sí | * | * | * | * |
| Haemophilusinfluenzae tipo b (4): 1 dosis | * | Sí | Sí | * | * | * | * |
| Hepatitis A (5): 2 dosis (0, 6 meses) | * | * | * | * | Sí | * | * |
| Hepatitis B (6): 3 dosis (0, 1, 6 meses) | Sí | * | * | Sí | Sí | * | * |
| Sarampión, paperas y rubéola (7): 1 o 2 dosis (0, 1 mes) | ** | No*** | Sí | Sí | Sí | Sí | Sí |
| Varicela (8): 2 dosis (0, 1-2 meses) | ** | No*** | Sí | Sí | Sí | Sí | Sí |
VIH: virus de la inmunodeficiencia humana.
Recomendada en caso de presentar otros factores de riesgo asociados a la edad, salud, trabajo o estilo de vida.
**No administrar la vacuna triple vírica (ni otras vacunas que contengan el virus del sarampión) ni la vacuna frente a varicela/herpes zóster a personas infectadas por el VIH con inmunosupresión grave (CD4 < 200).
***En cáncer e inmunosupresión pueden recibir triple vírica y varicela cuando estén indicadas a partir de 6 meses de finalizar el tratamiento.
(1) Tétanos-difteria-pertussis64
Personas vacunadas en la infancia (6 dosis) 1 dosis de Td de recuerdo en torno a los 65 años.
Personas primovacunadas en la edad adulta (3 dosis: 0, 1, 6-12 meses), 2 dosis de recuerdo con un intervalo de 10 años. Se recomienda que al menos una dosis de Td a lo largo de la vida sea sustituida por dTpa.
Administración de vacuna dTpa a mujeres embarazadas entre las semanas 27 y 36 de gestación. La vacuna se administrará en cada embarazo independientemente de su estado previo de vacunación.
(2) Neumocócica conjugada 13v (VNC13) y neumócica polisacárida 23v (VNP23)43
Cuando existe indicación para utilizar ambas vacunas (polisacárida y conjugada) se sigue la pauta secuencial VNC13 + VNP23 con un intervalo de 12 meses (mínimo 8 semanas).
En el caso de haber recibido con anterioridad una(s) dosis de VNP23 se aplicará la misma pauta, pero dejando al menos 12 meses de intervalo entre la última dosis de VNP23 y el inicio de la pauta secuencial.
Si han recibido 2 dosis de VNP23 antes de los 64 años recibirán una tercera a partir de los 65 años, siempre que hayan transcurrido 5 o más años desde la dosis anterior.
Revacunación con VNP23 al menos 5 años después en infección VIH, inmunodepresión grave, asplenia, insuficiencia renal y trasplantados.
La vacunación en pacientes con infección VIH debe iniciarse tan pronto como sea posible tras el diagnóstico.
(3) Meningococo C83’116y meningoco B84’117-119
Se consideran factores de riesgo para enfermedad meningocócica invasiva:
- •
Deficiencia de properdina o deficiencias de factores terminales del complemento (incluyendo las que reciben o van a recibir eculizumab).
- •
Asplenia o disfunción esplénica grave (anemia de células falciformes) y resección quirúrgica programada.
- •
Episodio de enfermedad meningocócica invasiva previo.
- •
Personal de laboratorio que trabaje con muestras
No se dispone por el momento de datos de inmunogenicidad ni de eficacia de la vacuna frente a meningococo B en estas poblaciones; la recomendación se basa en el mayor riesgo de enfermedad neumocócica invasiva en estos grupos. El intervalo mínimo aconsejado entre dosis es de 1 mes.
En individuos con asplenia, infección por VIH, deficiencia del complemento y terapia con eculizumab, y en brotes epidémicos y situaciones específicas, se debe considerar utilizar la vacuna conjugada tetravalente frente a serogrupos A, C, Y y W en lugar de la vacuna conjugada frente a serogrupo C. Si el riesgo es persistente se puede considerar una dosis de recuerdo cada 5 años. Para otros supuestos hay que valorar la situación epidemiológica.
En el VIH no se requiere vacunación rutinaria frente a MenB debido a que la meningitis es causada preferentemente por los serogrupos C, W e Y.
(4)Haemophilus influenzae tipo b (Hib)no
Se recomienda vacunación sistemática con una dosis en los pacientes en los que existe incremento de riesgo de enfermedad invasiva por Hib:
- •
Asplenia.
- •
Deficiencia de inmunoglobulinas o factores tempranos del complemento.
- •
Receptores de trasplante de células hematopoyéticas.
- •
Pacientes que reciben quimioterapia o radioterapia por neoplasias malignas.
La infección por HIV también aumenta el riesgo, pero como la incidencia es muy baja no se recomienda vacunación sistemática.
(5) Hepatitis A
Indicada en pacientes con hepatopatía crónica, los que se van a someter a trasplante hepático y los receptores de transfusiones o hemoderivados de manera repetida. Los nacidos antes de 1960 se consideran inmunes.
(6) Hepatitis B
En España, la vacunación frente a la HB está incluida en el calendario vacunal desde 1990.
Se consideran títulos protectores valores de anti-HBs ≥ 10 U/l. Recomendado comprobar seroconversión (anticuerpos anti-HBs) entre 1 y 3 meses después de una pauta completa. En el caso de que no haya respuesta a la vacuna se pueden administrar 3 dosis adicionales y, de seguir sin respuesta, ya no se indicarán nuevas series y se considerarán no respondedores. En pacientes en hemodiálisis e inmunodeprimidos se utiliza mayor cantidad de antígeno y conviene verificar que persisten títulos protectores con el tiempo; si los títulos descienden por debajo de 10 U/l, se administrará una dosis de refuerzo.
(7) Triple vírica (sarampión, paperas y rubéola) (TV)
Los adultos nacidos antes de 1966 se consideran inmunes. Se recomienda una segunda dosis de vacuna TV en los nacidos desde 1966 expuestos a un caso, a un brote, que viajen a zonas de riesgo o que trabajen en centros sanitarios y educativos.
No administrar TV a mujeres embarazadas o que pudieran quedarse embarazadas dentro de las 4 semanas siguientes a la administración de la vacuna.
(8) Varicela50
Se consideran inmunes los adultos que nacieron antes de 1966.
La vacunación está contraindicada en el embarazo, la leucemia, los linfomas y otras neoplasias malignas que afecten a la médula ósea o al sistema linfático, con excepción de la leucemia linfoblástica aguda en pacientes susceptibles que cumplan determinados criterios clínicos, analíticos y terapéuticos.
No debe administrarse a personas que reciban terapia inmunosupresora (incluye esteroides a dosis > 2 mg/kg/día o > 20 mg/día de prednisona o su equivalente), pero pueden recibirla pasado 1 mes de la suspensión del tratamiento.
Modificada de Centers for Disease Control and Prevention 2017.
Grupo A: Pacientes infectados por el virus de la inmunodeficiencia humana (VIH). Con niveles de CD4 < 200 no deben utilizarse las vacunas vivas y si los CD4 < 100 no se recomienda vacunar. Niveles de CD4 entre 200-400 se consideran como inmunodeficiencia limitada y niveles > 400 se consideran inmunocompetentes.
Grupo B. Inmunosupresión grave no relacionada con el VIH (leucemias, linfomas, neoplasias y pacientes en tratamiento con quimioterapia, radioterapia o corticoides a altas dosis). Se deben evitar las vacunas vivas/atenuadas y administrarlas 2 semanas antes o 3 meses después del tratamiento inmunosupresor.
Grupo C. Deficiencias inmunológicas limitadas. No hay contraindicaciones específicas. Se sigue el esquema general de vacunación. Pueden precisar dosis más elevadas o dosis de recuerdo más frecuentes. Situaciones de especial interés:
- •
Asplenia anatómica o funcional (talasemias, enfermedad celíaca, anemia de células falciformes, trombocitopenia esencial). Riesgo aumentado de infección por microorganismos encapsulados: neumococo, meningococo y Haemophilus influenzae tipo b (Hib). Se aconseja utilizar la pauta secuencial en la vacunación frente a neumococo (VNC13 + VNP23) y, frente a meningococo, utilizar vacuna conjugada tetravalente ACYW + antimeningocócica B.
- •
Insuficiencia renal crónica y hemodiálisis. En la diálisis se produce una pérdida de anticuerpos. Se recomienda el seguimiento serológico frente a hepatitis B y refuerzos si los niveles bajan por debajo de 10 UI/l (existe vacuna específica para hemodializados con mayor carga antigénica). En caso de trasplante renal se recomienda vacunación frente a varicela, porque después estará contraindicada y es causa frecuente de rechazo.
- •
Cirrosis. Mayor riesgo de infecciones por neumococo y gripe. Se recomienda la vacunación antineumocócica con pauta secuencial (VNC13 + VNP23).
- •
Trasplantes. La prioridad consiste en vacunar previamente al trasplante, incluso con esquemas acelerados. En general, aumenta la susceptibilidad a microorganismos encapsulados (neumococo e Hib, principalmente) y complicaciones por varicela. Las vacunas con virus vivos están contraindicadas 1 mes antes del trasplante y no deberían administrarse hasta 24 meses después. Las vacunas inactivadas son seguras, pero se administran a partir de los 2-6 meses del trasplante para asegurar una mejor respuesta. Vacunas aconsejadas: gripe, tétanos-difteria, neumococo, meningococo, Hib, HA, HB y VPH. La vacunación frente al neumococo debe realizarse con 3 dosis de VNC13 a los 3-6 meses del trasplante y una dosis de VNP23 a los 24 meses del trasplante. Se revacunará con VNP23, al menos 5 años después. En el trasplante de células hematopoyéticas se aconseja, además, la vacunación frente a Hib con 3 dosis separadas 4 semanas entre ellas, trascurridos al menos 6 meses desde la fecha del trasplante.
• Terapia inmunosupresora. Presentan un riesgo mayor de infección por neumococo y gripe. Las vacunas inactivadas pueden administrarse pero, como norma general, las de microorganismos vivos están contraindicadas. El tratamiento con esteroides implica actividad inmunosupresora si se utilizan las siguientes dosis: 60 mg/día más de 7 días, 20 mg/kg de peso al día más de 14 días, 2 mg/kg de peso al día más de 14 días o 1 mg/kg de peso más de 28 días. Respecto a la protección frente al herpes, ACIP recomienda vacunar solo a personas con baja dosis de inmunosupresores (menos de 20 mg/día de prednisona) o antes de tratamiento inmunosupresor, con preferencia de uso para la nueva vacuna recombinante autorizada desde octubre de 2017. En tratamientos con eculizumab se recomienda vacunación frente al meningococo con tetravalente conjugada ACYW.
En el caso del viajero, se revisará su carné vacunal para ponerlo al día si fuese necesario y se decidirá si precisa alguna vacuna específica por sus condiciones personales, de salud o de su viaje (tabla 19).
Vacunas del viajero
Recomendadas
|
Obligatorias
|
La mayoría de vacunas, así como otros consejos para la prevención de enfermedades durante el viaje, son asumibles en una consulta de atención primaria. Podemos apoyarnos en las recomendaciones del Ministerio de Sanidad y consultarlas en: https://www.msssi.gob.es/ca/profesionales/saludPublica/sanidadExterior/salud/faq.htm
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.