Analizar el riesgo de neumonía y/o exacerbaciones en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) tratados con corticoides inhalados (CI) y no tratados con CI (NCI). Estimar el riesgo de neumonía según la dosis de CI.
DiseñoEstudio de cohortes de base poblacional.
EmplazamientoAtención Primaria. Institut Català de la Salut.
ParticipantesPacientes ≥45 años diagnosticados de EPOC entre 2007 y 2009 en el Sistema de Información para el Desarrollo de la Investigación en Atención Primaria (SIDIAP).
IntervenciónDos cohortes; pacientes que inician CI y pacientes que inician broncodilatadores NCI después del diagnóstico de EPOC.
Mediciones principalesSociodemográficas, tabaquismo, antecedentes patológicos, neumonías, exacerbaciones, vacunaciones y tratamientos farmacológicos.
ResultadosSe incluyeron 3.837 pacientes: el 58% en el grupo CI y el 42% en el grupo NCI. Se detectaron incidencias superiores de neumonía y exacerbaciones en el grupo CI respecto al NCI (2,18 vs. 1,37). El riesgo de neumonía y de exacerbaciones graves no fue significativamente diferente entre grupos: HR de 1,17 (IC 95%: 0,87-1,56) y de 1,06 (IC 95%: 0,87-1,31), respectivamente. En el grupo CI presentaron mayor riesgo de exacerbaciones leves, con HR de 1,28 (IC 95%: 1,10-1,50). Las variables asociadas a mayor riesgo de neumonías fueron: edad, diabetes, neumonías y bronquitis previas, EPOC muy grave, tratamiento con β2-adrenérgicos o anticolinérgicos a dosis bajas, y tratamiento previo con corticoides orales.
ConclusionesNo hubo diferencias entre cohortes en el riesgo de NAC ni exacerbaciones graves. Las exacerbaciones leves fueron superiores en el grupo CI. Tanto NAC como exacerbaciones graves fueron más frecuentes en pacientes con EPOC grave y en pacientes tratados con dosis altas de CI.
To analyse the risk of pneumonia and/or exacerbations in patients with chronic obstructive pulmonary disease (COPD) who receive treatment with inhaled corticosteroids (CI), in comparison with those who are not treated with inhaled corticosteroids (NCI). To estimate the risk of pneumonia according to CI dose.
DesignPopulation-based cohort study.
SettingPrimary Healthcare. Institut Català de la Salut.
ParticipantsPatients ≥45 years-old diagnosed with COPD between 2007 and 2009 in the Information System for Research in Primary Care (SIDIAP).
InterventionTwo cohorts; patients initiating CI and patients initiating bronchodilators after COPD diagnosis.
Main measurementsDemographics, smoking, medical history, pneumonias, exacerbations, vaccinations, and drug therapy.
ResultsA total of 3,837 patients were included, 58% in the CI and 42% in the NCI group. Higher incidence rates of pneumonia and exacerbations were detected in the CI group compared with the NCI (2.18 vs. 1.37). The risk of pneumonia and severe exacerbations was not significantly different between groups, HR; 1.17 (95% CI; 0.87-1.56) and 1.06 (95% CI; 0.87-1.31), respectively. Patients in the CI group had a higher risk of mild exacerbations, HR; 1.28 (95% CI; 1.10-1.50). Variables associated with a higher risk of pneumonia were age, diabetes, previous pneumonias and bronchitis, very severe COPD, treatment with low doses of β2-adrenergic or anticholinergic agents, and previous treatment with oral corticosteroids.
ConclusionsThere were no differences between cohorts in the risk of pneumonia and severe exacerbations. The risk of mild exacerbations was higher in the CI group. Pneumonias and severe exacerbations were more frequent in patients with severe COPD and in patients receiving high doses of CI.
La enfermedad pulmonar obstructiva crónica (EPOC) tiene una alta prevalencia y gran impacto socioeconómico y en mortalidad1,2. En España supone la tercera causa de morbimortalidad y en 2009 tenía una prevalencia aproximada definida por criterios GOLD3 del 10% en fumadores, más elevada en hombres4.
La elección del tratamiento farmacológico de la EPOC está determinada por su gravedad. Las guías de manejo de EPOC recomiendan el uso de corticoides inhalados (CI) junto con broncodilatadores en pacientes con FEV1<50% y exacerbaciones repetidas3,5. Los ensayos clínicos en pacientes tratados con CI han demostrado reducción de la frecuencia de exacerbaciones y mejora en la calidad de vida6-8.
Diferentes estudios han detectado un incremento en la incidencia de neumonía en los pacientes tratados con CI9-14. En este contexto, la Agencia Española de Medicamentos y Productos Sanitarios publicó en 2016 una nota informativa sobre el riesgo de neumonía asociado a la administración de CI para el tratamiento de EPOC15 que confirmaba un aumento de riesgo en los pacientes que reciben CI. Aunque existen datos que sugieren que este riesgo se incrementaría con el aumento de dosis del CI, no se puede realizar esta afirmación de modo concluyente. Tampoco existe evidencia de diferencias en la magnitud del riesgo de neumonías entre los diferentes CI. A pesar de todo, la relación beneficio-riesgo de los CI se sigue considerando favorable.
Existen estudios de cohortes y metaanálisis que no encuentran asociaciones entre utilización de CI y neumonía, ni mayor riesgo con el aumento de dosis de CI16-18.
El objetivo principal del presente estudio es analizar si los pacientes con EPOC en tratamiento con CI tienen mayor riesgo de presentar neumonía adquirida en la comunidad (NAC) respecto a pacientes EPOC que reciben broncodilatadores. Los objetivos secundarios son analizar el riesgo de NAC según la dosis de CI, y conocer si los pacientes en tratamiento con CI tienen mayor riesgo de presentar exacerbaciones.
MétodosDiseño: estudio de cohortes retrospectivo de base poblacional.
Población: pacientes atendidos en los centros de Atención Primaria (CAP) del Institut Català de la Salut (ICS) de Catalunya, mayores de 45 años, diagnosticados de EPOC durante 2007-2009, con antecedentes de tabaquismo, y con una espirometría realizada ±1 año del diagnóstico. Se excluyeron pacientes con exacerbaciones en los 6 meses previos a la inclusión (si habían recibido al menos 2 tratamientos diferentes con corticoides orales), tratados con inmunosupresores, diagnosticados de asma, demencia, trasplantados o institucionalizados.
Fuente de datos: Sistema de Información para el Desarrollo de la Investigación en Atención Primaria (SIDIAP)19, que contiene información clínica anonimizada procedente de los centros del ICS, principal proveedor de servicios sanitarios en Catalunya que gestiona 279 CAP, con una población de referencia de 5,8 millones de personas (aproximadamente el 80% de la población catalana). La información de SIDIAP se origina en la historia clínica electrónica del ICS (ECAP), e incluye datos sociodemográficos, problemas de salud registrados mediante CIE1020, parámetros clínicos, exploraciones, hábitos tóxicos, datos de laboratorio, prescripciones generadas por médicos de familia y sus correspondientes datos de facturación de farmacia mediante códigos ATC21. SIDIAP se puede cruzar con el conjunto mínimo de datos de hospitalizaciones de agudos (CMBD-HA)22, que contiene los diagnósticos codificados con CIE923 de las altas hospitalarias en hospitales públicos.
Formación de las cohortes: la inclusión en la cohorte fue al inicio del tratamiento inhalado. Se formaron dos cohortes; pacientes que inician tratamiento con CI y pacientes no iniciadores de CI (NCI) que inician tratamiento con β-adrenérgicos o anticolinérgicos de larga duración (LABA o LAMA) en un periodo ±6 meses del diagnóstico. Ambas cohortes se siguieron hasta final de 2011.
Variables: sociodemográficas, tabaquismo (fumador, exfumador, o situación actual desconocida), consumo de alcohol, antecedentes patológicos, neumonía (códigos CIE9: 480 a 487) y bronquitis (códigos CIE9: 466, 490, 491, 494.0 y 494.1) en los 2 años previos, vacunaciones (gripe, neumocócica), tratamientos farmacológicos para el sistema respiratorio (β2-adrenérgicos, anticolinérgicos, CI, corticoides orales y antibióticos), y tratamientos relacionados con aparición de neumonías (benzodiacepinas y antiulcerosos).
ECAP no posibilita el registro de gravedad de la EPOC. Por ello se categorizó en función del consumo de fármacos inhalados (β2-adrenérgicos, anticolinérgicos, o CI). La EPOC se clasificó como leve si recibían <50% de la dosis diaria definida (DDD) teórica de algún tratamiento broncodilatador; moderada si recibían ≥50% de un tratamiento; grave si recibían ≥50% de 2 tratamientos, y muy grave si recibían ≥50% de 3 tratamientos.
Los diagnósticos de NAC se obtuvieron de los informes del CMBD-HA. Las exacerbaciones no siempre se registraban en ECAP, por lo que se definieron como graves aquellas que implicaban ingreso hospitalario y se obtenían del CMBD-HA, y leves cuando el/la paciente tenía datos de facturación de farmacia de un tratamiento antibiótico indicado en infecciones respiratorias y un corticoide oral durante el mismo periodo de tiempo.
Exposición a fármacos: a partir de las recetas facturadas se calcularon las dosis de tratamientos en DDD. Se estratificaron los consumos en función del número de DDD del teórico esperado que habían de recibir los pacientes. La exposición a β2-adrenérgicos y anticolinérgicos se estratificó en 3 grupos: sin tratamiento, <50% de DDD teóricas, y ≥50%. La exposición a CI se estratificó en 4 grupos según DDD: <40%, 40-80%, 80-120% y >120%.
Cálculo del tamaño de muestra: se incluyeron todos los pacientes de SIDIAP que cumplían criterios de inclusión y ninguno de exclusión. La muestra se calculó aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,20 en un contraste bilateral, para detectar al menos un riesgo relativo de 1,6, considerando una tasa de enfermos en el grupo de no expuestos a CI de 46,6 casos/1.000 personas-año24. Se precisaban 1.529 sujetos por grupo.
Análisis estadístico: para valorar la comparabilidad de las características basales entre cohortes se utilizó el test de Chi cuadrado o el test t de Student según el tipo de variable, empleando las pruebas no paramétricas correspondientes si no se cumplían las condiciones de aplicación. Se calculó la densidad de incidencia de NAC y exacerbaciones para las cohortes estudiadas. Se estudió el riesgo de presentarlas mediante regresión de Cox, expresando el resultado en forma de hazard ratio (HR) y su intervalo de confianza (IC) del 95%, ajustando el efecto por las variables: sexo, edad, patologías concomitantes, hábitos tabáquico y enólico, tratamiento basal respiratorio y otros tratamientos, antecedentes de exacerbaciones, neumonías y gravedad de la EPOC.
Debido a la gran inestabilidad de las cohortes, porque gran parte de los pacientes que no iniciaban CI los recibieron en mayor o menor medida durante el seguimiento, no se pudo realizar el análisis por protocolo ya que el número de pacientes que se mantenían en la cohorte inicial de NCI era excesivamente bajo, por lo que solo se realizó un análisis por intención de tratar. Se realizó un análisis de supervivencia para determinar el efecto de exposición a CI en la incidencia de neumonías y exacerbaciones.
Se usaron los programas R (versión 2.10.1) y Stata/SE versión 11 para Windows (Stata Corp., College Station, Texas, EE.UU.).
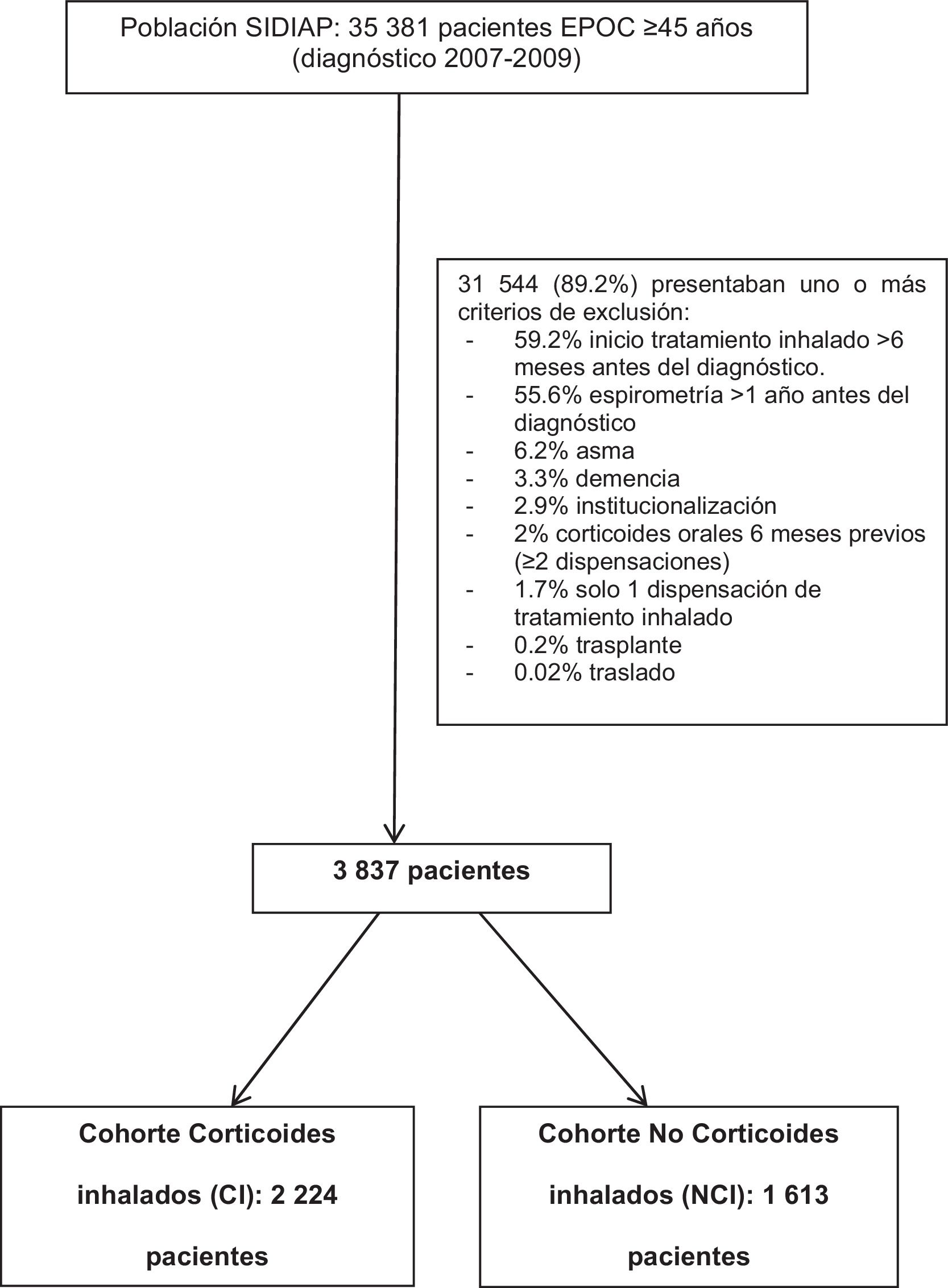
ResultadosDe 2007 a 2009, había 35.381 pacientes ≥45 años diagnosticados de EPOC en SIDIAP con antecedentes de tabaquismo, de los cuales se excluyeron el 89,2%. Se incluyeron 3.837 pacientes: 2.224 (58,0%) en la cohorte CI y 1.613 (42,0%) en la NCI.
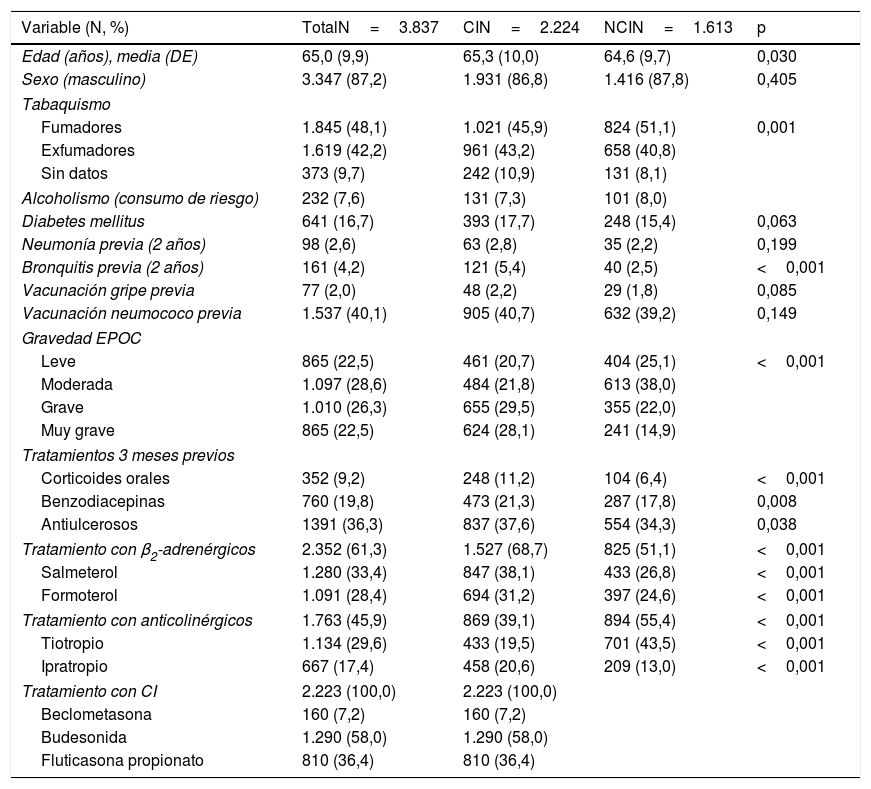
La tabla 1 muestra las características sociodemográficas y clínicas basales de los pacientes incluidos; el 87,2% eran varones, con una edad media de 65 años. Los pacientes con CI eran mayores. En el momento del diagnóstico de la EPOC, el 48,1% eran fumadores y el 42,2% eran exfumadores, con menor frecuencia de fumadores en la cohorte CI (45,9% vs. 51,1%). Los pacientes del grupo CI habían presentado bronquitis previas con mayor frecuencia que los del grupo NCI (5,4% vs. 2,5%). En la cohorte CI había más pacientes con EPOC grave y muy grave. No se observaron diferencias en los antecedentes de vacunaciones. La cohorte CI presentaba mayor consumo previo de corticoides orales, benzodiacepinas y antiulcerosos. Los pacientes de la cohorte CI recibían mayores dosis de β2-adrenérgicos y los de la cohorte NCI recibían más anticolinérgicos. Sobre el tratamiento CI, el 58% de los pacientes iniciaban tratamiento con budesonida. Del grupo NCI, 570 (35,3%) pacientes recibieron CI en algún momento durante el seguimiento.
Características demográficas y clínicas basales de los pacientes incluidos en las dos cohortes
| Variable (N, %) | TotalN=3.837 | CIN=2.224 | NCIN=1.613 | p |
|---|---|---|---|---|
| Edad (años), media (DE) | 65,0 (9,9) | 65,3 (10,0) | 64,6 (9,7) | 0,030 |
| Sexo (masculino) | 3.347 (87,2) | 1.931 (86,8) | 1.416 (87,8) | 0,405 |
| Tabaquismo | ||||
| Fumadores | 1.845 (48,1) | 1.021 (45,9) | 824 (51,1) | 0,001 |
| Exfumadores | 1.619 (42,2) | 961 (43,2) | 658 (40,8) | |
| Sin datos | 373 (9,7) | 242 (10,9) | 131 (8,1) | |
| Alcoholismo (consumo de riesgo) | 232 (7,6) | 131 (7,3) | 101 (8,0) | |
| Diabetes mellitus | 641 (16,7) | 393 (17,7) | 248 (15,4) | 0,063 |
| Neumonía previa (2 años) | 98 (2,6) | 63 (2,8) | 35 (2,2) | 0,199 |
| Bronquitis previa (2 años) | 161 (4,2) | 121 (5,4) | 40 (2,5) | <0,001 |
| Vacunación gripe previa | 77 (2,0) | 48 (2,2) | 29 (1,8) | 0,085 |
| Vacunación neumococo previa | 1.537 (40,1) | 905 (40,7) | 632 (39,2) | 0,149 |
| Gravedad EPOC | ||||
| Leve | 865 (22,5) | 461 (20,7) | 404 (25,1) | <0,001 |
| Moderada | 1.097 (28,6) | 484 (21,8) | 613 (38,0) | |
| Grave | 1.010 (26,3) | 655 (29,5) | 355 (22,0) | |
| Muy grave | 865 (22,5) | 624 (28,1) | 241 (14,9) | |
| Tratamientos 3 meses previos | ||||
| Corticoides orales | 352 (9,2) | 248 (11,2) | 104 (6,4) | <0,001 |
| Benzodiacepinas | 760 (19,8) | 473 (21,3) | 287 (17,8) | 0,008 |
| Antiulcerosos | 1391 (36,3) | 837 (37,6) | 554 (34,3) | 0,038 |
| Tratamiento con β2-adrenérgicos | 2.352 (61,3) | 1.527 (68,7) | 825 (51,1) | <0,001 |
| Salmeterol | 1.280 (33,4) | 847 (38,1) | 433 (26,8) | <0,001 |
| Formoterol | 1.091 (28,4) | 694 (31,2) | 397 (24,6) | <0,001 |
| Tratamiento con anticolinérgicos | 1.763 (45,9) | 869 (39,1) | 894 (55,4) | <0,001 |
| Tiotropio | 1.134 (29,6) | 433 (19,5) | 701 (43,5) | <0,001 |
| Ipratropio | 667 (17,4) | 458 (20,6) | 209 (13,0) | <0,001 |
| Tratamiento con CI | 2.223 (100,0) | 2.223 (100,0) | ||
| Beclometasona | 160 (7,2) | 160 (7,2) | ||
| Budesonida | 1.290 (58,0) | 1.290 (58,0) | ||
| Fluticasona propionato | 810 (36,4) | 810 (36,4) | ||
CI: cohorte corticoides inhalados; EPOC: enfermedad pulmonar obstructiva crónica; NCI: cohorte no corticoides inhalados.
La tabla 2 muestra las incidencias de neumonía y exacerbaciones por 100 pacientes/año. Se detectaron 230 casos de neumonía, siendo superior la incidencia en el grupo CI (2,18; IC 95%: 1,87-2,55) que en el NCI (1,37; IC 95%: 1,09-1,72). También se detectaron incidencias superiores de exacerbaciones graves y leves en la cohorte CI respecto a la NCI.
Incidencia de neumonías y exacerbaciones de la EPOC en las dos cohortes
| Corticoides inhalados | No corticoides inhalados | |||
|---|---|---|---|---|
| Eventos | N | Tasa 100 personas/año (IC 95%) | N | Tasa 100 personas/año (IC 95%) |
| Neumonías | 156 | 2,18 (1,87-2,55) | 74 | 1,37 (1,09-1,72) |
| Exacerbaciones graves | 309 | 4,54 (4,06-5,08) | 153 | 2,90 (2,47-3,40) |
| Exacerbaciones leves | 519 | 8,14 (7,47-8,87) | 260 | 5,14 (4,55-5,80) |
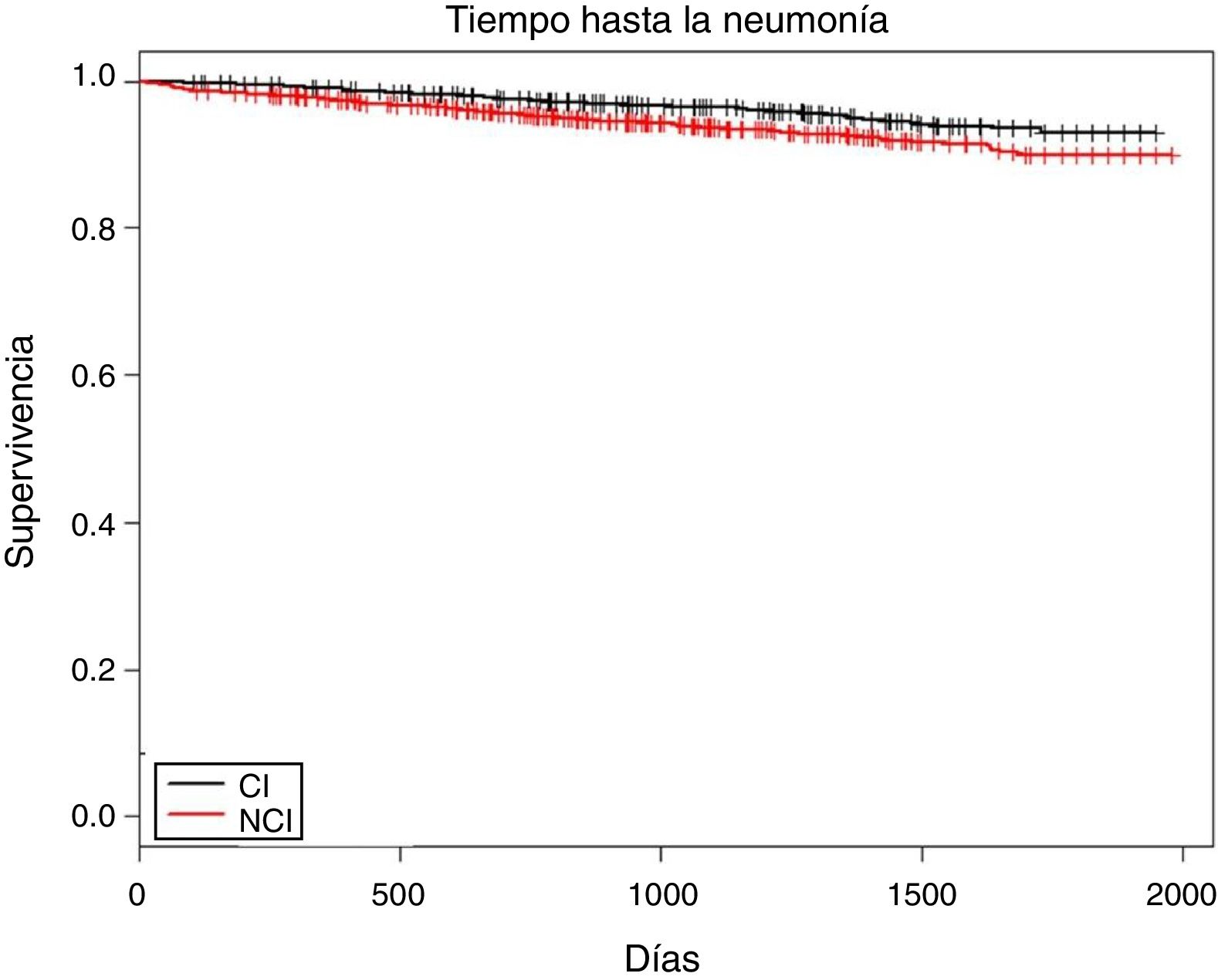
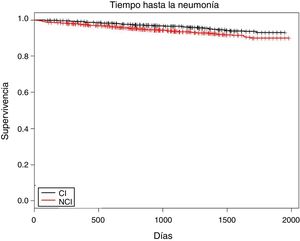
En la figura 1 se muestra el tiempo entre la entrada a la cohorte y la aparición del primer episodio de NAC (log rank test, p<0,001). La media fue de 555,2 días (DE: 440,8), sin diferencias entre grupos. Para las exacerbaciones graves hubo diferencias; en el grupo CI fue de 411,5 días (439,5) y en el NCI fue de 580,3 días (499,0) (p<0,001).
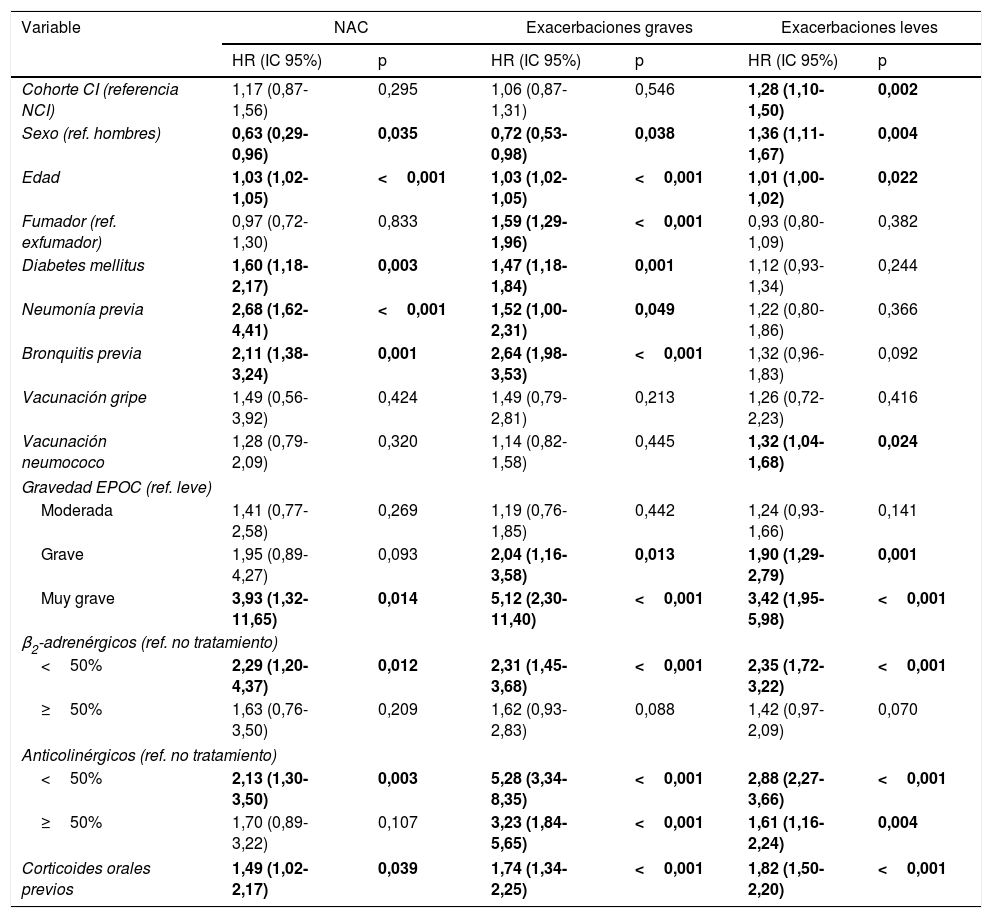
La tabla 3 detalla los factores de riesgo asociados a la aparición de NAC y de exacerbaciones. En el modelo ajustado por las variables, el HR de presentar NAC en la cohorte CI respecto a la NCI fue de 1,17 (IC 95%: 0,87-1,56; p=0,295). Las variables que mostraron una asociación positiva significativa fueron: edad, DM2, antecedentes de neumonías y bronquitis, EPOC muy grave, tratamiento con β2-adrenérgicos y con anticolinérgicos a dosis bajas, y tratamiento previo con corticoides orales. Hubo una asociación inversa con el sexo; las mujeres presentaban menor riesgo de NAC.
Variables independientes asociadas al riesgo de presentar neumonía y exacerbaciones
| Variable | NAC | Exacerbaciones graves | Exacerbaciones leves | |||
|---|---|---|---|---|---|---|
| HR (IC 95%) | p | HR (IC 95%) | p | HR (IC 95%) | p | |
| Cohorte CI (referencia NCI) | 1,17 (0,87-1,56) | 0,295 | 1,06 (0,87-1,31) | 0,546 | 1,28 (1,10-1,50) | 0,002 |
| Sexo (ref. hombres) | 0,63 (0,29-0,96) | 0,035 | 0,72 (0,53-0,98) | 0,038 | 1,36 (1,11-1,67) | 0,004 |
| Edad | 1,03 (1,02-1,05) | <0,001 | 1,03 (1,02-1,05) | <0,001 | 1,01 (1,00-1,02) | 0,022 |
| Fumador (ref. exfumador) | 0,97 (0,72-1,30) | 0,833 | 1,59 (1,29-1,96) | <0,001 | 0,93 (0,80-1,09) | 0,382 |
| Diabetes mellitus | 1,60 (1,18-2,17) | 0,003 | 1,47 (1,18-1,84) | 0,001 | 1,12 (0,93-1,34) | 0,244 |
| Neumonía previa | 2,68 (1,62-4,41) | <0,001 | 1,52 (1,00-2,31) | 0,049 | 1,22 (0,80-1,86) | 0,366 |
| Bronquitis previa | 2,11 (1,38-3,24) | 0,001 | 2,64 (1,98-3,53) | <0,001 | 1,32 (0,96-1,83) | 0,092 |
| Vacunación gripe | 1,49 (0,56-3,92) | 0,424 | 1,49 (0,79-2,81) | 0,213 | 1,26 (0,72-2,23) | 0,416 |
| Vacunación neumococo | 1,28 (0,79-2,09) | 0,320 | 1,14 (0,82-1,58) | 0,445 | 1,32 (1,04-1,68) | 0,024 |
| Gravedad EPOC (ref. leve) | ||||||
| Moderada | 1,41 (0,77-2,58) | 0,269 | 1,19 (0,76-1,85) | 0,442 | 1,24 (0,93-1,66) | 0,141 |
| Grave | 1,95 (0,89-4,27) | 0,093 | 2,04 (1,16-3,58) | 0,013 | 1,90 (1,29-2,79) | 0,001 |
| Muy grave | 3,93 (1,32-11,65) | 0,014 | 5,12 (2,30-11,40) | <0,001 | 3,42 (1,95-5,98) | <0,001 |
| β2-adrenérgicos (ref. no tratamiento) | ||||||
| <50% | 2,29 (1,20-4,37) | 0,012 | 2,31 (1,45-3,68) | <0,001 | 2,35 (1,72-3,22) | <0,001 |
| ≥50% | 1,63 (0,76-3,50) | 0,209 | 1,62 (0,93-2,83) | 0,088 | 1,42 (0,97-2,09) | 0,070 |
| Anticolinérgicos (ref. no tratamiento) | ||||||
| <50% | 2,13 (1,30-3,50) | 0,003 | 5,28 (3,34-8,35) | <0,001 | 2,88 (2,27-3,66) | <0,001 |
| ≥50% | 1,70 (0,89-3,22) | 0,107 | 3,23 (1,84-5,65) | <0,001 | 1,61 (1,16-2,24) | 0,004 |
| Corticoides orales previos | 1,49 (1,02-2,17) | 0,039 | 1,74 (1,34-2,25) | <0,001 | 1,82 (1,50-2,20) | <0,001 |
Variables de ajuste: sexo, edad, patologías concomitantes, hábitos tabáquico y enólico, tratamiento basal respiratorio y otros tratamientos, antecedentes de exacerbaciones, neumonías y gravedad de la EPOC.
CI: corticoides inhalados; EPOC: enfermedad pulmonar obstructiva crónica; HR: hazard ratio; IC: intervalo de confianza; NAC: neumonía adquirida en la comunidad; NCI: no corticoides inhalados.
En negrita se muestran los resultados estadísticamente significativos.
Para las exacerbaciones graves, las variables que mostraron una asociación positiva fueron: edad, tabaquismo, DM2, antecedentes de neumonías y bronquitis, EPOC grave y muy grave, tratamiento con β2-adrenérgicos a dosis bajas y con anticolinérgicos a cualquier dosis, y tratamiento previo con corticoides orales. Las mujeres presentaban menor riesgo de exacerbaciones graves.
Para las exacerbaciones leves, el HR en la cohorte de CI respecto a la de NCI fue de 1,28 (IC 95%: 1,10-1,50; p=0,002) y las variables asociadas fueron: edad, sexo masculino, vacunación antineumocócica previa, EPOC grave y muy grave, tratamiento con β2-adrenérgicos a dosis bajas y con anticolinérgicos a cualquier dosis, y tratamiento previo con corticoides orales.
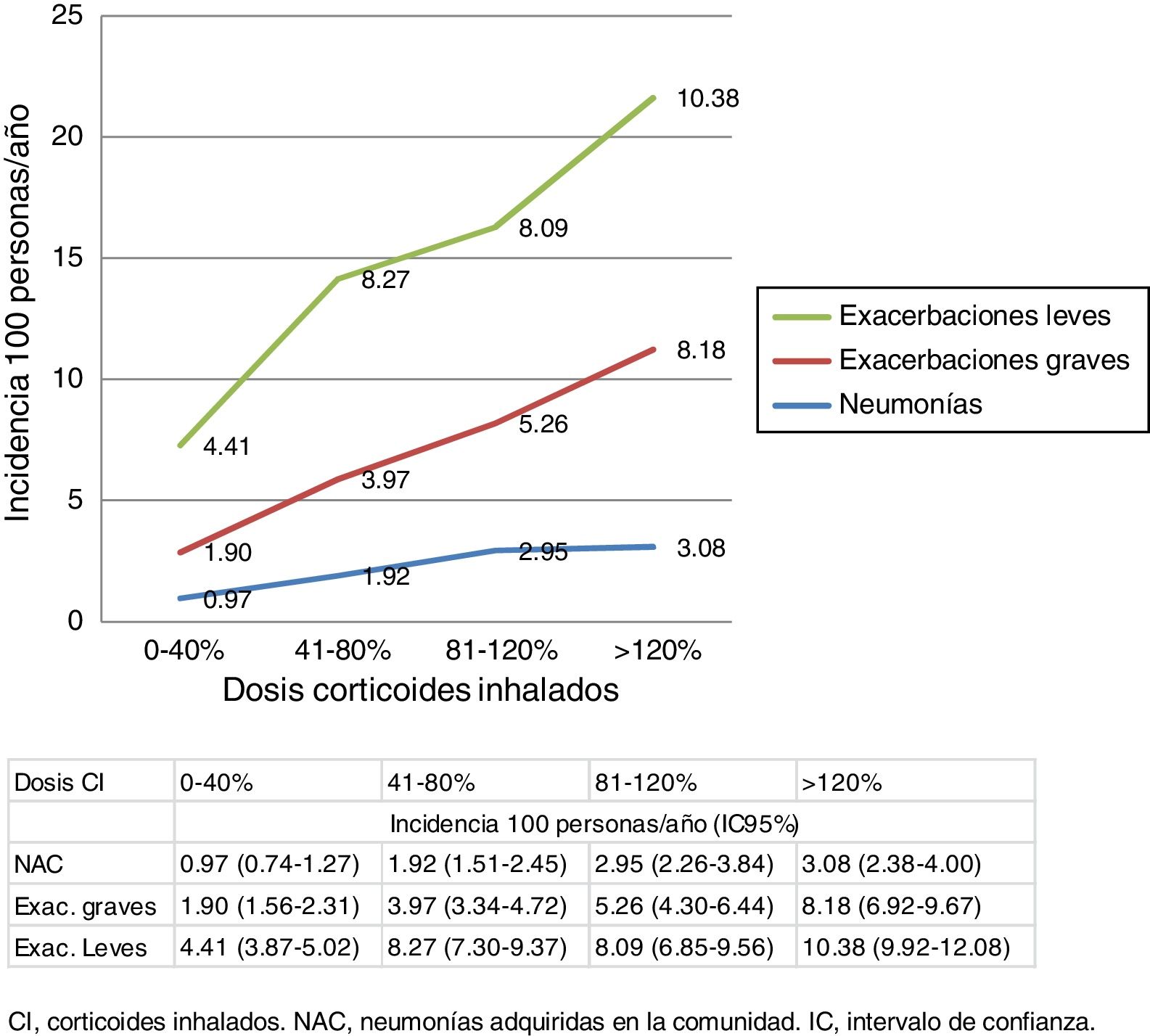
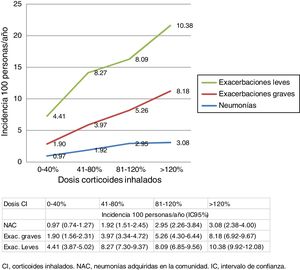
En la figura 2 se presentan incidencias de NAC y exacerbaciones en las dos cohortes según las dosis de exposición a CI durante el seguimiento. Para los 3 eventos se observa un aumento de la tasa de incidencia a medida que aumenta la dosis de CI.
DiscusiónSe analizó la incidencia de NAC en pacientes inicialmente tratados con CI en comparación con los que no iniciaron CI. En el análisis ajustado, la cohorte CI no demostró una tasa significativamente superior de NAC respecto a NCI. Las variables que se asociaron con el aumento de riesgo de NAC fueron: edad, DM2, antecedentes de neumonías y bronquitis, tratamientos con β2-adrenérgicos o anticolinérgicos a dosis bajas, tratamiento previo con corticoides orales y gravedad de la EPOC. Las mujeres presentaron menor riesgo.
Los ensayos clínicos TORCH10 o INSPIRE25 observaron incrementos en la incidencia de neumonías en pacientes EPOC tratados con CI. El metaanálisis de Kew y Seniukovich26 incluyó 43 estudios de 2002-2013 que evaluaban el riesgo de neumonía asociado a CI en 31.314 pacientes EPOC; los autores concluyen que los CI en monoterapia o asociados a LABA aumentan el riesgo de presentar neumonía, aunque sin afectar a la supervivencia.
Varios estudios de cohortes han evaluado el riesgo de NAC en pacientes con EPOC tratados con CI. Lin et al.14 incluyeron pacientes diagnosticados de EPOC y evaluaron los factores asociados a la aparición de neumonías, que fueron: edad, menor FEV1, exacerbaciones frecuentes, enfermedad cardiovascular previa y tratamiento con CI. Lee et al.27 encontraron asociación entre el uso de CI y neumonía, junto con factores como edad, sexo masculino, DM2, neumonías previas o uso reciente de corticoides orales. La mayoría de las variables asociadas a neumonía en estos estudios también muestran asociación en nuestro trabajo.
En otro estudio de cohortes de 163.514 pacientes EPOC tratados en 1990-2005 en Canadá12, el tratamiento con CI se asoció con un aumento del riesgo relativo de neumonía (RR: 1,69; IC 95%: 1,63-1,75), que disminuía progresivamente cuando se suspendía el tratamiento con CI y desaparecía a los 6 meses (RR: 1,08; IC 95%: 0,99-1,17). En un estudio caso-control anidado en una cohorte de EPOC13, se analizaron las recurrencias de neumonía en pacientes mayores de 65 años. El uso de CI se asoció con un aumento del 90% de recurrencias (OR: 1,90; IC 95%: 1,45-2,50).
Otros estudios no han encontrado asociación entre CI y aumento de riesgo de NAC. La revisión de Iannella et al.18 incluyó ensayos clínicos y estudios de cohortes, y detectó una asociación entre tratamiento con CI y neumonía, aunque no pueden establecer relación causal debido a diferentes sesgos.
En referencia a las exacerbaciones, los CI están indicados para reducir su frecuencia y suelen ser pacientes con una EPOC más evolucionada. En nuestro estudio, el riesgo de exacerbaciones graves no fue diferente entre grupos, aunque estas aparecían significativamente antes en la cohorte de CI. Las variables asociadas a presentar exacerbaciones graves fueron: edad, tabaquismo, DM2, neumonías y bronquitis previas, EPOC grave y muy grave, β2-adrenérgicos a dosis bajas, anticolinérgicos a cualquier dosis y tratamiento previo con corticoides sistémicos. Las mujeres presentaron menor riesgo de exacerbaciones graves, aunque mayor para exacerbaciones leves. El riesgo de exacerbaciones leves fue superior en el grupo CI en comparación con NCI.
En un metaanálisis de 11 estudios que comparaban el uso de LAMA+LABA con LABA+CI en 9.839 pacientes con EPOC, los pacientes con LAMA+LABA presentaron menos exacerbaciones que los que recibieron CI28. En otro estudio en 2.113 pacientes con EPOC, también se observó mayor tasa de exacerbaciones en pacientes tratados con CI respecto a los no tratados29.
Existen varias limitaciones en nuestro estudio referentes al tipo de datos, que dificultan la generalización de los resultados. Sobre el diagnóstico de EPOC, a parte del registro en SIDIAP, era criterio de inclusión que los pacientes tuviesen realizada una espirometría ±1 año del diagnóstico, ya que había posibilidad de infrarregistro diagnóstico o de codificación incorrecta. También se excluyeron los pacientes que tenían registrado el diagnóstico durante 2007-2009 pero recibían tratamiento inhalado previamente. En cuanto a la gravedad de la enfermedad, que no era posible registrarla en ECAP, recurrimos a una aproximación mediante la dosis de fármacos inhalados. No se pudo utilizar valores de FEV1, porque no se registraban los resultados de la espirometría. No se dispone de datos de cumplimiento del tratamiento inhalado, únicamente de datos de dispensación en oficinas de farmacia. También había posibilidad de infrarregistro de las exacerbaciones leves, por lo que se definieron según el tratamiento recibido. Las comorbilidades se analizaron en el momento de entrada a la cohorte para caracterizar a los pacientes incluidos. Todas estas situaciones, y el carácter observacional del estudio, no permiten establecer una relación causal entre el uso de CI y la aparición de NAC y exacerbaciones en pacientes con EPOC.
La principal fortaleza de nuestro estudio es la representatividad de los datos, pues SIDIAP incluye aproximadamente el 80% de la población catalana, y que estos datos son procedentes de la práctica clínica diaria.
ConclusionesNo se observaron diferencias significativas entre las cohortes en el riesgo de NAC. El tiempo hasta el primer episodio de NAC no difería significativamente entre grupos.
El riesgo de exacerbaciones graves tampoco fue diferente entre grupos, aunque estas aparecían significativamente antes en el grupo CI. El riesgo de exacerbaciones leves fue superior en el grupo CI.
Tanto NAC como exacerbaciones graves fueron más frecuentes en pacientes con EPOC grave y en pacientes tratados con dosis altas de CI.
- -
Las guías de manejo de EPOC recomiendan el uso de corticoides inhalados (CI) en pacientes con EPOC de carácter grave y exacerbaciones repetidas.
- -
El uso de corticoides inhalados se ha relacionado con la aparición de neumonías en pacientes con EPOC.
- -
Analiza el riesgo de presentar neumonía y exacerbaciones en pacientes EPOC que inician tratamiento con corticoides inhalados (CI) respecto a los que inician tratamiento broncodilatador en la práctica clínica habitual.
- -
No se han encontrado diferencias en el riesgo de neumonías en los pacientes EPOC que inician CI. El riesgo de exacerbaciones graves tampoco fue diferente, y el de exacerbaciones leves fue superior en los que recibían CI.
- -
Tanto las neumonías como las exacerbaciones graves fueron más frecuentes en pacientes con EPOC grave y en los tratados con dosis altas de CI.
«Neumonías adquiridas en la comunidad en pacientes con enfermedad pulmonar obstructiva crónica tratados con corticoides inhalados u otros broncodilatadores. Estudio PNEUMOCORT» recibió financiación del Ministerio de Sanidad, Política Social e Igualdad a través de la convocatoria de ayudas para proyectos de investigación clínica de carácter no comercial con medicamentos del Instituto Carlos III de 2010 (EC10-081).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Jesús Almeda, Universitat Autònoma de Barcelona, Bellaterra, Cerdanyola del Vallès. Unitat de Suport a la Recerca Metropolitana Sud, Institut Universitari d’Investigació en Atenció Primària Jordi Gol (IDIAP Jordi Gol), Cornellà de Llobregat, España. CIBER de Epidemiología y Salud Pública CIBERESP.
Teresa Rodríguez, Institut Universitari d’Investigació en Atenció Primària Jordi Gol (IDIAP Jordi Gol), Barcelona. Universitat Autònoma de Barcelona, Bellaterra, Cerdanyola del Vallès, España.
Oleguer Plana-Ripoll, Section of Epidemiology, Department of Public Health, Aarhus University, Aarhus, Dinamarca
Helena Pera, Institut Universitari d’Investigació en Atenció Primària Jordi Gol (IDIAP Jordi Gol), Barcelona. Universitat Autònoma de Barcelona, Bellaterra, Cerdanyola del Vallès. España.
Magdalena Rosell, Unitat Docent Metropolitana Nord, Sabadell, España.
Jose M. Elorza, CAP Ripollet, Servei d’Atenció Primària Vallès Occidental. Direcció d’Atenció Primària Metropolitana Nord, Institut Català de la Salut, Sabadell, España.
Pere Toran, Universitat Autònoma de Barcelona, Bellaterra, Cerdanyola del Vallès. Unitat de Suport a la Recerca Metropolitana Nord, Institut Universitari d’Investigació en Atenció Primària Jordi Gol (IDIAP Jordi Gol), Mataró, España.
Los investigadores del proyecto PNEUMOCORT se relacionan en el anexo.
Presentaciones a congresos: Vedia C, Plana-Ripoll O, Pera H, Morros R, Almeda J, Amado E. Neumonías adquiridas en la comunidad en pacientes con enfermedad pulmonar obstructiva crónica tratados con corticoides inhalados u otros broncodilatadores (Estudio PNEUMOCORT). Primera fase: formación de las cohortes y datos basales. XXV Congreso de la Sociedad Española de Farmacología Clínica. 28/09/2012, Alicante.
☆☆ Vedia C, Casellas A, Pera H, Amado E, Morros R, Almeda J, Baena JM, Rosell M, Rodríguez MT, Elorza JM. Póster. Exacerbaciones en pacientes con enfermedad pulmonar obstructiva crónica tratados con corticoides inhalados. XXVI Congreso de la Sociedad Española de Farmacología Clínica. 17/10/2013, Cádiz.