Nuestro objetivo es intentar contribuir al uso racional de los antibióticos prescritos por los médicos de familia cuando un paciente consulta por un problema odontológico. Actualmente la pregunta que nos debemos hacer es si hay que tomar antibiótico, en lugar de cuál dar. Revisamos las principales infecciones odontológicas, cuál debe ser el tratamiento adecuado y el papel de la prevención. Es necesario conocer la complejidad de la microflora de la cavidad oral, pues de ella dependerá la conveniencia de antibioterapia, la evolución hacia la curación o la progresión de algunas infecciones odontogénicas. La placa bacteriana, formada por el biofilm, se comporta como una barrera para la acción de los antimicrobianos. Es en la prevención de su formación, así como en la eliminación mecánica de esta una vez formada, en lo que el médico de familia debe insistir. Debemos transmitir a la población que los antibióticos no curan el dolor dental.
Our aim is to contribute to the rational use of antibiotics prescribed by family doctors when a patient consults for a dental problem. Nowadays we should not ask which antibiotic to give. The question has to be if we need to prescribe antibiotics in front of the most common odontogenic infections seen in our practice. We review the main dental infections, which should be their appropriate management and the role of prevention. We need to know the complexity of the oral microbiome because it?ll depend on the appropriateness of the antibiotherapy, the evolution towards cure or progression of some odontogenic infections. The bacterial plaque, formed by the biofilm, behaves as a barrier to the action of antimicrobials. It?s in the prevention of its development as well as in it mechanical elimination once shaped, in what the family doctor should insist. We must transmit antibiotics don?t heal dental pain.
La cavidad oral es el primer segmento del aparato digestivo y comunica directamente con el exterior, por lo que no es una cavidad aséptica. Recubierta por mucosa, encontramos las glándulas salivales y los dientes. Posee una variada flora comensal —microbiótica o microbioma oral— aerobia y anaerobia en equilibrio con el huésped. Este complejo ecosistema, único para cada individuo, está compuesto por más de 50.000 millones de bacterias de más de 700 especies, con unas 200 predominantes, de las cuales un 53% aún no tienen un nombre definido y un 35% aún no se han podido siquiera cultivar in vitro. Alberga además virus, hongos y parásitos.
Como en el resto de la naturaleza, en el microbioma oral tan solo una muy pequeña fracción de las bacterias se encuentra en forma planctónica o de libre flotación. La mayoría existen en calidad de biofilm o biopelícula. Esta película está compuesta por una matriz polimérica extracelular producida por las propias bacterias que forma una estructura en la que permanecen coagregados los diferentes microorganismos y que se adhiere a sustratos o superficies permanentes.
La cavidad oral ofrece las condiciones idóneas para que esta abundante flora oral genere las biopelículas. Por un lado, facilita la multiplicación bacteriana con condiciones favorables de temperatura, humedad y aporte de nutrientes por parte de la saliva y del líquido gingival crevicular originado en el epitelio libre de la encía; y por otro lado, ofrece una amplia superficie dental a la que adherirse. La saliva contiene gran cantidad de agentes antibacterianos, antivirales y antifúngicos que modulan la flora, ayudan a mantener una microbiota equilibrada y contribuyen a la curación de las heridas. Además tiene otras funciones, como facilitar la masticación, la deglución y el habla, y enzimas para iniciar el proceso de la digestión de nutrientes.
La mayoría de las bacterias de la microbiótica oral ejercen una relación simbiótica con el huésped. Aunque en individuos sanos se puedan detectar algunas con potencial cariogénico o periodontogénico generalmente adquiridas por contacto íntimo, su «carga» es muy baja en una boca sana. Para que se produzca la enfermedad es necesario un aumento en la proporción de las bacterias cariogénicas o periodontogénicas (disbiosis). Se ha propuesto que para que esto ocurra es necesario un cambio en las condiciones fisiológicas del individuo (edad, cambios hormonales puberales, gestación, etc.) o cambios locales de las características de la saliva (por disfunción glandular, mala higiene oral, tabaquismo, etc.). Todos estos cambios alteran el equilibrio flora/huésped, modificando la competitividad de las bacterias en el biofilm y seleccionando las especies más adaptadas al nuevo entorno1. En la mayoría de los casos, el individuo sano es capaz de adaptarse a los cambios de la flora sin padecer enfermedad.
La disrupción de este frágil equilibrio comporta la formación de patología infecciosa odontogénica sumamente frecuente, como la caries, la gingivitis o la periodontitis.
Infecciones odontogénicasSon las que afectan a las estructuras que forman el diente y el periodonto. Se caracterizan por su carácter polimicrobiano. La utilización del cultivo como método diagnóstico hacía complicado atribuir a uno o a varios microorganismos una determinada etiología. El uso de técnicas de diagnóstico inmunológico y molecular para la identificación de los microorganismos, independientes del cultivo (PCR, inmunoensayo, ADN, etc.), desde la década de 1990 ha permitido conocer mejor la flora de la cavidad oral, la asociación de especies en la formación de biopelícula y la relación de algunas bacterias subgingivales en el origen de las periodontitis. Se ha demostrado la presencia de una mayor densidad microbiológica en la cavidad oral enferma que en una sana, y su eliminación implica la regresión o el final de la enfermedad.
Formas clínicasCaries y pulpitisLa caries es la destrucción del esmalte dental por la acidificación ocasionada por la fermentación de los hidratos de carbono de la dieta. Su prevalencia es muy alta, hasta un 90% en adultos. Inicialmente es asintomática, hasta que alcanza tejidos dentales profundos —pulpitis—, causando dolor intenso al cepillado dental, con los cambios térmicos o con los azúcares de la dieta.
PericoronaritisInfección en la mucosa que recubre la corona del diente parcialmente erupcionado. Es frecuente en la erupción del tercer molar inferior, hacia los 20- 30 años de edad.
GingivitisInflamación de la encía por acúmulo de placa dental. Se limita a la encía sin afectar a la estructura de sujeción del diente. Produce sangrado al cepillado. Es un proceso frecuente en adultos (50%) pero reversible.
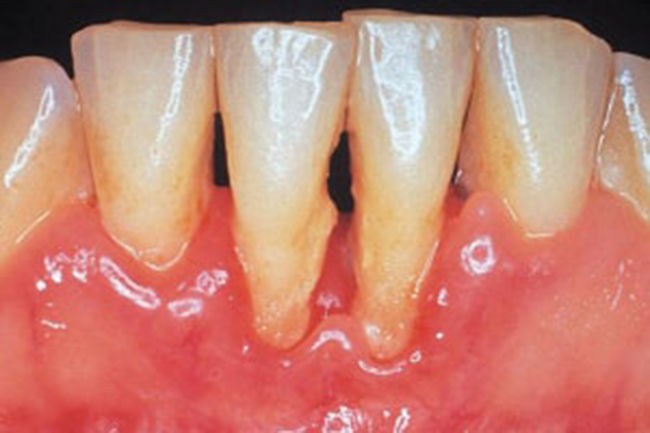
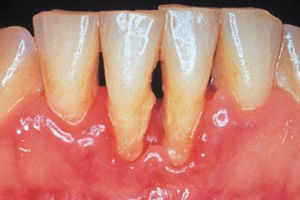
PeriodontitisProgresión de la inflamación gingival (fig. 1) que afecta a las estructuras de soporte del diente. Inicialmente asintomática, su avance supone la destrucción de las estructuras que fijan el diente, pérdida de hueso maxilar y, finalmente, la caída de la pieza dental. Afecta al 30% de los adultos2.
- -
Crónica o del adulto. Por su evolución en el tiempo y no a su imposibilidad de curación. Progresa lentamente. Se da en personas sanas, aunque se han descrito factores de riesgo como una pobre higiene oral, el estrés, el tabaquismo, etc.
- -
Agresiva, de rápida evolución. Se suele dar en adultos jóvenes y sanos. Se ha descrito agregación familiar
- -
Como manifestación de enfermedades sistémicas.
Engloba a las entidades antes llamadas gingivitis ulcerativa necrótica (GUN), periodontitis ulcerativa necrótica (PUN) y estomatitis necrosante (EN). Se diferencian entre ellas en el grado de severidad de la afectación. Fue muy frecuente durante e inmediatamente después de la Segunda Guerra Mundial, tanto en la población civil como militar, pero actualmente su prevalencia en nuestro ámbito es muy baja y se asocia a VIH+3.
Características:
- -
GUN: infección de las encías, con ulceración dolorosa de las papilas interdentales. Cursa con halitosis característica.
- -
PUN: progresión de la GUN que afecta las estructuras de fijación del diente, el ligamento periodontal y el hueso alveolar.
- -
EN: cuando la necrosis progresa a planos profundos por debajo de la línea mucogingival e incluye la mucosa orofaríngea, el labio o la lengua, produciendo osteítis y fístulas.
Es un proceso reversible de inflamación de las encías periimplante por el acúmulo de placa dental. Puede aparecer hasta en el 50% de los implantes. La colonización bacteriana sobre los implantes sigue el mismo patrón que sobre los dientes, así como la respuesta de la mucosa periimplantaria a periodos iniciales y prolongados de exposición a la placa bacteriana. Cursa con sangrado al sondaje por el odontólogo y tiene un valor predictivo negativo para la progresión de la enfermedad. Su ausencia indica una estabilidad de los tejidos periodontales.
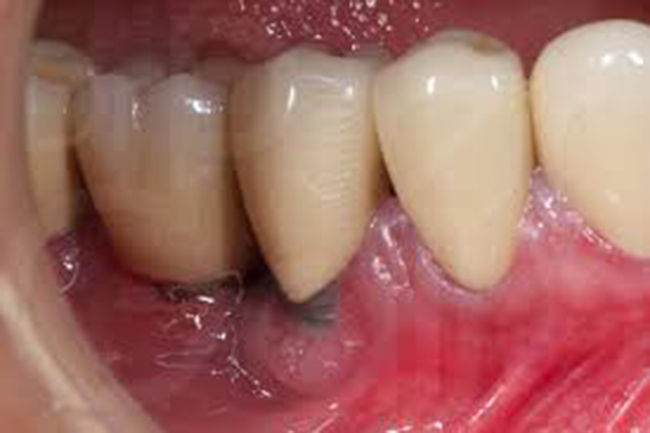
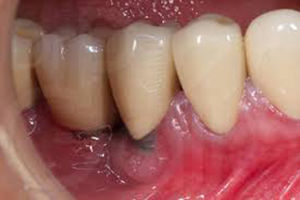
PeriimplantitisProceso inflamatorio destructivo (fig. 2) alrededor de un implante osteointegrado que conduce a la formación de una bolsa periimplante y a la destrucción del hueso circundante, desencadenado por la formación de biofilm en la superficie del implante. Ocurre en el 16% de los implantes y en el 26% de los pacientes. Cursa con dolor, inflamación y a veces supuración. Es muy característico el sangrado durante el sondaje realizado por el profesional para medir la profundidad de la bolsa periimplante. En la radiografía se aprecia pérdida ósea periimplante.
Abscesos periodontalesInfección purulenta localizada en los tejidos periodontales. Pueden ser causados por necrosis pulpar, por infecciones periodontales, por pericoronaritis, por un trauma o por cirugía. Son una causa frecuente de consulta urgente. Según su origen, los clasificamos en2:
- -
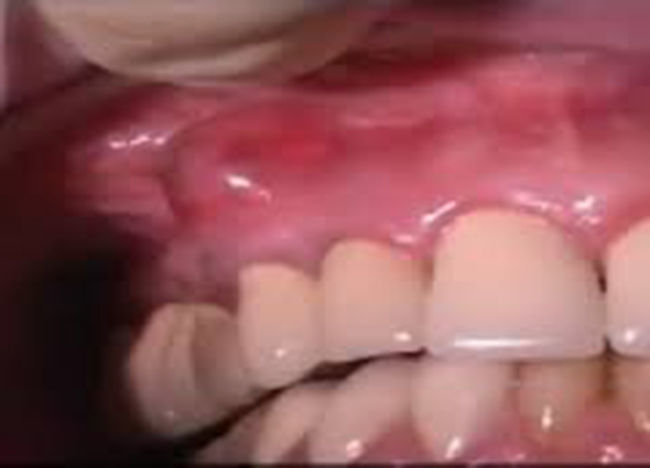
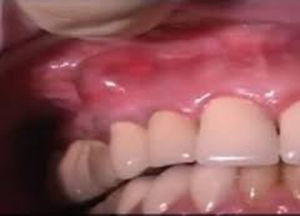
Absceso gingival (fig. 3): doloroso, localizado en la encía marginal e interdental, generalmente asociado al impacto de cuerpos extraños.
- -
Absceso periapical o dentoaveolar: afecta a los tejidos circundantes a la raíz dental tras la afectación pulpar originada por una caries. Puede cursar con exudado purulento. Se caracteriza por dolor intenso, constante y a la percusión de la pieza dental afectada dolorosa. Es característica la sensación de «diente largo» (el paciente refiere que el diente le ha crecido).
- -
Absceso periodontal: al alcanzar la pared gingival de una bolsa profunda periodontal. Puede cursar de forma aguda o cronificarse. Puede ser asintomático si drena espontáneamente.
- -
Absceso pericoronal: sobre la mucosa que cubre un diente parcialmente erupcionado.
Afectación de los espacios cervicofaciales por extensión de un absceso odontogénico, con afectación del estado general y fiebre. La clínica dependerá de los espacios afectados e implica la derivación para tratamiento hospitalario.
Prevención de las infecciones odontogénicasLa salud bucodental es esencial para la salud general y la calidad de vida4. La mayoría de las infecciones odontogénicas pueden prevenirse en gran medida con una buena higiene oral y teniendo en cuenta otros factores que se enumeran a continuación.
Higiene dentalLa deficiente higiene es el primer factor de riesgo de enfermedad odontológica. Podemos controlar la progresión del biofilm mediante procedimientos mecánicos como el cepillado dental, y mediante procedimientos químicos como el uso de colutorios.
El cepillado a diario de forma correcta elimina el 50% de la placa. Al asociarle el uso de hilo dental, la placa se reduce hasta un 70%. Cepillos interproximales e irrigadores completan y mejoran la limpieza, ya que las zonas interdentales representan un 40% de la superficie dental. Todas estas prácticas realizadas a diario tienen como objetivo reducir la carga bacteriana y evitar su progresión hacia una placa dental calcificada, también denominada sarro o tártaro dental5.
Los tratamientos preventivos realizados por profesionales logran eliminar más cantidad de placa y sarro. La aplicación de barniz o geles de flúor en la prevención de la caries en adultos tiene menos evidencia que en niños y adolescentes. La aplicación de sellados dentales ha demostrado prevenir la caries hasta en un 80% de los niños y adolescentes.
El control químico de la placa mediante el uso de fluoruros es la medida con mayor evidencia para evitar tanto la aparición como la progresión de la caries6.
La clorhexidina a bajas concentraciones se indica en pacientes con periodontitis o periimplantitis.
TabacoFumar es el segundo factor de riesgo mayor para la enfermedad periodontal. La nicotina favorece la formación del biofilm y el posterior desarrollo de enfermedad periodontal. Se asocia con menor sangrado gingival, por la acción vasoconstrictora de la nicotina, lo que dificulta el diagnóstico precoz7.
DietaHemos de potenciar una dieta que evite las sustancias cariogénicas (azúcares) y los depósitos interdentales favorecidos con las dietas blandas8.
Sustancias como el xilitol, un alcohol natural del azúcar, administrado en forma de jarabe o en gomas de mascar, ha demostrado efectividad clínica significativa en la prevención de caries, como resultado de reducir los mecanismos de adhesión bacteriana de la biopelícula8.
FármacosSe deben tener en cuenta los medicamentos que producen una disminución en la cantidad y calidad de la saliva, así como los que alteran la mucosa gingival (corticoides y AINE, ciertos antihipertensivos, antiepilépticos, inmunosupresores, anticonceptivos orales, etc.), dificultando la higiene y facilitando la enfermedad periodontal.
Los bifosfonatos9,10 y los fármacos antiplaquetarios pueden desencadenar efectos adversos severos tras extracciones o técnicas odontológicas invasivas.
Malposiciones dentalesTanto de dientes naturales como protésicos. Dificultan la correcta higiene.
BruxismoProvoca un desgaste acelerado del esmalte dental, lo que debilita al diente. No se ha encontrado relación con la periodontitis ni con la supervivencia de los implantes osteointegrados11.
EmbarazoLos cambios fisiológicos y hormonales que ocurren durante el embarazo contribuyen a padecer gingivitis y periodontitis. Hay cambios en la composición de la saliva y puede aparecer xerostomía. La gingivitis es más frecuente en el segundo y tercer trimestres, pero desaparece tras el parto12. Asociada a la gingivitis puede aparecer una tumoración benigna de rápido crecimiento y que también desaparece tras el parto. La hiperemesis gravídica expone al esmalte dental a mayor erosión. Las ingestas más frecuentes han de ser seguidas de correcta higiene oral.
Enfermedades sistémicasExiste evidencia de relación entre algunas enfermedades sistémicas y la periodontitis, considerándose esta como manifestación de ciertas patologías sistémicas, entre ellas las leucemias y el síndrome de Down.
Enfermedades crónicasExiste alguna evidencia sobre la relación las infecciones odontogénicas y ciertas enfermedades crónicas3: enfermedades de base inmunológica, alergias alimentarias, Alzheimer, síndrome metabólico, ateroesclerosis y ciertas enfermedades cardiovasculares. Parece que hay consenso en que no existe una forma especial de periodontitis en pacientes con diabetes mellitus tipo1 (DM1), si no que la DM1 actúa como factor modificador de la enfermedad periodontal, sobre todo cuando coexiste con mal control metabólico. La evolución y las complicaciones de los implantes en DM1 bien controlada son similares a las de las personas sanas.
Base familiar y genéticaSe considera que hay suficiente base científica a favor de la presencia de factores genéticos y la aparición de periodontitis agresiva, no así en la periodontitis crónica.
Tratamiento de la infección odontogénicaHemos visto que a día de hoy se precisa un nuevo enfoque en el tratamiento de las infecciones odontogénicas con predominio de medidas físicas o químicas que impidan la formación, reduzcan o eliminen el biofilm o placa dental tanto de los dientes naturales como de los implantes, más allá del tratamiento actual con antibióticos.
ColutoriosSe indican en la gingivitis y la periodontitis durante un corto periodo de tiempo13. Los de clorhexidina son los de primera elección (poseen la mayor evidencia sin que se hayan encontrado diferencias en cuanto a efectividad con las distintas concentraciones comercializadas), y los de aceites esenciales serían la alternativa. Los de fluoruro tienen indicación para prevenir las caries y evitar su progresión.
Antibióticos sistémicosSon la tercera causa de consumo de antibióticos en España, generando un 10% de las prescripciones de antibióticos14.
Actualmente su uso como terapia adjunta al tratamiento odontológico solo se indica cuando el riesgo de diseminación microbiológica regional, a distancia o sistémica sea significativo (celulitis/flemón, adenopatías regionales, inflamación difusa con afectación del estado general y fiebre) y en pacientes inmunocomprometidos15.
No existen criterios establecidos sólidos sobre qué antimicrobiano usar y las recomendaciones proceden de consensos de expertos16,17. La elección del antimicrobiano debe estar dirigida a la restauración del equilibrio ecológico de la cavidad oral y minimizar la emergencia de cepas resistentes. Actualmente el antibiótico de elección en nuestro ámbito es la amoxicilina.
- -
Nunca deben ser el único tratamiento y no son efectivos para tratar el dolor dental.
- -
La decisión no debe ser qué antibiótico instaurar sino si procede la antibioterapia (tablas 1 y 2).
Tabla 1.Manejo de las infecciones odontogénicas que no precisan antibioterapia
Infección Manejo Tratamiento por odontólogo Caries Buena higiene con cepillado correcto Flúor tópico en pacientes con menor producción de saliva Fluoruros (para prevención y evitar progresión):
– En la pasta de dientes
– Colutorios una vez al díaOdontología conservadora:
– ObturaciónDisminuir la ingesta de azúcares simples Pulpitis Analgesia Endodoncia o, si es imprescindible, extracción de la pieza Gingivitis Buena higiene con cepillado correcto y uso de hilo dental Higiene profunda por especialista para eliminación de la placa bacteriana calcificada gingival Analgesia Enjuagues con colutorio de clorhexidina si el dolor impide la higiene profunda Periodontitis crónica o del adulto25 Buena higiene con cepillado correcto y uso de hilo dental Eliminación de la placa bacteriana calcificada y alisado de la raíz dental para eliminar depósitos sub y supragingivales Analgesia Enjuagues con colutorio de clorhexidina si el dolor impide la higiene profunda Mucositis periimplantaria26 Higiene dental Eliminación de la placa bacteriana calcificada y alisado de la raíz del implante para eliminar depósitos sub y supragingivales Analgesia No se recomiendan enjuagues con antisépticos ni los irrigadores Periimplantitis2 Higiene dental con apoyo de artilugios (irrigadores, cepillos interdentales, etc.) y colutorios de clorhexidina Eliminación de la placa bacteriana calcificada y alisado de la raíz del implante para eliminar depósitos sub y supragingivales Analgesia Siempre estar alerta para la detección precoz de los síntomas y signos de diseminación local, regional o sistémica.
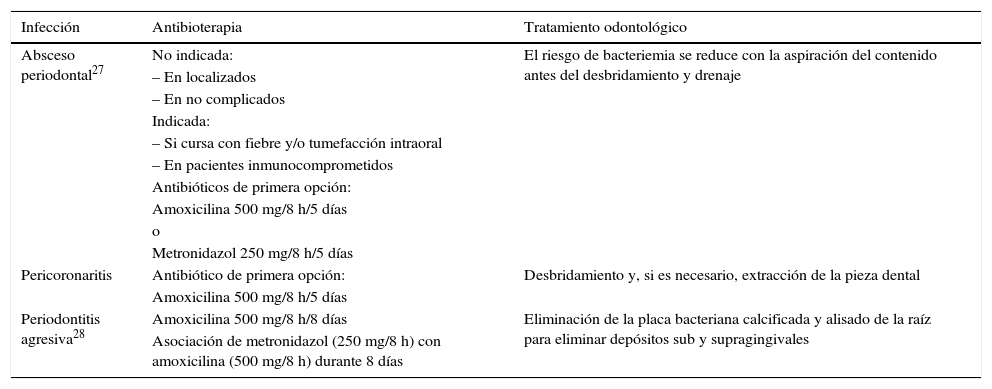
Tabla 2.Infecciones odontogénicas que precisan antibioterapia
Infección Antibioterapia Tratamiento odontológico Absceso periodontal27 No indicada: El riesgo de bacteriemia se reduce con la aspiración del contenido antes del desbridamiento y drenaje – En localizados – En no complicados Indicada: – Si cursa con fiebre y/o tumefacción intraoral – En pacientes inmunocomprometidos Antibióticos de primera opción: Amoxicilina 500 mg/8 h/5 días o Metronidazol 250 mg/8 h/5 días Pericoronaritis Antibiótico de primera opción: Desbridamiento y, si es necesario, extracción de la pieza dental Amoxicilina 500 mg/8 h/5 días Periodontitis agresiva28 Amoxicilina 500 mg/8 h/8 días Eliminación de la placa bacteriana calcificada y alisado de la raíz para eliminar depósitos sub y supragingivales Asociación de metronidazol (250 mg/8 h) con amoxicilina (500 mg/8 h) durante 8 días De segunda elección tenemos clindamicina (activa frente a organismos aerobios y anaerobios grampositivos, pero requiere vigilancia estricta por su relación con la colitis pseudomembranosa) y claritromicina (activa frente a las cepas productoras de beta-lactamasas) en los alérgicos a betalactámicos.
- -
Recomendamos pautas más cortas18,19, ya que han demostrado su utilidad en otras infecciones que tratamos en atención primaria, como las respiratorias y las urinarias. No hay evidencia de que continuar la antibioterapia cuando los síntomas se han resuelto contribuya a la reducción de la resistencia antibiótica. No obstante, hemos de personalizar el tratamiento y prolongarlo unos tres días si los síntomas no mejoran.
- -
Cuando hay fracaso terapéutico a pesar de antibioterapia, recomendamos, como primer paso, reevaluar el diagnóstico antes que cambiar el antibiótico, evitando su uso indiscriminado y el incremento de las resistencias bacterianas.
Quedan muchos aspectos por investigar. ¿Cuál es la dosis óptima? ¿Cuál es la duración del tratamiento? ¿Quiénes se van a beneficiar de la antibioterapia? ¿En qué momento del desbridamiento se deben administrar para tener el mejor resultado?, etc.
En la afectación de la zona apical, la descompresión y el drenaje por el especialista suelen ser curativos, con alivio sintomático, y si se circunscribe únicamente al diente, no precisa antibioterapia. La exodoncia estará indicada cuando no exista la posibilidad de tratamiento odontológico conservador.
Empiezan a publicarse estudios que demuestran un cierto beneficio de asociar antibioterapia sistémica al tratamiento odontológico en la periodontitis crónica, aunque ninguno de ellos ha reducido el número de piezas dentarias perdidas20.
En las tablas 1 y 2 se muestran las recomendaciones respecto al tratamiento antibiótico. Se recomienda una duración del tratamiento antimicrobiano de 5días o prolongarlo 3días tras desaparecer la clínica.
Para finalizar, en la tabla 3 pueden verse los criterios de derivación hospitalaria.
Criterios de derivación hospitalaria
| Pacientes inmunocomprometidos: alteraciones endocrinas como en la diabetes mellitus mal controlada, alteraciones nutricionales como en el alcoholismo, alteraciones hematológicas como en leucemias, enfermedades generales y/o por tratamientos que impliquen inmunocompromiso y VIH, y/o con elevado riesgo de progresión de la afectación a los espacios aponeuróticos del cuello y tejidos circundantes |
| Signos y síntomas de la progresión de la infección a espacios parafaríngeos |
| – Celulitis (flemón) rápidamente progresiva |
| – Afectación del estado general con fiebre alta |
| – Trismus intenso29 (distancia interincisiva entre el incisivo del maxilar superior y del inferior <10mm) |
| – Dificultad respiratoria, deglutoria o fonatoria |
Para recomendar profilaxis antibiótica ante un procedimiento dental, debemos valorar el tipo de procedimiento y las características del paciente.
La cirugía bucal no complicada tiene un bajo riesgo de infección. Los factores que pueden incrementar dicho riesgo son: el tiempo de intervención, si la cirugía es invasiva, si ha habido una infección previa o si se coloca un cuerpo extraño. Los procedimientos no invasivos no requieren profilaxis en ningún caso, mientras que en los invasivos dependerá del tipo de procedimiento y de su duración21. En personas sanas solo se recomienda la profilaxis en caso de manipulación del tejido gingival, de la mucosa oral o de la región periapical (extracción dentaria con cirugía, cirugía periapical, cirugía ósea, cirugía implantológica, injertos óseos y cirugía de tumores benignos).
La profilaxis se recomienda de forma rutinaria en pacientes con elevado riesgo de infección como los afectados por patologías que comporten una situación de inmunocompromiso: DM1; artropatías y enfermedades gastrointestinales inflamatorias; asplenia anatómica o funcional; insuficiencia renal o hepática no controlada; inmunodepresión por enfermedad o por tratamiento; los que posean riesgo de endocarditis, y la desnutrición severa.
Existe controversia respecto a la profilaxis en la exodoncia del tercer molar y en los implantes en el sujeto sano. La profilaxis en la extracción del tercer molar en una persona sin comorbilidades disminuye un 70% la probabilidad de infección y un 38% la probabilidad de desarrollar una alveolitis seca, pero aumenta los efectos secundarios22, por lo que no se recomienda en una persona sana. En los implantes, la evidencia sobre la profilaxis antibiótica sugiere una reducción en los fallos de implantación (aunque el grado de trauma quirúrgico y las condiciones anatómicas del paciente son factores más importantes para el fallo a corto plazo de los implantes23) pero no de la infección24.
La profilaxis de la infección odontogénica en adultos se realizará con 2g de amoxilicina una hora antes del momento de la incisión. En caso de alergias se realizará con clindamicina. No se recomienda en ningún caso profilaxis postintervención.
ConclusionesEl elevado consumo de antibióticos derivado de los procesos odontogénicos hace necesario realizar estudios con evidencia científica suficiente que protocolicen su indicación, tipo de antibiótico y posología y que sustituyan a los actuales consensos.
Por otro lado, la consulta a su médico de familia derivada de estos procesos se convierte en una buena oportunidad para reevaluar el proceso y al enfermo, y decidir si es necesario ese antibiótico.
En todos los casos debemos recomendar una buena higiene bucal personal y profesional.
- -
La mejor prevención de las infecciones odontogénicas es una correcta higiene oral.
- -
Los implantes dentales requieren las mismas medidas de higiene que los dientes naturales.
- -
El tabaco es determinante en la enfermedad periodontal.
- -
Los antibióticos NO mejoran el DOLOR dental.
- -
La antibioterapia NUNCA debe ser el ÚNICO tratamiento.
- -
La decisión no debe ser qué antibiótico instaurar, sino ¿PROCEDE la antibioterapia?
- -
Ante un fracaso terapéutico con antibioterapia recomendamos primero reevaluar el diagnóstico antes que instaurar un nuevo antibiótico.
- -
Indicar antibioterapia en pacientes inmunocomprometidos o con elevado riesgo de progresión de la afectación a los espacios aponeuróticos del cuello y tejidos circundantes.
Los autores declaran que no tienen relación económica con ninguna fuente de financiación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.