La información existente sobre la resistencia a los antibióticos se basa habitualmente en muestras de personas hospitalizadas. El objetivo fue evaluar la prevalencia de resistencia antibiótica de cepas de Staphylococcus aureus y Streptococcus pneumoniae de personas portadores nasales atendidas en las consultas de atención primaria según edad y sexo.
DiseñoEstudio transversal.
EmplazamientoSiete centros de salud del área de Barcelona.
ParticipantesPersonas portadoras nasales a partir de 4años de edad, sin signos de enfermedad infecciosa y que no habían tomado antibióticos ni habían estado hospitalizados en los 3meses anteriores.
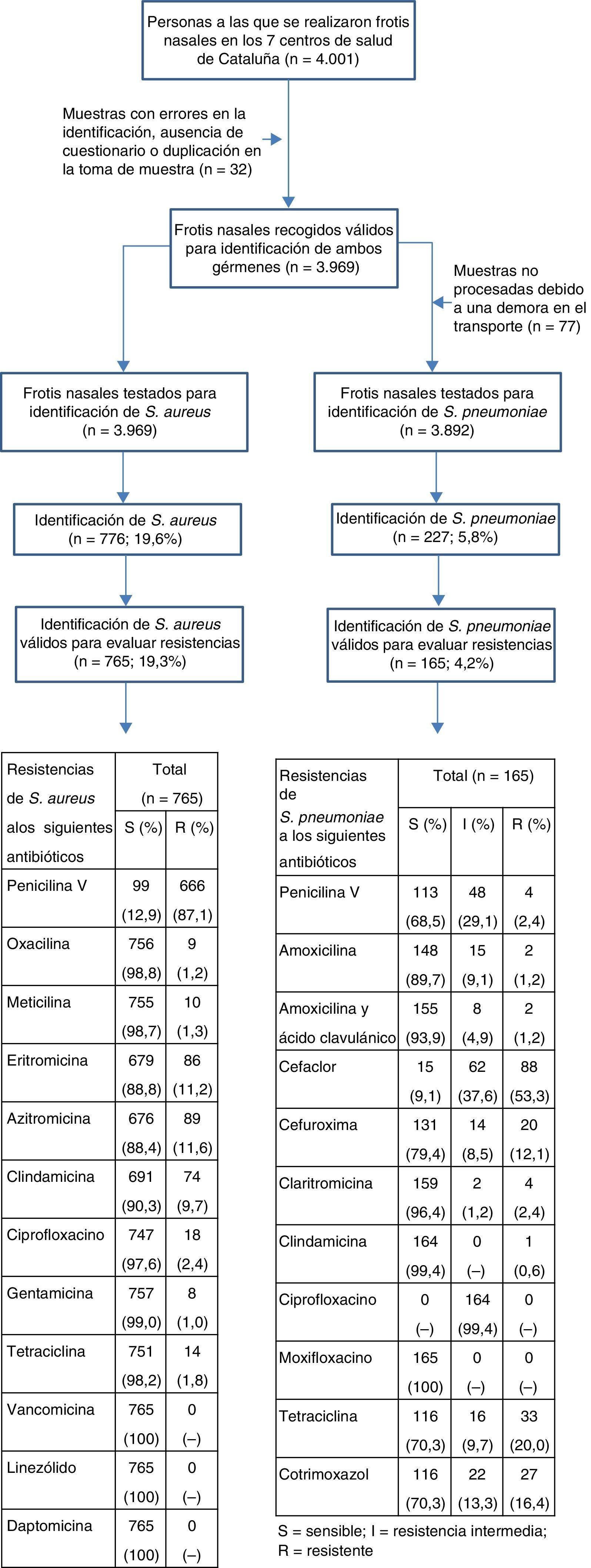
Mediciones principalesSe recogieron 3.969 frotis nasales válidos para identificación entre 2010 y 2011 y fueron enviados a un laboratorio central de microbiología para el aislamiento de ambos gérmenes. La resistencia a los antibióticos se estableció según los puntos de corte actuales de la guía del European Committee on Antimicrobial Susceptibility Testing.
ResultadosLa prevalencia de S.aureus resistente a meticilina fue del 1,3% (IC95%: 0,5-2,1%), con porcentajes de resistencia frente a fenoximetilpenicilina del 87,1% y a azitromicina del 11,6%, sin observar diferencias significativas según edad y sexo. Un 2,4% (IC95%: 0,1-4,7%) de las cepas de neumococo fueron altamente resistentes a fenoximetilpenicilina y macrólidos, mientras que las mayores resistencias se observaron frente a cefaclor (53,3%), tetraciclina (20%) y cefuroxima (12,1%).
ConclusionesEstos patógenos tienen resistencias más bajas en la comunidad que las que se observan en el medio hospitalario. Es importante que se conozca la resistencia antibiótica actual para poder hacer un uso más prudente de los antibióticos.
The information available on antibiotic resistance patterns are generally based on specimens from hospitalised individuals. This study was aimed at evaluating the antibiotic resistance rate of nasal carriage strains of Staphylococcus aureus and Streptococcus pneumoniae in healthy individuals, in accordance with age and gender, attended in Primary Care Centres (PCC).
DesignCross-sectional study.
SettingSeven PCC in the Barcelona area.
ParticipantsHealthy nasal carriers aged 4years or more who did not present with any sign of infectious disease, and had not taken any antibiotic or had been hospitalised in the previous 3months.
Main measurementsA total of 3,969 nasal swabs valid for identification were collected between 2010 and 2011 and were sent to one central microbiological laboratory for isolation of both pathogens. Resistance to common antibiotics was determined on the basis of the current European Committee on Antimicrobial Susceptibility Testing guidelines on cut-off points.
ResultsThe prevalence of methicillin-resistant S.aureus was 1.3% (95%CI: 0.5-2.1%), with resistance rates of 87.1% to phenoxymethylpenicillin and 11.6% to azithromycin, with no significant differences with age and gender. A total of 2.4% (95CI%: 0.1-4.7%) of the pneumococcal strains were highly resistant to both phenoxymethylpenicillin and macrolides, whereas the highest resistance rates were to cefaclor (53.3%), followed by tetracycline (20%) and cefuroxime (12.1%).
ConclusionsThese pathogens have lower resistance rates in the community than in the hospital setting. Primary Care physicians must be more aware of the current antimicrobial resistance, in order to ensure prudent use of antibiotics.
Las enfermedades infecciosas representan un tercio de las visitas al médico de atención primaria1. Existe una elevada sobreprescripción de antibióticos en nuestro país. Este consumo innecesario de antibióticos conlleva la aparición de resistencias, lo cual genera un importante problema en el manejo de las enfermedades infecciosas. Este problema es de mayor magnitud en España ya que, comparado con otros países europeos, el porcentaje de resistencias a los antibióticos es más elevado2. Streptococcus pneumoniae es una bacteria grampositiva α-hemolítica que se presenta en forma de diplococo, capaz de causar en humanos diversas infecciones, como neumonía, sinusitis y procesos invasivos severos, como peritonitis, meningitis y sepsis, particularmente en ancianos, niños e inmunodeprimidos. Staphylococcus aureus es una bacteria anaerobia facultativa, grampositiva, que se encuentra ampliamente distribuida por todo el mundo y puede producir una amplia gama de enfermedades, que van desde infecciones cutáneas y de las mucosas relativamente benignas, tales como foliculitis, forunculosis o conjuntivitis, hasta enfermedades de riesgo vital, como celulitis, abscesos profundos, osteomielitis, meningitis, sepsis, endocarditis o neumonía. Actualmente existen importantes problemas con las resistencias observadas en S.aureus y S.pneumoniae en la comunidad, en el primer caso por la aparición en la comunidad de cepas de estafilococo resistente a la meticilina (SARM), y en el caso del neumococo, por el creciente aumento de resistencias a macrólidos y a fluoroquinolonas3.
Cerca del 90% de los antibióticos se prescriben en la comunidad4, pero la información existente en cuanto a las sensibilidades de los gérmenes a los antibióticos se basa en muestras de pacientes hospitalizados, muchas veces con infecciones nosocomiales e invasivas. En consecuencia, no se pueden extrapolar estas prevalencias de resistencia al ámbito de la atención primaria. También es conocido que la microbiota comensal representa un importante reservorio de resistencia antibiótica. La diseminación de estas bacterias en la comunidad es frecuente que la realicen los portadores asintomáticos5. Recientemente se ha publicado un artículo sobre la prevalencia de portadores nasales de S.aureus y de S.pneumoniae en personas atendidas en las consultas de atención primaria del área de Barcelona, en el marco del proyecto europeo APRES. Como continuación de este proyecto se realiza el presente estudio, cuyo objetivo fue evaluar el nivel de resistencias de todas las cepas aisladas de ambos microorganismos frente a los antibióticos más comunes. Como objetivos secundarios se comparan los patrones de sensibilidad de ambos gérmenes según edad y sexo.
Material y métodosParte de la metodología de este estudio está explicada anteriormente6,7. De forma resumida, se trata de un estudio transversal multicéntrico realizado en 27 consultas de 7 centros de salud del área de Barcelona (Barcelona ciudad y Baix Llobregat) en 2010-2011. Se reclutaron personas de 4 o más años de edad que acudieron a las consultas de atención primaria sin presentar signos de enfermedad infecciosa y que no habían tomado antibióticos ni ingresado en ningún centro los 3meses previos. La selección de los pacientes se realizó sucesivamente entre los que acudieron a las consultas de medicina general o pediatría durante el periodo del estudio y que cumplían los criterios de inclusión. No se registraron los pacientes que declinaron participar. A todos los pacientes se recogieron frotis nasales en base a un protocolo establecido7.
Para el cálculo de la muestra, se consideró que se precisarían 610 sujetos para detectar una diferencia igual o superior al 5% si se asume que la proporción de S.aureus en el grupo de referencia es del 23%, aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,2 en un contraste bilateral, y estimándose en un 5% la tasa de reposición por pérdidas de información o participación. De la misma manera, se precisarían 1.983 sujetos para detectar una diferencia igual o superior al 1,5% si se asume que la proporción de S.pneumoniae en el grupo de referencia es del 5,3%, aceptando un riesgo alfa de 0,05 y un riesgo beta de 0,2 en un contraste bilateral, y estimándose en un 5% la tasa de pérdidas. El número de muestras requeridas para el estudio europeo era más elevado (4.000), permitiendo discriminar diferencias iguales o superiores al 2% para S.aureus y al 1% para S.pneumoniae, con la misma asunción de riesgos y pérdidas.
Las muestras se recogieron en hisopos con medio de transporte Amies agar con carbón, conservándose a temperatura ambiente hasta su procesamiento. Posteriormente se enviaron a dos laboratorios del área del estudio, en los que se valoró el aislamiento de colonias compatibles morfológicamente con S.aureus y S.pneumoniae. Todas las muestras se testaron en un laboratorio central (Centro Médico de la Universidad de Maastricht, Holanda) para determinar las resistencias de ambos gérmenes a los antibióticos examinados.
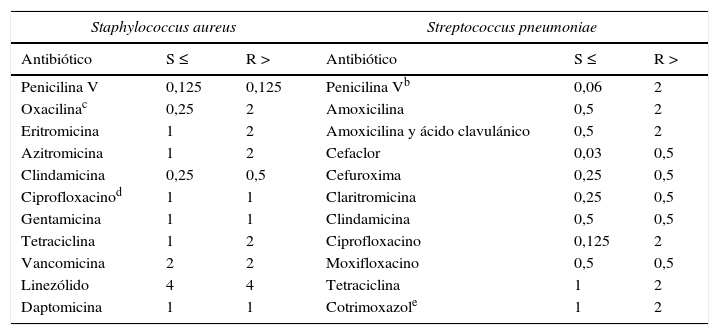
VariablesSe clasificó la edad de los participantes en tres grupos: niños (4-14años), adultos (15-64años) y ancianos (≥65años). La definición de resistencia se estableció con los puntos de corte de las concentraciones mínimas inhibitorias (CMI) de los gérmenes identificados frente a los antibióticos examinados en base a la última clasificación del European Committee on Antimicrobial Susceptibility Testing (EUCAST), publicado por la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas, el European Centre for Disease Prevention and Control y los comités nacionales europeos de puntos de corte8 (tabla 1). Se consideraron las categorías de sensible, resistencia intermedia (cuando la CMI se encuentra entre la CMI de sensibilidad y de resistencia) y alta resistencia para el S.pneumoniae, y se agruparon las categorías de resistencia intermedia y alta resistencia para S.aureus, ya que las tablas del EUCAST lo recogen así y porque el porcentaje de resistencia intermedia para el caso de estafilococo es muy bajo. Los antibióticos testados para S.aureus fueron penicilina (incluyendo penicilinaG o bencilpenicilina y penicilinaV o fenoximetilpenicilina), oxacilina, meticilina, eritromicina, azitromicina, clindamicina, ciprofloxacino, gentamicina, tetraciclina, vancomicina, linezólido y daptomicina. Los antibióticos testados para S.pneumoniae fueron penicilina (incluyendo penicilinaG yV), amoxicilina, asociación de amoxicilina y ácido clavulánico, cefaclor, cefuroxima, claritromicina, clindamicina, ciprofloxacino, moxifloxacino, tetraciclina y cotrimoxazol.
| Staphylococcus aureus | Streptococcus pneumoniae | ||||
|---|---|---|---|---|---|
| Antibiótico | S ≤ | R > | Antibiótico | S ≤ | R > |
| Penicilina V | 0,125 | 0,125 | Penicilina Vb | 0,06 | 2 |
| Oxacilinac | 0,25 | 2 | Amoxicilina | 0,5 | 2 |
| Eritromicina | 1 | 2 | Amoxicilina y ácido clavulánico | 0,5 | 2 |
| Azitromicina | 1 | 2 | Cefaclor | 0,03 | 0,5 |
| Clindamicina | 0,25 | 0,5 | Cefuroxima | 0,25 | 0,5 |
| Ciprofloxacinod | 1 | 1 | Claritromicina | 0,25 | 0,5 |
| Gentamicina | 1 | 1 | Clindamicina | 0,5 | 0,5 |
| Tetraciclina | 1 | 2 | Ciprofloxacino | 0,125 | 2 |
| Vancomicina | 2 | 2 | Moxifloxacino | 0,5 | 0,5 |
| Linezólido | 4 | 4 | Tetraciclina | 1 | 2 |
| Daptomicina | 1 | 1 | Cotrimoxazole | 1 | 2 |
S: sensible; R: resistente.
¿Cómo se lee la tabla? Tómese como ejemplo la CMI de S.pneumoniae frente a penicilinaV. Las cepas con CMI de 0,06mg/l o menores son sensibles; las CMI≥2mg/l (es decir, de 4mg/l o mayores) son resistentes (denominada también alta resistencia) y las cepas con CMI entre 0,12 y 2mg/l son intermedias (denominada también resistencia intermedia).
Son puntos de corte para aislados no meníngeos. En la neumonía deben considerarse sensibles a la bencilpenicilina con una CMI≤0,5mg/l cuando esta se administra a una dosis de 1,2g/6h, con una CMI≤1mg/l cuando se dan 2,4g/6h y con una CMI≤2mg/l cuando se dan 2,4g/4h. En la meningitis, solo los aislados con una CMI≤0,064mg/l deben considerarse como sensibles a la bencilpenicilina.
Se calcularon los porcentajes de resistencia a los antibióticos en global y comparándolos según categorías de edad y sexo, y se calcularon los intervalos de confianza del 95%. Se realizaron pruebas de chi cuadrado para comparar los patrones de sensibilidad por categorías de edad y sexo. Se consideraron significativas las diferencias cuando p<0,05. Para el análisis estadístico se utilizó el programa SPSS v. 22.
Aspectos éticosEl estudio fue aprobado por el Comité Ético de Investigación Clínica del IDIAP Jordi Gol (P10/55), y cada participante firmó de forma voluntaria el consentimiento informado. En el caso de los menores de edad, el padre/madre o tutor legal fue quien lo firmó. Se garantizó el anonimato y la confidencialidad, así como la protección de los datos.
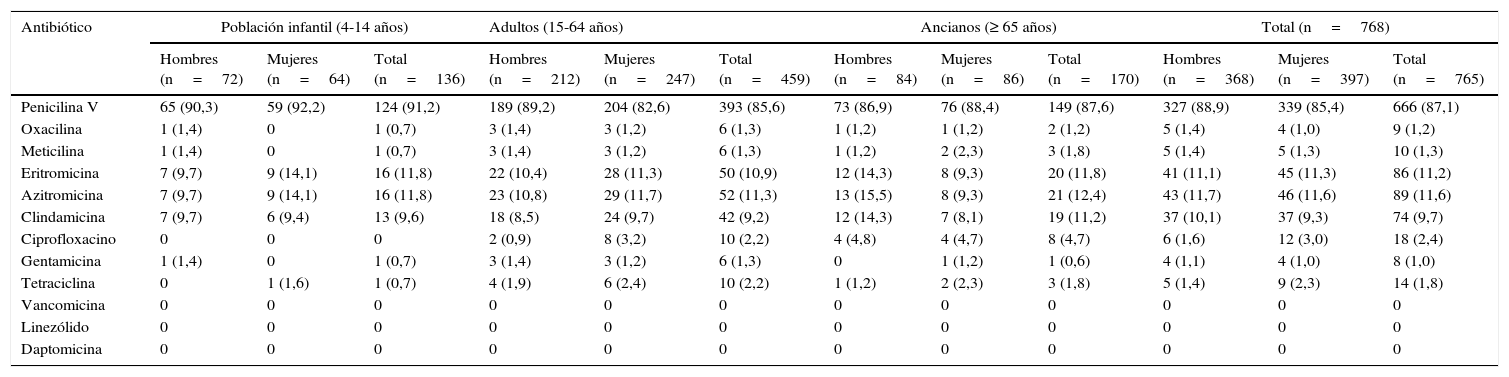
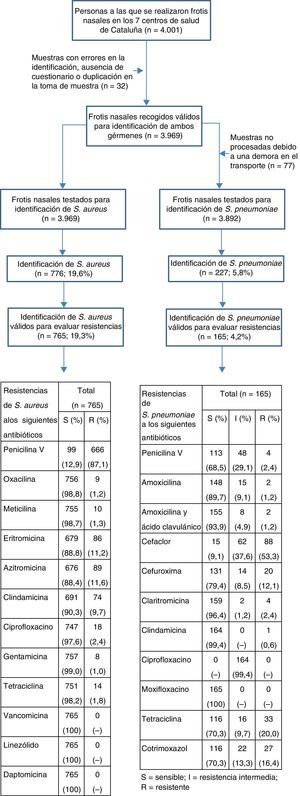
ResultadosDe los 776 aislados de S.aureus se pudieron procesar para el estudio de resistencias un total de 765, mientras que de los 227 aislados de S.pneumoniae se pudieron procesar 165, todo ello probablemente debido a problemas en la descongelación de las muestras, tal como se refleja en el esquema del estudio. En la tabla 2 se observa que el 87,1% de las cepas de S.aureus fueron resistentes a la fenoximetilpenicilina (intervalo de confianza del 95% [IC95%]: 84,7-89,5%). El porcentaje de resistencias frente a los macrólidos fue del 11,6% frente a azitromicina (IC95%: 9,3-13,9%) y del 11,2% frente a eritromicina (IC95%: 9-13,4%). Las tasas de resistencia frente a los otros antibióticos testados fueron bajas excepto clindamicina, con un 9,7% de resistencia (IC95%: 7,6-11,8%). Un total de 10 cepas (1,3%) presentaban SARM (IC95%: 0,5-2,1%). No se observaron diferencias significativas en cuanto al patrón de resistencias de los estafilococos a los antibióticos testados según edad y sexo de los individuos.
Prevalencia de cepas resistentes en personas portadoras de Staphylococcus aureus a los antibióticos examinados. Área de Barcelona, 2010-2011a. Datos presentados en porcentaje (%)
| Antibiótico | Población infantil (4-14 años) | Adultos (15-64 años) | Ancianos (≥ 65 años) | Total (n=768) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hombres (n=72) | Mujeres (n=64) | Total (n=136) | Hombres (n=212) | Mujeres (n=247) | Total (n=459) | Hombres (n=84) | Mujeres (n=86) | Total (n=170) | Hombres (n=368) | Mujeres (n=397) | Total (n=765) | |
| Penicilina V | 65 (90,3) | 59 (92,2) | 124 (91,2) | 189 (89,2) | 204 (82,6) | 393 (85,6) | 73 (86,9) | 76 (88,4) | 149 (87,6) | 327 (88,9) | 339 (85,4) | 666 (87,1) |
| Oxacilina | 1 (1,4) | 0 | 1 (0,7) | 3 (1,4) | 3 (1,2) | 6 (1,3) | 1 (1,2) | 1 (1,2) | 2 (1,2) | 5 (1,4) | 4 (1,0) | 9 (1,2) |
| Meticilina | 1 (1,4) | 0 | 1 (0,7) | 3 (1,4) | 3 (1,2) | 6 (1,3) | 1 (1,2) | 2 (2,3) | 3 (1,8) | 5 (1,4) | 5 (1,3) | 10 (1,3) |
| Eritromicina | 7 (9,7) | 9 (14,1) | 16 (11,8) | 22 (10,4) | 28 (11,3) | 50 (10,9) | 12 (14,3) | 8 (9,3) | 20 (11,8) | 41 (11,1) | 45 (11,3) | 86 (11,2) |
| Azitromicina | 7 (9,7) | 9 (14,1) | 16 (11,8) | 23 (10,8) | 29 (11,7) | 52 (11,3) | 13 (15,5) | 8 (9,3) | 21 (12,4) | 43 (11,7) | 46 (11,6) | 89 (11,6) |
| Clindamicina | 7 (9,7) | 6 (9,4) | 13 (9,6) | 18 (8,5) | 24 (9,7) | 42 (9,2) | 12 (14,3) | 7 (8,1) | 19 (11,2) | 37 (10,1) | 37 (9,3) | 74 (9,7) |
| Ciprofloxacino | 0 | 0 | 0 | 2 (0,9) | 8 (3,2) | 10 (2,2) | 4 (4,8) | 4 (4,7) | 8 (4,7) | 6 (1,6) | 12 (3,0) | 18 (2,4) |
| Gentamicina | 1 (1,4) | 0 | 1 (0,7) | 3 (1,4) | 3 (1,2) | 6 (1,3) | 0 | 1 (1,2) | 1 (0,6) | 4 (1,1) | 4 (1,0) | 8 (1,0) |
| Tetraciclina | 0 | 1 (1,6) | 1 (0,7) | 4 (1,9) | 6 (2,4) | 10 (2,2) | 1 (1,2) | 2 (2,3) | 3 (1,8) | 5 (1,4) | 9 (2,3) | 14 (1,8) |
| Vancomicina | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Linezólido | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Daptomicina | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
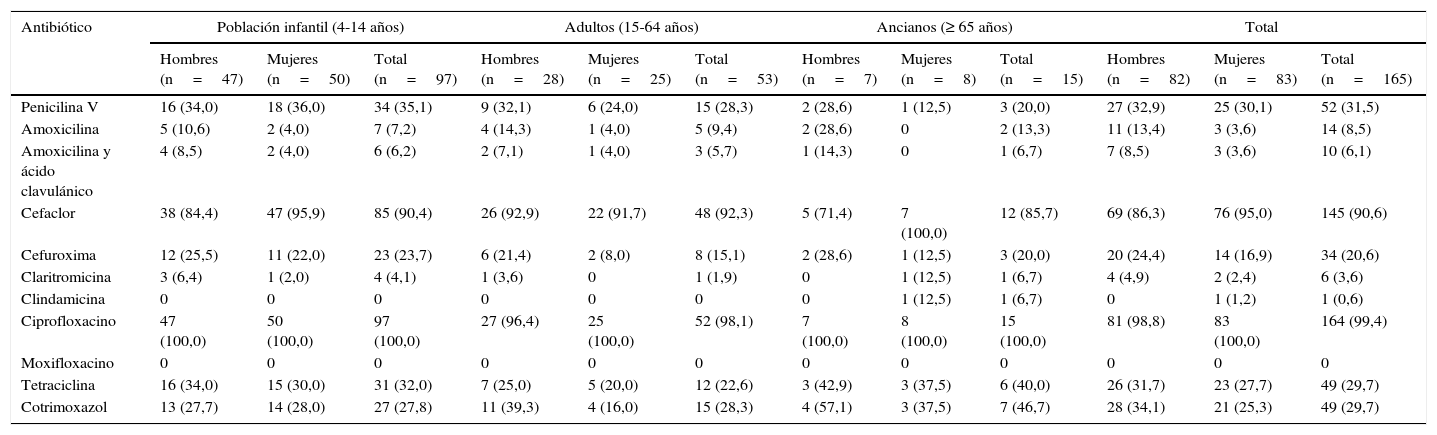
En el esquema del estudio se observan los porcentajes de resistencia alta, resistencia intermedia y sensibilidad de S.pneumoniae frente a los antibióticos testados en global, y en la tabla 3 se describen las prevalencias de resistencia agrupadas (resistencias alta e intermedia) y estratificadas por grupos de edad y sexo. En cuanto a los β-lactámicos, las mayores resistencias se observaron frente a las cefalosporinas, con un 53,3% de alta resistencia frente a cefaclor (IC95%: 45,7-60,9%) y del 12,1% frente a cefuroxima (IC95%: 7,1-17,1%). En cambio, las resistencias frente a las penicilinas fueron mucho más bajas, con un 2,4% de alta resistencia frente a fenoximetilpenicilina (IC95%: 0,1-4,7%) y un 1,2% frente a amoxicilina y a la asociación de amoxicilina y ácido clavulánico (0-2,9%). De forma similar, el porcentaje de resistencia intermedia fue también mayor para fenoximetilpenicilina (29,1%; IC95%: 22,2-36%), comparado con amoxicilina (9,1%; IC95%: 4,7-13,5%) y con la asociación de amoxicilina y ácido clavulánico (4,9%; IC95%: 1,6-8,2%). Un 2,4% de las cepas de S.pneumoniae fueron resistentes a claritromicina (IC95%: 0,1-4,7%), único macrólido testado para este microorganismo, pero solo el 0,6% lo fue frente a clindamicina. Solo 3 cepas aisladas presentaron algún grado de resistencia combinada frente a penicilina y macrólido (0,3%). Es importante también destacar que el 20% de los neumococos fueron resistentes a tetraciclina (IC95%: 13,9-26,1%). En cuanto a las quinolonas, prácticamente todas las cepas de S.pneumoniae fueron parcialmente resistentes a ciprofloxacino y, en cambio, el 100% fueron sensibles a moxifloxacino. No se observaron diferencias significativas en cuanto al patrón de resistencias de los neumococos según edad y sexo de los individuos.
Prevalencia de cepas resistentesa en personas portadoras de Streptococcus pneumoniae a los antibióticos examinados. Área de Barcelona, 2010-2011. Datos presentados en porcentaje (%)
| Antibiótico | Población infantil (4-14 años) | Adultos (15-64 años) | Ancianos (≥ 65 años) | Total | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hombres (n=47) | Mujeres (n=50) | Total (n=97) | Hombres (n=28) | Mujeres (n=25) | Total (n=53) | Hombres (n=7) | Mujeres (n=8) | Total (n=15) | Hombres (n=82) | Mujeres (n=83) | Total (n=165) | |
| Penicilina V | 16 (34,0) | 18 (36,0) | 34 (35,1) | 9 (32,1) | 6 (24,0) | 15 (28,3) | 2 (28,6) | 1 (12,5) | 3 (20,0) | 27 (32,9) | 25 (30,1) | 52 (31,5) |
| Amoxicilina | 5 (10,6) | 2 (4,0) | 7 (7,2) | 4 (14,3) | 1 (4,0) | 5 (9,4) | 2 (28,6) | 0 | 2 (13,3) | 11 (13,4) | 3 (3,6) | 14 (8,5) |
| Amoxicilina y ácido clavulánico | 4 (8,5) | 2 (4,0) | 6 (6,2) | 2 (7,1) | 1 (4,0) | 3 (5,7) | 1 (14,3) | 0 | 1 (6,7) | 7 (8,5) | 3 (3,6) | 10 (6,1) |
| Cefaclor | 38 (84,4) | 47 (95,9) | 85 (90,4) | 26 (92,9) | 22 (91,7) | 48 (92,3) | 5 (71,4) | 7 (100,0) | 12 (85,7) | 69 (86,3) | 76 (95,0) | 145 (90,6) |
| Cefuroxima | 12 (25,5) | 11 (22,0) | 23 (23,7) | 6 (21,4) | 2 (8,0) | 8 (15,1) | 2 (28,6) | 1 (12,5) | 3 (20,0) | 20 (24,4) | 14 (16,9) | 34 (20,6) |
| Claritromicina | 3 (6,4) | 1 (2,0) | 4 (4,1) | 1 (3,6) | 0 | 1 (1,9) | 0 | 1 (12,5) | 1 (6,7) | 4 (4,9) | 2 (2,4) | 6 (3,6) |
| Clindamicina | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 (12,5) | 1 (6,7) | 0 | 1 (1,2) | 1 (0,6) |
| Ciprofloxacino | 47 (100,0) | 50 (100,0) | 97 (100,0) | 27 (96,4) | 25 (100,0) | 52 (98,1) | 7 (100,0) | 8 (100,0) | 15 (100,0) | 81 (98,8) | 83 (100,0) | 164 (99,4) |
| Moxifloxacino | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Tetraciclina | 16 (34,0) | 15 (30,0) | 31 (32,0) | 7 (25,0) | 5 (20,0) | 12 (22,6) | 3 (42,9) | 3 (37,5) | 6 (40,0) | 26 (31,7) | 23 (27,7) | 49 (29,7) |
| Cotrimoxazol | 13 (27,7) | 14 (28,0) | 27 (27,8) | 11 (39,3) | 4 (16,0) | 15 (28,3) | 4 (57,1) | 3 (37,5) | 7 (46,7) | 28 (34,1) | 21 (25,3) | 49 (29,7) |
Este estudio pone de manifiesto que los mayores porcentajes de resistencia de S.aureus se observan, aparte de la fenoximetilpenicilina, frente a los dos macrólidos testados (eritromicina y azitromicina), con más del 10% de resistencia, y en cambio solo se observa un 1,3% de SARM. Las cepas de S.pneumoniae muestran un perfil de sensibilidad muy alto frente a penicilinas y macrólidos, mientras que se observan altos porcentajes de resistencia frente a cefalosporinas.
Fortalezas y limitaciones del estudioAunque el trabajo de campo de este estudio se llevó a cabo en los años 2010 y 2011, se han utilizado los puntos de corte actuales publicados en 2017. No obstante, consideramos que los niveles de resistencia no han cambiado desde entonces, ya que el consumo de antibióticos en España se ha mantenido de forma estable. Se obtuvieron los datos en portadores sanos atendidos en atención primaria, y aunque es cierto que los datos de resistencias en cepas patógenas aportarían mejor evidencia para el tratamiento empírico, creemos que los datos son representativos de los pacientes atendidos en la práctica habitual de las consultas. No obstante, en estudios recientes se observa que existe una fuerte asociación entre los aislados de S.pneumoniae que colonizan nasofaringe en niños sanos y los causantes de enfermedad invasiva9. En otros estudios se observa que las cepas de portadores podrían ser incluso más resistentes que las cepas patógenas10,11.
La mayor fortaleza de este trabajo es que se trata de un estudio realizado en personas atendidas en atención primaria y, por tanto, extrapolable a la realidad que se observa en la comunidad.
Comparación con otros estudiosEste estudio pone también de manifiesto que las resistencias existentes tanto en S.aureus como en S.pneumoniae en personas sanas atendidas en atención primaria son más bajas que los informes de sensibilidad de los gérmenes respiratorios que se publican y que se basan exclusivamente en muestras de pacientes hospitalizados12. En el caso de S.aureus es llamativo que tan solo el 1,3% de sus cepas sean SARM. Los trabajos realizados a nivel hospitalario a principios de esta década, a partir de cepas de infecciones invasivas, bacteriemias y neumonías, muestran porcentajes de resistencia superiores que oscilan entre el 7,8 y el 42,8%, según las series13-17. En cuanto al neumococo, también se observa esta diferenciación de los patrones de sensibilidad entre atención primaria y hospital; en trabajos realizados en España se observa que las resistencias del neumococo frente a macrólidos y quinolonas están al alza12,18. Sin embargo, en el presente trabajo el porcentaje de resistencia de los neumococos aislados de la nasofaringe de personas sanas frente a macrólidos fue prácticamente inexistente, con más de un 96% de sensibilidad. No obstante, la resistencia intermedia frente a ciprofloxacino fue muy elevada, aunque no se observaron cepas altamente resistentes frente a esta quinolona. En un estudio de ámbito hospitalario con muestras de pacientes con enfermedad invasiva (realizado en 2009 y 2010), el 10,6% de las cepas de S.pneumoniae fueron resistentes a levofloxacino, una fluoroquinolona denominada respiratoria por su buen perfil frente a los patógenos respiratorios19.
Uno de los resultados más destacados de este estudio son los reducidos porcentajes de alta resistencia de S.pneumoniae frente a penicilinaV. En enero de 2008, después de una reevaluación en la que se tuvieron en cuenta nuevos estudios clínicos, el Clinical and Laboratory Standards Institute (CLSI), organismo internacional encargado de fijar estos puntos de corte en aquella época, publicó unos nuevos puntos de corte para penicilina para las infecciones no meníngeas, de forma que disminuyó drásticamente el porcentaje de resistencias de este germen frente a la fenoximetilpenicilina20. Desde hace unos años, los laboratorios de microbiología en Europa están adaptando progresivamente nuevos puntos de corte con el uso de unas nuevas guías, las publicadas por EUCAST8. Con estas nuevas guías los porcentajes de resistencia parecen haber aumentado, ya que los puntos de corte establecidos por este organismo son mucho más estrictos que los que establecía el CLSI. A pesar de ello, solo un poco más del 2,4% de las cepas neumocócicas fueron altamente resistentes a la fenoximetilpenicilina en el presente estudio, cuando se consideran aquellas cepas que presentaban una CMI≥2μg/ml, aunque el 29,1% presentaban resistencia intermedia (CMI entre 0,06 y 2μg/ml). En otras palabras, se podrían tratar el 68,5% de las infecciones por S.pneumoniae con dosis habituales de penicilinaV, y solo en un 29,1% de los casos se debería subir la dosis para conseguir alcanzar concentraciones de antibiótico en más del 40% del tiempo entre dosis y ser capaz de erradicar el germen; en el 2,4% restante se debería cambiar el antibiótico21.
Esta baja prevalencia de resistencias de S.pneumoniae frente a fenoximetilpenicilina y amoxicilina también se ha observado en distintos trabajos recientemente publicados tanto en población infantil sana portadora de S.pneumoniae como en muestras de pacientes con enfermedad neumocócica invasiva realizados en los primeros años de la década actual, como el presente estudio22-25. No obstante, no puede descartarse que estas resistencias puedan ser más bajas en aislados de la comunidad ya que, en otro estudio realizado en atención primaria en pacientes con exacerbación de bronquitis crónica, ya se determinaron unos porcentajes de resistencias de neumococo aislados en cultivos de esputo frente a penicilinaV, amoxicilina y asociación de amoxicilina y ácido clavulánico más bajos que los observados en pacientes hospitalizados26.
La resistencia antimicrobiana es un fenómeno natural e imparable, exacerbado por el uso excesivo y mal uso de los antimicrobianos en el tratamiento de los procesos infecciosos. Como S.pneumoniae es la causa más frecuente de neumonía adquirida en la comunidad y en la práctica clínica es muy difícil distinguir esta causa de la debida a otros gérmenes, las guías recomiendan que el tratamiento empírico de estas infecciones supuestamente bacterianas sea efectivo frente al neumococo. En países donde los porcentajes de resistencia a las penicilinas son altos es lógico que las guías recomienden el uso de agentes no β-lactámicos. Sin embargo, estos hábitos de prescripción aumentan la presión selectiva de los agentes antimicrobianos como los macrólidos y las fluoroquinolonas. En base a los resultados obtenidos en este estudio, no hay razón para tener que cambiar de antibióticos de primera línea cuando se sospecha una infección por S.pneumoniae. Tampoco hay razón para prescribir la asociación de amoxicilina y ácido clavulánico en lugar de amoxicilina sola, ya que los porcentajes de resistencia a ambos antibióticos es prácticamente igual y la razón esgrimida por profesionales sanitarios de intentar cubrir las cepas de Haemophilus influenzae a amoxicilina por la liberación de β-lactamasas carece de sentido en la actualidad, ya que en la actualidad menos del 10% de estos gérmenes son resistentes a amoxicilina27.
Es conocido que la mayoría de los estafilococos son productores de penicilinasa, y esto queda reflejado en este estudio con los porcentajes de resistencia de estafilococo a los β-lactámicos. A partir de los datos del presente estudio, es preocupante el elevado porcentaje de resistencia de estafilococo a los macrólidos, de aproximadamente el 10%, aunque en un estudio del mismo proyecto APRES publicado anteriormente se observaba en todos los países participantes que las resistencias más altas son a penicilinaV, seguido de las resistencias frente a macrólidos28. También es preocupante el elevado porcentaje de resistencias de S.pneumoniae frente a cefalosporinas, fármacos aún bastante utilizados en atención primaria y el elevadísimo porcentaje de cepas neumocócicas parcialmente resistentes a ciprofloxacino, lo que podría conllevar problemas en un futuro. Probablemente estas resistencias hubiesen sido incluso superiores en aislados a partir de personas enfermas29. En este sentido, es importante la selección de antibióticos que pueda hacerse en personas con alergia o supuesta alergia a los β-lactámicos. Los macrólidos podrían constituir una buena elección en detrimento de las quinolonas. También se observa que los porcentajes de resistencia mixta frente a penicilina y macrólidos son muy bajos, de la misma manera que se ha demostrado a nivel europeo30. Si bien es cierto que las guías recomiendan el uso de las denominadas fluoroquinolonas respiratorias (levofloxacino y moxifloxacino) en pacientes alérgicos a los β-lactámicos, se ha observado que la sensibilidad frente a estos últimos es total, pero no se puede descartar que en futuro próximo se produzca un aumento de las resistencias, por lo que una actitud prudente en el uso de estos medicamentos parece la más sensata. Tampoco parece una buena opción el uso de tetraciclina, siendo esta familia de antibióticos apenas usada en atención primaria.
En conclusión, es importante disponer en atención primaria de un mapa de resistencias comunitarias de los gérmenes más habituales a los antibióticos más utilizados. Regularmente se dispone de los mapas de resistencia de los uropatógenos, pero es poco habitual disponer de las sensibilidades de los gérmenes que causan infecciones respiratorias, que son las más habitualmente atendidas por los médicos de familia. Este estudio pone de manifiesto los porcentajes de resistencia de S.aureus y S.pneumoniae. Conocer estos perfiles de resistencia es importante a la hora de utilizar más razonablemente en atención primaria los antibióticos y, así, ser capaces de minimizar, e incluso revertir, las elevadas tasas de resistencia antimicrobiana31.
A partir de estos resultados de resistencia sería interesante determinar si existe una asociación entre el consumo previo de antibióticos de estas personas portadoras de estas dos bacterias, ya que está claramente establecido que el consumo previo de agentes bacterianos es una de las principales causas de resistencia de los gérmenes que albergamos en nuestro organismo y ello pondría de manifiesto la necesidad de ser cautos a la hora de prescribir estos fármacos en la comunidad.
- •
En las últimas décadas se ha producido un aumento en las resistencias de los gérmenes gramnegativos y un descenso progresivo de los grampositivos a los antibióticos clásicos.
- •
No obstante, en los últimos años se está observando un aumento de resistencias de neumococo a macrólidos y quinolonas en estudios a partir de cepas hospitalarias.
- •
El porcentaje de S.aureus resistente a la meticilina en la comunidad es del 1,3%, mientras que los porcentajes de resistencia frente a penicilinas son elevados.
- •
Los porcentajes de resistencia de S.pneumoniae frente a los β-lactámicos son muy bajos, también frente a fenoximetilpenicilina, sin observarse diferencias en el perfil de resistencias respecto a edad y sexo de los individuos. En cambio, es preocupante el porcentaje de no sensibilidad frente a cefalosporinas que se usan habitualmente en atención primaria (cefaclor, cefuroxima) y a las quinolonas clásicas.
- •
Extrapolar los resultados de estudios con cepas aisladas recogidas del ámbito hospitalario a la realidad de la atención primaria puede ser equívoco.
Estudio financiado por la Comisión Europea, 7th Framework Programme (beca núm. 223083).
Conflicto de interesesCL declara haber recibido una beca del Institut Universitari d’Investigació en Atenció Primària Jordi Gol (IDIAP Jordi Gol) en el año 2013 para una estancia de investigación en Cardiff. También declara haber recibido becas de investigación de la Comisión Europea (Sixth & Seventh Programme Frameworks y Horizon 2020) y del Instituto de Salud CarlosIII.
AB ha recibido una beca XB 2015 para investigación del Institut Català de la Salut.
Los otros autores declaran no tener ningún conflicto de intereses.
Agradecemos a todos los pacientes y profesionales de atención primaria que han participado, así como a Laura Prats, Edurne Zabaleta, Bonaventura Bolíbar, Pere Simonet, Rosa Morros, Casper DJ den Heijer y Rachid Yahiaoui su ayuda en el desarrollo del proyecto. También agradecemos a Francois Schellevis, Mike Pringle, Ellen Stobberingh, Herman Goossens y Gilles Hebbrecht la dirección y coordinación del proyecto APRES. Agradecemos a Carolina Bayona su contribución en la corrección lingüística de la lengua española de este artículo.
Centro de Salud Guinardó, Barcelona: M. Carme Casanovas Fuste, Jordi Nadal Echevarría, Antonia Herrera Ruiz, María Asunción Altaba Barceló, Albert Boada Valmaseda, Elisabet Rodríguez Rodríguez.
Centro de Salud Congrés, Barcelona: Natalia López Pareja, M. Ángeles Salvador Millán.
Centro de Salud Santa Eulàlia Sud, l’Hospitalet de Llobregat, Barcelona: Xavier Mas Garriga, Isabel Zamora Casas, Immaculada Cid, Francisco J. Cañamares Barroso.
Centro de Salud Viladecans 2, Viladecans, Barcelona: Pere J. Simonet Aineto, Rosa Villafáfila Ferrero, Noelia Esplugas Muñoz, Estefanía Sanjuán Sanchís, María Jesús Llobera Bauza, Concepció García Peláez.
Centro de Salud Corbera, Corbera de Llobregat, Barcelona: Luis Altmann Muller, Ana M. Embid García.
Centro de Salud La Gavarra, Cornellà de Llobregat, Barcelona: Marta Soler Costa, Jordi Argimont Font, Raquel Martos Medina.
Centro de Salud Sant Ildefons, Cornellà de Llobregat, Barcelona: Manuel Álvarez Fernández, Marta Rosario D’Lacoste Farre, Eulalia Ruiz Gil, Amparo Pallares Sancho-Tello, Josep Balaguer Martínez.
Este trabajo ha sido realizado en el marco del Doctorado en Medicina de la Universitat Autònoma de Barcelona del doctorando Albert Boada Valmaseda.