La tasa de incidencia más alta de hepatitisB (HB) en España se detecta en los adultos entre 20 y 54años, mientras que la incidencia de casos en menores de un año es casi nula. La baja prevalencia de HB en los menores de un año se debe principalmente al éxito de las estrategias de cribado gestacional para la detección de gestantes HBsAg(+) y a las campañas de vacunación durante la infancia. Actualmente en España la última dosis de la vacuna frente a la HB en el calendario de vacunación infantil es a los 6meses de edad, si bien hay estudios que demuestran que retrasar la edad de la administración de la última dosis y aumentar el tiempo entre las dosis pueden mejorar la memoria inmunológica ofreciendo una mayor protección frente al virus en la edad adulta. Se revisa el impacto de la vacunación frente a la HB en España y se comentan otras estrategias posibles de vacunación en nuestro medio, ampliando el intervalo entre dosis y la administración de la última dosis en el segundo año de la vida, adaptando la estrategia vigente en España al actual contexto epidemiológico con el fin de disminuir la prevalencia en la edad adulta.
The highest incidence rate of hepatitisB (HB) in Spain is detected in adults between 20 and 54years old, whereas the incidence in children under 1year old is almost nil. The low prevalence of HB in children under 1year is mainly due to the success of gestational screening strategies for the detection of HBsAg(+) in pregnant women, and vaccination campaigns during childhood. Currently, in Spain, the last dose of the HB included in the national childhood immunization program is administered at 6months of age, although some studies show that delaying the age of the administration of the last dose of HB vaccine and increasing the time between doses, may improve immune memory by offering greater protection against this virus in the adulthood. In this article, the impact of HB vaccination in Spain is reviewed, and other potential vaccination strategies in our environment are discussed, such as extending the interval between doses, and administering the last dose in the second year of life, adapting the valid strategy in Spain to the current epidemiological context in order to reduce the prevalence of HB in adulthood.
Las vacunas frente a la hepatitisB (HB) (monovalentes o combinadas) se han mostrado muy seguras y con elevada efectividad. En España se introdujo la vacunación en 1982 en los grupos de riesgo, y en 1992 el Consejo Interterritorial del Sistema Nacional de Salud recomendó la vacunación en adolescentes y la inclusión gradual de la vacunación desde el nacimiento. En 2002, todas las comunidades autónomas (CCAA) habían incorporado la vacunación frente a la HB en los recién nacidos (RN) o en los lactantes de corta edad.
Tras más de una década desde la vacunación universal en el RN o lactante, procede evaluar el impacto que ha tenido en la comunidad y discutir potenciales áreas de mejora cuyo objetivo sería mantener la protección a largo plazo.
Antes de la vacunación, en España la tasa de portadores de antígeno de superficie del virus de la HB (HBsAg) se situaba entre el 1 y el 5% de la población general1,2, por lo que se consideraba un país de prevalencia intermedia/moderada de HB, superior a los países del centro o del norte de Europa, que oscilaba entre el 0,1 y el 2%3. En la encuesta seroepidemiológica de Cataluña4, en el año 1989, se observó que la prevalencia de HBsAg era baja en población infantil, y que a partir de los 15años de edad presentaba un incremento brusco, manteniendo una tendencia ascendente durante la edad adulta. Esta situación fue la que llevó en Cataluña a establecer inicialmente la vacunación en el adolescente como estrategia prioritaria.
Se han realizado pocos estudios en España que analicen los cambios epidemiológicos de la HB y el impacto de las estrategias de vacunación instauradas progresivamente en los últimos 20-25años. Dichas estrategias han consistido en la vacunación del personal sanitario, la vacunación de los grupos de riesgo, la vacunación en los adolescentes, la vacunación neonatal en hijos de madres portadoras de HBsAg, y finalmente la incorporación de la vacunación en el calendario vacunal sistemático en los lactantes5. La estrategia de vacunación realizada a los hijos de madres portadoras del HBsAg para el control de la enfermedad en niños es crítica, ya que pese a que actualmente la infección de los niños nacidos de madres portadoras del virus de la HB (VHB) no es frecuente, su infección tiende a cronificarse, de forma que antes de la vacunación representaban la tercera parte de los portadores crónicos del (VHB)2.
Las pautas de vacunación frente a la HB vigentes en el calendario vacunal infantil no están uniformizadas en todas las CCAA en España y coexisten 2 pautas diferentes con 3 dosis: a los 0-2-6 meses, y a los 2-4-6 meses6.
Los calendarios y pautas de vacunación deben ir ajustándose a la nueva epidemiología, modificada en gran parte por la propia vacunación, y basarse en las nuevas evidencias científicas, en la realidad epidemiológica, así como en las modificaciones de las fichas técnicas o la aparición de nuevos preparados vacunales. Un ejemplo reciente lo tenemos en el caso de la pauta de vacunación frente a la enfermedad meningocócica causada por el serogrupoC, donde se pasó de una pauta de 3dosis en el primer año a una nueva pauta de 2dosis en el primer año y una tercera dosis en el segundo año (pauta 2+1), y recientemente a una pauta de una dosis en el primer año, otra en el segundo año y una tercera dosis en la adolescencia (pauta 1+1+1)7. En el caso de la HB, las estrategias de prevención y protección en los RN y lactantes instauradas en España han sido un éxito, como así lo indican los informes epidemiológicos y los datos de prevalencia de la enfermedad en la población pediátrica8. Sin embargo, una vez que se ha conseguido controlar la infección en los niños, el objetivo debería ser optimizar el control de la enfermedad en otras edades, y fundamentalmente garantizar una mayor duración de la protección en la edad adulta, ya que es en los sujetos adultos no vacunados donde se concentra básicamente la circulación del virus y la mayoría de los casos de enfermedad actualmente en nuestro medio.
Este artículo tiene un triple objetivo: analizar el impacto que la vacunación frente a la HB ha tenido en España, evaluar las recomendaciones internacionales de vacunación frente a la HB, y en función de ello considerar recomendaciones en España en relación con la prevención de la HB mediante la vacunación en los primeros años de vida.
MetodologíaSe ha realizado una revisión no sistemática de la literatura sobre la epidemiología de la HB en España, las vacunas frente al virus de la HB disponibles, el fenómeno de la protección a largo plazo y la memoria inmune, así como pautas de calendario vacunal. La revisión de las bases de datos EBM Reviews, Embase y MedLine se realizaron entre diciembre de 2013 y enero de 2014. La estrategia de búsqueda incluyó términos relacionados con HB y vacunación, limitada a estudios publicados en inglés y español. También se incluyó en la revisión toda literatura gris, como informes de la Organización Mundial de la Salud (OMS), Centers of Disease Control (CDC) o European Centre for Disease Prevention and Control (ECDC), además de informes del Ministerio de Salud y de diferentes consejerías de salud de las CCAA españolas.
ResultadosEpidemiología de la hepatitis B e impacto de la vacunaciónSegún datos de la OMS, se estima que aproximadamente 2.000 millones de personas están infectadas por el VHB en todo el mundo. De ellas, entre 350 y 400 millones de personas sufren la enfermedad de forma crónica y es la causa de más de 780.000 defunciones anuales9. En una revisión sistemática de la literatura en artículos publicados entre 1975 y 2011 se estimó que entre el 8 y el 30% de las madres portadoras de HBsAg transmiten el virus a sus hijos RN10.
En Estados Unidos, entre los años 1978 y 2009 los casos de HB pasaron de 26.000 a mediados de los ochenta (incidencia de 10,93 casos por 100.000 habitantes), a 3.405 casos en 2009 (1,1 por 100.000 habitantes). El periodo en el que se produjo mayor reducción fue entre 1990 y 2004, con una disminución de la incidencia del 75%. Esto se produjo por una serie de estrategias adoptadas desde 1982, entre las que se encontraba la vacunación frente al VHB. A partir de 1991 comenzó la vacunación universal en niños y la inclusión de medidas rutinarias de detección del VHB en mujeres embarazadas, implantándose la inmunoprofilaxis en los RN de madres con HBsAg(+), la vacunación en niños y adolescentes previamente no vacunados y la vacunación en adultos no vacunados considerados población de riesgo11. Se estima que la incorporación de los diferentes programas de prevención en Estados Unidos entre los años 1994 y 2013 habrá prevenido en relación con la hepatitis B 4.000.000 de casos de infección, 623.000 hospitalizaciones relacionadas con la enfermedad y casi 60.000 muertes12.
En Europa la vacunación frente a la HB no es homogénea en los distintos países, de forma que prácticamente no se utiliza en los países del norte de Europa, donde la prevalencia de la enfermedad es baja, inferior a la que había en el sur de Europa antes de la vacunación. Con toda esta heterogeneidad, se estima que el número de personas infectadas por el VHB en Europa es de 13,3millones, que supone una prevalencia global del 1,8% de los adultos9,13. La incidencia media se estima en 3,5 casos por 100.000 habitantes, según datos de la encuesta realizada en 28 países en 2012 y publicados en el informe del ECDC de 201313, y varía en función del país. Los datos disponibles muestran que la transmisión vertical madre-hijo sigue siendo la vía más frecuente de transmisión del virus en la edad pediátrica. La prevalencia de infección en mujeres gestantes (HBsAg+) es muy variable y oscila entre el 0,1 y el 4,4%. Por rangos de edad, se observa que el mayor número de personas infectadas se concentra entre los 25-34años, donde se declaran el 32,9% de los casos crónicos, si bien el incremento comienza a partir de los 15años de edad y sigue aumentando hasta la franja de los 25-34años. La infección por el VHB también es responsable del 5-10% de los trasplantes hepáticos en Europa14.
En España, desde la incorporación de la vacuna frente a la HB se ha ido reduciendo la incidencia de infección por el VHB, pasando de 2 casos por 100.000 habitantes en 2002 a 1,27 casos por 100.000 habitantes en 2005. Durante el periodo 2005 a 2008 hubo un aumento de casos que hizo que la incidencia aumentase un 25% anual (hasta 2,27 casos por 100.000 habitante en 2008), debido posiblemente al aumento de población inmigrante procedentes de zonas con elevada prevalencia, el contagio por transmisión sexual y la detección precoz de la enfermedad que favorece el mayor reporte de los casos5. A partir del 2008 se observa de nuevo un descenso de la incidencia de HB que se mantiene en los años 2011 y 2012, con tasas que se sitúan en 1,65 y 1,27 casos por 100.000 habitantes/año, respectivamente15,16. Dado que el comienzo de la vacunación frente a la HB se inició en los años noventa en niños de 12años (que en la actualidad están al inicio de la tercera década de su vida), la edad media de las personas infectadas por el VHB, en los años 2011 y 2012 fue de 43años, superior a la época prevacunal, que se encontraba en 38años. Por franja de edad, la tasa de incidencia más alta se detecta en el grupo de 35 a 54años, con 1,99 casos por 100.000 habitantes, seguido de la franja de edad entre 20-34años, donde la tasa se sitúa en 1,64 casos por 100.000 habitantes16. En los menores de un año la incidencia de casos es prácticamente nula (2 casos en 2012).
Así mismo, la tasa global de casos debidos a transmisión parenteral entre 2011 y 2012 (según últimos datos disponibles) tiene una tendencia negativa, siendo de 1,74 casos por 100.000 habitantes en 2011 y de 1,31 casos por 100.000 habitantes en 201216.
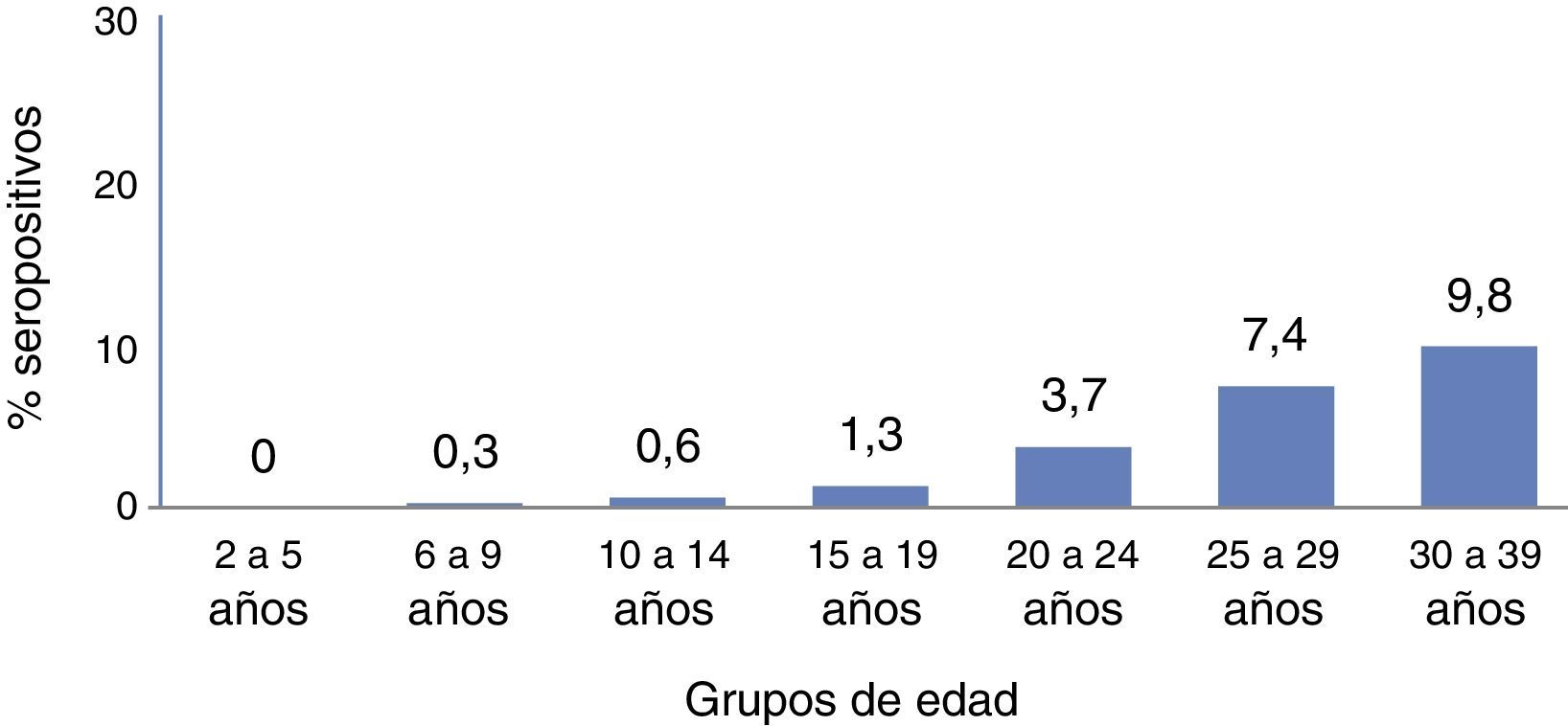
Los datos seroepidemiológicos de la última encuesta de seroprevalencia en España a nivel nacional son de 199617 (posteriormente se realizaron encuestas regionales en el País Vasco [2011]18 y en Asturias [2004])19, y mostraron en aquel entonces que en España la prevalencia de portadores del VHB era entre el 2 y el 9,8% en mayores de 15años, según el rango de edad2. Estas cifras deben tomarse hoy con cautela, ya que ha pasado más de una década desde la última encuesta y muy probablemente la situación actual es diferente (fig. 1).
Según datos de la misma encuesta de seroprevalencia en España2, la prevalencia global de anti-HBc(+) era del 0% en el grupo de edad de 0-5años. Es a partir de los 20 a 24años cuando se observaba un mayor incremento de pacientes con anti-HBc(+), con una tasa del 3,6%, y que alcanza el 7,4% en el grupo de 25 a 29años y del 9,8% en el grupo de 30 a 39años8.
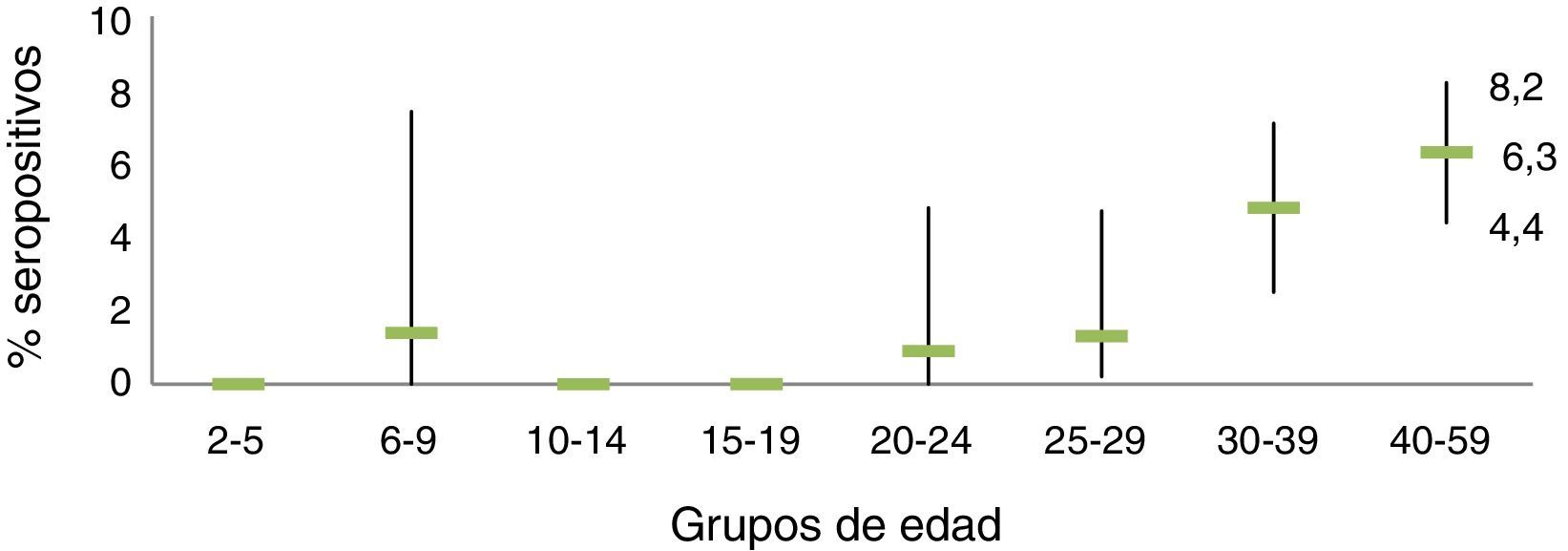
En la encuesta de seroprevalencia del País Vasco en 201118 se obtuvo una prevalencia muy baja de anticuerpos frente al antígeno del core del VHB en menores de 30años, lo que significa una baja circulación del virus en esta población, mayoritariamente vacunada (fig. 2).
Estrategias para la prevenciónHijos de madres portadoras de HBsAgEn aquellos RN cuyas madres son HBsAg(+), el riesgo de transmisión del VHB por transmisión vertical es del 8-30%10. La prevención en la transmisión perinatal del VHB se basa en la inmunoprofilaxis frente a la HB con la inmunoglobulina específica anti-HB al nacimiento y con la vacunación frente a la HB en el RN en pauta 0, 1 y 6meses. Sin embargo, estas estrategias pueden no ser eficaces en aquellos RN cuyas madres tengan una elevada carga viral >106,7UI/ml, ya que tienen un mayor riesgo de transmisión del VHB que aquellas madres con una menor carga (incremento del riesgo superior al 10%). En estos casos, la eficacia de la inmunoglobulina y de la vacuna en el RN es superior cuando estas madres son tratadas durante el embarazo y reducen su carga viral antes de dar a luz20.
Afortunadamente, la realidad en España es que existen campañas de cribado gestacional en todas las CCAA, siendo excepcional la transmisión vertical del virus de la HB, dada la gran efectividad (>95%) de la estrategia preventiva mediante la administración neonatal de inmunoglobulina y la vacuna en los RN de las madres detectadas como portadoras, por lo que la vacunación en el RN (<24h) no debería ser necesaria de forma rutinaria, si existe un cribado gestacional bien implementado.
Hijos de madres no portadoras de HBsAgEn el caso de las madres no portadoras de HBsAg, coexisten en España 2 pautas de vacunación frente a la HB mencionadas anteriormente en el apartado de introducción de este artículo. Una pauta de vacunación frente al VHB en niños nacidos de madres no portadoras de VHB a los 2-4-6meses permite una mayor respuesta de anticuerpos anti-HBs que una pauta administrada a los 0-2-6meses. Un estudio reciente muestra que en adolescentes nacidos de madres no portadoras de VHB y que habían sido vacunados frente al VHB en la época de lactantes, la persistencia de anti-HBs >10mUI/ml era mayor en los vacunados con la primera dosis a partir de los 2meses de edad (grupo 1) que en los vacunados con la primera dosis en los primeros 7días de vida (grupo 2), con diferencias estadísticamente significativas. Además, tras la administración en estos adolescentes de una dosis de vacuna VHB de recuerdo, la respuesta de anti-HBs en títulos medios geométricos (GMT) era superior en el grupo 1 con respecto al grupo 2, con diferencias igualmente significativas. Otros estudios de la literatura muestran también las mismas conclusiones21-24. Por consiguiente, una pauta de vacunación frente al VHB iniciada a los 2meses de edad genera una mayor respuesta de anticuerpos protectores que una pauta iniciada en las primeras horas o días de vida25.
Vacunas monovalentes y combinadas de hepatitis BActualmente en España se comercializan tanto vacunas frente la HB monovalentes como combinadas. Las vacunas monovalentes comercializadas para población pediátrica son Engerix-B® 10μg y Hbvaxpro® 5μg26. Por su parte, las vacunas combinadas ofrecen, con una sola administración, protección frente a un mayor número de enfermedades, lo que favorece el cumplimiento del calendario de vacunación, y además obtienen una mayor aceptación entre los padres por la disminución del número de pinchazos y la simplificación de la pauta27,28. Existen 2 vacunas hexavalentes combinadas comercializas en España (Infanrix Hexa® y Hexyon®), y ambas ofrecen una buena inmunogenicidad, eficacia y tolerabilidad frente a los antígenos que contienen: difteria (D), tétanos (T), tos ferina acelular (Pa), HB, polio inactivada (VPI) y Haemophilus influenzaeb (Hib)29-32.
Las concentraciones de anticuerpos en primovacunación en el primer año y en dosis de recuerdo en el segundo año de la vida con Infanrix Hexa® sugieren que esta vacuna ofrece una protección a largo plazo frente al VHB28. En cuanto a Hexyon®, disponible desde 2013, contiene un nuevo antígeno de superficie de la HB (HBsAg) recombinante desarrollado exclusivamente para esta vacuna. Los diferentes ensayos clínicos realizados han demostrado la no inferioridad de Hexyon® frente a Infanrix Hexa® y frente al resto de vacunas con las que se comparó31. Los resultados de los diferentes ensayos clínicos han mostrado tasas de seroprotección frente a la HB (≥10mUI/ml) un mes después de la primovacunación, con independencia o no del uso de la vacuna frente al HB al nacimiento. Además, Hexyon® es una vacuna líquida y lista para usar, lo que simplifica la labor del profesional sanitario en la práctica clínica diaria, ya que reduce los errores de administración, reduce el tiempo de preparación y el riesgo de contaminación de los componentes de la vacuna33.
Los resultados de ambas vacunas hexavalentes están en línea con las recomendaciones de la OMS9, donde se menciona que la eficacia protectora de la vacunación frente a la HB se relaciona con la inducción de anticuerpos, pero también con la inducción de célulasB de memoria.
Protección a largo plazo y memoria inmuneEl objetivo último de los programas de vacunación frente a la HB debe ser el de proteger frente a la infección durante el mayor tiempo posible de la vida de una persona.
Se considera que una persona está protegida de la enfermedad por HB cuando se consiguen niveles de anti-HBs ≥10mUI/ml después de la primovacunación. Al finalizar la pauta de vacunación, las concentraciones alcanzadas de anti-HBs se reducen rápidamente durante el primer año y más lentamente en los años siguientes. Los mecanismos que permiten que la vacuna tenga una protección a largo plazo frente a la infección son la inducción o estimulación de la memoria inmune gracias a la mediación de los linfocitosT helper y la diferenciación de linfocitosB a células de memoria34.
Un metaanálisis publicado en 201335, basado en una revisión de la literatura de los estudios que incluían información sobre resultados de la concentración de anti-HBs ≥10mUI/ml en lactantes vacunados durante los 6 primeros meses de vida y después de la dosis de recuerdo, concluyó que uno de los determinantes para mejorar la memoria inmune inducida tras la vacunación era aumentar el tiempo entre dosis. Se observó que los 3 factores más relacionados con no alcanzar títulos de anti-HBs ≥10mUI/ml fueron los siguientes: haber administrado antes de los 6meses la última dosis, recibir la primera dosis al nacimiento y el no cumplimiento con el número de las dosis de vacuna recomendadas. En esta misma línea, otros estudios también indican que aumentar el tiempo entre la segunda y la tercera dosis puede dar una mayor protección a largo plazo27.
También se ha observado que la memoria inmunológica está relacionada con la edad del niño en el momento de la administración de la vacuna, y muy especialmente con la edad de administración de la última dosis. Se ha observado que la respuesta inmunológica, tanto en la tasa de anticuerpos como en la génesis de células memoria, es menor en los 12 primeros meses de la vida debido a la inmadurez del sistema inmunitario. Específicamente antes de los 6meses de edad existe un menor desarrollo de folículos linfoides en los ganglios linfáticos que condiciona una menor génesis de célulasB memoria, con implicaciones en la protección conferida a largo plazo por las vacunas. Por tanto, es importante identificar las estrategias de inmunización temprana que sean capaces de dar una respuesta inmunológica robusta en los primeros meses o años de vida, pero que también induzcan protección a largo plazo por la persistencia de tasas de anticuerpos seroprotectores, y sobre todo por la génesis de célulasB de memoria que persistan durante el mayor tiempo posible. Con estas estrategias, además de una protección temprana en la infancia, es posible disminuir la frecuencia y la severidad de las infecciones en la edad adulta gracias a la protección a más largo plazo inducida por la vacunación en la edad pediátrica35.
En un estudio realizado36 en población italiana con adultos sanos, los resultados mostraron, con diferencias estadísticamente significativas, que la población vacunada después del primer año de vida tenía una mejor tasa de seroprotección frente al VHB que los individuos en los que la última dosis fue antes de los 12meses. También en este estudio se valoró la respuesta a una dosis de refuerzo con nuevo control serológico a los 20-30días en una cohorte de vacunados pero con títulos anti-HBs <10mUI/ml. Los resultados mostraron que aquellos sujetos en los que los valores antes de la dosis de refuerzo eran <2mUI/ml, la respuesta a dicha dosis fue inferior que en aquellos con valores superiores. Por tanto, los títulos de anticuerpos anti-HBs superiores a 2mUI/ml en los adultos podría ser un nuevo valor predictivo de respuesta a la vacunación de refuerzo y, por tanto, de la existencia de mayor memoria inmunológica29.
En esta misma línea, en España, en la encuesta de seroprevalencia del País Vasco, solo el 50% de los niños menores de 5años presentaron anti-HBs ≥10mUI/ml, y es por ello que se sugiere administrar una dosis en el segundo año de vida, o espaciar la segunda y tercera dosis en más de 5meses; por tanto, una pauta recomendada podría ser a los 2-4-12meses de edad18.
Las evidencias indican que un mayor intervalo entre la segunda y la tercera dosis, así como la administración de una de las dosis de la vacuna a partir de los 12meses de edad (dosis de primovacunación o dosis de refuerzo), podría tener un efecto positivo en la protección a largo plazo frente a la HB y sin ninguna repercusión negativa en el grado de seroprotección en la infancia.
Pautas de vacunación/calendario de vacunaciónLa inmunización universal mediante la vacunación frente a la HB desde el nacimiento es la principal estrategia de prevención de esta enfermedad y ha permitido reducir drásticamente la transmisión de la HB en la población pediátrica en muchos países con altas tasas de prevalencia de esta infección9, e incluso llegar a tasas de menos del 1% en países cercanos a nuestro entorno26.
Desde el 2008, 177 países han incorporado en sus calendarios de vacunación sistemática la vacuna frente a la HB. La OMS advierte que existen diferentes pautas o esquemas de vacunación, y que cada país debe adoptar la que crea que se ajuste mejor a sus programas nacionales y a su epidemiología. En el caso de madres portadoras del VHB, se recomienda la primera dosis de vacuna en las primeras 24h después del nacimiento asociada a inmunoglobulina específica, seguido de 2 o 3dosis con un intervalo mínimo de 4semanas entre dosis. Los intervalos más largos pueden incrementar los títulos finales de anti-HBs. La primovacunación convencional consiste en 3 o 4dosis: la primera al nacimiento monovalente, seguida de 2 vacunas monovalentes o de 2-3dosis de vacunas combinadas9. Según el European Centre for Disease Prevention and Control con datos de 31 países, la vacunación al nacimiento está implantada en 21 países, aunque en 14 de ellos la vacunación al nacimiento solo se contempla para casos en que la madre está infectada por el VHB. También se observa que en países como Francia, Alemania o Italia la última dosis (tercera o cuarta dosis según los calendarios) se administra en el segundo año de la vida, con un intervalo mínimo de 6meses desde la dosis anterior. Entre los 12 países que en su calendario incluyen la posibilidad de administrar la última dosis a partir de los 11meses se encuentran Alemania, Austria, Bélgica, Chipre, Francia, Grecia, Holanda, Italia, Letonia, Luxemburgo, Malta y Eslovenia15.
En España, como se ha comentado anteriormente, la pauta de vacunación frente a la HB con 3dosis varía en las distintas CCAA, existiendo la pauta de vacunación a los 2-4-6meses en Baleares, Canarias, Cataluña, Murcia, Navarra, La Rioja y País Vasco, y la pauta a los 0-2-6meses en el resto de CCAA, Ceuta y Melilla. Estos esquemas se aplican a los hijos de madres HBsAg negativas. En 2013, el Consejo Interterritorial del Sistema Nacional de Salud (SNS) estableció las recomendaciones de vacunación para España en su Calendario Común de Vacunaciones, que entró en vigor en enero de 2014, y para la vacunación frente a la HB establece la pauta 0-2-6meses31. Para la vacunación en RN, la primera dosis es monovalente, y continúa con la administración alternante de vacuna combinada hexavalente (DTPa-VPI-Hib-HB) a los 2 y 6meses, y el preparado pentavalente (DTPa-VPI-Hib) a los 4 meses. De esta forma, en España coexisten 2 pautas diferentes, donde la primera dosis puede administrarse al nacer o a partir de los 2meses. En cualquiera de las pautas, la última dosis siempre es a los 6meses de edad en niños.
DiscusiónLa prevención de la infección frente al VHB en el caso de la transmisión vertical se realiza mediante el cribado gestacional del HBsAg en todas las CCAA en España. No obstante, en hijos de madres no portadoras de VHB hay CCAA que administran la primera dosis de la vacuna frente a la HB a los 0 meses, aunque otras CCAA inician la primera dosis a los 2meses, por lo que al ser esta una pauta más inmunogénica podría considerarse como una mejor opción. Sin embargo, y teniendo en cuenta que en España la prevalencia de la HB en población infantil es muy baja en menores de 5años (prácticamente inexistente), y que el mayor número de casos de HB se produce entre los 20 y 39años, el objetivo de la vacunación debería ser, además de controlar y proteger a la población infantil, optimizar la estrategia de vacunación para garantizar que esta protección se mantenga en la edad adulta, que es el momento de máxima exposición al virus.
La cuestión de debate es si las pautas vacunales actuales (pautas 0-2-6 o 2-4-6 meses de edad) son realmente las más adecuadas para garantizar una mayor duración de la protección frente al VHB, que alcance la edad adulta. En países como Francia, Alemania o Italia administran la última dosis a partir de los 11-12meses, y en algunos países en los que se administra dosis de refuerzo, esta se realiza a los 24meses de edad, independientemente de cuál sea la pauta de la primovacunación37. En nuestra opinión, las pautas actuales en España podrían optimizarse, precisamente si tenemos en cuenta que la tercera y última dosis de la vacuna HB se administra a los 6meses de edad, una edad relativamente temprana, y con un periodo transcurrido entre la segunda y la tercera dosis de solo de 8semanas, que corresponde al límite del intervalo mínimo recomendado para que se considere la dosis como suficientemente inmunógena.
Sobre el calendario de vacunaciones actualmente vigente en España, existen para los hijos de madres no portadoras del VHB, entre otras, 2 posibles estrategias sencillas y asumibles que podrían permitir una optimización de la vacunación frente a la HB y tratar de garantizar la persistencia de la protección a edades más avanzadas y de mayor riesgo de exposición a la infección (tabla 1). La primera estrategia consistiría en ampliar el intervalo actual entre la segunda y la tercera dosis, administrando la última dosis a partir de los 12meses de edad en lugar de los 6meses de edad actuales. Para ello se podría aplicar una pauta de 3dosis, con la administración de la primera dosis a los 2-4meses, la segunda a los 4-6meses y la tercera entre los 12-18meses de edad, todas ellas en forma de vacunas combinadas hexavalentes. Esta estrategia no conllevaría la modificación de las pautas de las otras vacunas existentes en los preparados combinados hexavalentes, es decir, no obligaría a un cambio más radical de todo el calendario vacunal infantil en España. Una segunda estrategia, más sencilla y centrada solamente en la HB, sería mantener los actuales esquemas de primovacunación de 3dosis (0-2-6 o 2-4-6meses según las CCAA) añadiendo una dosis adicional de refuerzo a los 12-18meses (cuarta dosis), para lo que se sustituiría la vacuna pentavalente (sin HB) que se administra a los 12-15meses de edad, por una vacuna hexavalente (con HB).
Esquemas de vacunación frente a la hepatitisB existentes y propuestas de nuevas estrategias
| 0 meses | 1 mes | 2 meses | 4 meses | 6 meses | 12-18 meses | |
|---|---|---|---|---|---|---|
| Pauta existente | ||||||
| Pauta 1 (Andalucía, Aragón, Asturias, Cantabria, Castilla-León, Castilla-La Mancha, CU Ceuta, Extremadura, Galicia, Madrid, CU Melilla y Comunidad Valenciana) | HB | HB | HB | |||
| Pauta 2 (Cataluña, Canarias, Baleares, Murcia, Navarra, La Rioja y País Vasco) | HB | HB | HB | |||
| Pauta para hijos nacidos de madres portadoras del VHB | HB | HB | HB | |||
| Pauta propuesta | ||||||
| Propuesta 1 | HB (dosis entre los 2-4 meses) | HB | ||||
| HB (dosis entre los 4-6 meses) | ||||||
| Propuesta 2a | HBa | HB | HBa | HB | HB | |
| Pauta para hijos nacidos de madres portadoras del VHB | HB | HB | HB | HB | ||
Con cualquiera de estas 2 estrategias se mejoraría la respuesta inmune y la duración de la protección, sin que ello suponga una importante modificación estructural en el calendario vacunal actual o un coste económico añadido significativo.
Los calendarios y las pautas de vacunación deben ser flexibles, ajustarse a la realidad epidemiológica del país y permitir la adecuación a objetivos más ambiciosos a un coste razonable. La vacunación frente a HB en nuestro país requiere un nuevo planteamiento que permita optimizar los excelentes resultados obtenidos con la vacunación sistemática en la edad pediátrica. En nuestra opinión, la estrategia de vacunación frente a HB en este momento debería orientarse a conseguir la disminución de la prevalencia en la edad adulta, y para ello la ampliación del intervalo entre dosis, y la administración de la última de las dosis a partir de los 12meses de edad, parece la opción más razonable para lograrlo.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses en la elaboración de este artículo.