Determinar las características clínicas, daño y calidad de vida de una cohorte de pacientes colombianos con lupus eritematoso sistémico.
MétodosEn un periodo de seis meses se recolectaron datos clínicos, sociodemográficos, se realizó SELENA-SLEDAI, BILAG, SLICC y SF-36, de pacientes con lupus, asistentes a dos centros de referencia de Bogotá D.C.
ResultadosSe estudiaron 109 pacientes de los 440 registrados. El 91,7% de los pacientes fueron mujeres, el tiempo de evolución fue de 10.5±8,86 años; 76,1% de los pacientes procedía del área urbana; 60,6% de los pacientes pertenecía a estrato socioeconómico bajo, 45% tenía menos de 5 años de enfermedad. En BILAG A el componente renal fue el más comprometido (11,9%). Por SELENA-SLEDAI, 45,9% de los pacientes se encontraba en remisión de la enfermedad. Por SLICC/ACR 45,9% presentó algún grado de daño orgánico. Para el SF-36, 83,5% de pacientes presentó puntaje menor o igual a 50 para el componente resumido de salud física y 74,3% para el componente resumido de salud mental. La correlación entre el puntaje del SF-36 componente físico (−0,21) y daño orgánico fue débil.
ConclusionesLas características clínicas y de actividad de la enfermedad, reportadas en el presente estudio se correlacionan con los datos publicados por series mundiales y latinoamericanas. Además, se observó importante compromiso en la calidad de vida.
To determine the clinical characteristics, activity, damage, and quality of life in Systemic lupus erythematosus in Colombian patients.
MethodsClinical and demographic data was collected over a six-month period, and the SELENA-SLEDAI, BILAG 2004, SLICC/ACR and SF-36 was used on patients with Systemic Lupus Erythematosus attending two referral Clinics in Bogota D.C.
ResultsA total of 109 patients from the 440 registered, of whom 91.7% were women. The time to progression was 10.5±8.86 years, and 76.1% of the patients came from urban areas, 60.6% patients belonged to low socioeconomic status, and 45% had the disease for less than 5 years. In BILAG A, the renal component was the most affected (11.9%). According to SELENA-SLEDAI, 45.9% of patients were in remission. Using SLICC/ACR, 45.9% had some degree of organ damage. With the SF-36, 83.5% of patients had scoresof < 50 for the physical health components, and 74.3% had scores of <50 for the mental health component summary. There was a weak correlation between the SF-36 physical component score (−0.21) and organ damage.
ConclusionsThe clinical characteristics and disease activity reported in this study are similar to the data published by global and Latin American series. Additionally, we observed significant compromise in the quality of life.
El Lupus eritematoso sistémico (LES) es una enfermedad autoinmune de origen desconocido, potencialmente mortal, caracterizada por episodios de remisión y de reactivación clínica, con compromiso orgánico variado. A menudo se confunde con otras enfermedades por la variedad de las manifestaciones clínicas que la caracterizan1,2. Los pacientes que padecen LES pueden presentar eventos por actividad de la enfermedad generalizada o específica sobre un órgano y lesiones crónicas irreversibles, lo que altera su calidad de vida y productividad3,4. De lo anterior, se entiende que la vigilancia estricta de cada uno de estos componentes permite el enfoque apropiado del paciente. Varios instrumentos clinimétricos han sido diseñados para valorar diferentes dominios del LES, permitiendo la comparación entre las valoraciones del paciente y entre diferentes pacientes5.
La actividad de la enfermedad6 puede ser valorada con instrumentos que miden la inf lamación generalizada sobre un individuo o con índices específicos para los órganos comprometidos. Entre los primeros están: Systemic Lupus Erythematosus Disease Activity Index (SLEDAI), validado ampliamente en estudios y en la práctica clínica7; The Safety of Estrogens in Lupus Erythematosus-National Assessment Trial SLEDAI (SELENA-SLEDAI), que añadió un puntaje para exacerbaciones de la enfermedad y modificó algunas descripciones, principalmente neurológicas8, The Systemic Lupus Activity Measure (SLAM)9; validado en diferentes poblaciones incluyendo la pediátrica. De los índices específicos para órganos, se destaca el British Isles Lupus Assessment Group (BILAG), publicado en el año 198810 y basado en el principio de la intención de tratar por el médico. Este índice ha mostrado buena correlación entre observadores con estándares previamente definidos11 y se ha modificado a través del tiempo en algunas de las definiciones, se han removido ítems relacionados con daño y no con actividad, y se han realizado cambios en sus puntajes, resultando finalmente en la versión BILAG 2004, instrumento utilizado en la actualidad12.
El daño crónico de la enfermedad, definido como todo cambio irreversible no relacionado con inflamación activa, fue reconocido desde la conferencia acerca de estudios de pronóstico en LES, llevada a cabo en 1985 en Ontario (Canadá), donde, posteriormente, en 1992, se desarrolló un índice por los miembros del Systemic Lupus International Collaborating Clinics (SLICC)13 y en 1996 este mismo grupo, junto con el American College of Rheumatology (ACR), desarrollaron el SLICC/ACR Damage Index (SDI), instrumento probado en varios estudios14 y aceptado como medida independiente de pronóstico. Además, es útil para predicción de mortalidad y en la evaluación a largo plazo de los efectos de medicamentos15.
La calidad de vida (CV) se refiere al impacto que la enfermedad y su tratamiento tienen sobre la funcionalidad del individuo y su percepción de bienestar físico, mental y social. Existen instrumentos genéricos y específicos para la medición de la CV en el paciente con LES, siendo los genéricos los más conocidos, y de estos, el MOS SF-36, útil además en otras enfermedades crónicas16,17. El SF-36 mide un componente físico y uno mental, otorga un puntaje de cero (la peor CV) a 100 (la mejor CV) y permite una valoración multifactorial del paciente18. Sin embargo, la evidencia ha mostrado que este instrumento no es sensible a los cambios cuando se usa en intervalos menores de 12 meses19.
En América, dos de los grupos más importantes que han realizado aportes respecto al estudio de LES, son: el Grupo Latinoamericano de Estudio del Lupus (GLADEL)20, en el que se encuentran incluidos pacientes colombianos y el Lupus in Minorities: Natura vs. Nurture (LUMINA)21, que se creó por la evidencia de mayor gravedad en la presentación clínica de LES en minorías étnicas en Estados Unidos. Gracias a sus investigaciones se conoce el comportamiento de la enfermedad en población latinoamericana, lo que permite tener una evidencia avalada para confrontar los hallazgos del presente estudio.
En Colombia, los estudios realizados sobre LES han caracterizado poblaciones, con especial interés en describir variables clínicas, sociodemográficas y de laboratorio, existiendo autores que han investigado la actividad de la enfermedad en cohortes de seguimiento a largo plazo2,22. Un estudio realizado en 78 pacientes colombianos con LES valoró el MOS SF-36, la Escala Hospitalaria de Ansiedad y Depresión, el cuestionario de Apoyo Social Funcional DUKE-UNK y la actividad de la enfermedad por SLEDAI, encontrando que los factores fisiopatológicos (daño orgánico y actividad lúpica), psicológicos (ansiedad y depresión), sociodemográficos (ocupación y estado civil) y la interacción entre estos son los que afectan la calidad de vida más a nivel mental que físico23. El presente estudio se realizó en pacientes pertenecientes a dos instituciones universitarias colombianas: el Hospital Militar Central (institución de referencia del Sistema de Salud de las Fuerzas Militares) y el Hospital Universitario de La Samaritana (institución de referencia del departamento de Cundinamarca), instituciones de salud de tercer nivel de complejidad con una población de 440 pacientes con diagnóstico de LES (atendida en los últimos 10 años) y buscó establecer el grado de actividad, daño y su impacto en la CV en estos dos centros de referencia, mediante el uso de instrumentos de clinimetría validados.
Pacientes y métodosSe trata de un estudio descriptivo de corte transversal, realizado entre julio y diciembre de 2011. A través de un protocolo aprobado y un formulario estructurado de recolección de datos diseñado por el grupo de investigadores, se relacionaron aspectos sociodemográficos (edad, género, estrato social, lugar de procedencia, nivel de educación, estado civil, ocupación, tipo de vivienda), aspectos clínicos (criterios clasificatorios del American College of Rheumatology ACR), compromiso orgánico al inicio de la enfermedad, tratamiento actual, antecedentes médicos, antecedentes de enfermedad reumática y los aspectos inmunológicos (definidos como la detección de auto-anticuerpos).
La actividad de la enfermedad fue determinada aplicando el instrumento BILAG-200412, que evalúa 86 secciones y 9 dominios y se clasifica en categorías: A (actividad alta); B (actividad intermedia); C (actividad leve); D (enfermedad inactiva), E (enfermedad nunca activa) puntaje de 0 a 72, y SELENA-SLEDAI6,8, con este índice la sintomatología y los hallazgos deben de estar presentes al menos durante 10 días; la sumatoria y promedio se interpretan así: inactividad 0–2; leve 2–4; moderada 5–8; 9 o más grave. El daño fue evaluado por el índice SLICC/ACR14, que involucra 12 sistemas orgánicos. A lo largo del tiempo, el daño puede permanecer estable o puede aumentar, en teoría hasta un máximo de 47 puntos, a mayor puntaje mayor daño. La CV se midió utilizando SF-3624 auto administrado, que incluye 36 ítems, agrupados en 8 escalas (funcionamiento físico, limitación por problemas físicos, dolor corporal, funcionamiento o rol social, salud mental, limitación por problemas emocionales, vitalidad, energía o fatiga y percepción general de la salud) y dos medidas resumidas que incluyen: el componente de salud mental (considerando la depresión, ansiedad, autocontrol, y bienestar general) y física con la puntuación de Rand Group (graduación de cada ítem desde 0 hasta 100)25.
Se incluyeron pacientes mayores de 18 años de acuerdo con los criterios del ACR26,27. Se excluyeron pacientes que no tenían información clínica y paraclínica completa, así como pacientes que después de conocer la naturaleza del estudio no desearon participar.
En los seleccionados se ejecutaron tres tiempos, así: 1. T0 captura de pacientes: A partir de los registros estadísticos de las instituciones participantes se seleccionaron pacientes con diagnóstico de LES y se depuraron los datos, incluyendo sólo aquellos con diagnóstico confirmado de la enfermedad. También se incluyeron los pacientes con LES que acudieron a las áreas de hospitalización, consulta externa y urgencias durante el desarrollo del protocolo. Una vez recolectada la información, se realizó contacto telefónico con los pacientes para planificar una cita médica. 2. T1 primera cita: incluyó la lectura y firma del consentimiento informado, el inicio de diligenciamiento de formulario, la revisión de registro médico con el fin de obtener síntomas previos, examen físico y clinimetría según los índices; BILAG 2004, SELENA-SLEDAI, SLICC/ ACR y SF-36, se tomaron muestras para: hemograma, velocidad de sedimentación globular (VSG), proteína C reactiva ultrasensible (PCR), creatinina, nitrógeno ureico (BUN), glucosa, aspartato aminotrasferasa (AST), alanino aminotrasferasa (ALT), hormona estimulante de la tiroides (TSH), parcial de orina con sedimento urinario, anticuerpos anti DNA, niveles séricos del complemento C3–C4, anticuerpos antinucleares (ANAS), anticuerpos contra antígenos nucleares extractables (ENAS): anti-Ro, anti-La, anti-Smith (Sm), anti-ribonucleoproteína (RNP), anticuerpos anticardiolipinas (ACAS) IgG, IgM, anticoagulante lúpico, depuración de creatinina y cuantificación de proteínas en orina de 24 horas y 3. T2 segunda cita: Se leyó nuevamente el consentimiento informado, se evaluaron los paraclínicos solicitados y se completó el formulario.
Análisis estadísticoLa información obtenida en los formularios se ingresó al paquete estadístico SPSS 19 con categorización y operacionalización de las variables. Se realizó análisis descriptivo usando medidas de tendencia central y de dispersión para variables cuantitativas, y porcentajes y frecuencias para variables cualitativas, además de análisis univariado para frecuencias absolutas y relativas, y de daño acumulado medido por SLICC/ACR. Se utilizó la prueba de correlación de Spearman entre variables sociodemográficas y calidad de vida. Se definió un valor con significado estadístico a un valor de p menor de 0,05. Se utilizaron intervalos de confianza del 95%.
Aspectos éticosEl proyecto tuvo la aprobación de la Comisión de Investigación y de los comités de Ética del Hospital Militar Central y del Hospital Universitario de La Samaritana. Todos los pacientes firmaron un consentimiento informado y se mantuvo estrictamente la confidencialidad. Durante las evaluaciones, los pacientes que presentaron exacerbación o mejoría de la enfermedad fueron atendidos por un reumatólogo experto quien se encargó de las modificaciones correspondientes al tratamiento.
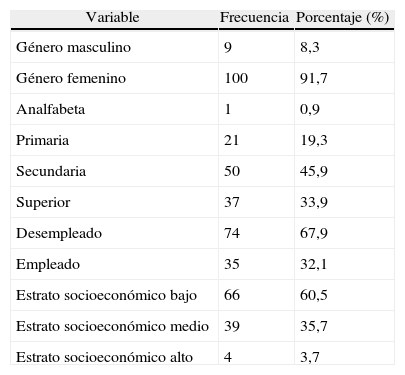
ResultadosCaracterísticas sociodemográficasSe estudiaron 109 del total de 440 pacientes registrados. 61,5% pertenecía al Hospital Militar Central. 91,7% fueron mujeres, la razón mujer/hombre fue de 11:1; la edad media al momento de diagnóstico fue de 30±12,5 años y al inicio del estudio de 38,39±14,59 años; el tiempo de evolución fue 10,5±8,8 años; 76,1% de pacientes procedía del área urbana. Solo 17,4% de los individuos contaba con nivel de educación superior.
El mayor porcentaje de los pacientes pertenecía al estrato socioeconómico bajo (60,5%). En relación con el tiempo de evolución de la enfermedad, 45% tenía menos de 5 años de enfermedad (60 meses) (tabla 1).
Variables sociodemográficas
| Variable | Frecuencia | Porcentaje (%) |
| Género masculino | 9 | 8,3 |
| Género femenino | 100 | 91,7 |
| Analfabeta | 1 | 0,9 |
| Primaria | 21 | 19,3 |
| Secundaria | 50 | 45,9 |
| Superior | 37 | 33,9 |
| Desempleado | 74 | 67,9 |
| Empleado | 35 | 32,1 |
| Estrato socioeconómico bajo | 66 | 60,5 |
| Estrato socioeconómico medio | 39 | 35,7 |
| Estrato socioeconómico alto | 4 | 3,7 |
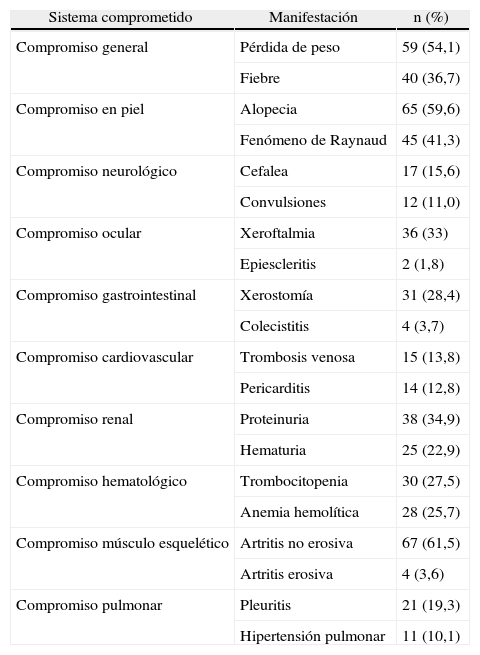
Las manifestaciones iniciales más frecuentes fueron: artritis no erosiva (61,5%), alopecia (59,6%), pérdida de peso (54,1%), fenómeno de Raynaud (41,3%) y fiebre (36,7%). Se encontró proteinuria en 34,9% de los individuos. En la patología renal, 6,4% presentó lesiones activas (tabla 2). 96,3% de los pacientes tuvo ANAs positivos, siendo el patrón moteado el más predominante (48,6%). En 89,9% de los pacientes se realizaron ENAs, con mayor positividad para Sm (22%) y Ro (19,3%). En 59,6% de los pacientes el Anti-DNA fue positivo.
Principales manifestaciones del compromiso de cada sistema en la población estudiada
| Sistema comprometido | Manifestación | n (%) |
| Compromiso general | Pérdida de peso | 59 (54,1) |
| Fiebre | 40 (36,7) | |
| Compromiso en piel | Alopecia | 65 (59,6) |
| Fenómeno de Raynaud | 45 (41,3) | |
| Compromiso neurológico | Cefalea | 17 (15,6) |
| Convulsiones | 12 (11,0) | |
| Compromiso ocular | Xeroftalmia | 36 (33) |
| Epiescleritis | 2 (1,8) | |
| Compromiso gastrointestinal | Xerostomía | 31 (28,4) |
| Colecistitis | 4 (3,7) | |
| Compromiso cardiovascular | Trombosis venosa | 15 (13,8) |
| Pericarditis | 14 (12,8) | |
| Compromiso renal | Proteinuria | 38 (34,9) |
| Hematuria | 25 (22,9) | |
| Compromiso hematológico | Trombocitopenia | 30 (27,5) |
| Anemia hemolítica | 28 (25,7) | |
| Compromiso músculo esquelético | Artritis no erosiva | 67 (61,5) |
| Artritis erosiva | 4 (3,6) | |
| Compromiso pulmonar | Pleuritis | 21 (19,3) |
| Hipertensión pulmonar | 11 (10,1) |
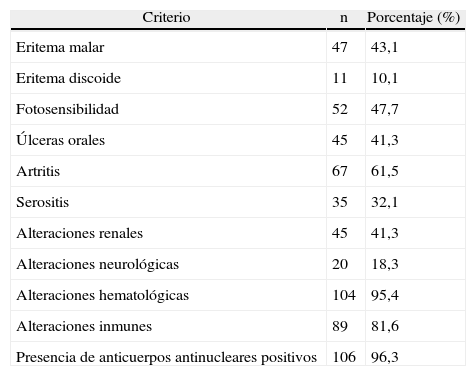
En la tabla 3 se resume la frecuencia de los principales criterios de LES del ACR para la población estudiada.
Prevalencia de criterios de lupus eritematoso sistémico del American College of Rheumatology
| Criterio | n | Porcentaje (%) |
| Eritema malar | 47 | 43,1 |
| Eritema discoide | 11 | 10,1 |
| Fotosensibilidad | 52 | 47,7 |
| Úlceras orales | 45 | 41,3 |
| Artritis | 67 | 61,5 |
| Serositis | 35 | 32,1 |
| Alteraciones renales | 45 | 41,3 |
| Alteraciones neurológicas | 20 | 18,3 |
| Alteraciones hematológicas | 104 | 95,4 |
| Alteraciones inmunes | 89 | 81,6 |
| Presencia de anticuerpos antinucleares positivos | 106 | 96,3 |
30,3% de los pacientes padecía hipertensión arterial y 21,1% síndrome de Sjögren, siendo ésta la enfermedad autoinmune que más se asoció con LES.
Actividad de la enfermedadBILAG 2004En cuanto a gravedad de la enfermedad, 45,9% de los pacientes presentaba actividad leve, 23% actividad moderada y 27,5% actividad grave. 23% de los pacientes se encontraba en remisión al momento del estudio.
El dominio renal fue el más comprometido en BILAG A (11,9%). En BILAG B y C, el componente músculo esquelético fue el más afectado (9,2% y 30,3%, respectivamente).
SELENA-SLEDAI45,9% de los pacientes se encontraba sin actividad de enfermedad, 28,4% presentó actividad severa, 10,1% actividad moderada y 15,6% actividad leve.
Daño orgánico (SLICC / ACR)45,9% presentó algún grado de daño orgánico. Los dominios más comprometidos fueron: neuropsiquiátrico (20,2%), renal (11,0%), vascular periférico (11,0%), pulmonar (9,2%) y músculo esquelético (6,4%).
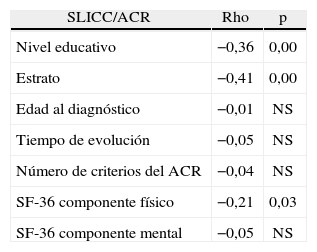
En la tabla 4 se resume la asociación entre el compromiso de órgano blanco medido por SLICC/ACR y variables clínico/ demográficas.
Asociación entre daño orgánico medido por SLICC/ACR y variables clínicas y demográficas
| SLICC/ACR | Rho | p |
| Nivel educativo | −0,36 | 0,00 |
| Estrato | −0,41 | 0,00 |
| Edad al diagnóstico | −0,01 | NS |
| Tiempo de evolución | −0,05 | NS |
| Número de criterios del ACR | −0,04 | NS |
| SF-36 componente físico | −0,21 | 0,03 |
| SF-36 componente mental | −0,05 | NS |
ACR: American College of Rheumatology; NS: no significativo.
La interpretación del SF-36 se hizo mediante norma poblacional; un puntaje menor o igual a 50 fue catalogado como mala salud y mayor o igual a 51 como buena salud. Presentaron mala salud 83,5% de los pacientes para el componente resumido de salud física y 74,3% para el componente resumido de salud mental y buena salud 16,5% para el componente de salud física y 30,2% para el componente de salud mental.
Relación entre daño orgánico, calidad de vida y variables sociodemográficasSe encontró correlación moderada e inversa entre el daño orgánico y el estrato socioeconómico (−0,41) y el nivel educativo (−0,36); la correlación entre el puntaje del SF-36 componente físico (−0,21) y daño orgánico fue débil (tabla 4).
DiscusiónLos resultados del presente estudio muestran características propias de la población, diferentes de otras cohortes descritas en otros países28. Para los hombres de nuestra población, los criterios de clasificación del ACR más frecuentes fueron, en orden de presentación, la presencia de ANAs, artritis y alteraciones hematológicas, a diferencia de las mujeres, en quienes se encontró con mayor frecuencia, la presencia de ANAs, compromiso inmunológico y artritis. En relación con la actividad de la enfermedad, los hombres presentaron compromiso renal y músculo-esquelético severo, lo que se correlaciona con datos de la literatura local29,30 y mundial31,32.
La prevalencia de síndrome de Sjögren en la corte estudiada dista de la reportada en el estudio GLADEL20, en los que se remarca una baja frecuencia para síntomas secos a pesar de tener anti-Ro y anti-La positivos, en porcentaje elevado. La literatura señala una concomitancia de 8–30% de LES y síndrome de Sjögren; sin embargo, ésta es muy discutida y ha creado controversia33.
La mayoría de pacientes se presentó sin actividad de la enfermedad por SELENA-SLEDAI, pero para el resto de pacientes, predominó la actividad alta. De estos últimos, gran parte pertenecía al Hospital La Samaritana, centro que valora una población de bajos recursos, lo que podría explicar este hallazgo. Los pacientes sin actividad o actividad baja provenían, principalmente, del Hospital Militar Central, que valora pacientes con mejor cobertura de salud.
Este es uno de los primeros estudios llevado a cabo en Latinoamérica, que tiene en cuenta la realización de escalas como SELENA-SLEDAI, BILAG 2004 y SLICC/ACR en una población nativa con LES, en la que, además, se valoró la calidad de vida con SF-36. Nuestros resultados muestran una relación mujer/hombre y una edad de diagnóstico similares a las reportadas en la literatura34.
Cada vez se comprende mejor que, para evaluar las consecuencias totales que ejerce el LES en un determinado enfermo, hay que considerar el nivel de actividad35, el daño36 y la percepción que el propio paciente siente sobre su estado de salud37. En nuestra población, la mayoría de los casos con actividad medida por BILAG fue leve y por SELENA-SLEDAI la mayoría de los pacientes no tenía enfermedad activa; en los activos, la severidad correspondió al dominio renal, hallazgos correspondientes con los reportados en la literatura mundial en la que se señala que los pacientes latinoamericanos presentan compromiso renal grave38.
A lo largo del tiempo el daño orgánico puede permanecer estable o aumentar39–43. Stoll39 reporta que el incremento del daño se asocia fuertemente a un elevado índice de actividad; nuestros datos señalan que 45,9% de la población presentó algún grado de daño, con compromiso notorio en los dominios neuropsiquiátrico, renal, vascular periférico, pulmonar y músculo-esquelético. El daño se convierte en un predictor de mortalidad en lupus eritematoso sistémico; de ahí la importancia de incluirlo en la evaluación de estos sujetos.
Es de anotar que se ha asociado la CV con la sobrevida, considerándose la primera como predictor de mortalidad en algunos estudios44. Es de esperar que, con un tratamiento adecuado y control de la patología, se controlen las consecuencias sobre la calidad de vida y sobrevida, tal como se ha visto en otros trabajos15.
Los investigadores del grupo LUMINA45 evaluaron de manera extensa los principales predictores de peor CV presente de forma temprana en LES y encontraron que los pacientes evaluados exhiben relativamente bajos niveles de CV relacionada con la salud medida por SF-36, que son comparables con otros estudios de enfermedades crónicas y lupus. Se enfatiza en el deterioro funcional de LES, a pesar de que estos pacientes no tienen alta actividad de la enfermedad ni un daño significativo. En nuestro estudio, presentaron puntajes menores de CV tanto para el componente físico como mental, con una actividad leve o inactividad para la mayoría de los pacientes, tanto por BILAG y SELENA-SLEDAI, y daño orgánico presente. Estos hallazgos contrastan con los que se encontraron en otra cohorte evaluada en Colombia, tal vez explicable por las características clínicas de las poblaciones23.
Otros importantes predictores de una peor CV descritos en el trabajo de LUMINA fueron algunas variables sociodemo-gráficas (edad avanzada, pobreza, bajos niveles de educación), enfatizando que el estrato socioeconómico y las características personales influyen en la enfermedad, y un inadecuado soporte social se asocia a un peor funcionamiento mental y físico; en este grupo de pacientes estudiado, el estrato socioeconómico, el nivel educativo y el componente físico, se correlacionaron con un mayor daño orgánico en los pacientes con LES.
Este estudio muestra los datos transversales de una población de la ciudad de Bogotá, pero se hacen necesarios estudios de corte longitudinal que nos indiquen cómo se modifican las herramientas de actividad, de daño orgánico y de calidad de vida con los ajustes de medicación y con el comportamiento de la enfermedad.
La principal fortaleza de este estudio fue la variedad de instrumentos que se realizaron a los pacientes, que facilitaron la valoración de la gravedad de la enfermedad y el compromiso psicosocial de los enfermos. Como debilidad se anota la característica transversal del estudio, que no permite inferir causalidad ni otras conclusiones.
ConclusionesLa población estudiada fue, principalmente, de mujeres de bajos recursos, con compromiso articular y baja actividad de la enfermedad. Se encontró correlación significativa entre el nivel educativo, estrato socioeconómico y peor función física con daño orgánico.
Los autores declaran no tener ningún conflicto de intereses.