Investigar el valor de predicción de afectación tumoral del ganglio linfático centinela (GLC) de factores celulares y moleculares determinados en la frontera tumoral de los tumores primarios, así como el valor de esas expresiones en los GLC para predecir la afectación de los ganglios linfáticos no centinela (GLNC) en el cáncer de mama.
Pacientes y métodosSe analizaron muestras tisulares de 59 pacientes que se sometieron a la fase de validación de la técnica de la biopsia selectiva del GLC por cáncer de mama. Se seleccionaron aquellas muestras tisulares de la frontera tumoral de los tumores primarios y de los GLC, sobre los que se realizaron estudios inmunohistoquímicos utilizando mallas de tejido y anticuerpos específicos frente a D2-40, CD3, CD20, CD68, CD138, metaloproteasa (MMP)-1, MMP-7, MMP-13 y inhibidor de metaloproteasas de tejido-1 (TIMP-1).
ResultadosLa invasión linfática tumoral, el número de células mononucleares inflamatorias (CMI) CD68-positivas o CD138-positivas, se asociaron de forma positiva y significativa con la afectación tumoral de los GLC; mientras que la expresión de TIMP-1, tanto por las células tumorales como por los CMI o fibroblastos del estroma tumoral, se asoció significativamente de forma negativa. La expresión de MMP-1 por las CMI del GLC neoplásico se asoció significativamente con la afectación tumoral de los GLNC.
ConclusionesLa determinación de factores celulares y moleculares en la frontera tumoral puede contribuir a conocer mejor las diferentes fases de la metastatización ganglionar linfática en el cáncer de mama.
To investigate the predictive value of tumour involvement of the sentinel lymph node (SLN) in terms of specific cellular and molecular factors at the tumoural margin of primary tumours, as well as the value of expression of these factors in the SLNs to predict the involvement of non-SLNs in breast cancer.
Patients and methodsTissue samples from 59 patients who underwent the validation phase of SLN biopsy of breast cancer were analyzed. Tissue samples from the tumoural margin of primary tumours and from SLNs were selected. Immunohistochemical studies were performed using the tissue array technique and antibodies against D2-40, CD3, CD20, CD68, CD138, metalloprotease (MMP)-1, MMP-7, MMP-13 and the tissue inhibitor of metalloproteases-1 (TIMP-1).
ResultsTumoural invasion of the lymph nodes and the number of CD68- or CD138-positive mononuclear inflammatory cells (MICs) were positively and significantly associated with tumoural involvement of the SLNs. TIMP-1 expression, both by tumour cells and by MICs or fibroblasts from the tumor stroma, was negatively and significantly associated with tumoural involvement. MMP-1 expression by MICs from neoplastic SLNs was significantly associated with tumoural involvement of non-SLNs.
ConclusionsDetermination of both cellular and molecular factors at the tumoural margin may contribute to better assessment of the different phases of lymph node metastases in breast cancer.
La biopsia selectiva del ganglio linfático centinela (GLC) es el método estándar para la evaluación del estado de afectación del sistema linfático axilar en el cáncer de mama con ganglios clínicamente negativos1,2.
Cuando el GLC presenta afectación tumoral, todavía en la mayoría de los centros se realiza linfadenectomía de los niveles I y II. Pero ese procedimiento es el que conlleva más comorbilidad en el contexto de la cirugía del cáncer de mama. Los resultados de un conocido ensayo aleatorizado y prospectivo concluyeron que las pacientes no se benefician objetivamente de ello3. Así, en muchos otros centros, la radioterapia es utilizada como alternativa a la disección axilar completa en pacientes con GLC positivo. No obstante, esta técnica tampoco está exenta de morbilidad, además de un consumo nuevo de recursos sanitarios.
Es sabido que el GLC es el único ganglio linfático positivo entre el 50-80% de los casos4,5. Por tanto, si esos casos pudieran ser identificados, en ellos podría evitarse la práctica de una linfadenectomía innecesaria o la irradiación de la axila. Diversos estudios encontraron ciertos parámetros clínicos que predicen en algún grado la probabilidad de afectación de los ganglios linfáticos no centinela (GLNC), tales como el tamaño de la metástasis en el GLC4,6, el incremento del número de GLC positivos4,7, la extensión extravascular de la metástasis en el GLC8 o la invasión vascular linfática en el tumor primario9,10. Sin embargo, a pesar de que incluso se han desarrollado diferentes graduaciones en monogramas basados en esos factores para determinar el riesgo de afectación ganglionar8,11,12, los resultados obtenidos aún no son del todo satisfactorios para su uso clínico13,14. Por lo que resulta necesaria la investigación de nuevos marcadores moleculares que nos permitan predecir con más exactitud el proceso de metastatización ganglionar en el cáncer de mama. En esta línea, recientemente hemos descrito que la expresión de la metaloproteasa-1 (MMP-1, o colagenasa intersticial) por las células mononucleares inflamatorias (CMI) adyacentes a las células cancerosas de las metástasis del GLC tienen una sensibilidad y un valor predictivo negativo ambos del 100% para predecir la afectación de los GLNC en el cáncer de mama15. Ello sugiere que pueden existir marcadores moleculares como las MMP o sus inhibidores tisulares (TIMP), posiblemente involucrados en la metástasis ganglionar, como la MMP-1, -7, -13 y TIMP-1 como mostraron los resultados de dicho estudio. Así mismo, los fenotipos de los diferentes tipos celulares presentes en los carcinomas mamarios, tales como las células inflamatorias, parecen estar involucrados en las diferentes fases de la metastatización ganglionar.
Ahora, en el presente estudio, nos planteamos explorar algunos de esos factores que pueden estar relacionados con la primera fase de la metastatización ganglionar; es decir, la migración de las células cancerosas al GLC. Para ello, investigamos el valor de predicción de afectación tumoral del GLC de factores celulares y moleculares determinados en la frontera tumoral de los tumores primarios del cáncer de mama: densidad de vasos linfáticos peritumorales y/o su invasión por células cancerosas, las variaciones de las poblaciones de células inflamatorias (CD3, CD20, CD68 y CD138), y las expresiones de MMP y TIMP (MMP-1, -7, -13 y TIMP-1). Asimismo, evaluamos el valor de esas expresiones en los GLC para predecir la afectación de los GLNC.
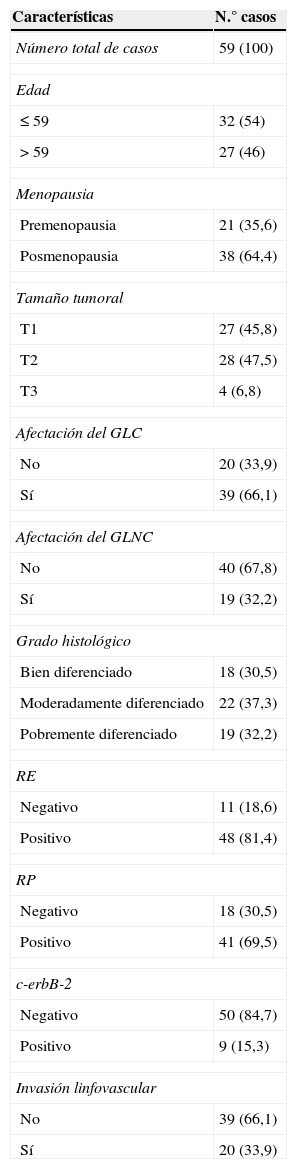
Pacientes y métodosPacientesLas 59 pacientes incluidas en este estudio corresponden a pacientes que se sometieron a la fase de validación de la técnica de la BSGC por cáncer de mama, entre 1992-2009, en la Fundación Hospital de Jove de Gijón. El estudio fue aprobado por el comité ético de referencia. En la tabla 1 se detallan las características clínico-patológicas de las pacientes.
Caracteristicas de los 59 casos de carcinomas mamarios incluidos en el estudio
| Características | N.° casos |
|---|---|
| Número total de casos | 59 (100) |
| Edad | |
| ≤59 | 32 (54) |
| >59 | 27 (46) |
| Menopausia | |
| Premenopausia | 21 (35,6) |
| Posmenopausia | 38 (64,4) |
| Tamaño tumoral | |
| T1 | 27 (45,8) |
| T2 | 28 (47,5) |
| T3 | 4 (6,8) |
| Afectación del GLC | |
| No | 20 (33,9) |
| Sí | 39 (66,1) |
| Afectación del GLNC | |
| No | 40 (67,8) |
| Sí | 19 (32,2) |
| Grado histológico | |
| Bien diferenciado | 18 (30,5) |
| Moderadamente diferenciado | 22 (37,3) |
| Pobremente diferenciado | 19 (32,2) |
| RE | |
| Negativo | 11 (18,6) |
| Positivo | 48 (81,4) |
| RP | |
| Negativo | 18 (30,5) |
| Positivo | 41 (69,5) |
| c-erbB-2 | |
| Negativo | 50 (84,7) |
| Positivo | 9 (15,3) |
| Invasión linfovascular | |
| No | 39 (66,1) |
| Sí | 20 (33,9) |
GLC: ganglio centinela; GLNC: ganglio no centinela; RE: receptores estrógenos; RP: receptores de progesterona.
Los valores están representados como el número de casos (porcentaje).
Para la identificación del ganglio centinela se utilizó conjuntamente sulfuro de coloide marcado con Tc99 y azul de isosulfan, mediante técnica tal con describimos previamente15. Una vez escindido, el ganglio centinela fue enviado al laboratorio para análisis anatomo-patológio, tal como también detallamos previamente15. Las pacientes que mostraron células tumorales en el análisis de los ganglios centinelas se sometieron a linfadenectomía inmediata de los niveles axilares I–II, siendo todo el tejido resecado procesado para estudio anatomo-patológico estándar.
Elaboración de mallas de tejido y tinción inmunohistoquímicaSe elaboraron mallas de tejido o «array» de tejido que nos han permitido procesar hasta 32 muestras de pacientes a la vez. Las muestras de los tejidos se fijaron siguiendo las condiciones rutinarias.
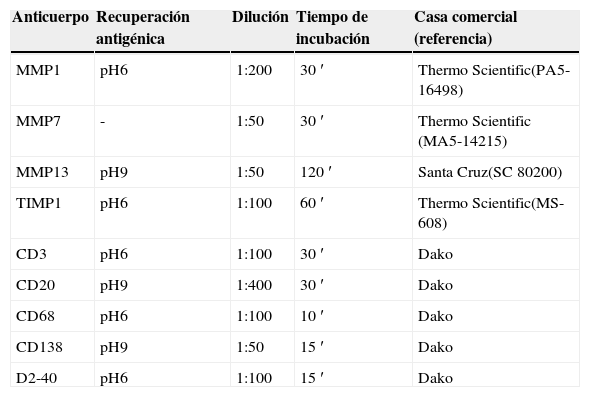
Tras la obtención de bloques de tejido y con la ayuda de un microtomo (Leica Micosystems GmbH, Wetzlar, Alemania), se cortaron muestras a un grosor de 3μm, siendo posteriormente teñidos con hematoxilina-eosina para seleccionar las zonas más representativas. Usando estos como mapa en los bloques de parafina correspondientes, elaboramos el «array» mediante «manual tissue microarray» (Modelo MTA-1, Beecker instruments, Sun Praerie, Wisconsin, EE. UU.) con muestras tumorales correspondientes a la frontera tumoral (área tumoral de 2mm) y a los GLC, siguiendo el procedimiento descrito por nuestro grupo anteriormente16. Sobre las secciones obtenidas de las mallas de tejido, se realizó el estudio inmunohistoquímico (IHQ) utilizando para ello anticuerpos específicos frente a MMP-1, MMP-7, MMP-13, TIMP-1, CD3, CD20, CD68, CD138, D2-40, tal como hemos descrito previamente15,17. Las condiciones de uso de cada anticuerpo están reflejadas en la tabla 2.
Anticuerpos primarios utilizados para las tinciones inmunohistoquímicas
| Anticuerpo | Recuperación antigénica | Dilución | Tiempo de incubación | Casa comercial (referencia) |
|---|---|---|---|---|
| MMP1 | pH6 | 1:200 | 30′ | Thermo Scientific(PA5-16498) |
| MMP7 | - | 1:50 | 30′ | Thermo Scientific (MA5-14215) |
| MMP13 | pH9 | 1:50 | 120′ | Santa Cruz(SC 80200) |
| TIMP1 | pH6 | 1:100 | 60′ | Thermo Scientific(MS-608) |
| CD3 | pH6 | 1:100 | 30′ | Dako |
| CD20 | pH9 | 1:400 | 30′ | Dako |
| CD68 | pH6 | 1:100 | 10′ | Dako |
| CD138 | pH9 | 1:50 | 15′ | Dako |
| D2-40 | pH6 | 1:100 | 15′ | Dako |
Se estableció un nivel mínimo de 10% de células teñidas para considerar la tinción como positiva de un determinado tipo celular. Distinguimos las células cancerosas de las células estromales a causa de que las células tumorales son de mayor tamaño, con los núcleos hipercromáticos, algunas multinucleadas, con presencia de nucléolos, aumento del radio núcleo/citoplasma. Las CMI son de forma redondeada u ovalada, de contornos bien definidos, poseen un solo núcleo. Los fibroblastos son fusiformes, con el núcleo ovalado de contorno bien delimitado. Por otra parte, las células tumorales suelen formar nidos, cordones o acinos, estructuras cribiformes o sólidas, mientras que las células de estroma están dispersas. El análisis de las muestras fue realizado en ciego por 2 patólogos (NB y LOG).
Análisis estadísticoPara realizar el análisis estadístico de los resultados obtenidos de las inmunotinciónes se ha utilizado el programa PAW Statistics 18. Las diferencias en porcentajes fueron calculadas con la prueba del Chi-cuadrado. Las diferencias entre grupos se consideraron significativas cuando el valor de p era igual o inferior a 0,05.
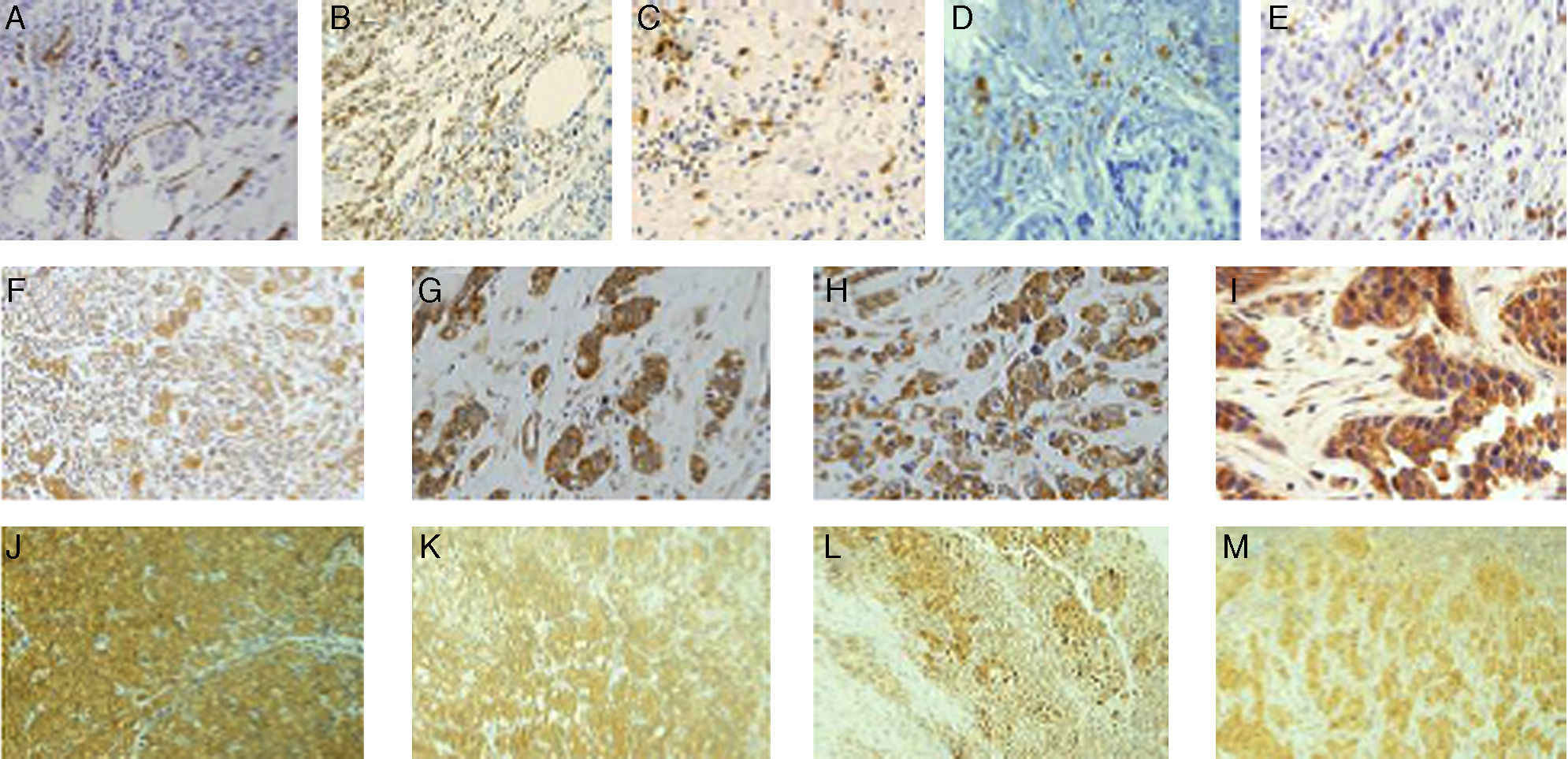
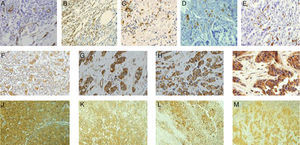
ResultadosLa figura 1 muestra tinciones inmunohistoquímicas representativas de los diferentes factores analizados en la periferia tumoral y/o en los GLC. Como se puede apreciar, la tinción positiva para los vasos linfáticos con anti D2- 40 en la frontera tumoral se caracterizó por una tinción intensa de la membrana citoplasmática del endotelio de los vasos linfáticos (fig. 1A), como era de esperar. La tinción inmunohistoquímica positiva para los marcadores CD3 y CD20 se localizó en la membrana citoplasmática y las tinciones positivas para los marcadores CD68 y CD138 se localizaron en el citoplasma celular de las CMI, lo que corresponde con la localización celular de dichos marcadores (fig. 1B-E). Las tinciones inmunohistoquímicas positivas para los MMP-1, MMP-7, MMP-13 y TIMP-1 se localizaron en el citoplasma, tanto de las células cancerosas como en los CMI o fibroblastos de la frontera tumoral o de los ganglios centinela (fig. 1F-M), acorde con la localización celular de estas proteínas.
Tinciones inmunohistoquímicas representativas de los diferentes factores. 1A: tinción positiva de vasos linfáticos anti-D2-40 (x200). 1B-1E: expresión de CD3, CD20, CD68 y CD138 respectivamente, por las CMI (x200). 1F-1I: expresión de MMP1, MMP7, MMP13 y TIMP1 respectivamente en la frontera tumoral (x200). 1J-1M: expresión de MMP1, MMP7, MMP13 y TIMP1 respectivamente, en los ganglios linfáticos axilares (x200).
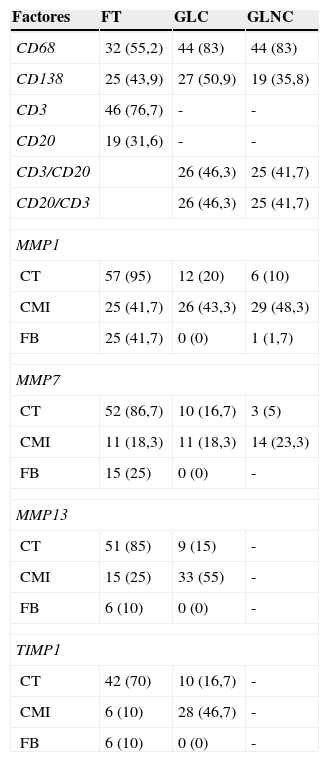
La tabla 3 muestra la expresión de CMI en la frontera tumoral y en los ganglios linfáticos axilares. En ambas localizaciones tumorales existieron porcentajes variables de CMI que mostraron tinciones inmunohistoquímicas positivas para el CD3, CD20, CD68 y CD138. La expresión de CD3 por CMI en la frontera tumoral fue en un porcentaje alto de los casos (76,7%) y la de CD20 en un porcentaje más bajo (31,6%). La expresión de CD68 tuvo lugar en un elevado porcentaje de casos, tanto en los GLC como en los GLNC (83%). En la frontera tumoral, la evaluación de expresión de los factores CD3 y CD20 se realizó en números (porcentajes). Sin embargo, en los ganglios axilares (dado que los ganglio linfáticos están compuestos mayormente de los linfocitos B y T, y los factores CD20 y CD3 son marcadores específicos para estas células, respectivamente), la evaluación consistió en calcular la relación entre ambos. Los datos del ratio CD3/CD20 y CD20/CD3 arrojaron resultados muy parecidos, tanto en los GLC como en los GLNC.
Expresión de diferentes factores en la frontera tumoral y en los ganglios linfáticos axilares en 59 casos de carcinoma mamario
| Factores | FT | GLC | GLNC |
|---|---|---|---|
| CD68 | 32 (55,2) | 44 (83) | 44 (83) |
| CD138 | 25 (43,9) | 27 (50,9) | 19 (35,8) |
| CD3 | 46 (76,7) | - | - |
| CD20 | 19 (31,6) | - | - |
| CD3/CD20 | 26 (46,3) | 25 (41,7) | |
| CD20/CD3 | 26 (46,3) | 25 (41,7) | |
| MMP1 | |||
| CT | 57 (95) | 12 (20) | 6 (10) |
| CMI | 25 (41,7) | 26 (43,3) | 29 (48,3) |
| FB | 25 (41,7) | 0 (0) | 1 (1,7) |
| MMP7 | |||
| CT | 52 (86,7) | 10 (16,7) | 3 (5) |
| CMI | 11 (18,3) | 11 (18,3) | 14 (23,3) |
| FB | 15 (25) | 0 (0) | - |
| MMP13 | |||
| CT | 51 (85) | 9 (15) | - |
| CMI | 15 (25) | 33 (55) | - |
| FB | 6 (10) | 0 (0) | - |
| TIMP1 | |||
| CT | 42 (70) | 10 (16,7) | - |
| CMI | 6 (10) | 28 (46,7) | - |
| FB | 6 (10) | 0 (0) | - |
CMI: célula mononuclear inflamatoria; CT: célula tumoral; FB: fibroblasto; FT: frontera tumoral; GLC: ganglio linfático centinela; GLNC: ganglio linfático no centinela.
Los valores están representados como el número (porcentaje) de casos positivos. En caso de CD3 y CD20 en los ganglios linfáticos, como el número (porcentaje) de casos por encima de la mediana.
En el presente estudio también consideramos el valor de la mediana de los porcentajes de cara a evaluar los resultados. La mediana (intervalo) en los GLC para CD3/CD20 fue 1,03 (0-9,85); para CD20/CD3, 0,78 (0-2,04). En los GLNC para CD3/CD20 fue 1,1 (0-3,14), y para CD20/CD3, 0,84 (0-5,16).
La expresión de MMP-1, MMP-7 y MMP-13 por las células tumorales tuvo lugar en un elevado porcentaje de casos en la frontera tumoral. Es destacable que no existe expresión de MMP-1, MMP-7, MMP-13 y TIMP-1 por los fibroblastos en los GLC. Además, alrededor de un 50% de los GLC muestran expresión de MMP-13 y TIMP-1 por las CMI (tabla 3).
Por otra parte, cabe mencionar que no encontramos concordancias significativas entre la expresión de los distintos factores estudiados entre la frontera tumoral y el GLC (datos no mostrados).
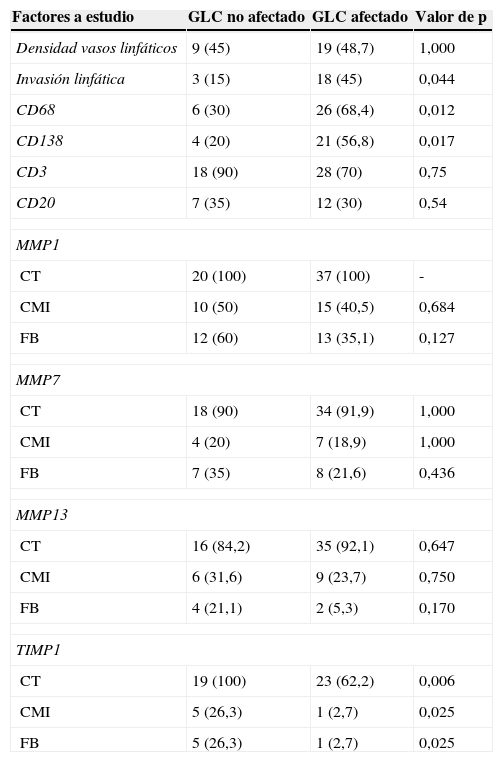
Relación entre la expresión de los diferentes factores en la frontera tumoral y la afectación neoplásica del ganglio centinelaLas relaciones entre todos los factores evaluados en la frontera tumoral y la afectación tumoral de los GLC se presentan en la tabla 4. Como se puede apreciar en esa tabla, la determinación del número de vasos linfáticos en la frontera tumoral no se relacionó significativamente con la afectación de los GLC. Sin embargo, existió una asociación significativa entre la invasión linfática tumoral en la frontera tumoral y la afectación neoplásica de los GLC (p=0,044). Además, resultó llamativo comprobar cómo un número más elevado de CMI CD68-positivas o CD138-positivas se asociaron significativamente (p=0,012 y p=0,017, respectivamente), y de forma positiva, con la afectación tumoral de los GLC, poniendo de manifiesto el papel activo de las CMI, en este caso células CD68 y CD138 positivas, en la metastatización ganglionar. Sin embargo, ninguna de las expresiones de las MMP en la frontera tumoral por los diferentes tipos celulares se asoció significativamente con la afectación del GLC. No obstante, la expresión de TIMP1, tanto por las células tumorales como por los CMI o fibroblastos del estroma tumoral, se asoció negativamente y de forma significativa (p=0,006, p=0,025 y p=0,025, respectivamente) con la afectación tumoral del GLC. TIMP-1 aparece como un factor que puede impedir la afectación de los GLC.
Relación entre la expresión de los diferentes factores en la frontera tumoral y la afectación de GLC en 59 carcinomas mamarios
| Factores a estudio | GLC no afectado | GLC afectado | Valor de p |
|---|---|---|---|
| Densidad vasos linfáticos | 9 (45) | 19 (48,7) | 1,000 |
| Invasión linfática | 3 (15) | 18 (45) | 0,044 |
| CD68 | 6 (30) | 26 (68,4) | 0,012 |
| CD138 | 4 (20) | 21 (56,8) | 0,017 |
| CD3 | 18 (90) | 28 (70) | 0,75 |
| CD20 | 7 (35) | 12 (30) | 0,54 |
| MMP1 | |||
| CT | 20 (100) | 37 (100) | - |
| CMI | 10 (50) | 15 (40,5) | 0,684 |
| FB | 12 (60) | 13 (35,1) | 0,127 |
| MMP7 | |||
| CT | 18 (90) | 34 (91,9) | 1,000 |
| CMI | 4 (20) | 7 (18,9) | 1,000 |
| FB | 7 (35) | 8 (21,6) | 0,436 |
| MMP13 | |||
| CT | 16 (84,2) | 35 (92,1) | 0,647 |
| CMI | 6 (31,6) | 9 (23,7) | 0,750 |
| FB | 4 (21,1) | 2 (5,3) | 0,170 |
| TIMP1 | |||
| CT | 19 (100) | 23 (62,2) | 0,006 |
| CMI | 5 (26,3) | 1 (2,7) | 0,025 |
| FB | 5 (26,3) | 1 (2,7) | 0,025 |
CMI: célula mononuclear inflamatoria; CT: célula tumoral; FB: fibroblasto; GLC: ganglio linfático centinela.
Los valores están representados como el número de casos (porcentaje) positivos. En caso de la Densidad de vasos linfáticos, son número (porcentaje) de casos por encima de la mediana.
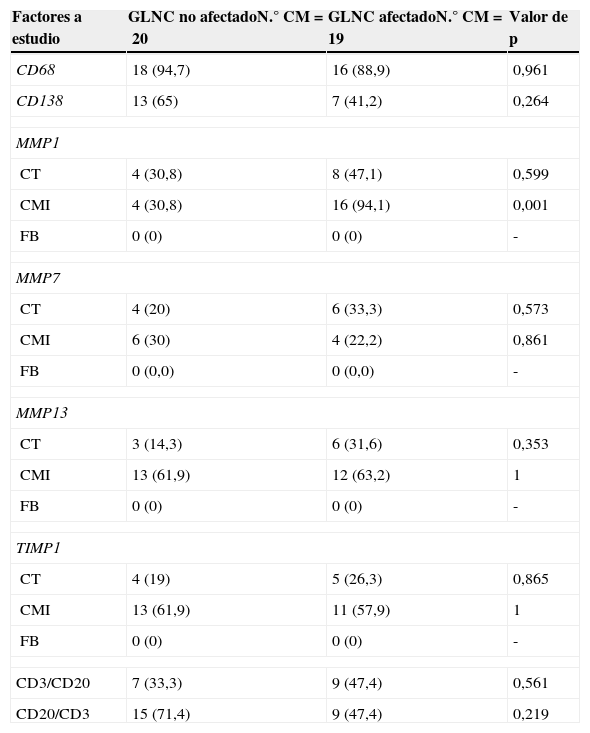
En la tabla 5 se recogen las relaciones entre los factores en el GLC afectado (n=39) y la afectación tumoral de los GLNC. De todos los factores analizados, incluyendo datos del ratio CD3/CD20 y CD20/CD3, tan solo la expresión de MMP-1 por las CMI peritumorales del GLC se asoció significativamente con la afectación tumoral de los GLNC, evidenciando la participación activa de la MMP-1 en la metastatización ganglionar.
Relación entre la expresión de diferentes factores en el GLC con afectación tumoral y la afectación de los GLNC en 39 carcinomas mamarios
| Factores a estudio | GLNC no afectadoN.° CM=20 | GLNC afectadoN.° CM=19 | Valor de p |
|---|---|---|---|
| CD68 | 18 (94,7) | 16 (88,9) | 0,961 |
| CD138 | 13 (65) | 7 (41,2) | 0,264 |
| MMP1 | |||
| CT | 4 (30,8) | 8 (47,1) | 0,599 |
| CMI | 4 (30,8) | 16 (94,1) | 0,001 |
| FB | 0 (0) | 0 (0) | - |
| MMP7 | |||
| CT | 4 (20) | 6 (33,3) | 0,573 |
| CMI | 6 (30) | 4 (22,2) | 0,861 |
| FB | 0 (0,0) | 0 (0,0) | - |
| MMP13 | |||
| CT | 3 (14,3) | 6 (31,6) | 0,353 |
| CMI | 13 (61,9) | 12 (63,2) | 1 |
| FB | 0 (0) | 0 (0) | - |
| TIMP1 | |||
| CT | 4 (19) | 5 (26,3) | 0,865 |
| CMI | 13 (61,9) | 11 (57,9) | 1 |
| FB | 0 (0) | 0 (0) | - |
| CD3/CD20 | 7 (33,3) | 9 (47,4) | 0,561 |
| CD20/CD3 | 15 (71,4) | 9 (47,4) | 0,219 |
CM: carcinoma mamario; CMI: células mononucleares inflamatorias; CT: célula tumoral; FB: fibroblasto; GLC: ganglio linfático centinela; GLNC: ganglio linfático no centinela.
Los valores están representados como el número (porcentaje) de casos positivos. En caso de CD3/CD20 y CD20/CD3, como el número (porcentaje) de casos por encima de la mediana.
Parece lógico considerar que la expresión de determinados factores en la frontera tumoral podría influir en la metastatización ganglionar. Ello es debido a que esta localización tumoral es la zona donde tienen lugar las más importantes interacciones entre las células tumorales y las células del organismo huésped del tumor, lo que tiene una gran importancia como zona origen de señales biológicas que pueden influir en la progresión tumoral. Además, tenemos que considerar que en el estroma intratumoral del cáncer de mama existe una disminución importante de los vasos linfáticos, y que los pocos existentes están colapsados debido a la gran presión existente en el tumor y, por tanto, no resultan funcionales18,19. No obstante, otra situación diferente puede ocurrir en la frontera tumoral. En esta localización se ha descrito que los carcinomas mamarios muestran un incremento de la densidad de vasos linfáticos en relación con el tejido mamario normal19, ya que existen factores liberados por los tumores que pueden propiciar el desarrollo extraordinario de esos vasos a partir de los preexistentes en el tejido mamario peritumoral y, así, alterar la dinámica del flujo linfático.
Nuestros resultados mostraron una variabilidad en la determinación del número de vasos linfáticos en la periferia tumoral entre los diferentes tumores, lo que resulta indicativo de la heterogeneidad biológica de los carcinomas mamarios en cuanto su capacidad de inducir linfangiogénesis. A «priori» podríamos considerar que una mayor densidad de vasos linfáticos adyacentes a las células tumorales podría favorecer la migración de las células cancerosas hacia los ganglios axilares. Sin embargo, aunque existió una tendencia positiva, nuestros resultados no mostraron una asociación significativa entre ambos factores. En cambio, la invasión tumoral linfática en la frontera tumoral sí se relacionó significativamente con una mayor probabilidad de afectación del GLC. Ello parece indicar que es más determinante la capacidad invasiva de las células cancerosas que el número de vasos linfáticos de cara a conseguir el avance tumoral hacia los GLC en el cáncer de mama.
Ninguna de las expresiones de MMP evaluadas en la frontera tumoral se asoció significativamente con la afectación tumoral del GLC. La expresión de MMP, tanto en el centro tumoral como en la frontera tumoral, y tanto por las células cancerosas como por las células estromales (fibroblastos y CMI), se han asociado con una mayor incidencia de desarrollo de metástasis hematógenas20,21. No obstante, se ha señalado que el mecanismo de metástasis linfática ganglionar es diferente del proceso de metastatización hematógena en el cáncer de mama. Así, por ejemplo, la expresión del MMP-1 por las CMI en el GLC se ha asociado con la progresión tumoral a través del sistema linfático y afectación del resto de los ganglios axilares15, pero no con el desarrollo de metástasis hematógenas en cáncer de mama21. Resulta también significativo que la expresión de TIMP-1 se ha relacionado con el desarrollo de metástasis hematógenas en el cáncer de mama21. Ello puede ser debido a que los TIMP son proteínas multifuncionales que, además de su papel inhibidor de las MMP, pueden promocionar la progresión tumoral a través de su efecto inductor de apoptosis21. Sin embargo, nuestros resultados indican que la expresión de TIMP1, tanto por las células cancerosas como por el estroma tumoral, se asocian negativamente y de forma significativa con la afectación del GLC. Ello sugiere que los TIMP pueden contribuir en ese caso en algún modo a proteger de la metastatización ganglionar mediante algún bloqueo enzimático de las MMP.
Nuestros resultados mostraron que un elevado número de células CD68 positivas y CD138 positivas (macrófagos y células dendríticas, respectivamente), se relacionó con una mayor probabilidad de afectación tumoral del GLC. Esto puede ser debido a que las células inflamatorias pueden influir en la promoción del cáncer mediante la secreción de citoquinas, factores de crecimiento, quimioquinas y proteasas, que estimulan la proliferación y el potencial invasivo de las células cancerosas22.
Otra hipótesis posible de la relación entre el incremento de células dendríticas en la frontera tumoral y una mayor posibilidad de metástasis en el ganglio centinela es que, considerando la capacidad fagocítica de las células dendríticas, interiorizando posiblemente macromoléculas de células tumorales con efecto inmunosupresor, su posterior migración desde la frontera tumoral al ganglio centinela posibilita un efecto facilitador de la colonización posterior de las células tumorales en el ganglio. En este sentido, es sabido que los tumores pueden producir sustancias inmunosupresivas de efecto inmunomodulador en los GLC23. De hecho, se ha descrito en el cáncer de mama que en los ganglios axilares metastásicos hay una menor presencia de células T citotóxicos en relación con los ganglios no metastásicos24. Por otra parte, también tenemos que considerar la posibilidad de la importancia del tipo de célula dendrítica en cuanto a su influencia sobre la migración de la célula tumoral. En este estudio utilizamos como marcador para las mismas el CD138, pero existen otros tipos de células dendríticas que pueden ser reconocidas con otros marcadores de superficie, tales como CD1a, CD 208, etc.
En cuanto a la relación entre los factores analizados en el GLC positivo y la afectación tumoral de los GLNC, tan solo encontramos que la expresión de MMP-1 por las CMI peritumorales del ganglio centinela afectado, se relaciona significativamente y de forma positiva con la afectación de los GLNC. Este resultado está de acuerdo con nuestros estudios previos15, reflejando que la expresión de MMP-1 por las CMI es un potente predictor de la cascada metastásica a través de la cadena ganglionar linfática axilar en el cáncer de mama. Ello puede deberse fundamentalmente a la capacidad de la MMP-1 de degradar elementos de la matriz extracelular, facilitando de esa forma la invasión tumoral y las metástasis. Así, se ha descrito que la MMP-1 escinde varios componentes de la matriz extracelular, incluyendo diferentes tipos de colágeno, inhibidores de serinproteasas, y la macroglobulina α2.
En el presente estudio no encontramos ninguna concordancia significativa entre los factores evaluados en la frontera tumoral y en los GLC, y en los distintos tipos celulares analizados. El cáncer de mama es un grupo heterogéneo de neoplasias que se originan en las células epiteliales que recubren los conductos de la leche. La heterogeneidad del tumor de mama se ha observado en la histología del tumor y su evolución clínica durante un largo tiempo, y estas diferencias han servido como base para la clasificación de la enfermedad25. Así pues, todos esos datos parecen reflejar la heterogeneidad de los carcinomas mamarios que se traduce en una gran variabilidad de expresión de factores, no solo por las propias células tumorales, sino también por las células estromales del microambiente tumoral. Estos datos apoyan la hipótesis de que la heterogeneidad tumoral también es debida a cambios dinámicos del microambiente tumoral, lo que hace que la categorización tumoral sea una tarea exigente, especialmente en lo que se refiere a la respuesta a tratamiento y progresión de la enfermedad.
En definitiva, nuestros resultados nos inducen a considerar que la determinación de factores celulares y moleculares en la frontera tumoral puede contribuir a conocer mejor las diferentes fases de la metastatización ganglionar en el cáncer de mama. Concretamente, nuestro estudio apoya el papel de las células inflamatorias en la progresión e invasión tumoral, en este caso vía ganglionar. Así mismo, se pone de manifiesto el papel de la MMP-1 y TIMP-1 en el desarrollo o inhibición, respectivamente, de la metástasis ganglionar. Por ello, futuros estudios en esta línea pueden mejorar la predicción de la afectación del GLC y GLNC en el cáncer de mama.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo fue financiado por el Fondo de Investigaciones Sanitarias del Instituto Carlos III (PI08/90043 and PI10/02106).
AutoríaNana Berdize: adquisición de los datos, análisis e interpretación de los datos, redacción del texto, aprobación de la versión final.
Noemí Eiró: concepción y diseño, análisis e interpretación de los datos, redacción del texto, aprobación de la versión final.
Luis O. González: concepción y diseño, análisis e interpretación de los datos, aprobación de la versión final
Germán Juan: interpretación de los datos, aprobación de la versión final.
Francisco Vizoso: concepción y diseño, análisis e interpretación de los datos, redacción del texto, aprobación de la versión final.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.