Determinar el porcentaje de pacientes con diagnóstico inicial de carcinoma ductal in situ (CDIS) que presentó infiltración tras la excisión quirúrgica e identificar los factores relacionados tanto con la sobreestadificación como con la positividad del ganglio centinela (GC) en el estudio definitivo.
Material y métodosAnálisis retrospectivo de 135 pacientes diagnosticadas mediante biopsia core de CDIS a las que se les realizó biopsia selectiva del GC de forma consecutiva de 2003 a 2011. La técnica fue mixta en el período inicial y posteriormente mediante administración intraperilesional de radiocoloides. En 2009 se introdujo una gammacámara portátil y se inició el estudio intraoperatorio molecular mediante amplificación de ácido nucleico de un solo paso.
ResultadosSe produjo sobreestadificación en 45 de las 135 pacientes (33,3%), de las que 30 (22,2%) presentaron CDIS con microinfiltración y 15 (11,1%) carcinoma infiltrante. Los CDIS con microinfiltración mostraron mayor tamaño, mayor porcentaje de alto grado, de HER2 positivo y de Ki-67 alto que los CDIS (p<0,001, p<0,001, p=0,002 y p=0,031, respectivamente). Los porcentajes de positividad del GC fueron del 3,6% en el CDIS, del 6,9% en el CDIS con microinfiltración y del 20% en los carcinomas infiltrantes, correspondiendo a 8 pacientes, de las cuales 6 presentaron HER2 positivo y Ki-67 alto.
ConclusionesEl porcentaje global de infraestimación fue alto, principalmente debido a la presencia de microinfiltración. Tanto esta como la afectación metastásica del GC mostró relación con el HER2 positivo y el Ki-67 alto, por tanto, disponer de estos datos en la biopsia percutánea podría ser relevante para establecer la indicación de realización de biopsia selectiva del GC en el CDIS.
To determine the percentage of patients with ductal carcinoma in situ (DCIS) with infiltration after surgical excision and to identify the factors related to both upstaging and sentinel node (SN) positivity in the final study.
Material and methodsA retrospective analysis was performed in 135 patients diagnosed with DCIS by core biopsy who subsequently underwent sentinel lymph node biopsy from 2003 to 2011. In the first period of the study, the technique was mixed and subsequently consisted of intra-perilesional radiocolloid administration. In 2009, a portable gamma camera was introduced and we began to use intraoperative one-step nucleic acid amplification.
ResultsUpstaging occurred in 45 of the 135 patients (33.3%), of which 30 (22.2%) had DCIS with microinfiltration and 15 (11.1%) had invasive carcinoma. Compared with DCIS, DCIS with microinfiltration were larger and showed a higher percentage of high grade, HER2 positivity and high Ki-67 (P<.001, P<.001, P=.002 and P=.031, respectively). SN positivity rates were 3.6% in DCIS, 6.9% in DCIS with microinfiltration, and 20% in invasive carcinomas, corresponding to 8 patients, of whom 6 showed HER2-positivity and high Ki-67.
ConclusionsOverall underestimation was high, mainly due to the presence of microinfiltration. Both microinfiltration and metastatic SN involvement were associated with HER2-positivity and high Ki-67. Therefore, the availability of this information in core needle biopsy could be relevant in establishing the indication for sentinel lymph node biopsy in DCIS.
El carcinoma ductal in situ (CDIS) es una proliferación maligna de células epiteliales confinadas a la membrana basal de los ductos mamarios. Sus células muestran características citológicas, expresión de receptores hormonales y perfiles de Ki-67 y de HER2 similares a los de los cánceres infiltrantes, porque hoy se reconoce su carácter de lesión precursora. El diagnóstico de esta enfermedad se está incrementando gracias a la generalización de los programas de detección precoz, llegando casi al 30% de los casos nuevamente diagnosticados1.
No existe unanimidad sobre los criterios de selección respecto a la biopsia selectiva del ganglio centinela (BSGC) en el CDIS. Si no se realiza estadificación axilar mediante BSGC en la intervención quirúrgica inicial y el examen histopatólogico definitivo demuestra un carcinoma invasivo será necesaria una segunda intervención o, en caso de que se haya realizado mastectomía, no será posible el estudio del ganglio centinela (GC)2. En este sentido, cuando el diagnóstico preoperatorio de CDIS se realiza mediante biopsia con aguja gruesa (BAG) se han observado porcentajes de cáncer invasivo en el diagnóstico final que varían del 8,3 al 43,6%3,4. Al contrario, el uso rutinario de la BSGC en todas las pacientes con CDIS no está justificado por el bajo porcentaje de positividad del GC, que se encuentra entre el 1 y el 13%5–7, y algunos autores indican que puede ser omitida con seguridad8–10.
Ante esta disyuntiva, numerosos trabajos analizan los hallazgos clínicos, radiológicos y patológicos que ayudarían a identificar a las pacientes que resultarían más beneficiadas con la realización de esta técnica, es decir, a definir aquellas características predictoras tanto del diagnóstico final de carcinoma infiltrante como de afectación metastásica del GC11–13.
El objetivo del presente estudio es realizar una revisión de nuestra experiencia en la aplicación de la BSGC en pacientes con diagnóstico inicial de CDIS analizando, en primer lugar, el porcentaje de pacientes que en el estudio definitivo mostraron un carcinoma invasivo, y en segundo lugar, determinando los factores relacionados tanto con la sobreestadificación como con la positividad del GC.
Material y métodosPacientesSe han analizado retrospectivamente 135 pacientes con diagnóstico inicial de CDIS sin microinfiltración a las que se les realizó tratamiento quirúrgico primario y BSGC de forma consecutiva entre enero de 2003 y diciembre de 2011.
El criterio seguido para indicar la realización de BSGC fue que se tratase de carcinomas intraductales extensos y de alto grado y/o con comedonecrosis y/o que fuera a realizarse mastectomía, sin evidencia clínica ni ecográfica de afectación axilar. A partir de 2008 la afectación axilar prequirúrgica se excluyó mediante BAG de los ganglios ecográficamente sospechosos. Todas las pacientes firmaron el consentimiento informado.
Se estudiaron las variables edad, hallazgos mamográficos, método de diagnóstico inicial, tamaño, grado tumoral (bajo, intermedio y alto), estado de los receptores hormonales, índice de proliferación Ki-67 (punto de corte 14%), el HER2 (IHQ: 0, 1+, 2+, 3+ o FISH con/sin amplificación) y tratamiento quirúrgico (conservador vs. mastectomía).
Diagnóstico inicialEn 103 casos en los que la lesión era visible únicamente en la mamografía se realizaron biopsias asistidas por vacío guiadas por estereotaxia, con agujas de 10 y 11G. En 28 pacientes en las que la lesión fue detectable por ecografía se realizó biopsia core (BAG) con aguja de 14G. En 3 pacientes se practicó biopsia dirigida, y en una, punch del pezón.
Técnica de marcaje del ganglio centinelaEn el periodo inicial la técnica fue mixta, con administración superficial de azul de isosulfán y profunda de radiocoloides; posteriormente, en 95 pacientes, únicamente radiotrazador intraperilesional. Se administraron 111MBq (3mCi) de sulfuro de renio coloidal (Nanocis®) en inyección única el día previo a la intervención. En 98 pacientes con lesión no palpable (72,6%) el radiocoloide se inyectó con guía ecográfica o mamográfica, y en 37 (27,4%) con lesión palpable se administró en el Servicio de Medina Nuclear.
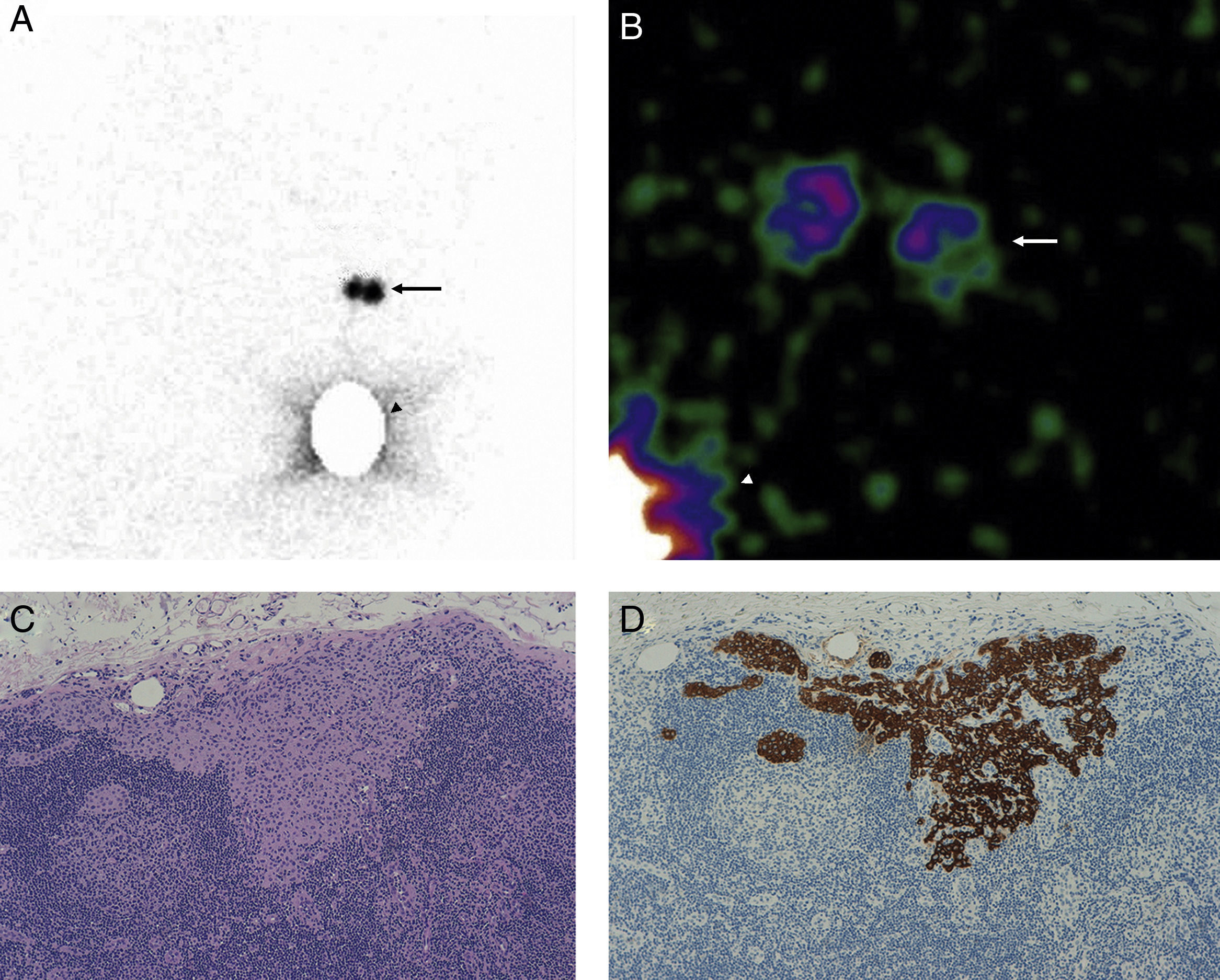
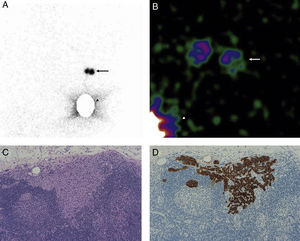
En la linfogammagrafía prequirúrgica obtuvimos imágenes precoces y tardías utilizando una gammacámara de campo amplio (SkyLight® ADAC, Philips). Para la detección del GC se utilizó una sonda (Neo2000®, Neoprobe Corporation), hasta que a partir de octubre de 2009 se dispuso de una gammacámara portátil (Sentinella® S102, GEM Imaging) (fig. 1).
A. Imagen linfogammagráfica en proyección anterior en la que se ha realizado una máscara en el sitio de inyección. B. Imagen adquirida en quirófano con gammacámara portátil intraoperatoria previamente a la incisión axilar (las flechas señalan la localización de los 2 GC axilares y la punta de flecha el sitio de inyección). C. Imagen panorámica de una micrometástasis de 1mm de diámetro máximo de localización paracortical (H-E, x100). D. La misma micrometástasis teñida con queratina cóctel AE1/AE3 para confirmar su naturaleza epitelial (IHQ, x100).
En el estudio anatomopatológico del GC se siguieron 3 procedimientos diferentes. En 29 pacientes se realizó estudio intraoperatorio convencional mediante impronta citológica y cortes por congelación y estudio diferido mediante hematoxilina-eosina e IHQ con anticuerpos anticitoqueratina (clona AE1/AE3). En 66 casos se llevó a cabo únicamente este estudio diferido14 y a partir de octubre de 2009, lo cual incluye 40 pacientes, se realizó estudio intraoperatorio molecular mediante amplificación de ácido nucleico de un solo paso.
Análisis estadísticoSe han descrito las variables cuantitativas (edad y tamaño del tumor) mediante la mediana y el rango intercuartílico (RI), y las variables categóricas mediante la frecuencia y el porcentaje, tanto para la muestra total como para los grupos según el diagnóstico final. La variable ordinal (grado del tumor) se comparó entre los grupos con el test χ2 de tendencias en las proporciones, las variables categóricas con χ2 o test de Fisher, según correspondiese, y, finalmente, las variables continuas mediante el test de Kruskal-Wallis. Las comparaciones 2 a 2 se han realizado con el test de Fisher o el test de Mann-Whitney, según el tipo de variable. Se consideró estadísticamente significativo un valor de p<0,05. Los programas informáticos utilizados fueron SPSS® Statistics 20.0 y R® versión 2.13.1.
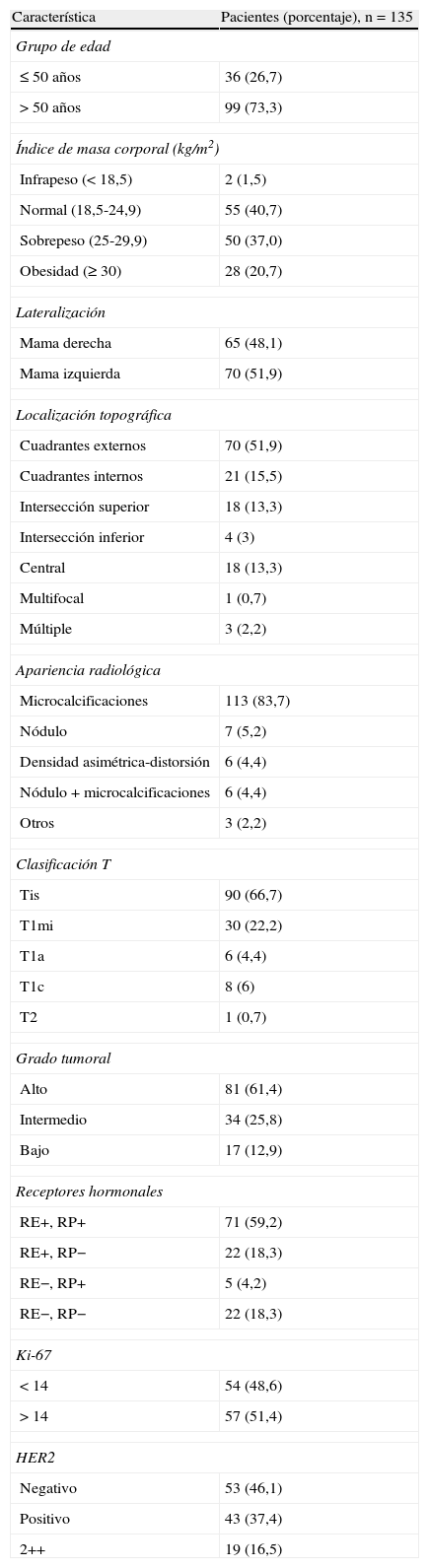
ResultadosLas características clinicopatológicas de las 135 pacientes estudiadas se presentan en la tabla 1. En 90 de ellas (66,7%) el diagnóstico definitivo fue de CDIS, mientras que en 45 (33,3%) casos se observó un carcinoma infiltrante, tratándose de CDIS con microinfiltración (CDISM) en 30 (22,2%) y de un carcinoma infiltrante en las 15 (11,1%) restantes. En estas últimas se trató de un carcinoma ductal infiltrante en 14 casos y un carcinoma lobulillar infiltrante en uno, presentando 13 de ellas extenso componente intraductal.
Características clínicas, radiológicas y patológicas de las pacientes
| Característica | Pacientes (porcentaje), n=135 |
| Grupo de edad | |
| ≤50 años | 36 (26,7) |
| >50 años | 99 (73,3) |
| Índice de masa corporal (kg/m2) | |
| Infrapeso (<18,5) | 2 (1,5) |
| Normal (18,5-24,9) | 55 (40,7) |
| Sobrepeso (25-29,9) | 50 (37,0) |
| Obesidad (≥30) | 28 (20,7) |
| Lateralización | |
| Mama derecha | 65 (48,1) |
| Mama izquierda | 70 (51,9) |
| Localización topográfica | |
| Cuadrantes externos | 70 (51,9) |
| Cuadrantes internos | 21 (15,5) |
| Intersección superior | 18 (13,3) |
| Intersección inferior | 4 (3) |
| Central | 18 (13,3) |
| Multifocal | 1 (0,7) |
| Múltiple | 3 (2,2) |
| Apariencia radiológica | |
| Microcalcificaciones | 113 (83,7) |
| Nódulo | 7 (5,2) |
| Densidad asimétrica-distorsión | 6 (4,4) |
| Nódulo+microcalcificaciones | 6 (4,4) |
| Otros | 3 (2,2) |
| Clasificación T | |
| Tis | 90 (66,7) |
| T1mi | 30 (22,2) |
| T1a | 6 (4,4) |
| T1c | 8 (6) |
| T2 | 1 (0,7) |
| Grado tumoral | |
| Alto | 81 (61,4) |
| Intermedio | 34 (25,8) |
| Bajo | 17 (12,9) |
| Receptores hormonales | |
| RE+, RP+ | 71 (59,2) |
| RE+, RP− | 22 (18,3) |
| RE−, RP+ | 5 (4,2) |
| RE−, RP− | 22 (18,3) |
| Ki-67 | |
| <14 | 54 (48,6) |
| >14 | 57 (51,4) |
| HER2 | |
| Negativo | 53 (46,1) |
| Positivo | 43 (37,4) |
| 2++ | 19 (16,5) |
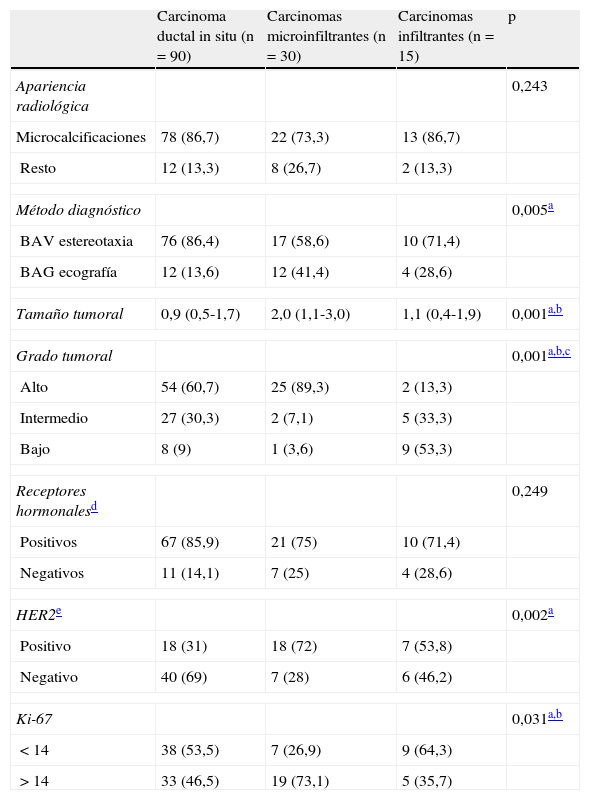
Las pacientes con CDIS tuvieron una mediana de edad de 58 años (RI: 49,5-64,5), que fue superior a la de las pacientes con CDISM y carcinoma infiltrante, cuya mediana fue de 54 (RI: 47-62) y 52,5 (RI: 47-63,7), respectivamente, sin que esta diferencia fuese estadísticamente significativa. En la tabla 2 se muestra el análisis univariable de los principales datos radiológicos y patológicos del estudio definitivo en los 3 grupos de pacientes. Se obtuvieron diferencias significativas en tamaño tumoral, siendo este mayor en los CDISM que en el resto, y también en el grado tumoral, siendo mayor la proporción de carcinomas de alto grado en los CDISM (89%) que en los otros 2 grupos y, sobre todo, frente a los carcinomas infiltrantes (13%). Asimismo, existió mayor proporción de HER2 positivo en los CDISM (72%) que en los CDIS (31%), y mayor proporción de Ki-67>14 en los CDISM (73%) que en el resto (46 y 36% en CDIS e infiltrantes, respectivamente).
Análisis univariable de las principales características radiológicas y patológicas del estudio definitivo en los 3 grupos de pacientes
| Carcinoma ductal in situ (n=90) | Carcinomas microinfiltrantes (n=30) | Carcinomas infiltrantes (n=15) | p | |
| Apariencia radiológica | 0,243 | |||
| Microcalcificaciones | 78 (86,7) | 22 (73,3) | 13 (86,7) | |
| Resto | 12 (13,3) | 8 (26,7) | 2 (13,3) | |
| Método diagnóstico | 0,005a | |||
| BAV estereotaxia | 76 (86,4) | 17 (58,6) | 10 (71,4) | |
| BAG ecografía | 12 (13,6) | 12 (41,4) | 4 (28,6) | |
| Tamaño tumoral | 0,9 (0,5-1,7) | 2,0 (1,1-3,0) | 1,1 (0,4-1,9) | 0,001a,b |
| Grado tumoral | 0,001a,b,c | |||
| Alto | 54 (60,7) | 25 (89,3) | 2 (13,3) | |
| Intermedio | 27 (30,3) | 2 (7,1) | 5 (33,3) | |
| Bajo | 8 (9) | 1 (3,6) | 9 (53,3) | |
| Receptores hormonalesd | 0,249 | |||
| Positivos | 67 (85,9) | 21 (75) | 10 (71,4) | |
| Negativos | 11 (14,1) | 7 (25) | 4 (28,6) | |
| HER2e | 0,002a | |||
| Positivo | 18 (31) | 18 (72) | 7 (53,8) | |
| Negativo | 40 (69) | 7 (28) | 6 (46,2) | |
| Ki-67 | 0,031a,b | |||
| <14 | 38 (53,5) | 7 (26,9) | 9 (64,3) | |
| >14 | 33 (46,5) | 19 (73,1) | 5 (35,7) | |
Diferencias estadísticamente significativas entre carcinomas ductales in situ y carcinomas ductales in situ microinfiltrantes.
Diferencias estadísticamente significativas entre carcinomas ductales in situ microinfiltrantes y carcinomas infiltrantes.
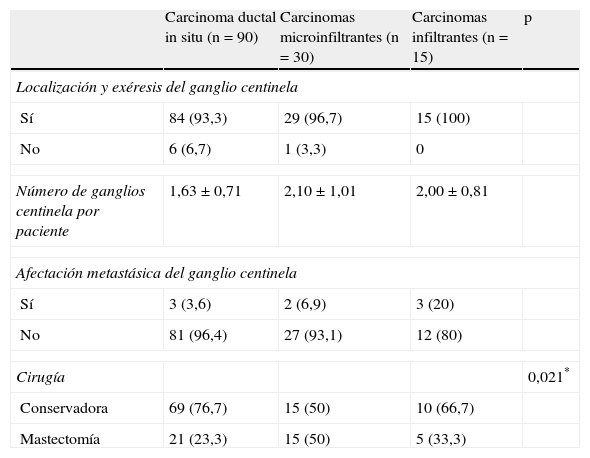
La linfogammagrafía prequirúrgica mostró migración del radiocoloide en 130 pacientes (96,3%). Se localizó y se llevó a cabo la exéresis del GC en el 94,8% de las pacientes. Se realizó resección segmentaria de la lesión mamaria primaria en 94 pacientes (69,6%) y mastectomía en las 41 restantes (30,4%). En la tabla 3 se muestran los resultados de la BSGC y el tipo de intervención quirúrgica mamaria en los 3 grupos.
Resultados de la biopsia selectiva del ganglio centinela y tipo de cirugía realizada en los 3 grupos de pacientes
| Carcinoma ductal in situ (n=90) | Carcinomas microinfiltrantes (n=30) | Carcinomas infiltrantes (n=15) | p | |
| Localización y exéresis del ganglio centinela | ||||
| Sí | 84 (93,3) | 29 (96,7) | 15 (100) | |
| No | 6 (6,7) | 1 (3,3) | 0 | |
| Número de ganglios centinela por paciente | 1,63±0,71 | 2,10±1,01 | 2,00±0,81 | |
| Afectación metastásica del ganglio centinela | ||||
| Sí | 3 (3,6) | 2 (6,9) | 3 (20) | |
| No | 81 (96,4) | 27 (93,1) | 12 (80) | |
| Cirugía | 0,021* | |||
| Conservadora | 69 (76,7) | 15 (50) | 10 (66,7) | |
| Mastectomía | 21 (23,3) | 15 (50) | 5 (33,3) | |
* Diferencias estadísticamente significativas entre carcinomas ductales in situ y carcinomas ductales in situ microinfiltrantes.
Considerando el número total de pacientes, la BSGC fue positiva en 8 casos (6,3%), exponiéndose el análisis descriptivo de las principales características patológicas que presentaron en la tabla 4. El diagnóstico se realizó en 6 casos mediante amplificación de ácido nucleico de un solo paso y en 2 con estudio intraoperatorio y diferido convencional. En todas las pacientes se llevó a cabo la linfadenectomía axilar, obteniéndose una media de 15,7±5,9 ganglios, rango 9-26, sin hallarse ningún ganglio no centinela afectado.
Tipo de intervención quirúrgica realizada y características patológicas de aquellas pacientes cuyo ganglio centinela fue positivo
| Paciente | Diagnóstico final | Tipo de intervención | Grado nuclear | RE/RP | HER2 | Ki-67 | GC |
| 1 | CDIS | Conservadora | Alto | RE−/RP− | Positivo | >14 | Una micrometástasis |
| 2 | CDIS | Mastectomía | Alto | RE−/RP− | Positivo | >14 | Dos micrometástasis |
| 3 | CDIS | Conservadora | Intermedio | RE−/RP− | Positivo | >14 | Una micrometástasis |
| 4 | CDISM | Mastectomía | Intermedio | RE+/RP− | Positivo | >14 | Una micrometástasis |
| 5 | CDISM | Conservadora | Alto | RE+/RP+ | Negativo | <14 | Una micrometástasis |
| 6 | Carcinoma infiltrante | Conservadora | 2 | RE+/RP+ | Positivo | >14 | Una micrometástasis |
| 7 | Carcinoma infiltrante | Conservadora | 2 | RE−/RP− | Positivo | >14 | Una macrometástasis |
| 8 | Carcinoma infiltrante | Mastectomía | 2 | RE−/RP− | Negativo | <14 | Una micrometástasis |
El papel de la BSGC en el CDIS no está bien definido y, por tanto, la primera pregunta que se nos plantea ante una paciente con este diagnóstico mediante biopsia percutánea es si será necesaria la estadificación axilar. En la actualización del consenso de la Sociedad Española de Senología y Patología Mamaria15 se indica la realización de BSGC en carcinoma intraductal extenso (>4cm) y de alto grado y/o con comedonecrosis y/o que se trate con mastectomía. La American Society of Clinical Oncology considera que la BSGC es aceptable en pacientes con CDIS tratadas con mastectomía (con evidencia limitada), sin embargo, no se recomienda en general cuando el tratamiento es una resección segmentaria, excepto en tumores grandes (>5cm) o con sospecha o prueba de microinfiltración (evidencia insuficiente)16. En las directrices de la National Comprehensive Cancer Network versión 1.2013 se señala que la BSGC se debe considerar en caso de mastectomía o si la localización de la excisión compromete la futura realización del procedimiento.
Definir el subgrupo de pacientes en riesgo de tener un carcinoma infiltrante permitiría seleccionar a aquellas que se beneficiarían de la BSGC, ya que es preferible que esta se realice en el mismo tiempo quirúrgico para evitar estrés psicológico, el riesgo de una nueva anestesia e intervención, y además es económicamente más eficiente.
En nuestro estudio encontramos que el 33,3% de las pacientes diagnosticadas inicialmente de CDIS a las que se les realizó BSGC presentaron carcinomas microinfiltrantes o infiltrantes en el estudio definitivo. Este porcentaje se halla dentro del rango entre 20 y 37% obtenido por otros autores2,17–19 manteniendo este mismo criterio de selección, aunque en algún caso se trata de series cortas de pacientes. En otros estudios que incluyen pacientes con CDIS, se les haya realizado o no BSGC, hallan porcentajes entre el 1820 y el 42%12, o estudios con una amplia casuística obtienen un 20%11 habiéndose realizado el diagnóstico inicial mediante biopsia asistida por vacío únicamente. También nos puede servir para encuadrar este resultado la conclusión del metaanálisis realizado por Brennan et al.21 que muestra que en uno de cada 4 casos (25,9%) de CDIS diagnosticados mediante biopsia core se infraestimó la existencia de cáncer invasivo.
Por otra parte, son numerosos los estudios que ante el diagnóstico inicial de CDIS analizan aquellos factores clínicos, radiológicos o patológicos predictores de invasión y que, por tanto, ayudan a seleccionar a las candidatas más apropiadas para BSGC, reduciendo el número de procedimientos innecesarios11,13,17,20,22. Así, Yen et al.17 abogan porque los riesgos y beneficios de la BSGC se discutan con las pacientes jóvenes (≤55 años), diagnosticadas mediante biopsia core o que presenten CDIS grandes (≥4cm) o de alto grado. Para otros, como Trentin et al.11, la edad<de 40 años, el tamaño<20mm y la ausencia de lesión residual serían predictores de ausencia de invasión y de afectación ganglionar. En ocasiones, solo a partir de un GC positivo se diagnostica un carcinoma microinfiltrante-infiltrante, retallando la pieza y volviendo sobre ella, siendo una razón adicional para indicar BSGC en CDIS de alto riesgo.
Nuestros resultados muestran que los casos en los que se halló microinfiltración en el diagnóstico definitivo correspondieron a tumores de mayor tamaño, con porcentajes superiores de alto grado, HER2 positivo y Ki-67 alto que cuando no se produjo sobreestadificación, y estas diferencias fueron estadísticamente significativas. De forma similar, los autores previamente citados11 encontraron que el Ki-67 alto y la invasión vascular peritumoral se asociaron significativamente con el componente invasivo y la afectación ganglionar, estimando que valdría la pena investigar el Ki-67 en las biopsias, mientras que no hallaron relación con el estado de los receptores hormonales, como ocurrió en nuestro caso. A su vez, autores como Roses et al. refieren que la sobreexpresión del HER2 predice la presencia de focos de carcinoma invasivo en el CDIS23. Parece que la sobreexpresión del HER2 representa un subtipo de CDIS biológicamente agresivo, correlacionándose con el alto grado, la expresión de p53 y la negatividad de los receptores hormonales24,25. Por otra parte, en nuestro estudio fue más frecuente el diagnóstico de CDISM cuando se realizó BAG y cuando la intervención quirúrgica fue una mastectomía, lo cual también ha sido descrito por otros autores2,12.
Sin embargo, el hallazgo de un carcinoma infiltrante en el estudio definitivo no ha mostrado un patrón tan claro. No se ha observado relación con el HER2, y un alto porcentaje de casos han presentado grado tumoral y Ki-67 bajos, pudiendo estar en relación con el escaso número de pacientes. Es de destacar que en un 86,6% de los carcinomas infiltrantes se evidenció un extenso componente intraductal.
Respecto al resultado de la BSGC, el porcentaje de positividad hallado en el CDIS fue del 3,6%, cifra igual a la obtenida en el metaanálisis de Ansari et al.26. Llama la atención que en las 3 pacientes se tratase de tumores con receptores de estrógenos y progesterona negativos, HER2 positivo, Ki-67 alto, en 2 casos de alto grado tumoral e intermedio en uno, aunque el escaso número no permite establecer conclusiones.
En los CDISM el porcentaje de positividad del GC fue del 6,9%, habiéndose descrito en la literatura entre el 2 y el 29%. Nuevamente debemos decir que existe controversia sobre si la BSGC está indicada en este tipo de tumores. Autores como Intra et al.9 encuentran un porcentaje de positividad del 9,7% y argumentan que la BSGC debe ser un procedimiento estándar debido al significativo porcentaje de metástasis. Sin embargo, otros, como Parikh et al,27, no están de acuerdo con esta estrategia, debido a que obtienen menor incidencia de GC positivos (2%) y observan que el CDISM no es un factor predictor independiente de recidiva ni de supervivencia global, recomendando que la estadificación axilar se realice analizando caso por caso. Lyons et al.28 encuentran un 12% e indican que la BSGC podría estar justificada en el CDISM, pero que obtendrían mayor beneficio el 2,7% de ellas que presentaron macrometástasis.
Cabe mencionar que 6 de las 8 pacientes (75%) que tuvieron afectación metastásica del GC presentaron tumores con HER2 positivo y Ki-67 alto.
Retomando la pregunta planteada inicialmente se puede concluir que ante el diagnóstico de CDIS en la biopsia inicial, aparte de recomendar BSGC cuando el tratamiento quirúrgico va a ser mastectomía, en lo que parece que existe un acuerdo bastante generalizado, en el resto de los casos convendría conocer tanto como sea posible las condiciones de la paciente y las características del CDIS, incluyendo datos inmunohistoquímicos como receptores hormonales, HER2 y Ki-67, para establecer la indicación. Con esta perspectiva, en nuestro grupo desde hace 2 años estos datos forman parte del informe de la biopsia inicial. De acuerdo con otros autores, pensamos que es esencial el desarrollo y validación de métodos precisos de estratificación del riesgo basados en una comprensión global de los factores clínicos, patológicos y biológicos asociados con el CDIS1.
En conclusión, el porcentaje de infraestimación de carcinoma microinfiltrante o infiltrante en pacientes con diagnóstico inicial de CDIS ha sido alto. La microinfiltración ha mostrado relación con las características patológicas del tumor (mayor tamaño tumoral, alto grado, HER2 positivo, Ki-67 alto), con la técnica diagnóstica (BAG vs. biopsia asistida por vacío) y con el tratamiento quirúrgico (mastectomía vs. resección segmentaria), lo cual no se ha producido en los carcinomas infiltrantes.
Para establecer la indicación de BSGC ante el diagnóstico inicial de CDIS se pueden tomar en consideración otros factores, como HER2 y Ki-67, si se dispone, como en nuestro caso, de IHQ en la biopsia percutánea, además de otros reconocidos como la edad, el tamaño del tumor, la apariencia radiológica o el método diagnóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.