Analizar las diferencias entre los angiosarcomas primarios y posradioterapia de mama.
Pacientes y métodosRevisamos retrospectivamente angiosarcomas de mama entre los años 2000 y 2010. Realizamos un estudio clinicopatológico e inmunohistoquímico con CKAE1/AE3, CD31, CD34, Ki-67, D2-40.
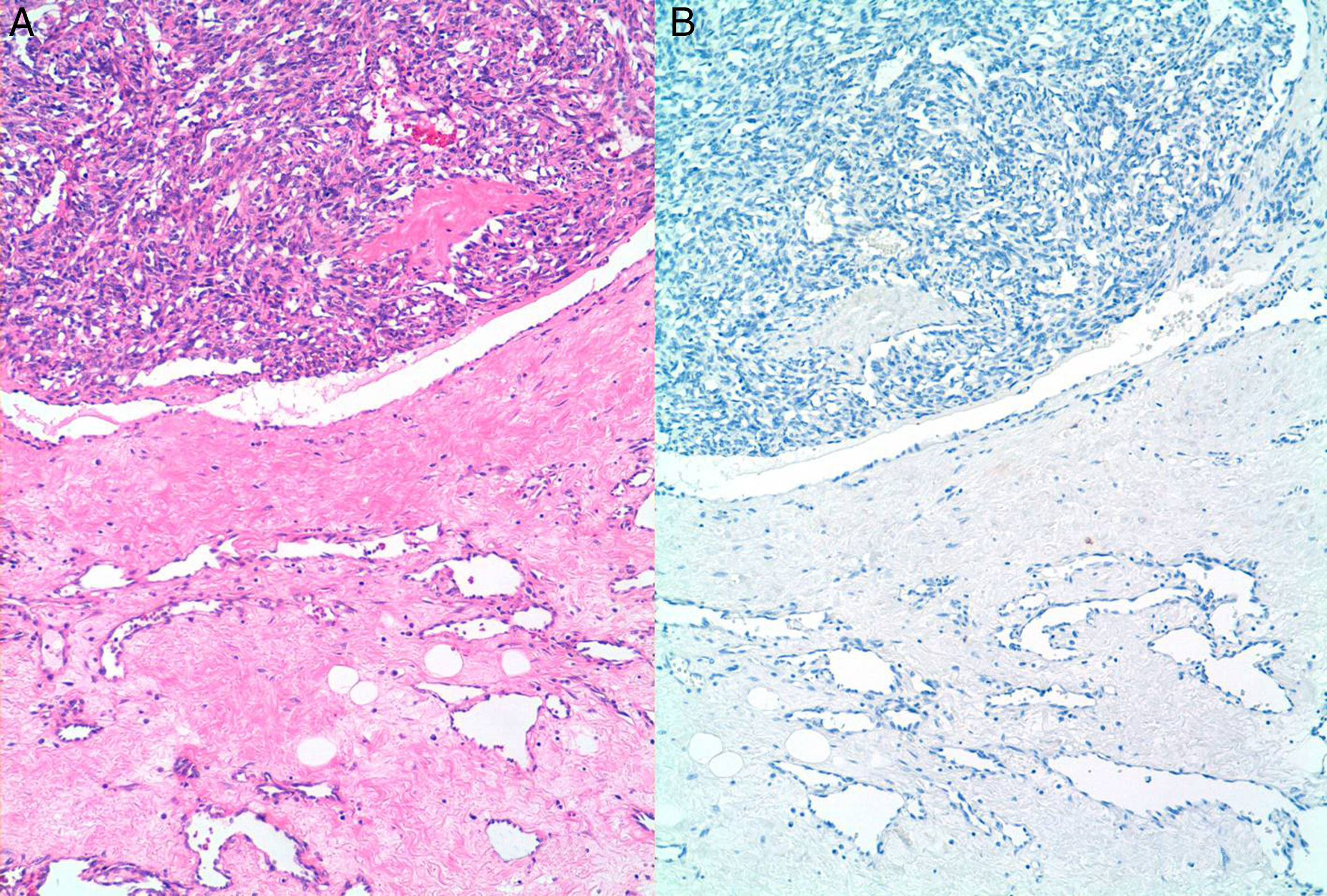
ResultadosSe incluyeron 8 mujeres, 4 con angiosarcomas primarios y 4 secundarios. La edad media era de 66 años en los primarios y de 74 en los secundarios. El periodo de latencia medio posradioterapia en los angiosarcomas secundarios fue de 118 meses. Tres tumores secundarios afectaban la piel, 3 angiosarcomas primarios eran intraparenquimatosos y los 2 restantes fueron mixtos. Todos los casos fueron CD31+/CD34+/CKAE1/AE3−. Los angiosarcomas secundarios expresaron el marcador linfático D2-40, mientras que los primarios eran D2-40−.
ConclusionesLos angiosarcomas secundarios expresan D2-40, mientras que los primarios son negativos para este marcador. Ello evidencia un origen vascular linfático para los angiosarcomas posradioterapia.
To analyze differences between primary and radiation-associated secondary breast angiosarcomas.
Patients and methodsWe retrospectively reviewed all cases of angiosarcoma diagnosed at our hospital between 2000 and 2010. We analyzed the clinical and pathological features. In the immunohistochemical study, we assessed expression of CKAE1/AE3, CD31, CD34, Ki-67 and D2-40.
ResultsThere were 8 women, 4 with primary angiosarcoma and 4 with secondary angiosarcoma. The mean age at presentation was 66 years for primary tumors and 74 years for secondary angiosarcomas. The mean latency period for radiation-associated angiosarcomas was 118 months. Three secondary tumors involved the skin, 3 primary angiosarcomas were intramammary and the remaining 2 were mixed. All tumors were CD31+/CD34+/CKAE1/AE3−. The secondary angiosarcomas also expressed D2-40, while the primary tumors were negative for this lymphatic marker.
ConclusionsSecondary angiosarcomas express D2-40, while primary angiosarcomas are negative for this lymphatic marker. This finding suggests a lymphatic origin for post-radiation angiosarcomas.
Los sarcomas primarios de la mama son muy infrecuentes, constituyendo menos del 0,1% de los tumores malignos de la mama. Entre estos, los angiosarcomas (AS) comprenden<0,05% de las neoplasias de mama1–3. El AS puede ser primario (ASP), sin otro factor asociado4,5, o secundario (ASS) y ocurrir como complicación de la radioterapia después del tratamiento conservador del carcinoma in situ e invasivo6,7. El ASS posradioterapia ocurre aproximadamente en 7 por 1.000.000personas/año4. También se ha asociado a linfedema crónico después de una mastectomía radical, pero la frecuencia de este subtipo ha disminuido los últimos tiempos debido al incremento en el tratamiento conservador del cáncer de mama no avanzado. Tanto el ASP como los ASS tienen un pronóstico peor que el carcinoma de mama.
Existen indicios para pensar que los ASP son diferentes de los ASS en lo que respeta al origen biológico, ya que difieren en las características clínicas. Se presentan en localizaciones distintas6, y el ASP típicamente ocurre en mujeres más jóvenes4,5. Los ASS tienen una relación directa causa-efecto con el tratamiento radioterápico por cáncer de mama. El periodo de latencia entre la radiación y el diagnóstico de AS varía entre 3 y 12 años, y la mayoría de los tumores aparecen dentro de los 6 años posradioterapia8–10.
Existen estudios que han demostrado que posteriormente a la cirugía y la radioterapia de la piel afecta existe un incremento de linfangiogénesis durante el primer año, con un incremento de vasos linfáticos podoplanina positivos. Por todo ello, se ha planteado que los ASS puedan tener un origen linfático11.
La hipótesis de este estudio radica en que consideramos que los ASP y los ASS son biológicamente distintos. Nuestro objetivo ha sido comparar las diferencias entre ASP y ASS de mama desde el punto de vista clinicopatológico, y también en su expresión inmunofenotípica.
MétodosRevisamos restrospectivamente la serie de ASP y ASS diagnosticados en nuestro centro entre los años 2000 y 2010. Los datos clínicos valorados fueron la edad de las pacientes, el intervalo de tiempo entre radioterapia y aparición del tumor en los ASS, medida de las lesiones según tamaño mayor reflejado en el informe patológico, y localización cutánea y/o parenquimatosa. Se evaluaron también los datos radiológicos.
Los tumores fueron fijados en formol tamponado al 4% y se incluyeron en parafina, realizándose secciones de 2-4μm y tinción de hematoxilina-eosina.
Desde el punto de vista patológico se valoró el grado histológico en bajo (1), intermedio (2) o alto (3), según la clasificación de Rosen12.
Se realizó estudio inmunohistoquímico siguiendo los protocolos estándar con citoqueratina AE1/AE3 (IR053 DAKO) y con diferentes marcadores vasculares y endoteliales: CD31 (IR610 DAKO), CD34 (IR632 DAKO) y el marcador linfático D2-40 (IR072 DAKO). Se evaluaron las diferencias entre los 2 tipos de tumores. El índice proliferativo se estudió con el marcador Ki-67 (IR626 DAKO), y se cuantificó bajo microscopio óptico mediante recuento de núcleos teñidos por 100 células tumorales por campos de gran aumento escogidos en las zonas con más positividad. En el resto de las tinciones se valoró positividad cuando más de un 10% de células expresaban el marcador, y negatividad en el caso contrario, cuando menos de un 10% expresaban el marcador.
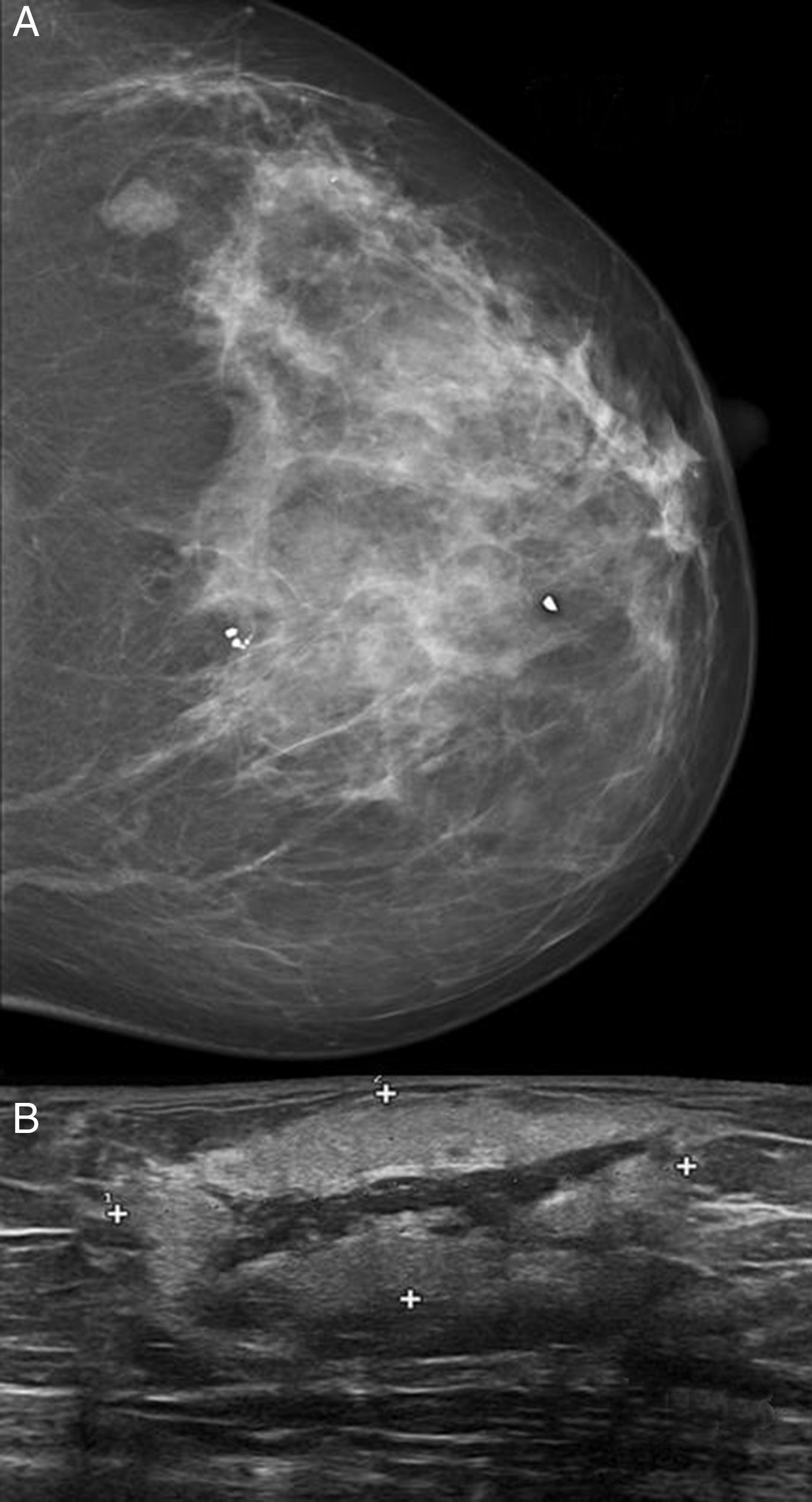
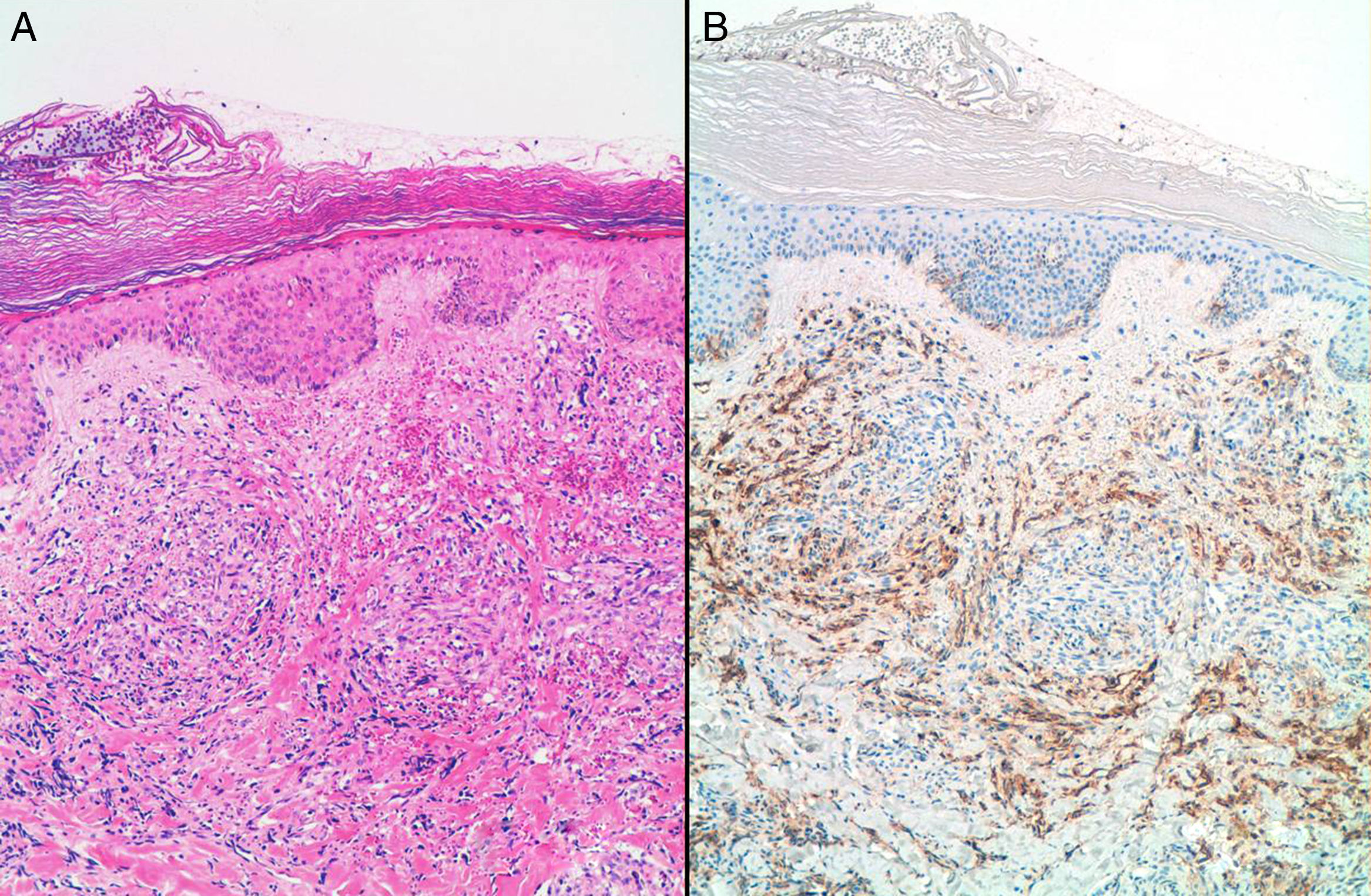
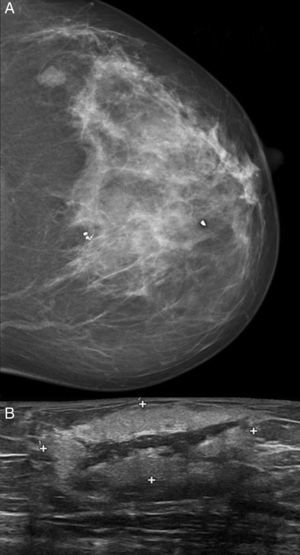
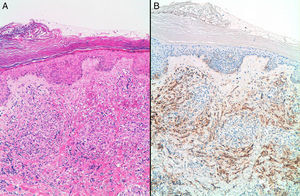
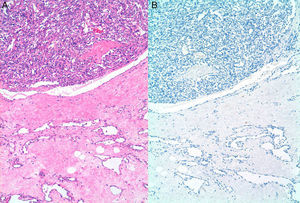
ResultadosSe incluyeron 8 mujeres, 4 con ASP y 4 con ASS (tabla 1). Las 4 pacientes con ASS habían recibido tratamiento conservador por carcinoma ductal invasivo de mama con tumorectomía y radioterapia adyuvante de 50Gy sobre la glándula mamaria a un fraccionamiento de 2Gy por fracción, y una sobreimpresión 10-20Gy sobre el lecho tumoral. El intervalo medio posradioterapia en los ASS fue de 118 meses (9,8 años) (rango 62-198 meses). La edad media fue de 70,5 años (rango 48-87). Para los ASP la edad media era de 66,2 años (rango 48-87 años), mientras que en los ASS fue de 74,7 años (rango 71-77). Tres lesiones afectaban exclusivamente piel (3 ASS). Otras fueron exclusivamente intraparenquimatosas (3 ASP), siendo uno de los tumores bifocal, y 2 fueron mixtas (un ASP y un ASS). En la ecografía y la mamografía, los AS cutáneos mostraban engrosamiento dérmico sin evidencia de lesiones parenquimatosas. Las lesiones parenquimatosas presentaban criterios radiológicos inespecíficos. Los hallazgos mamográficos más frecuentes fueron la presencia de una masa de contornos mal definidos, o bien una densidad focal asimétrica. Ecográficamente estos hallazgos se correlacionan con masas predominantemente heterogéneas, de contornos mal definidos, con áreas hiperecoicas en su interior, destacando una importante vascularización en el estudio doppler (fig. 1). Se realizó punch cutáneo en 2 casos y biopsia con aguja gruesa en 3. En una paciente se realizó biopsia excisional. En 2 casos no se tiene conocimiento de biopsia previa en nuestro centro. En 4 pacientes se realizó el diagnóstico de AS y en 2 el informe patológico fue de lesión vascular atípica. En 6 casos se realizó mastectomía, y en 2, tumorectomía. Macroscópicamente se observaron lesiones violáceas mal delimitadas afectando piel y/o parénquima (fig. 2). Los tamaños de los tumores estaban comprendidos entre 1 y 12cm. El grado histológico fue 1 en 2 casos, 2 casos fueron clasificados como grado 2, y 4 casos, como grado 3. En una paciente que recibió quimioterapia inicial por comenzar con enfermedad metastásica, el grado histológico se valoró solo en la biopsia, ya que en la pieza quirúrgica la lesión había prácticamente remitido. Todos los casos expresaron marcadores vasculares CD31+/CD34+, y fueron negativos para CKAE1/AE3. Adicionalmente, los 4 ASS expresaron el marcador linfático D2-40 (fig. 3), mientras que los ASP eran negativos para D2-40 (fig. 4). Las pacientes fueron seguidas durante un periodo medio de 48,6 meses (rango 7-115). Cuatro estaban libres de enfermedad (3 ASP y un ASS), una presentaba metástasis óseas probablemente por el carcinoma mamario, y otra presentaba metástasis viscerales. Dos pacientes fallecieron, por recidiva y metástasis.
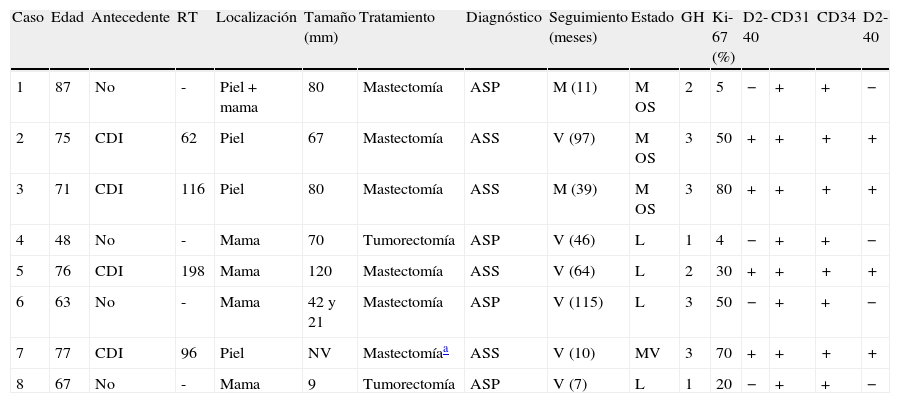
Angiosarcomas primarios y secundarios. Datos clínicos y patológicos
| Caso | Edad | Antecedente | RT | Localización | Tamaño (mm) | Tratamiento | Diagnóstico | Seguimiento (meses) | Estado | GH | Ki-67 (%) | D2-40 | CD31 | CD34 | D2-40 |
| 1 | 87 | No | - | Piel+mama | 80 | Mastectomía | ASP | M (11) | M OS | 2 | 5 | − | + | + | − |
| 2 | 75 | CDI | 62 | Piel | 67 | Mastectomía | ASS | V (97) | M OS | 3 | 50 | + | + | + | + |
| 3 | 71 | CDI | 116 | Piel | 80 | Mastectomía | ASS | M (39) | M OS | 3 | 80 | + | + | + | + |
| 4 | 48 | No | - | Mama | 70 | Tumorectomía | ASP | V (46) | L | 1 | 4 | − | + | + | − |
| 5 | 76 | CDI | 198 | Mama | 120 | Mastectomía | ASS | V (64) | L | 2 | 30 | + | + | + | + |
| 6 | 63 | No | - | Mama | 42 y 21 | Mastectomía | ASP | V (115) | L | 3 | 50 | − | + | + | − |
| 7 | 77 | CDI | 96 | Piel | NV | Mastectomíaa | ASS | V (10) | MV | 3 | 70 | + | + | + | + |
| 8 | 67 | No | - | Mama | 9 | Tumorectomía | ASP | V (7) | L | 1 | 20 | − | + | + | − |
ASP: angiosarcoma primario; ASS: angiosarcoma secundario; CDI: carcinoma ductal invasivo; GH: grado histológico; L: libre de enfermedad; M: muerta; M OS: metástasis óseas; MV: metástasis viscerales; NV: no valorable; RT: intervalo en meses entre radioterapia y aparición del tumor; V: viva.
Los resultados de este estudio demuestran que los ASP y los ASS son tumores biológicamente distintos. Los ASS probablemente tienen un origen linfático, y ello viene corroborado por la expresión de D2-40 en todos los casos de nuestra serie, mientras que los ASP son negativos para este marcador.
Morfológicamente los ASP y los ASS son muy similares, pero existen pocos estudios inmunohistoquímicos comparativos entre las 2 entidades. Recientemente se han desarrollado una variedad de anticuerpos relacionados con el origen linfático, como la podoplanina, identificada con el anticuerpo D2-40, VEGFR3 y Prox-1. Estos marcadores se encuentran en tejidos linfáticos maduros, mientras que los vasos sanguíneos no expresan ninguno de estos antígenos11. Estos marcadores se expresan frecuentemente en AS, incluyendo el sarcoma de Kaposi11,13,14, pero no en hemangiomas.
Al-Salam et al.15 observaron que los ASP no expresaban D2-40, y plantearon que estos tumores se originan a partir de las células endoteliales de los vasos sanguíneos y no de células endoteliales linfáticas. Otros han observado que la expresión de VEGFR está relacionada con tumores de grado intermedio y alto16. En un estudio inmunohistoquímico de 49 AS de tejidos blandos, más de la mitad de los tumores eran positivos para los 3 marcadores linfáticos11. Existen pocos estudios sobre la expresividad de estos marcadores en AS, aunque algunos de ellos plantean que ciertos AS podrían tener diferenciación linfática13,17,18. Se ha observado inmunopositividad en relación con la histología de patrón «en tachuela» o con patrón papilar y presencia de agregados linfocitarios, pero ninguno de estos estudios ha relacionado la expresión de D2-40 con tumores radioinducidos.
Aunque la serie es limitada a 8 casos y solo hemos utilizado un marcador linfático, en el presente estudio observamos claras diferencias entres los ASP y los ASS en lo que se refiere a la expresión del antígeno D2-40, lo cual evidencia que los ASS tienen un origen linfático, mientras que los ASP tendrían un origen endotelial vascular. Sería de interés poder tanto ampliar la serie como incorporar nuevos marcadores diferenciales entre las 2 entidades, de cara a posibles dianas terapéuticas. Hoy en día prácticamente nunca se realiza la distinción entre linfangiosarcoma y hemangiosarcoma19, ya que generalmente es muy difícil determinar qué tumores tienen un origen linfático o vascular.
Todas las pacientes con ASS habían recibido tratamiento previo con radioterapia, y diversos estudios han demostrado que posteriormente a la cirugía y radioterapia de la piel afecta existe un incremento de linfangiogénesis durante el primer año, con un incremento de vasos linfáticos podoplanina positivos. La radioterapia es un factor de riesgo independiente. Se ha descrito un incremento en el riesgo de desarrollar sarcomas de tejidos blandos, especialmente AS, después de radioterapia adyuvante. El pico de incidencia ocurre entre los 5 y 10 años después del tratamiento. Aunque los sarcomas secundarios son infrecuentes, un 40% de todos los sarcomas inducidos por radioterapia se desarrollan después de radiación por cáncer de mama, y la mayoría son AS20. La incidencia de cáncer de mama ha aumentado los últimos años. Actualmente, afecta aproximadamente a una de cada 10 mujeres en el mundo occidental. De acuerdo con ello, se han reportado más ASS, con una incidencia acumulativa de 0,9 por 1.000 carcinomas de mama en los últimos 15 años21. Los ASS posradioterapia se han observado después de un periodo medio de latencia de entre 3 y 12 años1,8,22. En nuestra serie, el periodo medio de latencia fue de 9,8 años.
El ASS es un tumor potencialmente agresivo asociado con un riesgo significativo de morbimortalidad. Los ASS posradioterapia pueden afectar la piel o la pared torácica, o también afectar tejido mamario residual, aunque la mayoría de los tumores son cutáneos, mientras que los ASP afectan más frecuentemente el parénquima mamario6,17,20. Estos hallazgos se corroboran también en nuestra serie.
La edad de presentación también varía entre los ASP y los ASS4,5, y ello también se observa en el presente estudio, en el cual las pacientes con ASP eran más jóvenes que las de los ASS.
El tratamiento de elección del AS es la resección completa con márgenes amplios. Es frecuente observar afectación de los márgenes debido al patrón de crecimiento invasivo y la naturaleza a menudo multifocal de estos tumores, lo cual les confiere un peor pronóstico. Debido al riesgo de recurrencia local, se recomienda también realizar radioterapia adyuvante y quimioterapia por el riesgo de diseminación hematógena, pero su efectividad no está del todo demostrada9. Una de nuestras pacientes recibió quimioterapia previa a la cirugía por comenzar con enfermedad metastásica, y mostró buena respuesta clinicopatológica. Las terapias biológicas, especialmente las antiangiogénicas a través del VEGFR, pueden suponer un tratamiento específico, pero se ha observado que en muchos de los pacientes no son efectivas23–25. Son necesarios estudios prospectivos que permitan incorporar posibles terapias diana y establecer una estrategia terapéutica para estos tumores.
La mayoría de las series reportan una supervivencia global de 18-36 meses, aunque algunas han informado supervivencias superiores a 3 años4. Algunos autores reportan mejor pronóstico para los ASS8. En nuestra serie observamos que 3 pacientes con ASP han sobrevivido libres de enfermedad por un periodo de hasta 115 meses.
El diagnóstico diferencial de los AS, especialmente en casos de AS epitelioide de alto grado en biopsias dirigidas, incluye carcinoma de alto grado y otros sarcomas1. Las tinciones inmunohistoquímicas para marcadores epiteliales (citoqueratina), endoteliales (CD34 y CD31) y otros marcadores de sarcoma ayudan a realizar el diagnóstico correcto. En los AS de bajo grado el diagnóstico diferencial se plantea con lesiones vasculares benignas o atípicas1. Una complicación descrita de la radioterapia es el desarrollo de lesiones vasculares que afectan a la piel. La incidencia exacta de estas lesiones no se conoce con exactitud, pero se ha observado un incremento en los últimos años13. Estudios previos han demostrado que la mayoría de las lesiones vasculares atípicas tienen un curso benigno y no progresan a AS26, por lo cual se han propuesto alternativas de nomenclatura para estas lesiones para reemplazar el término atípico y que reflejen su origen linfático, como linfangioma progresivo adquirido o linfangioma circunscrito. En estos casos el diagnóstico puede ser muy difícil, no pudiéndose realizar hasta que se puede estudiar el tumor en su totalidad. De hecho, en 2 casos de nuestra serie, la biopsia no fue concluyente y el diagnóstico se realizó en la pieza quirúrgica. Los tumores de bajo grado contienen canales vasculares abiertos anastomosados que suelen proliferar en la dermis, el tejido celular subcutáneo o en el parénquima mamario, que disecan el estroma causando distorsión, pero no destrucción, de los lóbulos y ductos mamarios. Están revestidos por una capa única de células endoteliales aplanadas de núcleos hipercromáticos, a veces con pequeño nucléolo. En este subtipo de tumores no se observan áreas sólidas o fusiformes, lagos hemorrágicos ni focos de necrosis. La diferenciación entre lesiones vasculares atípicas posradioterapia y el AS de bajo grado es compleja, ya que ambos forman parte de un espectro morfológico de lesiones vasculares asociadas a la radioterapia y ambos expresan el marcador linfático D2-40. En general, las lesiones vasculares atípicas son muy pequeñas, bien delimitadas, circunscritas a la piel. Recientemente se han observado amplificaciones genéticas del C-MYC, especialmente en los ASS27, aunque existen pocos estudios al respecto con los ASP28,29. Las lesiones vasculares atípicas no presentan estas alteraciones20,27,30. Sería interesante estudiar si existen diferencias respecto a las alteraciones de MYC en los subtipos de AS de mama.
En conclusión, los ASS expresan D2-40, mientras que los ASP son negativos para este marcador linfático, lo cual apoya que los ASS tienen un origen vascular linfático.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
AutoríaLos autores del Servicio de Anatomía Patológica han colaborado en el estudio de las muestras y elaboración del manuscrito. Los autores de los servicios de Radiología, Oncología, Cirugía Plástica y Oncorradioterapia han colaborado en el diagnóstico, tratamiento y seguimiento de todas las pacientes y en la revisión final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las Srtas. Carolina García Calero y Mónica Guerrero Campos, por su colaboración en la realización de los estudios inmunohistoquímicos.