El cáncer de mama es una enfermedad muy heterogénea a nivel clínico, morfológico y biológico, que se clasifica en diferentes subgrupos. El tipo «triple negativo» representa el 10-20% de todos los cánceres de mama, frecuentemente muestra expresión de marcadores basales, afecta a mujeres jóvenes y tiene mal pronóstico, sin una terapia dirigida.
Material y métodoEstudio retrospectivo de análisis de tres alteraciones moleculares (mutación de EGFR y PIK3CA e hipermetilación del promotor del gen BRCA1), mediante la técnica de pirosecuenciación, en 60 casos de cáncer de mama «triple negativo».
ResultadosUn 28,33% de las pacientes fueron diagnosticadas con 50 o menos años, y el 16,67% progresaron por diseminación vía hematógena con metástasis viscerales y murieron (menos una) en un intervalo de entre 1-5 años desde el diagnóstico. En 5 de los 16 casos estudiados se encontró una mutación patogénica de BRCA. Inmunohistoquímicamente la mayoría eran tumores con alto índice proliferativo de Ki67 y un 73,33% eran «basal-like» por expresión de CK5/6 y/o EGFR. A nivel molecular, no se encontraron mutaciones activadoras de EGFR, aunque el 53,33% de los casos mostraron sobreexpresión inmunohistoquímica de EGFR. La mutación de PIK3CA se detectó en un 10% de casos, con predominio en exón20 y con coexpresión de receptores de andrógenos en la mitad de los casos. La hipermetilación de la región promotora del gen BRCA1 estaba presente en un 25% de los casos, coexistiendo en un caso con hipermetilación del estroma no tumoral y en dos con mutación patogénica del gen BRCA1.
ConclusionesEl hallazgo de alguna alteración molecular específica, aunque sea infrecuente, puede plantear una posible diana terapéutica dirigida.
Breast cancer is a clinically, morphologically and biologically heterogeneous disease. It is classified in distinct subtypes. Triple-negative breast cancers represent approximately 10-20% of all breast cancers and often express basal markers. This type preferentially affects young women and has no specific therapy.
Material and methodWe conducted a retrospective study of three molecular alterations (the EGFR and PIK3CA mutations and BRCA1 promoter hypermethylation) by pyrosequencing in a series of 60 patients with a diagnosis of triple-negative breast cancer.
ResultsA total of 28.33% of patients were diagnosed at age 50 years or younger. Only 16.67% of patients had clinical progression due to haematological dissemination with visceral metastasis and all of them, except one, died from breast cancer between 1 and 5 years after diagnosis. The BRCA1 mutation was studied in 16 patients and a known pathogenic mutation was found in 5. Immunohistochemical study showed a high Ki67 proliferative index and 73.33% of carcinomas were basal-like due to CK5/6 and/or EGFR expression. Although we found no EGFR-activating mutations, EGFR overexpression was present in 53.33% of patients. The PIK3CA mutation was identified in 10% of patients, predominantly in exon 20 and with androgen receptor expression in half of these patients. BRCA1 promoter hypermethylation was observed in 25% of the patients. Only one of these patients exhibited BRCA1 hypermethylation of non-tumoural stroma and two showed a pathogenic mutation of the BRCA1 gene.
ConclusionThe finding of specific molecular alterations, although infrequent, could suggest a possible directed therapeutic target.
El cáncer de mama es la neoplasia más frecuente en el sexo femenino. En 2012 en España representó el 28,99% de todos los cánceres diagnosticados, y la primera causa de muerte en mujeres adultas1.
El cáncer de mama es una enfermedad muy heterogénea tanto a nivel histológico, molecular/genético, como clínico, con respuesta variable a los diferentes tratamientos. Si bien los patólogos han intentado desarrollar sistemas de clasificación relacionados con el pronóstico, y mayoritariamente basados en el exhaustivo estudio histológico del tumor, siguen existiendo limitaciones debido a la situación clínica y al comportamiento intrínseco de cada tumor.
Aunque los estudios moleculares han permitido ampliar el conocimiento de las lesiones precursoras y han facilitado pruebas para dividir los tumores en diferentes grupos según su pronóstico, en la práctica clínica diaria los valores pronósticos y predictivos utilizados siguen siendo el estudio anatomopatológico y los resultados inmunohistoquímicos, que permiten la aproximación a la subdivisión intrínseca genética de los tumores, definida en el Consenso Internacional de Expertos de St. Gallen2,3.
El cáncer de mama triple negativo (TNBC) representa el 10-20% de los cánceres de mama, y se define por la ausencia de expresión de receptores hormonales de estrógenos y progesterona, así como por la ausencia de sobreexpresión de Her2. A menudo, muestran expresión intrínseca y/o inmunohistoquímica de marcadores basales, así como un alto grado histológico. Además, la mayoría son carcinomas ductales infiltrantes de tipo no específico con cierto predominio de tipos especiales y tienen mal pronóstico.
Su gran heterogeneidad intrínseca ha sugerido diferentes intentos de subclasificación para discriminar su comportamiento clínico. Uno de los primeros intentos fue descrito por Perou en 20004, quien señaló que, aunque un 70-80% de los TNBC eran «basal-like», había un 20-30% de TNBC que eran de tipo no basal (Luminal y Her2). Cabe destacar la subclasificación descrita por Lehmann en 20115 quien los dividía en 6 subtipos (basal-like 1, basal-like 2, inmunomoduladores, mesenquimales, mesenquimales «stem-like» y luminal receptores de andrógenos).
Como las subclasificaciones del TNBC no llegan a ningún consenso, hemos estudiado posibles biomarcadores, que, aunque no sean exclusivos, su presencia no es despreciable y pueden sugerir posibles dianas terapéuticas (EGFR, PIK3CA y metilación del promotor del BRCA1).
Material y métodosSe trata de un estudio observacional, descriptivo y retrospectivo, que incluye 60 casos (bloques de parafina) de TNBC, diagnosticados entre 2006 y 2011 en el servicio de Anatomía Patológica de un Hospital Universitario. El estudio consta de cuatro partes: 1) recopilación de datos clínicos; 2) revisión de las características histológicas; 3) revisión y realización de estudios inmunohistoquímicos, y 4) realización de pruebas moleculares.
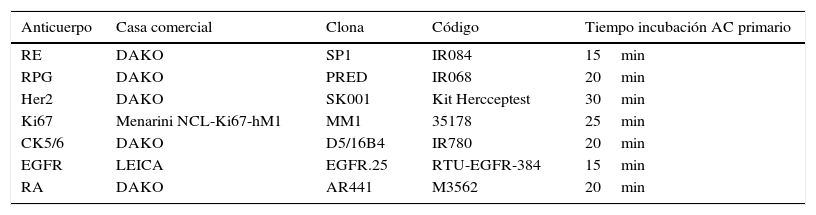
Los estudios inmunohistoquímicos de receptores de estrógenos, receptores de progesterona, Her2, índice proliferativo de Ki67, citoqueratina 5/6, EGFR y receptores de andrógenos se determinaron mediante el equipo Autostainer de DAKO (Dakocytomation Autostainer Labelling) (tabla 1).
Descripción de las características de los anticuerpos utilizados para el estudio inmuohistoquímico
| Anticuerpo | Casa comercial | Clona | Código | Tiempo incubación AC primario |
|---|---|---|---|---|
| RE | DAKO | SP1 | IR084 | 15min |
| RPG | DAKO | PRED | IR068 | 20min |
| Her2 | DAKO | SK001 | Kit Hercceptest | 30min |
| Ki67 | Menarini NCL-Ki67-hM1 | MM1 | 35178 | 25min |
| CK5/6 | DAKO | D5/16B4 | IR780 | 20min |
| EGFR | LEICA | EGFR.25 | RTU-EGFR-384 | 15min |
| RA | DAKO | AR441 | M3562 | 20min |
La valoración de los resultados inmunohistoquímicos utilizada ha sido para cada anticuerpo y con relación al porcentaje de células neoplásicas que los expresan de:
- •
Receptores hormonales de estrógenos y progesterona negativos: expresión nuclear menor o igual al 1% de las células neoplásicas.
- •
Her2/neu negativo (score 0 y 1+): ausencia o tinción de membrana débil e incompleta en menos de un 10% de las células neoplásicas.
- •
Índice proliferativo de Ki67 alto: mayor o igual al 14% de las células neoplásicas.
- •
CK5/6 positiva: positividad citoplasmática en >5% de las células neoplásicas.
- •
EGFR positivo: positividad citoplasmática >1% de las células neoplásicas.
- •
Receptores de andrógenos positivos: positividad nuclear >30% de células neoplásicas.
Los estudios moleculares realizados son las mutaciones de las regiones «hotspot» del gen EGFR (mutaciones puntuales en exones 18, 20 y 21; y deleciones y deleciones-inserciones en exón19), las mutaciones de las regiones «hotspot» del gen PIK3CA (exones 9 y 20) y la hipermetilación de la región promotora del gen BRCA1, mediante la técnica de pirosecuenciación. Esta consiste en un estudio cuantitativo de secuenciación de ADN a tiempo real, basada en la síntesis de la cadena de ADN acoplada a una reacción quimioluminiscente, indicando el resultado en porcentaje de mutación presente en las muestras. Las ventajas de esta técnica son la mejora de la sensibilidad versus la secuenciación de Sanger y la posibilidad del análisis de múltiples variantes, no solo de mutaciones puntuales como con el estudio de PCR específica de alelos.
Para realizar estos estudios moleculares se ha extraído el ADN de las muestras que estaban fijadas en formol e incluidas en parafina, utilizando el «kit» QIAamp DNA FFPE Tissue Kit, una PCR y la técnica de pirosecuenciación Therascreen KRAS/EGFR/BRAF Pyro Kit adaptada al laboratorio, junto con la máquina PyroMark Q24 y los Pyromark PCR kits.
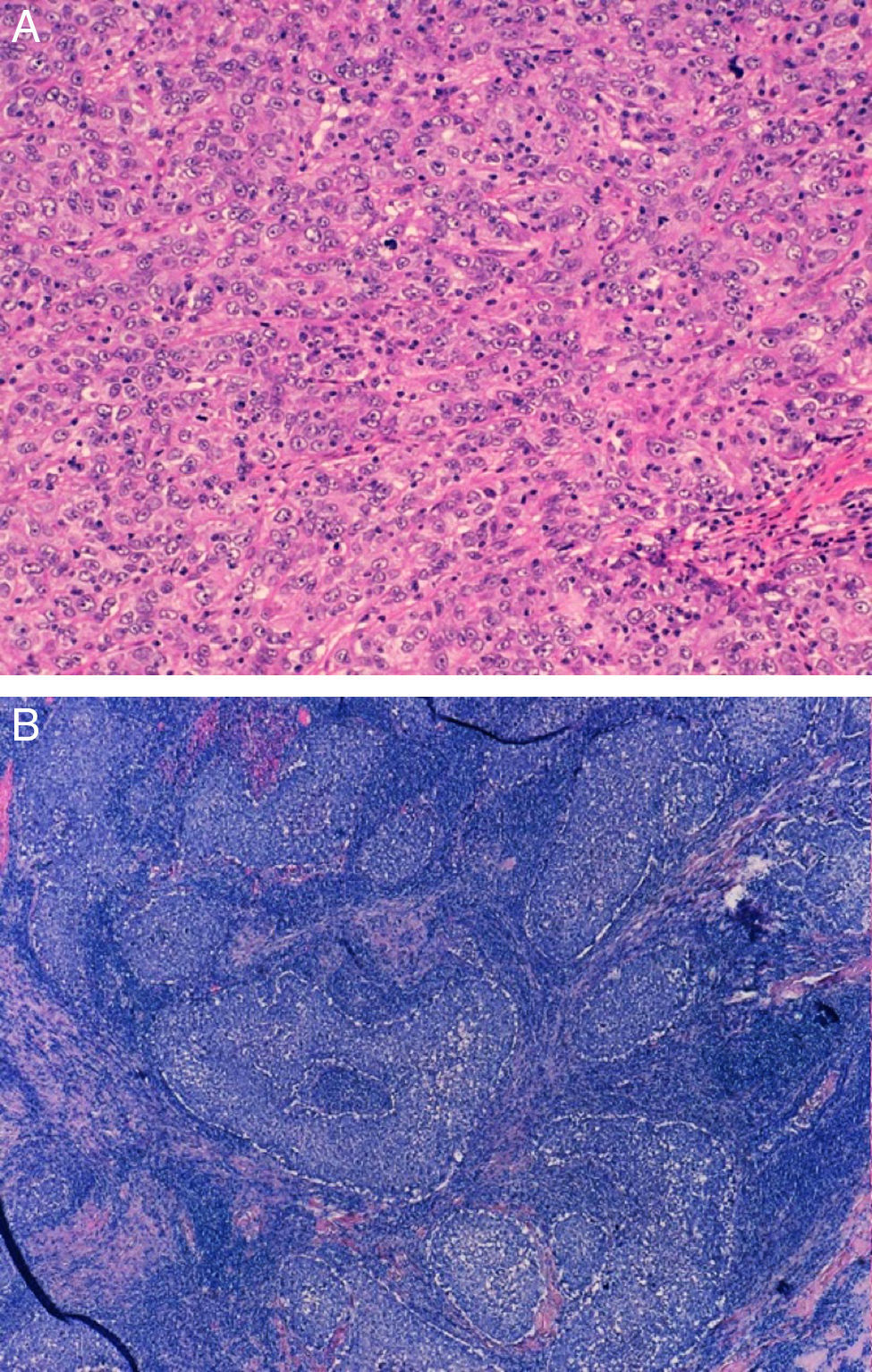
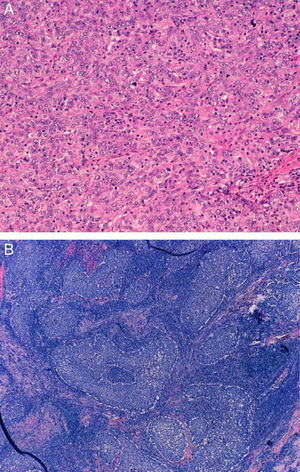
ResultadosEn nuestra cohorte de pacientes con TNBC el 28,33% tenían una edad menor o igual a 50 años en el momento del diagnóstico, y de estas solo el 10% eran menores de 40 años. Casi la mitad de las pacientes fueron intervenidas mediante cirugía y ganglio centinela, siendo el 75% de todos los estudios axilares negativos. La mayoría eran carcinomas ductales infiltrantes de tipo no específico, seguidos de carcinomas medulares en el 20% (fig. 1), y la mayoría con alto grado histológico (85%). Aproximadamente la mitad de los casos mostraron algún grado de necrosis.
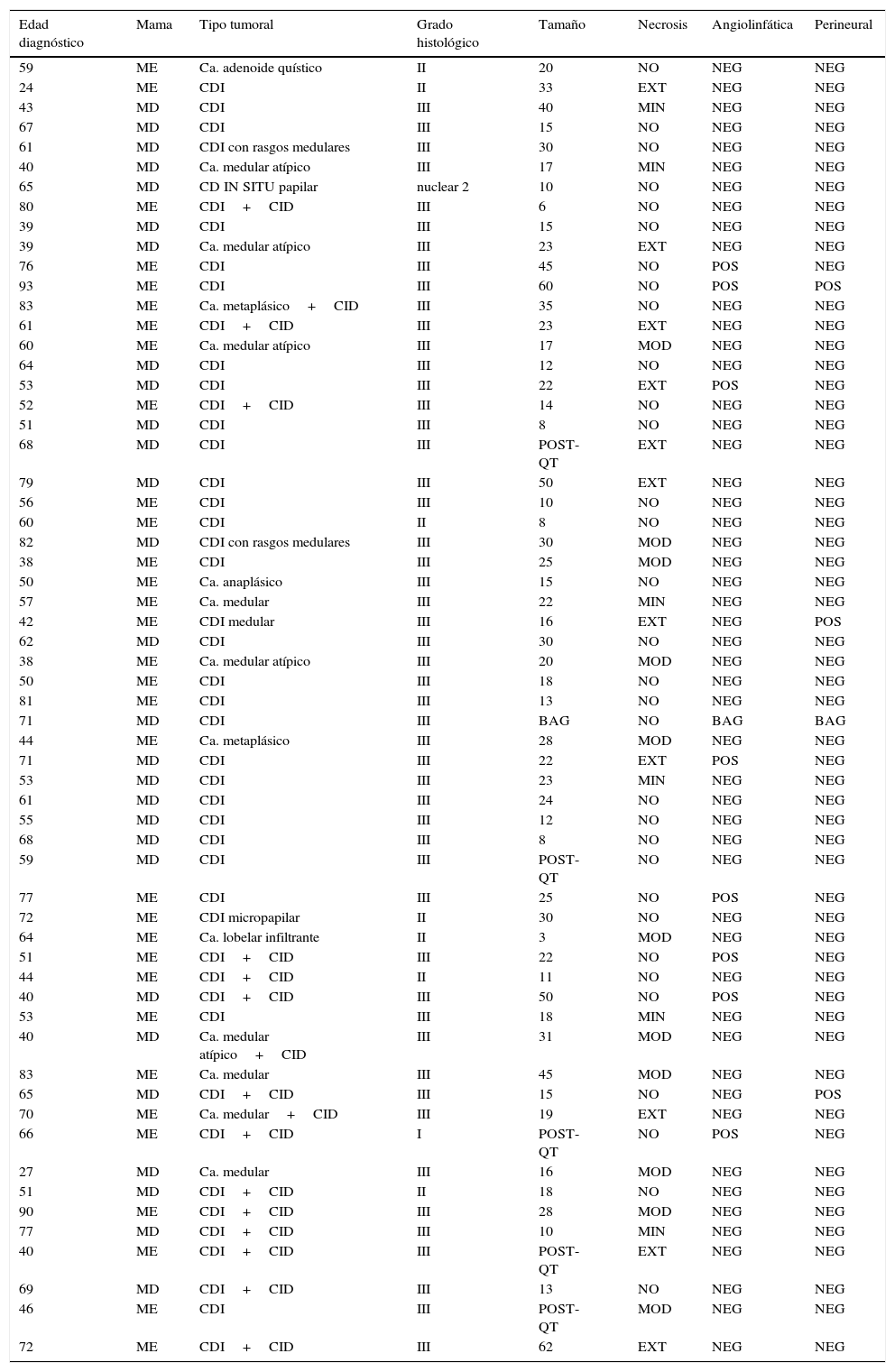
La medida tumoral media fue de 22,68mm, oscilando entre 3 y 62mm; de estos, un 51,85% eran menores o iguales a 20mm y un 48,15% eran mayores de 20mm (tabla 2).
Resultados histológicos desglosados de todos los casos de la serie (N=60)
| Edad diagnóstico | Mama | Tipo tumoral | Grado histológico | Tamaño | Necrosis | Angiolinfática | Perineural |
|---|---|---|---|---|---|---|---|
| 59 | ME | Ca. adenoide quístico | II | 20 | NO | NEG | NEG |
| 24 | ME | CDI | II | 33 | EXT | NEG | NEG |
| 43 | MD | CDI | III | 40 | MIN | NEG | NEG |
| 67 | MD | CDI | III | 15 | NO | NEG | NEG |
| 61 | MD | CDI con rasgos medulares | III | 30 | NO | NEG | NEG |
| 40 | MD | Ca. medular atípico | III | 17 | MIN | NEG | NEG |
| 65 | MD | CD IN SITU papilar | nuclear 2 | 10 | NO | NEG | NEG |
| 80 | ME | CDI+CID | III | 6 | NO | NEG | NEG |
| 39 | MD | CDI | III | 15 | NO | NEG | NEG |
| 39 | MD | Ca. medular atípico | III | 23 | EXT | NEG | NEG |
| 76 | ME | CDI | III | 45 | NO | POS | NEG |
| 93 | ME | CDI | III | 60 | NO | POS | POS |
| 83 | ME | Ca. metaplásico+CID | III | 35 | NO | NEG | NEG |
| 61 | ME | CDI+CID | III | 23 | EXT | NEG | NEG |
| 60 | ME | Ca. medular atípico | III | 17 | MOD | NEG | NEG |
| 64 | MD | CDI | III | 12 | NO | NEG | NEG |
| 53 | MD | CDI | III | 22 | EXT | POS | NEG |
| 52 | ME | CDI+CID | III | 14 | NO | NEG | NEG |
| 51 | MD | CDI | III | 8 | NO | NEG | NEG |
| 68 | MD | CDI | III | POST-QT | EXT | NEG | NEG |
| 79 | MD | CDI | III | 50 | EXT | NEG | NEG |
| 56 | ME | CDI | III | 10 | NO | NEG | NEG |
| 60 | ME | CDI | II | 8 | NO | NEG | NEG |
| 82 | MD | CDI con rasgos medulares | III | 30 | MOD | NEG | NEG |
| 38 | ME | CDI | III | 25 | MOD | NEG | NEG |
| 50 | ME | Ca. anaplásico | III | 15 | NO | NEG | NEG |
| 57 | ME | Ca. medular | III | 22 | MIN | NEG | NEG |
| 42 | ME | CDI medular | III | 16 | EXT | NEG | POS |
| 62 | MD | CDI | III | 30 | NO | NEG | NEG |
| 38 | ME | Ca. medular atípico | III | 20 | MOD | NEG | NEG |
| 50 | ME | CDI | III | 18 | NO | NEG | NEG |
| 81 | ME | CDI | III | 13 | NO | NEG | NEG |
| 71 | MD | CDI | III | BAG | NO | BAG | BAG |
| 44 | ME | Ca. metaplásico | III | 28 | MOD | NEG | NEG |
| 71 | MD | CDI | III | 22 | EXT | POS | NEG |
| 53 | MD | CDI | III | 23 | MIN | NEG | NEG |
| 61 | MD | CDI | III | 24 | NO | NEG | NEG |
| 55 | MD | CDI | III | 12 | NO | NEG | NEG |
| 68 | MD | CDI | III | 8 | NO | NEG | NEG |
| 59 | MD | CDI | III | POST-QT | NO | NEG | NEG |
| 77 | ME | CDI | III | 25 | NO | POS | NEG |
| 72 | ME | CDI micropapilar | II | 30 | NO | NEG | NEG |
| 64 | ME | Ca. lobelar infiltrante | II | 3 | MOD | NEG | NEG |
| 51 | ME | CDI+CID | III | 22 | NO | POS | NEG |
| 44 | ME | CDI+CID | II | 11 | NO | NEG | NEG |
| 40 | MD | CDI+CID | III | 50 | NO | POS | NEG |
| 53 | ME | CDI | III | 18 | MIN | NEG | NEG |
| 40 | MD | Ca. medular atípico+CID | III | 31 | MOD | NEG | NEG |
| 83 | ME | Ca. medular | III | 45 | MOD | NEG | NEG |
| 65 | MD | CDI+CID | III | 15 | NO | NEG | POS |
| 70 | ME | Ca. medular+CID | III | 19 | EXT | NEG | NEG |
| 66 | ME | CDI+CID | I | POST-QT | NO | POS | NEG |
| 27 | MD | Ca. medular | III | 16 | MOD | NEG | NEG |
| 51 | MD | CDI+CID | II | 18 | NO | NEG | NEG |
| 90 | ME | CDI+CID | III | 28 | MOD | NEG | NEG |
| 77 | MD | CDI+CID | III | 10 | MIN | NEG | NEG |
| 40 | ME | CDI+CID | III | POST-QT | EXT | NEG | NEG |
| 69 | MD | CDI+CID | III | 13 | NO | NEG | NEG |
| 46 | ME | CDI | III | POST-QT | MOD | NEG | NEG |
| 72 | ME | CDI+CID | III | 62 | EXT | NEG | NEG |
Ca.: carcinoma; CDI: carcinoma ductal infiltrante; CID: carcinoma intraductal; EXT: extensa; MD: mama derecha; MI: mama izquierda; MIN: mínima; MOD: moderada; NEG: negativo; POS: positivo; POST-QT: posquimioterapia.
Solamente el 16,67% de los casos progresaron y todos, menos uno, murieron en un intervalo de entre 1-5 años desde el momento del diagnóstico, siendo la forma de diseminación más frecuente la vía hematógena con metástasis viscerales, principalmente en pulmón y cerebro (15,79%).
Se conoce la realización del estudio genético de mutaciones del gen BRCA en 16 de las 60 pacientes de la cohorte, entre las cuales en solo 5 casos se encontró una mutación patogénica de gen BRCA.
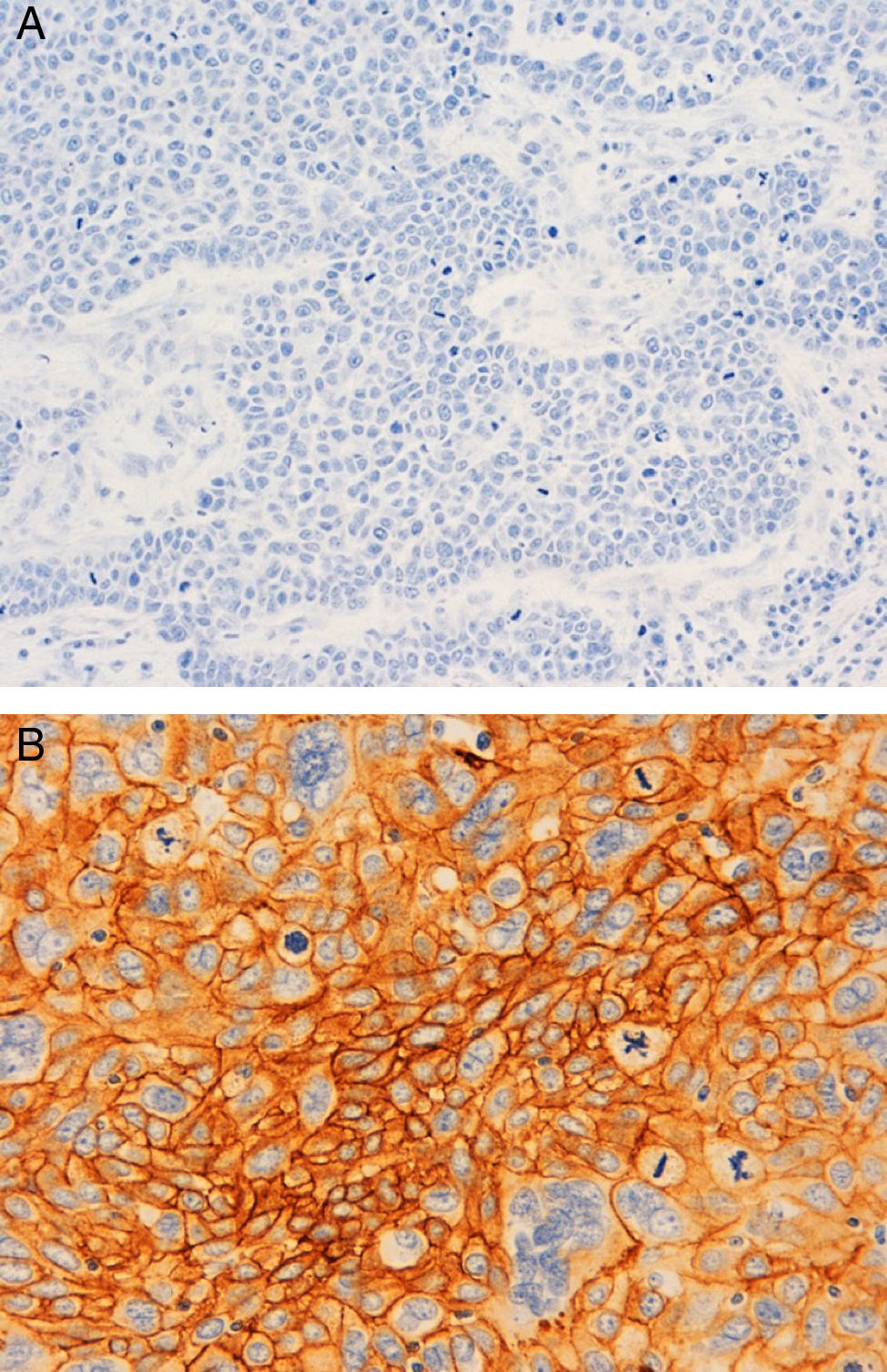
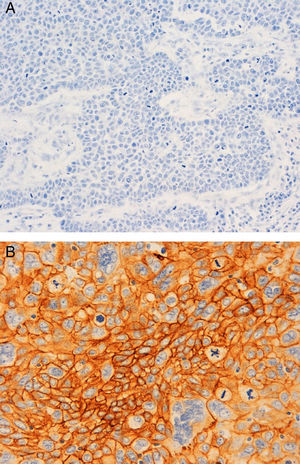
A nivel inmunohistoquímico, el 83% eran tumores con alto índice proliferativo de Ki67. Un 73,33% eran de tipo basal-like por la expresión de CK5/6 (55%) y/o EGFR (53,33%) (fig. 2), y coexpresión de los dos en un 35%. Solo el 11,67% mostró expresión de receptores de andrógenos.
A nivel molecular, no se han observado mutaciones activadoras de EGFR en las regiones «hotspot» estudiadas de los exones 18, 19, 20 y 21, a pesar de que el 53,33% de los casos muestran sobreexpresión inmunohistoquímica de EGFR.
En un 10% (6/60) de los casos se ha observado mutación de PIK3CA en alguna de las tres regiones «hotspot» estudiadas, con predominio (66,67%) en el dominio cinasa del exón20 (H1047) versus el dominio hélix del exón9 (E545 y E542). A la vez, tres de estos casos mostraron coexpresión de receptores de andrógenos, entre los 7 casos de la cohorte que los expresaban.
Se encontró hipermetilación del promotor del gen BRCA1 en un 21,67% (13/60) de los casos, con un grado medio de hipermetilación del 38,67%, oscilando entre el 58,11 y el 20,67%. Solo en uno de los 11 casos estudiados coexistía con la presencia de hipermetilación del estroma no tumoral. La coexistencia de hipermetilación del tumor y mutación en línea germinal de BRCA1 se encontró en dos casos, siendo estas mutaciones de tipo «nonsense» y de VSI (variante de significado incierto).
El 90% de los casos con mala evolución clínica mostraban positividad para uno o los dos marcadores inmunohistoquímicos basales, y solo en dos de estos casos se estudió la posible presencia de mutación germinal del gen BRCA, encontrándose mutación en uno de ellos.
En nuestra serie de TNBC, la mayoría de tumores mostraron un nivel elevado de índice proliferativo de Ki67(p=0,6), receptores de andrógenos negativos (p=0,6), pocas metilaciones de BRCA (p=0,3) y pocas mutaciones en PIK3CA (p=0,9). No obstante, ninguno de estos factores, así como tampoco la positividad para CK5/6 (p=0,4) ni EGFR (p=0,1), mostró relación estadísticamente significativa con la supervivencia.
Entre los pocos casos con estudio y presencia de mutación patogénica conocida del gen BRCA, el 80% expresaban uno o los dos marcadores inmunohistoquímicos basales estudiados. Cabe destacar que el único caso que no mostró su expresión era un caso con mutación patogénica del gen BRCA2.
DiscusiónEl TNBC afecta frecuentemente a mujeres jóvenes (51,8% en menores de 50 años)6, siendo este valor en nuestra cohorte menor del esperado (28,33%). Cuando el tratamiento elegido del cáncer de mama es quirúrgico, normalmente es conservador6, con estudio ganglionar con resultado predominantemente negativo7, siendo estos hallazgos reproducibles en nuestra cohorte.
El TNBC es un tumor de alto grado (con gran tamaño tumoral, mayor indiferenciación, alto índice proliferativo y frecuente necrosis), con predominio del carcinoma ductal infiltrante de tipo no específico, seguido de tipos especiales, como medular y metaplásico8-10, e infrecuentes imágenes de invasión angiolinfática y perineural. Todas estas características histológicas son reproducibles en nuestra cohorte. No obstante, existen discrepancias en la medida tumoral predominante8,11,12 y la necrosis, la cual es frecuente en aproximadamente la mitad de los casos6,7,12.
El TNBC tiene un mal pronóstico con un corto tiempo entre la recaída, metástasis viscerales y muerte, sobre todo en los primeros años de diagnóstico13. Estas características están presentes en nuestros casos de la cohorte con progresión tumoral; 9/10 casos con progresión han muerto en los primeros 5 años tras el diagnóstico con metástasis a distancia, sobretodo viscerales en pulmón y cerebro.
Aunque, actualmente, el único tratamiento para el TNBC es la quimioterapia sistémica, se ha observado una peor supervivencia en aquellos casos que después de neoadyuvancia queda enfermedad residual versus aquellos casos con respuesta patológica completa14. En nuestra serie, solo 5 casos han recibido quimioterapia previa con respuesta parcial (probablemente la baja tasa de incidencia de neoadyuvancia está influida por ser un estudio retrospectivo).
En relación con los estudios inmunohistoquímicos, el alto valor del índice proliferativo de Ki67 es muy útil como factor de mal pronóstico y en la toma de decisiones terapéuticas. Sin embargo, el hecho de que este índice esté sujeto a gran variabilidad intra e interobservador (es patólogo-dependiente) en los valores intermedios ha hecho que en los últimos consensos de cáncer de mama se recomiende ajustar su valor a cada laboratorio o incluso se desaconseja su uso como biomarcador15. En nuestra serie, se ha encontrado un alto índice proliferativo de Ki67 (mayor del 14% de las células neoplásicas) en la gran mayoría de los casos.
Existe un gran solapamiento entre los TNBC y basal-like desde el punto de vista clínico, morfológico e inmunohistoquímico. No obstante, su diferenciación es importante ya que en aquellos tumores triple negativos que expresan marcadores basales tienen una supervivencia libre de enfermedad sensiblemente más corta16. De ahí la pregunta de cuáles deben ser los marcadores inmunohistoquímicos (citoqueratinas basales, EGFR, vimentina o marcadores mioepiteliales, como actina de músculo liso y CD10, entre otros) utilizados para diferenciarlos.
Dada la gran diversidad en sus resultados, el poco conocimiento de su significado y la ausencia de acuerdo en su utilización y lindares de valoración cualitativos y cuantitativos, el término patológico definido inmunohistoquímicamente «fenotipo basal-like» no impacta en la decisión clínica terapéutica. En nuestra cohorte, casi tres cuartas partes de los casos muestran expresión de alguno de los dos marcadores inmunohistoquímicos basales utilizados, siendo estos valores aproximados a los descritos en varias series17,18. Ocho de las 9 pacientes muertas por cáncer de mama tenían expresión de alguno o de los dos marcadores basales, reflejando así el factor de mal pronóstico que tienen estos marcadores.
Se describe la expresión de receptores de andrógenos en un tercio de los TNBC, asociándose a una mejor supervivencia libre de enfermedad en estadios precoces, a pacientes con mutaciones BRCA1/2 y a mayor edad de diagnóstico8,19. En nuestra cohorte, la expresión de receptores de andrógenos es menor que la descrita en la literatura, siendo la edad media de diagnóstico de estas pacientes de 67 años y solamente en una de ellas se ha estudiado la posible presencia de mutación del gen BRCA1 siendo su resultado no informativo (ausencia de mutación patogénica conocida).
Una minoría de cánceres de mama se consideran hereditarios (5-10%) y de estos aproximadamente una cuarta parte son debidos a genes susceptibles de cáncer como son BRCA1/2, siendo estos pacientes posibles candidatos a beneficiarse de tratamientos con inhibidores de PARP y/o quimioterapias con platinos20. Tanto los cánceres triple negativos como con mutación en línea germinal BRCA1 son frecuentemente de tipo basal y se asocian a mal pronóstico (más del 15% de TNBC tienen mutación germinal del gen BRCA1)21. En nuestra cohorte, se observa expresión de marcadores basales en el 80% (4/5) de los casos de TNBC con mutación conocida en línea germinal del gen BRCA1.
La proteína EGFR se expresa entre un 30-52% de los TNBC, y puede ascender hasta un 60% en el tipo basal-like, asociándose a mal pronóstico22,23. No obstante, la respuesta a terapias anti-EGFR (como los inhibidores de la tirosina-cinasa) no depende de la expresión inmunohistoquímica sino de la presencia de mutación activadora y/o de la amplificación del gen. A pesar de que en nuestra cohorte el 53,33% de casos muestran expresión inmunohistoquímica de EGFR, en ningún caso se ha detectado mutación activadora de EGFR en los exones estudiados, siendo estos hallazgos equiparables a otros grupos europeos, caucásicos y japoneses publicados17,23-27, pero no con los resultados de un grupo de Singapur, que encuentra hasta un 11,4% de mutaciones potencialmente patogénicas25, planteando así si esta discrepancia en diferentes grupos podría ser debida a la influencia de factores genéticos y ambientales (sobre todo geográficos y étnicos), tal y como pasa en el cáncer de pulmón no célula pequeña.
La vía de señalización de PiK3/AKT es la vía más frecuentemente alterada en el cáncer de mama. Aunque la mutación de PIK3CA es más prevalente en el cáncer de mama receptores hormonales positivos (35%) y Her2 positivo (23%), en el triple negativo oscila entre un 5-13%19; siendo la segunda mutación más frecuentemente descrita en el TNBC, después de p53 (68%)28. El 80% de las mutaciones somáticas del gen PIK3CA suceden en tres «hotpsot», dos situados en los codones 542 y 545 del dominio hélice del exón9 y uno en el codón1047 del dominio cinasa del exón2029, con predomino en H1047R, siendo alrededor del 70, 90 y 40% en diferentes series17,19,28. Algunos autores comentan la posible relación con mejor pronóstico y supervivencia, otros no ven efectos significativos y otros indican que las mutaciones en exón9 son independientes del pronóstico y que las del exón20 tienen mejor pronóstico30,31. Aunque los resultados en nuestra cohorte de 10% de mutaciones en PIK3CA, con predomino en exón20, son similares a los descritos en la literatura, su relación con el pronóstico es dudosa, pues el 50% han tenido un buen pronóstico y el otro 50% con mal pronóstico muestran variabilidad en la localización de la mutación, probablemente influido por el pequeño número de casos.
La coexistencia de expresión de receptores de andrógenos y mutación de PIK3CA observada en el 42,86% de la cohorte es similar a la descrita en la literatura, donde el TNBC con receptores de andrógenos positivos muestra mutación de PIK3CA hasta en un 40% versus el 4% de receptores de andrógenos negativos32.
Se observa mayor incidencia de metilación de BRCA1: en cánceres de alto grado histológico y con fenotipo triple negativo; se correlacionan con expresión de citoqueratinas basales; y juegan un papel significativo en la patogénesis del cáncer de mama basal-like esporádico. Además, la similitud genética con el cáncer de mama portador de mutaciones germinales BRCA1 plantea si la terapéutica utilizada en estos casos podría ser útil en el cáncer esporádico metilado, introduciendo así el concepto de «BRCAness». La presencia de metilación en el promotor del gen BRCA1 se ha descrito en entre el 11-32% de cánceres de mama esporádicos33, alrededor del 30-35% si son triples negativos34 y puede aumentar hasta un 60% en TNBC de tipo medular y metaplásico con fenotipo «basal-like»13,35.
En nuestra cohorte la presencia de hipermetilación del promotor del gen BRCA1 (21,67%) es menor que la descrita en la literatura, siendo el 23,1% de los casos metilados de tipo medular; estos resultados probablemente están influidos por la metodología utilizada. Solo en uno de los casos estudiados hemos encontrado metilación del estroma mamario no neoplásico, siendo su grado similar al del tumor. En la literatura se describe la presencia de hipermetilación en entre el 8,3-22% de los parénquimas mamarios normales de pacientes con cáncer de mama metilado36,37.
La coexistencia de hipermetilación del promotor del gen BRCA1 con mutación del BRCA1 se ha descrito en ocasionales casos, normalmente en relación con mutaciones de variante de significado incierto o BRCA1x. No se sabe si la metilación del promotor, que es muy heterogénea en las células tumorales, influye de la misma manera que la mutación patogénica en línea germinal21.
ConclusionesEn conclusión, en nuestra cohorte de TNBC se ha podido determinar: (1) la ausencia de mutaciones en EGFR, independientemente de la sobreexpresión inmunohistoquímica presente; (2) la mutación de PIK3CA en un 10% de casos, con coexpresión de receptores de andrógenos en la mitad de los casos, permitiendo plantear una posible terapia dirigida, y (3) la hipermetilación de la región promotora del gen BRCA1 en un 25% de los casos, sugiriendo la posibilidad de establecer una correlación con la terapéutica utilizada en los cánceres «BRCAness».
La información aportada por estas técnicas moleculares, así como por las recientes incorporaciones de plataformas genómicas para el estudio del cáncer, permiten ampliar el conocimiento de posibles dianas terapéuticas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.