Introducción
Debido a la facilidad de transporte y difusión de la glucosa hacia los tejidos metabólicamente activos, la ingesta de carbohidratos (CHO) tiene una importancia clave para suplir las demandas energéticas generadas por el ejercicio1. Se ha demostrado que la suplementación con CHO mejora el rendimiento físico, prolongando la duración del ejercicio antes de alcanzar la fatiga2, incrementando la potencia muscular3, así como el estado cognitivo y el nivel de vigilia durante un ejercicio de larga duración4. La duración del esfuerzo es la variable, inherente al ejercicio, más determinante para la mejora del rendimiento a través de la ingesta de CHO. Sin embargo, periodos cortos de ejercicio de alta intensidad (> 75% del consumo máximo de oxígeno), con un metabolismo predominantemente glucolítico, también se benefician de este nutriente5, especialmente después de un ejercicio de larga duración, como es el caso de los llamados "sprints finales"6,7.
El término "índice glucémico" (IG) apareció por primera vez en 1981 como una clasificación fisiológica para la selección de los CHO dietéticos en el tratamiento de la diabetes8. Actualmente, el IG se define como el efecto que tiene un CHO glucémico, en una comida determinada, sobre la glucosa sanguínea, expresado como un porcentaje del efecto provocado por una cantidad igual de glucosa u otro CHO patrón. Aunque su verdadero interés científico ha surgido en los últimos 10 años, desde su aparición, este concepto no ha dejado de tener promotores y detractores en relación a su aplicación en nutrición clínica9,10. La nutrición deportiva no es la excepción en esta controversia. Sin embargo, debido a que las demandas energéticas del ejercicio son habitualmente cubiertas mediante la ingesta de CHO simples, es decir CHO no incluidos en una matriz alimentaria compleja, la aplicabilidad de este concepto se muestra importantemente favorecida, a diferencia de lo que ocurre en condiciones de reposo, donde uno de los principales problemas que plantea el uso del IG es su capacidad relativa para predecir el impacto glucémico real, provocado por una comida mixta11.
Recientemente, un gran número de estudios ha investigado, directa o indirectamente, los efectos del IG de los alimentos sobre las variables de rendimiento deportivo en diferentes protocolos de ejercicio físico; sin embargo, existe entre ellos una amplia variabilidad acerca del momento de la ingesta de los CHO evaluados. Por ello, en la presente revisión analizaremos las evidencias que muestran estos estudios, según el momento de la suplementación en las tres fases fisiológicas relacionadas con el ejercicio y con las necesidades de CHO. Estas fases y sus principales objetivos en términos de rendimiento deportivo son: a) antes del ejercicio, para reforzar las reservas de glucógeno e iniciar el ejercicio con una glucemia normal12,13; b) durante el ejercicio, para incrementar la oxidación de CHO exógenos preservando el glucógeno para retrasar la fatiga14,15, y c) después del ejercicio, para restituir las reservas de glucógeno e incluso para incrementarlas16,17. Otros efectos relacionados con las variables metabólicas e inmunitarias en relación al ejercicio han sido reportados a partir de diferentes CHO glucémicos y se discuten también en esta revisión.
El índice glucémico: breve reseña y estado actual
El interés por medir el impacto de los CHO ingeridos sobre las concentraciones plasmáticas de glucosa, y su relación con la salud de las poblaciones, surgió inicialmente con la hipótesis de la fibra dietética propuesta por Burkit y Trowell (1975). Estos investigadores postularon, tras varios años de servicio médico en poblaciones rurales de África, que existía una relación directa entre el contenido de fibra de la dieta de estas poblaciones y la ausencia de varias enfermedades típicamente prevalentes en occidente, como la diabetes y las patologías cardiovasculares18. El descubrimiento en los años setenta del mecanismo por el cual la fibra influenciaba la ocurrencia de estas patologías19-21 condujo al desarrollo del concepto de IG, inicialmente aplicado en el tratamiento de la diabetes. Desde entonces, diferentes grupos de investigación alrededor del mundo investigaron el efecto glucémico de diferentes alimentos22-25. Las investigaciones realizadas en la década de los noventa por estos y otros grupos26-28 ampliaron el conocimiento de la respuesta glucémica (RG) y condujeron a la validación científica del concepto de IG.
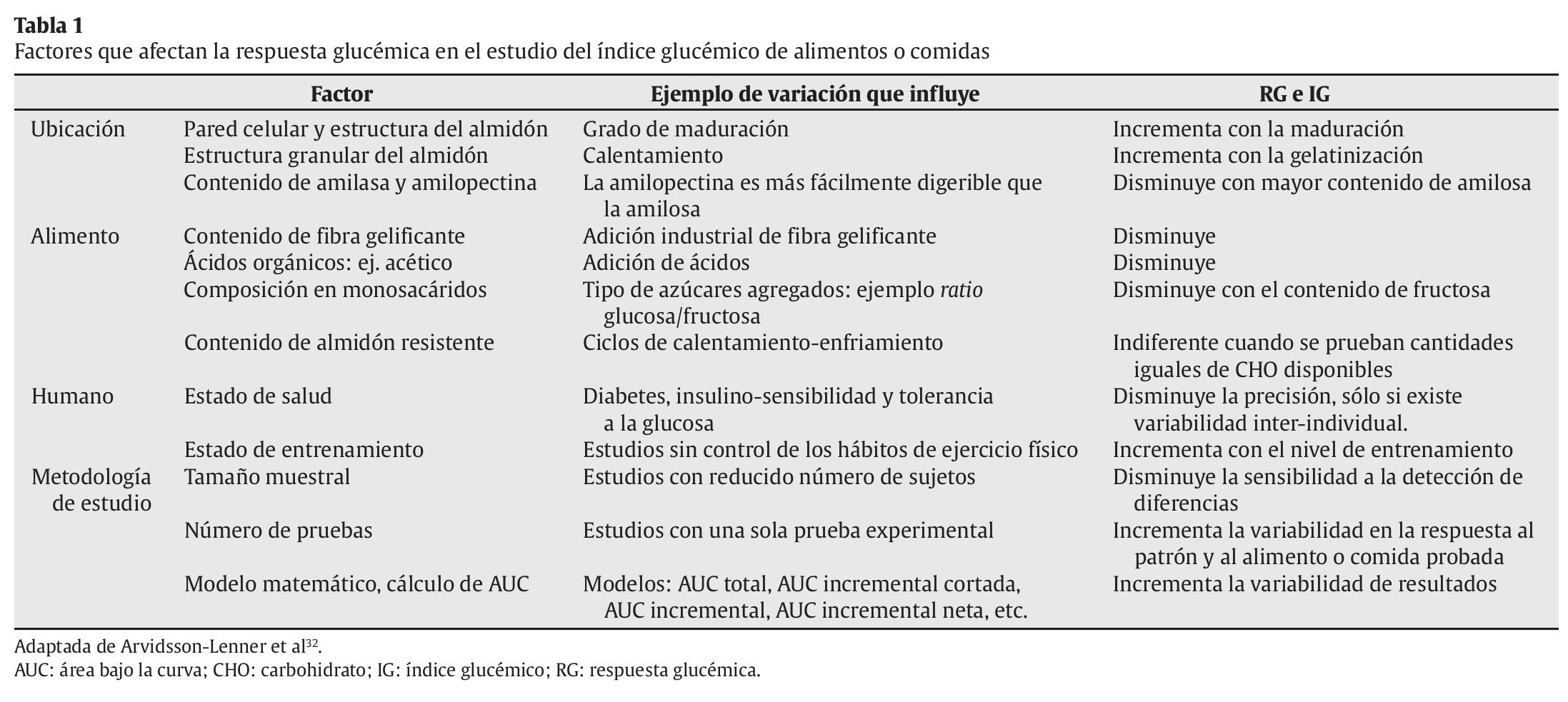
Actualmente, el IG es definido como el área incremental bajo la curva de respuesta de glucosa sanguínea provocada por la ingesta de 50 g de CHO disponibles en una porción alimentaria, y expresada como un porcentaje de la respuesta a 50 g de glucosa anhidra en el mismo individuo29. Esta definición parece clara e incluso resulta simplista, sin embargo, diferentes problemas metodológicos surgen en la obtención de los valores de IG y por lo tanto en la aplicabilidad de este concepto. Esto es debido a que una gran variedad de factores afectan la RG real de los alimentos y las comidas (tabla 1). Posiblemente la estandarización del método usado para conocer el IG de los alimentos o comidas es el mayor problema extrapolado al uso y precisión del IG para clasificar a los CHO. Aun así, excelentes revisiones han sido recientemente publicadas en la literatura científica, con el objetivo de aportar recomendaciones metodológicas para la estandarización de las investigaciones sobre el IG29-31.
El índice glucémico y la ingesta de carbohidratos antes del ejercicio
Un importante número de estudios ha analizado el efecto del consumo de CHO con alto o bajo IG (AIG o BIG, respectivamente) antes de realizar un ejercicio físico, sobre la respuesta metabólica y el rendimiento deportivo en sujetos físicamente entrenados. DeMarco et al33 investigaron, en 10 ciclistas entrenados, el efecto de una comida de AIG: 69 (cereales, plátano y leche), una de BIG: 36 (cereales All Bran, manzana y yogurt edulcorado) o únicamente agua, 30 minutos antes de pedalear dos horas (70% VO2máx), y realizar después un pedaleo final hasta la fatiga (100% VO2máx). En este estudio, los autores reportaron un incremento del 59% en el tiempo de pedaleo hasta la fatiga y una reducción de la percepción del esfuerzo, que fueron asociados a una mayor glucemia durante el ejercicio, después de la ingesta de la comida con BIG. Resultados semejantes habían sido mostrados previamente por un estudio realizado por Thomas et al, quienes compararon el efecto de la ingesta de un alimento con un IG = 19 frente a otro con un IG = 9834.
La principal hipótesis de estos investigadores para explicar la mejora del rendimiento tras la ingesta de CHO de BIG fue que el mantenimiento de un nivel fisiológicamente mayor de glucemia podría proporcionar energía de forma más estable durante el ejercicio de larga duración. Tanto DeMarco et al como Thomas et al propusieron que los niveles de glucemia, al final del ejercicio de larga duración, se correlacionan negativamente con el IG de los alimentos ingeridos antes del esfuerzo. Una diferencia de 10 unidades en el IG de los alimentos ingeridos fue asociada con una diferencia de más de 3,5 mg/dl de glucosa al final del ejercicio35. Una disponibilidad más estable de glucosa para un músculo con escasa capacidad de almacenamiento de glucógeno significaría un incremento en la capacidad de trabajo y una menor dependencia de las reservas hepáticas de glucógeno36. Adicionalmente, también se propuso que una mayor estimulación insulinémica, inducida por los CHO de AIG, podría incrementar la velocidad de depleción del glucógeno hepático al inhibir el aporte de los ácidos grasos al sustrato oxidativo durante el ejercicio37. Por ello, un CHO de BIG podría ayudar a preservar en el tiempo las reservas hepáticas de glucógeno, que subsecuentemente se usarían en la generación de energía durante los segmentos finales del ejercicio, evitando además el riesgo de una hipoglucemia fisiológica reactiva, como ocurre con los CHO de AIG38.
Sin embargo, en años posteriores varios estudios fueron publicados sin aportar ninguna evidencia de mejora en el rendimiento deportivo por alimentos de BIG39-41. Estas discrepancias podrían ser atribuidas a las diferencias metodológicas entre los estudios realizados, más que a las diferencias en los CHO probados, que normalmente fueron: puré de patatas, lentejas y plátano, entre otros. Posiblemente la duración del periodo digestivo en reposo antes del inicio del ejercicio, junto con diferencias en los protocolos de ejercicio, hayan creado disparidades en el "escenario metabólico" en el que se obtuvieron los diferentes resultados. Así, por ejemplo, los estudios que mostraron una mejora del rendimiento33,34 también hallaron, al final del ejercicio, claras diferencias en la glucemia provocada por los diferentes alimentos glucémicos. En estos estudios, los CHO fueron ingeridos entre 30 y 45 minutos antes del ejercicio, y aunque la glucemia se incrementó rápidamente tras los CHO de AIG, luego disminuyó y fue menor que en los de BIG, especialmente al final del ejercicio. Contrariamente, en los estudios que no reportaron diferencias en los niveles de glucemia a lo largo del ejercicio entre los CHO de BIG y AIG, tampoco se mostró una mejora del rendimiento deportivo39-41. Además, es importante resaltar que en estos últimos estudios el tiempo de reposo después de la ingesta de los CHO, antes del inicio del ejercicio, fue de más de una hora.
Las evidencias de que la mejora del rendimiento sólo ocurre cuando se logra reducir la RG provocada por los CHO antes del ejercicio fueron posteriormente reforzadas por otros estudios42,43, que compararon el efecto de la ingesta de CHO de moderado índice glucémico (MIG) con CHO de AIG. Por otra parte, independientemente de la influencia del IG sobre el rendimiento deportivo, todos los estudios antes mencionados mostraron un hallazgo común durante el ejercicio: una comida de BIG antes del ejercicio modifica la utilización metabólica de sustratos, desde el uso predominante de CHO hacia una mayor utilización de grasas.
El índice glucémico y la ingesta de carbohidratos durante el ejercicio
El incremento del rendimiento deportivo en ejercicios con una duración mayor a 45 minutos es el principal fundamento de la ingesta continua de CHO durante el esfuerzo36,44. La capacidad de mantener la glucemia e incrementar la oxidación de CHO por parte del músculo sería la explicación fisiológica de esta mejora de la capacidad de trabajo. Además, el ahorro del glucógeno muscular es otro posible fenómeno asociado a la mejora del rendimiento45, aunque esto ha sido recientemente discutido por varios estudios que muestran que una mayor oxidación total de CHO tras el suplemento continuo también se acompaña de un aumento en la oxidación del glucógeno almacenado46,47.
Sin embargo, pocos estudios han investigado el efecto diferencial de la ingestión continua de CHO de AIG o BIG sobre el rendimiento deportivo. Massicotte et al48 no observaron diferencias en la oxidación total de CHO, ni en la participación de los ácidos grasos al sustrato energético, durante un ejercicio de prolongada duración (120 min; 58% VO2máx) cuando se suplementó de forma fraccionada con 100 g de glucosa, o 50 g de glucosa más 50 g de fructosa, o 100 g de sacarosa. Estos investigadores tampoco hallaron diferencias en el rendimiento deportivo entre los diferentes suplementos glucémicos. En otro estudio realizado por Earnest et al49 se examinó el efecto de la ingestión continua de miel (IG = 35), o dextrosa (IG = 100), o una solución placebo, en 9 sujetos que simularon un carrera de 64 km contrarreloj en un cicloergómetro. Estos investigadores observaron una mejora en el tiempo de recorrido cuando los sujetos consumieron CHO durante el ejercicio que cuando no lo hicieron, pero no observaron ninguna diferencia entre los CHO probados. Sin embargo, los resultados de este estudio deben ser interpretados con cautela debido al reducido tamaño muestral y al uso de dextrosa, un CHO compuesto por proporciones semejantes de glucosa y fructosa, ambos con una diferente vía de metabolización y comportamiento posprandial.
En ausencia de nuevas evidencias, la recomendación general continúa siendo la de ingerir CHO de AIG durante el ejercicio debido a su disponibilidad y fácil digestión. Además, un estudio publicado por Burke et al50 demostró que la ingesta continua de CHO de AIG (1 g/min) durante un ejercicio de moderada intensidad y larga duración puede eliminar las diferencias iniciales en la glucemia e insulinemia estimuladas por la ingesta previa de CHO de alto o bajo IG. Este hallazgo podría, por lo tanto, restar importancia a la controversia sobre la selección de CHO de alto o bajo IG antes del ejercicio, al menos para aquellos esfuerzos de larga duración, aunque son necesarios otros estudios al respecto.
El índice glucémico y la síntesis de glucógeno tras el ejercicio
Se ha sugerido que la síntesis de glucógeno posterior a la depleción muscular inducida por un ejercicio ocurre principalmente en dos fases51. En la primera de ellas (primeros 30 a 60 minutos después del ejercicio) la síntesis de glucógeno es independiente de la presencia de insulina y se ve favorecida por los siguientes mecanismos: a) un incremento de la permeabilidad de la membrana del miocito a la glucosa52; b) una elevada translocación de los transportadores GLUT453, y c) una activación simultánea de la glucógeno sintetasa muscular54. Por el contrario, la segunda fase de síntesis (después de la primera hora de finalizado el ejercicio) es dependiente de los niveles de insulina y se caracteriza por una síntesis glucogénica entre un 10 a un 30% menor que la producida en la fase uno51. Según estas evidencias, podemos entender que la selección de la comida posterior al ejercicio o competición depende de la duración e intensidad del esfuerzo realizado, en otras palabras, de si ocurrió o no una significativa depleción glucogénica. Además, la frecuencia, característica glucémica e ingesta total de CHO para acelerar la síntesis glucogénica, será diferencialmente determinada por la proximidad o no de un nuevo esfuerzo o competición.
En aquellos atletas que compiten de forma repetida en un corto periodo de tiempo resultaría fundamental la ingesta aguda de CHO de AIG en la primera fase de síntesis de glucógeno; y de ser posible también en las horas subsiguientes. Es evidente que en esta primera fase de restitución, dicha selección no se fundamenta en el estímulo que estos CHO producen sobre las células β del páncreas, sino en la velocidad de absorción y en su capacidad de difusión hacia el tejido muscular. Un consumo inmediato y fraccionado de 1,5 g de CHO/kg de peso corporal es actualmente recomendado para lograr una rápida resíntesis de glucógeno55.
Sin embargo, en la mayoría de los casos, el deportista tiene uno o más días de recuperación antes de un nuevo esfuerzo, por lo cual forzar una ingesta aguda y fraccionada de CHO carece de relevancia, y es la dieta en las 24 horas posteriores al ejercicio56,57 la que merece consideraciones especiales. En este sentido, Burke et al demostraron que tras un protocolo de depleción glucogénica con un ejercicio extenuante, la ingesta de una dieta de AIG produce una mayor reposición de glucógeno muscular al cabo de 24 horas que aquella que, aportando la misma cantidad total de CHO, tiene un BIG58. Además, debido a que la diferencia en el almacenamiento de glucógeno fue mayor que la diferencia en la RG e insulinémica entre las comidas con AIG y BIG, estos investigadores propusieron que otros mecanismos, como la velocidad de absorción de los CHO, podrían también explicar la menor reposición tras los CHO de BIG. Por ello, los mismos investigadores59 compararon posteriormente el efecto de la ingesta de CHO de AIG en dos tipos de ingesta diaria: a) en 4 grandes bolos, o b) en bolos pequeños y frecuentes que se usaron para imitar una absorción lenta y sostenida, como ocurriría con CHO de BIG. Tras 24 horas de este protocolo de reposición no se hallaron diferencias en la cantidad de glucógeno almacenado, y por lo tanto se descartó la influencia de la velocidad de presentación de los CHO absorbidos sobre la efectividad muscular para reponer el glucógeno.
Hasta la fecha, los mecanismos involucrados en la mejora de la síntesis de glucógeno mediada por los CHO de AIG son aún solo parcialmente comprendidos. Se ha propuesto que los CHO de BIG estimulan una insulinemia estable, lo cual reduce la disponibilidad de ácidos grasos y obliga a la oxidación de parte de los CHO ingeridos, reduciendo la efectividad de almacenamiento en comparación con los de AIG60. Además, es posible que otros factores independientes del efecto glucogénico del CHO de AIG puedan también intervenir en la mejor repleción glucogénica después del ejercicio. En este sentido, existe evidencia de que la RG posterior a la ingesta de CHO de AIG se relaciona inversamente con el tiempo transcurrido hasta una nueva ingesta alimentaria inducida por el apetito61,62, lo cual en condiciones de recuperación al ejercicio podría favorecer que el atleta ingiera una cantidad suficiente de CHO para la resíntesis y supercompensación de glucógeno. En cualquier caso, resulta necesario considerar que una elevada ingesta de CHO de AIG para inducir una mayor síntesis de glucógeno es una medida que disminuye su efectividad en el transcurso del tiempo, por lo que este tipo de protocolos debiera reservarse para cuando una síntesis máxima de glucógeno sea clave en el logro de los objetivos deportivos. Además, un moderado incremento del contenido de glucógeno muscular puede ser logrado en deportistas, al menos por un periodo de 30 días, con una dieta que incluya cantidades normales de alimentos de AIG63.
El índice glucémico y la respuesta inmunitaria inducida por el ejercicio
Es bien conocido que la suplementación con CHO antes y durante un ejercicio de prolongada duración provoca una reducción del estrés metabólico inducido por el esfuerzo. Este fenómeno es demostrado por una menor secreción de cortisol cuando el ejercicio es realizado en condiciones de disponibilidad exógena de CHO64. Además, se ha reportado una reducción de la respuesta inflamatoria mediada por citoquinas tras el incremento de la disponibilidad de CHO antes de un esfuerzo prolongado65,66. Sin embargo, existe un conocimiento limitado acerca del efecto del IG de los CHO ingeridos sobre la respuesta inmunitaria aguda inducida por el ejercicio. En un reciente estudio realizado por Chen et al67 se investigó la respuesta inmunitaria aguda inducida tras correr 21 km en un tapiz rodante y su relación con el IG de la comida previa al ejercicio. Estos investigadores hallaron una reducción en los niveles de cortisol durante el ejercicio y una menor respuesta inmunitaria mediada por la interleucina 6 cuando una comida de AIG fue sustituida por una de BIG antes de realizar el esfuerzo. El hecho de que una mayor oxidación de glucógeno durante el ejercicio conduzca a un menor ahorro del mismo, tras la ingesta de CHO de AIG68, sustenta la hipótesis de que los CHO de BIG tienen un efecto contrario, provocando un menor estrés metabólico e inmunitario al evitar un agotamiento precoz del glucógeno. Sin embargo, serán necesarios futuros estudios para reforzar estos primeros hallazgos sobre la reducción de la respuesta inflamatoria cuando un ejercicio es realizado tras la ingesta de CHO de BIG.
El índice glucémico y la respuesta metabólica durante el ejercicio
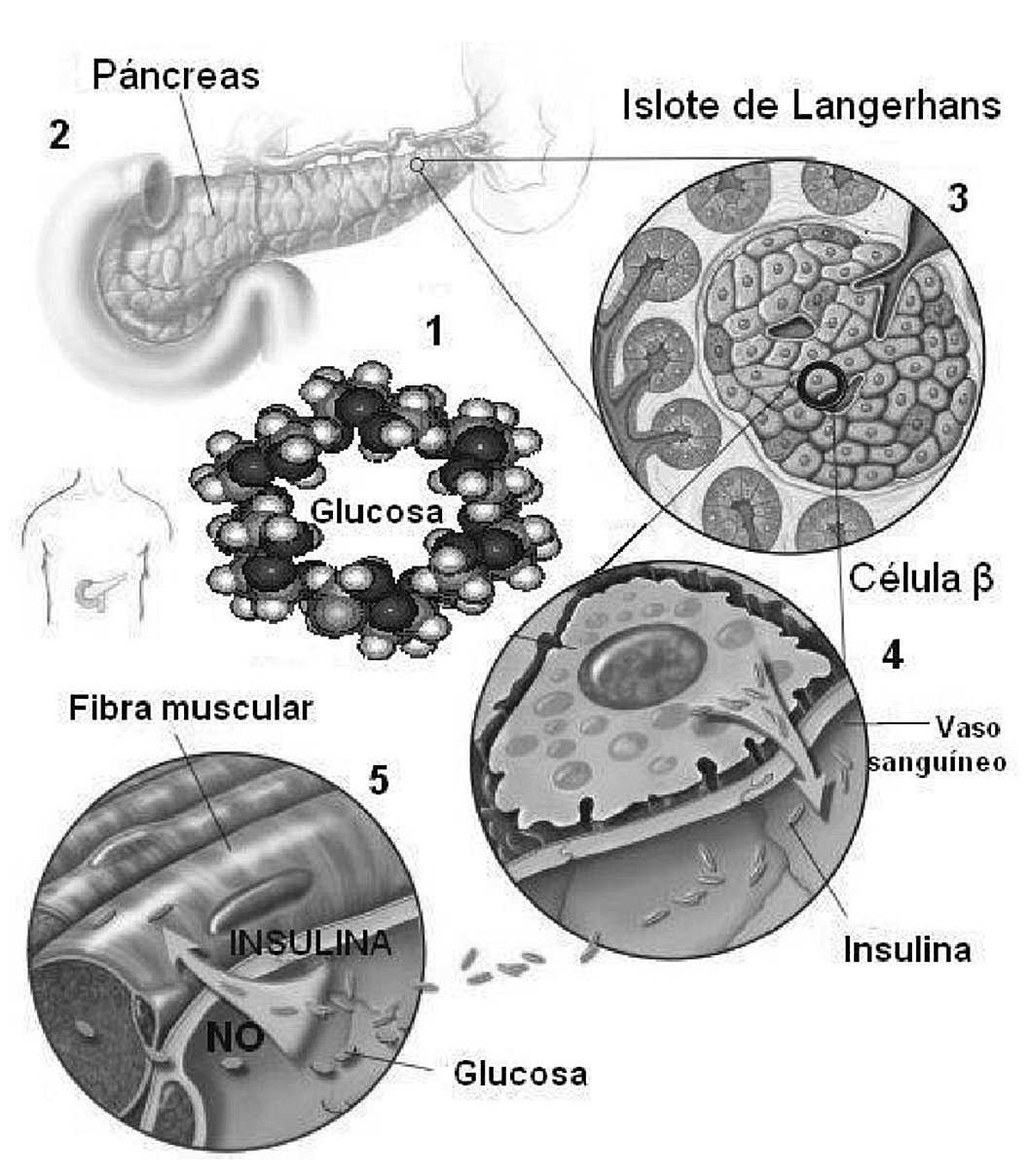
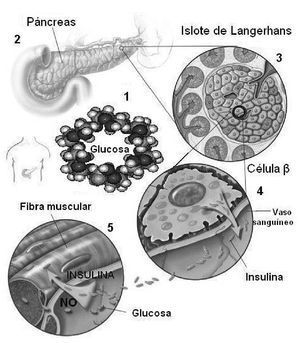
Incrementar la tasa de oxidación lipídica es una prioridad para aquellas personas que combinan un tratamiento dietético y un programa de ejercicio físico, con el objetivo de reducir masa grasa y mejorar su situación metabólica. Es bien conocido que la utilización de sustratos durante un ejercicio predominantemente lipolítico es modulado exógenamente por el control autonómico y endocrino, en respuesta al tipo y cantidad de CHO ingeridos antes del ejercicio1. Durante este, un aumento significativo de la glucemia conduce a un fenómeno llamado simpatolisis funcional, que involucra la atenuación β-adrenérgica y un aumento del estímulo α-adrenérgico vagal, lo que da paso a la distribución de la glucosa a través de la vasodilatación mediada por la insulina y el óxido nítrico, para su subsiguiente oxidación69-71 (fig. 1). Por el contrario, una glucemia menor y una baja insulinemia durante el ejercicio provocan una reducción del estímulo α-adrenérgico vagal, favoreciendo la estimulación β-adrenérgica para un incremento de la lipólisis72 y el uso selectivo de sustratos durante el ejercicio lipolítico72-74.
Fig. 1. Respuesta insulinémica y distribución periférica de la glucosa mediada por insulina y óxido nítrico (NO).
Varios estudios sobre rendimiento deportivo han mostrado un incremento de la oxidación de grasas durante el ejercicio cuando se comparó la ingesta de CHO de BIG antes del ejercicio con aquellos de AIG34,40,41. La ingesta de una comida mixta de BIG 3 horas antes de realizar una sesión de ejercicio también ha mostrado una mejora de la disponibilidad de ácidos grasos libres en sangre y del perfil oxidativo durante el ejercicio75,76. Sin embargo, solo dos estudios han investigado la relación entre el IG y la lipólisis inducida por el ejercicio en mujeres sanas, un grupo de la población que frecuentemente combina estrategias dietéticas con ejercicio físico. En el primero de ellos77, 6 mujeres saludables, pero no entrenadas, completaron tres sesiones de ejercicio de baja intensidad (1 hora de caminata al 50% VO2máx), 3 horas después de consumir agua, o una comida de AIG, o una de MIG (resultante de la combinación de alimentos de AIG y BIG). Aunque fue observada una menor concentración insulinémica durante el ejercicio realizado tras la comida de MIG, no se hallaron diferencias significativas en la oxidación de sustratos con la comida de AIG. Estos autores sugirieron que la escasa diferencia en la RG entre ambas comidas (MIG y AIG), así como el reducido tamaño muestral, podrían haber sido la causa de estos resultados. Sin embargo, en el segundo estudio, Stevenson et al78 estudiaron, en mujeres moderadamente entrenadas, el efecto de dos comidas mixtas con mayor diferencia glucémica (AIG y BIG) sobre un ejercicio moderado (1 hora de trote al 70% VO2 max) realizado 3 horas después de la ingesta. Aunque la oxidación de grasas fue significativamente menor y la oxidación de CHO mayor durante el periodo posprandial de reposo tras la comida de AIG, no se hallaron diferencias en la utilización de sustratos durante el ejercicio.
En ambos estudios resulta lógico pensar que la ausencia de un efecto direccional de las comidas sobre la oxidación de sustratos podría deberse a factores metodológicos. Probablemente la utilización de un prolongado periodo de reposo posprandial (3 horas) antes de realizar el ejercicio puede haber evitado que la respuesta glucémica e insulinémica coincida con el estímulo lipolítico de los ejercicios. En este sentido, en un reciente estudio publicado por nuestro grupo79, la ingesta de glucosa más fructosa, 15 minutos antes de realizar un ejercicio aeróbico (30 minutos al 70% VO2 max), provocó una mayor insulinemia durante el ejercicio, que se acompañó de una menor secreción de adrenalina y una reducida disponibilidad de ácidos grasos libres en sangre, en comparación con la ingesta de un suplemento único de glucosa.
Otro factor de gran importancia en la interacción RG-oxidación de sustratos podría ser el nivel de entrenamiento de los sujetos estudiados. En un reciente estudio Mettler et al80 investigaron la influencia del estado de entrenamiento sobre la RG a 50 g de CHO aportados por una ración de cereales para desayuno o por glucosa anhidra. Estos autores hallaron que el IG obtenido varió significativamente (23 unidades de IG) entre los sujetos altamente entrenados y aquellos que fueron sedentarios. Aunque en los moderadamente entrenados se halló un IG intermedio, este no se diferenció significativamente del obtenido en los otros dos grupos. Por ello, es posible que el efecto de una comida de BIG antes del ejercicio sea más favorable para aquellas personas con un programa sistemático de entrenamiento y un buen acondicionamiento físico, o que la reducción del estímulo lipolítico observada tras una comida de AIG se inactive a medida que el nivel de entrenamiento del individuo se incrementa.
La fructosa y el índice glucémico en el ejercicio
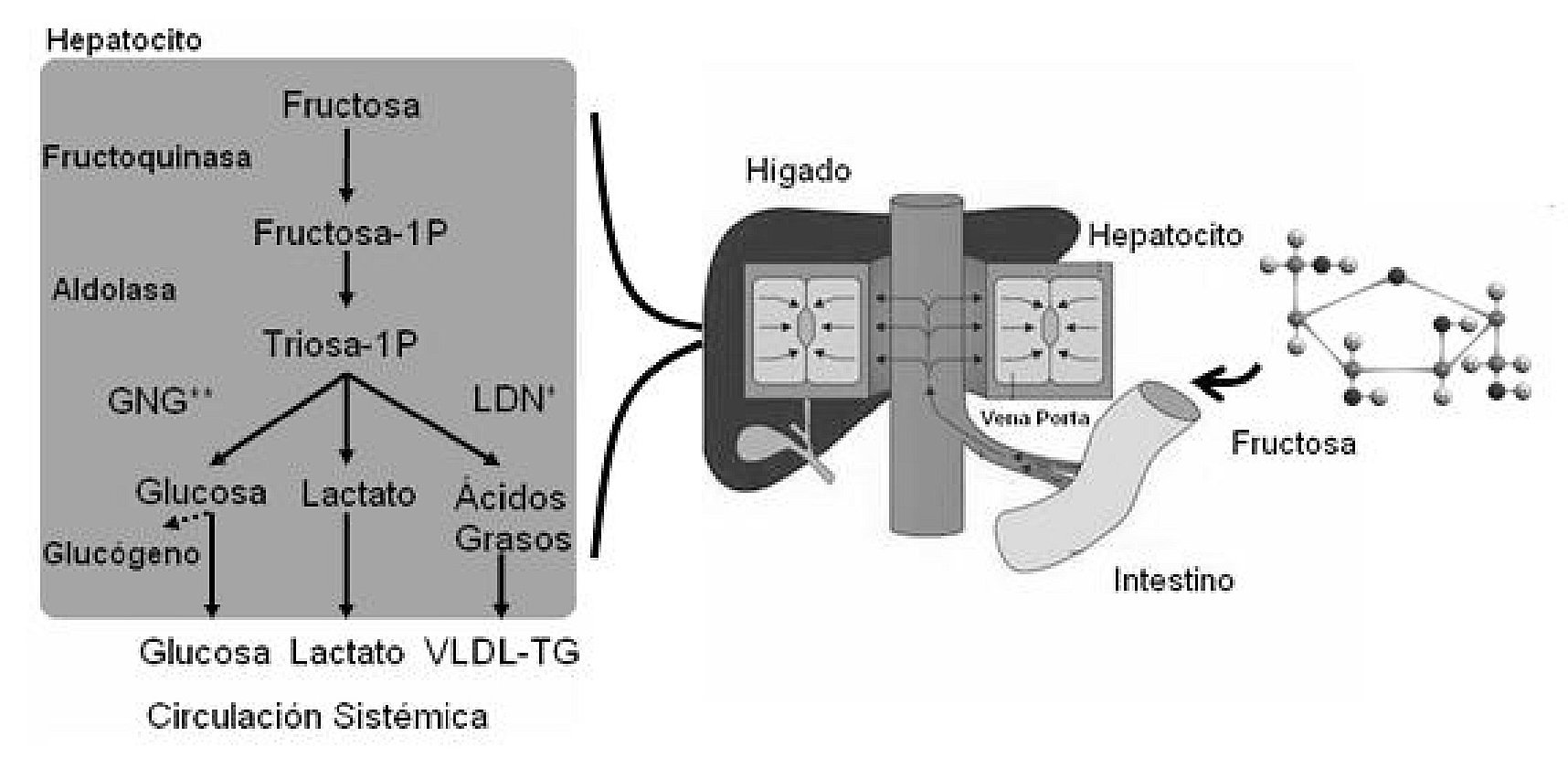
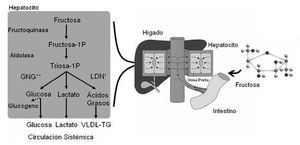
La fructosa es un monosacárido de bajo IG (IG = 23), que frecuentemente ha sido estudiado como un suplemento ergogénico en condiciones de ejercicio. Se ha observado que su ingesta puede mejorar el rendimiento deportivo, mientras que a diferencia de la glucosa, no induce hipoglucemia reactiva81. El bajo IG de la fructosa se debe principalmente a que después de su metabolismo hepático, solo una pequeña proporción es liberada como glucosa en la circulación sistémica82,83. Otros productos metabólicos de la conversión hepática de la fructosa son el ácido láctico, ácidos grasos libres y aminoácidos84 (fig. 2).
Fig. 2. Destino metabólico de la fructosa ingerida. GNG: gluconeogénesis; LDN: lipogénesis de novo; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad.
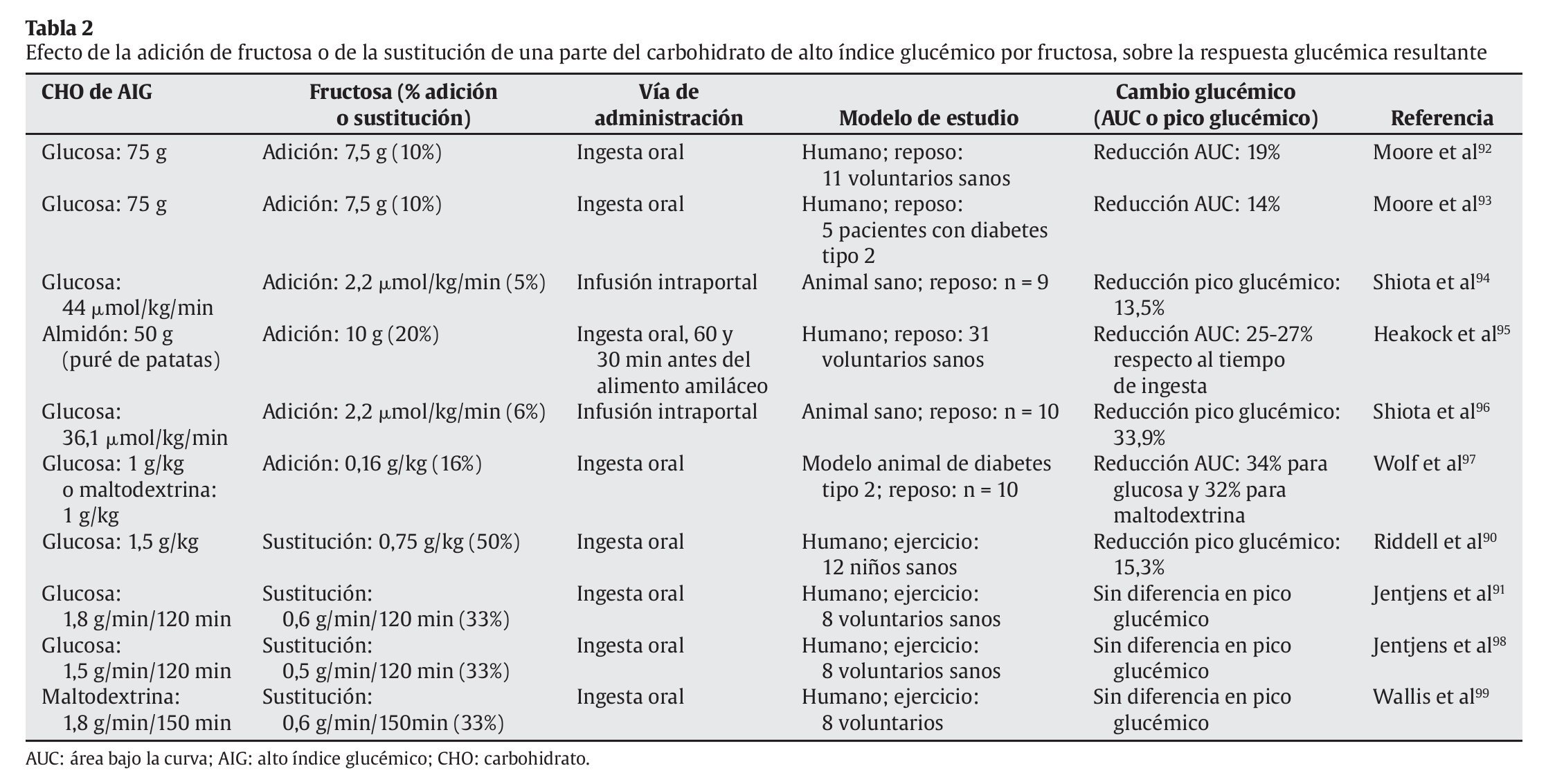
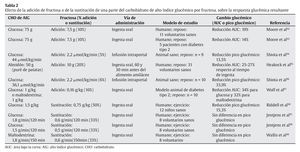
Por otra parte, la fructosa no es completamente absorbida, incluso en personas sanas85, lo que explica la ocurrencia de distrés gastrointestinal86,87 y, en condiciones de ejercicio físico, limita su uso como un sustitutivo total de los CHO de AIG. Al respecto, se ha demostrado que su digestibilidad y absorción mejora significativamente, en condiciones de reposo y ejercicio, a través de su combinación con diferentes proporciones de otros CHO glucémicos, como la glucosa88,89. Estudios recientes reportaron una mejora del rendimiento deportivo, dependiente de la tasa de oxidación de CHO exógenos, cuando una dosis de fructosa fue combinada con glucosa e ingerida durante un ejercicio aeróbico90,91. Sin embargo, existen pocos reportes sobre la respuesta glucémica e insulinémica provocada por la combinación de CHO de AIG y fructosa (tabla 2).
El mayor conocimiento hasta la fecha existe a partir de estudios realizados en reposo, en los que la fructosa redujo la respuesta glucémica e insulinémica a CHO de AIG, tanto en modelos animales como en humanos92,95,97. Este efecto de interacción glucosa-fructosa sobre la RG en reposo ha sido explicado a causa de una incrementada translocación de la glucoquinasa hepática por efecto de la fructosa, conduciendo a un aumento de la captación hepática de la glucosa circulante100. Para ello, la fructosa-1-fosfato, cuyos niveles hepáticos aumentan rápidamente tras la ingesta o infusión de fructosa101, se une a la proteína reguladora de la glucoquinasa, liberando a la enzima de su proteína inhibidora. Sin embargo, existe cierto consenso de que este efecto sólo ocurriría con dosis catalíticas de fructosa (< 10% del influjo total de CHO)92,94,100,102.
Contrariamente, un creciente número de investigaciones que han estudiado el efecto de comidas o dietas enriquecidas con fructosa (cantidades superiores a una dosis catalítica) ha mostrado la ocurrencia de desregulaciones del metabolismo lípidico e insulinorresistencia103,104. La estimulación de la lipogénesis de novo105, un defecto en la clarificación de las lipoproteínas ricas en triglicéridos106, o incluso la esterificación de los ácidos grasos derivados del metabolismo hepático de la fructosa107, son las principales explicaciones para la hipertrigliceridemia inducida por la fructosa en humanos sanos, mientras que la reducción en la sensibilidad a la insulina parece ser una consecuencia de la desregulación lipídica antes mencionada84. En condiciones de ejercicio, nuestro grupo reportó recientemente que una dosis de fructosa (23% del influjo total de CHO en forma de glucosa) provocó un significativo incremento de la trigliceridemia, al tiempo que redujo la disponibilidad de ácidos grasos libres en sangre e incrementó el estrés oxidativo, durante y después de un ejercicio aeróbico, en individuos sanos y físicamente entrenados79.
Por todo esto, aunque aún existe un limitado conocimiento, es posible que el beneficio de la fructosa sobre la glucemia posprandial tanto en reposo como en condiciones de ejercicio sea superado por los efectos negativos sobre el metabolismo lipídico y la oxidación de sustratos. Actualmente la fructosa es adicionada en una proporción variable (desde dosis catalíticas hasta proporciones de un 50% del influjo de CHO) junto a CHO de AIG en numerosas bebidas deportivas108,109. Sin embargo, el desconocimiento sobre el umbral a partir del cual los beneficios glucorregulatorios de la fructosa se convierten en efectos negativos sobre los lípidos y la sensibilidad a la insulina fundamenta la necesidad de más estudios, especialmente en condiciones de ejercicio físico.
Conclusiones
A partir de las evidencias analizadas acerca de la influencia del IG en el ejercicio físico, es posible realizar las siguientes conclusiones y recomendaciones:
1) La ingesta de CHO de BIG antes de un ejercicio de larga duración puede incrementar el rendimiento deportivo, preservando una glucemia más estable en el curso del ejercicio, aunque el momento exacto para esta ingesta es aún una variable que requiere ser estudiada.
2) Durante la realización de un ejercicio físico de larga duración es indiscutible la importancia de la ingesta fraccionada de CHO, aunque su característica glucémica parece carecer de relevancia, dando prioridad a la selección de CHO de fácil digestión y absorción. Posiblemente el efecto del IG de los CHO en esta fase es el que mayor investigación requiere.
3) Una dieta posterior al ejercicio o competición que contenga CHO de AIG favorece una mayor reposición de las reservas musculares de glucógeno, aunque los mecanismos que intervienen en este efecto no serían exclusivamente explicados por la RG e insulinémica de los alimentos.
4) Una más rápida y mayor reposición de glucógeno puede ser alcanzada a través de un protocolo fraccionado de suplementación con CHO de AIG durante las fases agudas de recuperación al esfuerzo, en aquellos deportistas que precisan cumplir con ejercicios continuados.
5) La respuesta inflamatoria inducida por el estrés metabólico del ejercicio de larga duración es modulada por la disponibilidad de sustratos energéticos, y evidencias recientes sugieren que la ingesta de CHO de BIG puede evitar el agotamiento del glucógeno oxidativo, reduciendo el estrés muscular y la respuesta inflamatoria subsiguiente.
6) La magnitud de la RG e insulinémica a los CHO ingeridos durante un ejercicio aeróbico determina la efectividad lipolítica del esfuerzo. Otros factores, como el estado de entrenamiento del músculo y el momento de la suplementación con los CHO, pueden ser claves para explicar un mayor o menor efecto del IG en la oxidación lipídica.
7) Aunque la ingesta de fructosa asociada a CHO de AIG está fundamentada por una mejora en la absorción y el rendimiento deportivo, existe evidencia de que cantidades superiores a una dosis catalítica pueden provocar alteraciones de las fracciones lipídicas, insulinorresistencia y menor oxidación de sustratos lipídicos.
Correspondencia:
J. Marcelo Fernández.
Unidad de Lípidos y Arteriosclerosis. Servicio de Medicina Interna. Hospital Universitario Reina Sofía. Av. Menéndez Pidal, s/n. 14004 Córdoba. España.
Correo electrónico: juf_nutryinves@yahoo.com
Historia del artículo:
Recibido el 1 de julio de 2008
Aceptado el 15 de agosto de 2008