Ésteres constituem uma das classes de substâncias químicas largamente encontradas na natureza. Alguns ésteres, de baixo peso molecular, tendem a apresentar sabor e aroma agradáveis e, por isso, são bastante usados em alimentos e bebidas industrializadas. Os ésteres podem ser sintetizados através da reação entre um ânion carboxilato e um haleto de alquila ou ainda pela reação de esterificação de Fischer. Industrialmente, a reação de esterificação de Fischer é um dos principais métodos para a síntese dos ésteres. No presente trabalho descreve‐se a realização de um experimento simples para a obtenção de ésteres na disciplina Análise Orgânica na graduação. A preparação de levulinato de alquila e lactato de alquila, a partir do ácido levulínico e/ou ácido lático, é muito simples; requer 3 aulas de 4h e é útil para o apoio em sala de aula nos cursos de graduação.
Esters consist in one of the classes of chemical substances widely found in nature. Some esters of low molecular weight tend to have a pleasant flavor and therefore are widely used by food and drinks industries. The esters can be synthesized by the reaction between a carboxylate anion and an alkyl halide, or by Fischer esterification reaction. Industrially, this last reaction is one of the main procedures for the esters synthesis, and according this work, a simple experiment about this specific obtaining method is described and proposed for undergraduate discipline of organic analysis. The preparation of alkyl levulinate and lactate, from levulinic acid and/or lactic acid, is carried out in laboratory, easily, requiring three periods of four hours and is useful for chemistry teaching.
Nas aulas experimentais de Química Orgânica em curso de graduação o estudante normalmente é introduzido às técnicas básicas de laboratório, bem como à síntese de moléculas orgânicas simples, mediante a interconversão de grupos funcionais e/ou a formação de ligação carbono‐carbono e carbono‐heteroátomo (Cunha, Lião, Bonfim, Bastos e Monteiro et al., 2003). A inter‐relação entre o conhecimento adquirido em química através de estudos teóricos e a experimentação laboratorial, quando realizada de forma bem clara e coordenada, permite ao estudante a construção de conceitos científicos de forma mais sólida e com um maior relacionamento entre os tópicos teóricos (Hamelin, 1995). Neste sentido, Bieber (1999) ratifica que o laboratório de química experimental é a grande oportunidade que os estudantes têm de ter contato com o mundo real da química que, se bem conduzida, leva ao aprofundamento do aprendizado de diversos temas pouco explorados em sala de aula como, por exemplo, processos de separação e técnicas espectroscópicas. A busca por melhores métodos experimentais (Imamura e Baptistella, 2000; Reis e Andrade, 1996) ou experimentos ricos em subsídios para discussões teóricas utilizando reagentes de baixo custo e de fácil aquisição, tem sido um tema bastante investigado nas diversas áreas da química (Pereira, 1989; Soares, Pires e Souza., 1987).
Um dos tópicos abordados nas aulas experimentais de Química Orgânica é a reação de substituição nucleofílica acílica, apresentada através das reações de esterificação e transesterificação. De modo geral, no ensino dessas reações se utilizam compostos de partida simples e de baixo custo, como por exemplo, o ácido benzoico, o ácido salicílico, a anilina para preparação do benzoato de metila, ácido acetilsalicílico e acetanilida, respectivamente (Vogel, 1985; Soares, Souza e Pires, 1988).
Motivados por estes fatos, por relatos de inovações no ensino de química orgânica experimental (Cunha et al., 2003; Ferreira, Silva e Perrone, 2001), neste trabalho utilizou‐se como estratégia de ensino estratégia a experimentação para obtenção ésteres a partir do ácido levulínico e ácido (R,S)‐láctico utilizando como catalisador o ácido 4‐tolueno sulfônico.
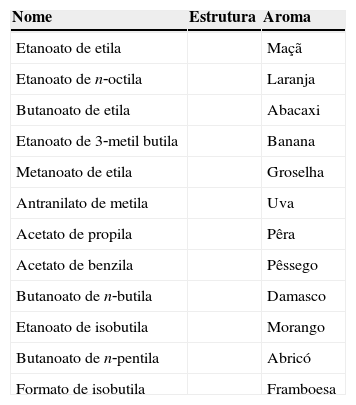
Entre os compostos encontrados na natureza, os ésteres estão entre os mais comuns. Estes compostos comumente estão associados ao odor agradável exalado por flores e frutos. Por exemplo, quando tomamos um sorvete de abacaxi, comumente no seu preparo utiliza‐se uma essência sintética que dá o gosto de abacaxi (Costa, Ornelas, Guimaraes e Merçon, 2004). Também podemos encontrar os ésteres na gordura animal e nos óleos vegetais (os triglicerídeos). A tabela 1 apresenta alguns exemplos de ésteres e seus respectivos aromas. Esses compostos possuem importantes aplicações na indústria como flavorizantes, ou seja, substâncias que, quando adicionadas em pequena quantidade aos alimentos, conferem‐lhes características degustativas e olfativas.
Ésteres usados como aromas de frutas nas indústrias de alimentos
| Nome | Estrutura | Aroma |
|---|---|---|
| Etanoato de etila | Maçã | |
| Etanoato de n‐octila | Laranja | |
| Butanoato de etila | Abacaxi | |
| Etanoato de 3‐metil butila | Banana | |
| Metanoato de etila | Groselha | |
| Antranilato de metila | Uva | |
| Acetato de propila | Pêra | |
| Acetato de benzila | Pêssego | |
| Butanoato de n‐butila | Damasco | |
| Etanoato de isobutila | Morango | |
| Butanoato de n‐pentila | Abricó | |
| Formato de isobutila | Framboesa |
Existe uma grande variedade de ésteres encontrados na composição de polímeros. Dentre estes ésteres pode‐se citar o éster polivinílico presente na forma de emulsões na composição de tintas, o poliéster utilizado principalmente na fabricação de tecidos e o acetato de celulose presente em filmes fotográficos. Outro polímero bastante comum é o politereftalato de etileno (PET), produzido pela reação entre o ácido tereftálico e o etilenoglicol, que se apresenta como uma resina plástica de grande resistência. O PET é usado na fabricação de fibras têxteis, filmes (para adesivos, por exemplo) e embalagens para refrigerantes, águas e sucos. Diversos outros líquidos podem estar embalados em PET: óleos comestíveis, medicamentos, cosméticos, produtos de higiene e limpeza, destilados, isotônicos e cervejas, entre outros (Pereira et al., 2002).
Os ésteres são compostos de baixa polaridade e com ponto de ebulição menor do que os ácidos carboxílicos de peso molecular semelhante. Podem ser sintetizados através de reação entre um ânion carboxilato e um haleto de alquila ou ainda pela reação de esterificação de Fischer, à qual se tem dado maior ênfase devido à viabilidade de aplicação industrial para síntese de flavorizantes (Costa et al., 2004).
Os ésteres são derivados dos ácidos carboxílicos e podem ser preparados através da reação de álcoois com ácidos, cloretos de ácido ou anidridos na presença de catalisador. A reação de ácidos com álcoois é uma reação de equilíbrio. No sentido direto conduz à formação de ésteres e no sentido inverso leva à hidrólise dos mesmos. Para deslocar a reação no sentido da formação do éster pode utilizar‐se um excesso de um dos reagentes ou remover um dos produtos à medida que a reação decorre.
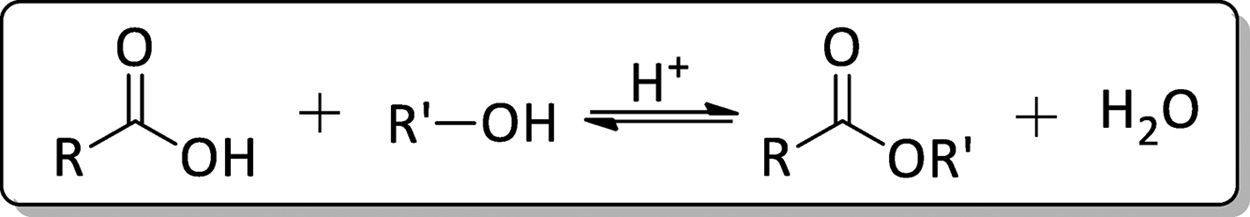
Em 1895, Fischer e Speier constataram que era possível a obtenção de ésteres através do aquecimento de um ácido carboxílico e um álcool na presença de catalisador ácido (Oliveira, Souza, Santos, Silva e Lachter et al., 2014). Esta reação ficou conhecida como esterificação de Fischer (fig. 1), sendo um dos principais métodos utilizados na produção de ésteres.
Segundo Yadav e Rahuman (2002), reações de esterificação são amplamente empregadas em uma variedade de indústrias químicas. O procedimento geralmente usa ácidos minerais como catalisador. Esses catalisadores geram grandes quantidades de resíduos ácidos, que requerem tratamento adequado antes do descarte. O processo catalítico convencional consiste na catálise homogênea com ácido sulfúrico, o qual permanece dissolvido no meio reacional. Neste processo, o catalisador deve ser removido ao final da reação por lavagem aquosa alcalina. É um reagente de baixo custo e é muito ativo. No entanto, também é corrosivo e apresenta problemas de armazenamento e de controle segundo Bondioli (2004). A reação de esterificação pode ser catalisada por catalisadores ácidos de Brönsted ou de Lewis, por catalisadores básicos de Lewis, além de enzimas (Cardoso, 2008).
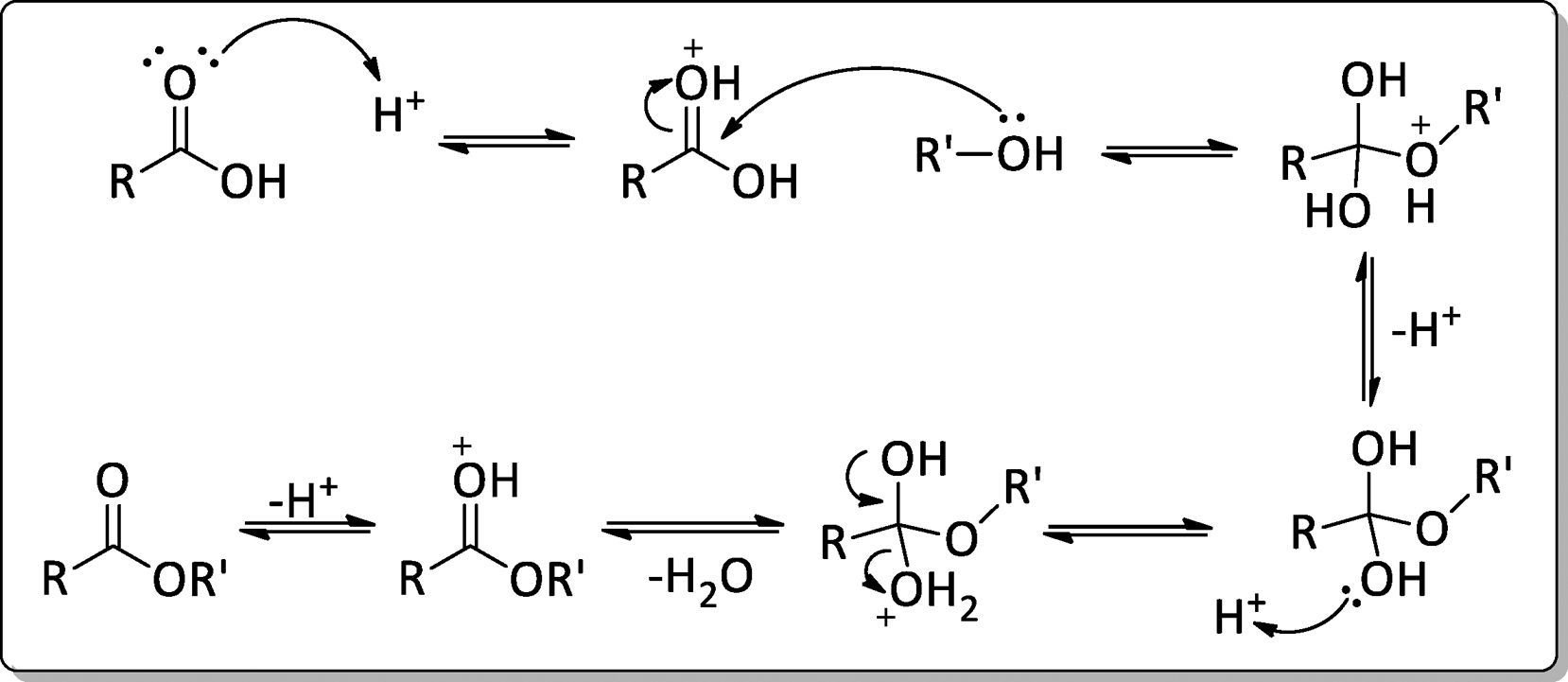
A esterificação de Emil Fischer é uma reação de substituição nucleofílica do grupamento acila catalisada por ácido mineral, envolvendo um ácido carboxílico e um álcool. O ácido mineral protona o átomo de oxigênio do grupo carbonila, tornado o ácido carboxílico muito mais reativo ao ataque nucleofílico do álcool e dando origem a um intermediário tetraédrico. A partir daí, a transferência de um próton de um oxigênio para outro origina um segundo intermediário tetraédrico e converte o grupo OH em um bom grupo de saída. Finalmente a perda de um próton regenera o catalisador ácido, originando o éster conforme a figura 2. 2. O mecanismo de reação para a formação de ésteres a partir de ácidos carboxílicos e alcoóis na presençaa de catalisador ácido foi demonstrado por Solomons e Fryhle (2009).
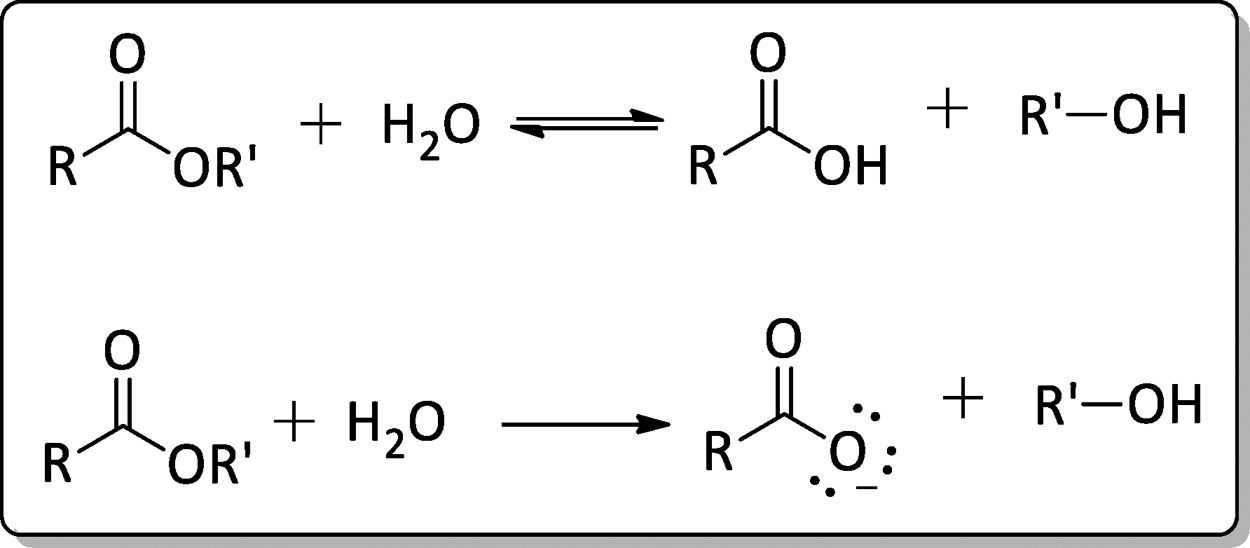
Por outro lado, a esterificação é uma reação reversível, sendo necessária cautela durante todo o processo reacional, de purificação ou ainda de armazenagem. A etapa de purificação do éster é um ponto crítico, pois a reação inversa, a hidrólise do éster, pode ser catalisada tanto por ácido quanto por base, como pode ser visto na figura 3, necessitando de um controle rigoroso na neutralização do meio reacional e na destilação. Assim, para deslocar o equilíbrio em favor dos produtos podem‐se utilizar 2 métodos: remoção de um dos produtos, preferencialmente a água, ou utilizar um excesso de um dos regentes, como o álcool (Neves, 2008).
Em 2004, Costa et al. (2004) propôs o desenvolvimento de um experimento simples para a obtenção de ésteres de baixa massa molar, os quais podem ser facilmente caracterizados por possuírem aromas de frutas. Esta atividade possibilitou a correlação entre os conteúdos programáticos da Química no Ensino Médio e o cotidiano dos alunos.
A reação de esterificação de ácidos monocarboxílicos com álcoois foi extensivamente estudada. Estes estudos envolveram reação de esterificação via catálise homogênea ou heterogênea. Diferentes metodologias podem ser empregadas na reação de esterificação via catálise homogênea ou heterogênea (Rezende, Pinto, Suarez, Aroeira e Pereira et al., 2012). Lilja, Murzin, Salmo, Aumo e Mäki‐Arvela et al. (2002) propuseram uma reação de esterificação sobre catálise heterogênea e homogênea com diferentes ácidos e álcoois usando como catalisador heterogêneo as resinas de troca iônica (amberlyst 15 e smopex‐101) e HCl como catalisador homogêneo.
O emprego de aula experimental na disciplina Análise Orgânica não costuma ser uma estratégia de ensino aplicada nas aulas de Análise Orgânica, pois os conteúdos programáticos selecionados para a disciplina são extensos e os professores responsáveis pela disciplina preferem abordar os conteúdos através de aula expositiva dialogada, pois acreditam que não vão dar conta de todos os conteúdos previstos. Acreditam que as aulas experimentais vão atrapalhar a vivência dos mesmos. Por outro lado, as reações orgânicas geralmente se caracterizam por apresentarem longo tempo de duração, cuidados na manipulação dos reagentes, necessidade de vidraria específica e dificuldade na comprovação imediata dos produtos.
ObjetivoCom o presente trabalho buscou‐se a realização de um experimento simples para obtenção de ésteres, os quais podem ser facilmente caracterizados por técnicas de infravermelho e ressonância magnética nuclear. Esta atividade possibilitou a correlação entre os conteúdos programáticos da disciplina de Análise Orgânica e o cotidiano dos estudantes. Inicialmente os experimentos foram otimizados por 2 estudantes de iniciação científica, coautores do trabalho e, posteriormente, aplicado como aula experimental na disciplina.
MetodologiaMateriais e métodosOs espectros de RMN 1H e 13C (Ressonância Magnética Nuclear de Hidrogênio e Carbono‐13) foram obtidos em espectrofotômetro VARIAN modelo Unity Plus 300MHz, para 1Hea 75MHz para 13C, respectivamente, usando CDCl3 como solvente. Os desvios químicos de RMN 1H e 13C estão expressos em δ ppm relativamente a um padrão de tetrametilsilano (TMS).
Os espectros de infravermelho (IV) dos compostos sólidos foram obtidos com um espectrofotômetro de infravermelho com transformada de Fourier no instrumento BRUKER Modelo IFS 66.
Para obtenção dos espectros recorreu‐se à técnica de pastilha de brometo de potássio: aproximadamente 1mg do composto a estudar foi disperso em cerca de 100mg de brometo de potássio e a mistura prensada a 10t durante 15min.
Os solventes e reagentes comerciais foram utilizados na sua forma comercial para análise (p.a), sem nenhuma purificação adicional.
Para concentrar as soluções orgânicas foram utilizados evaporadores rotatórios do modelo IKA‐WERK operando a pressão reduzida.
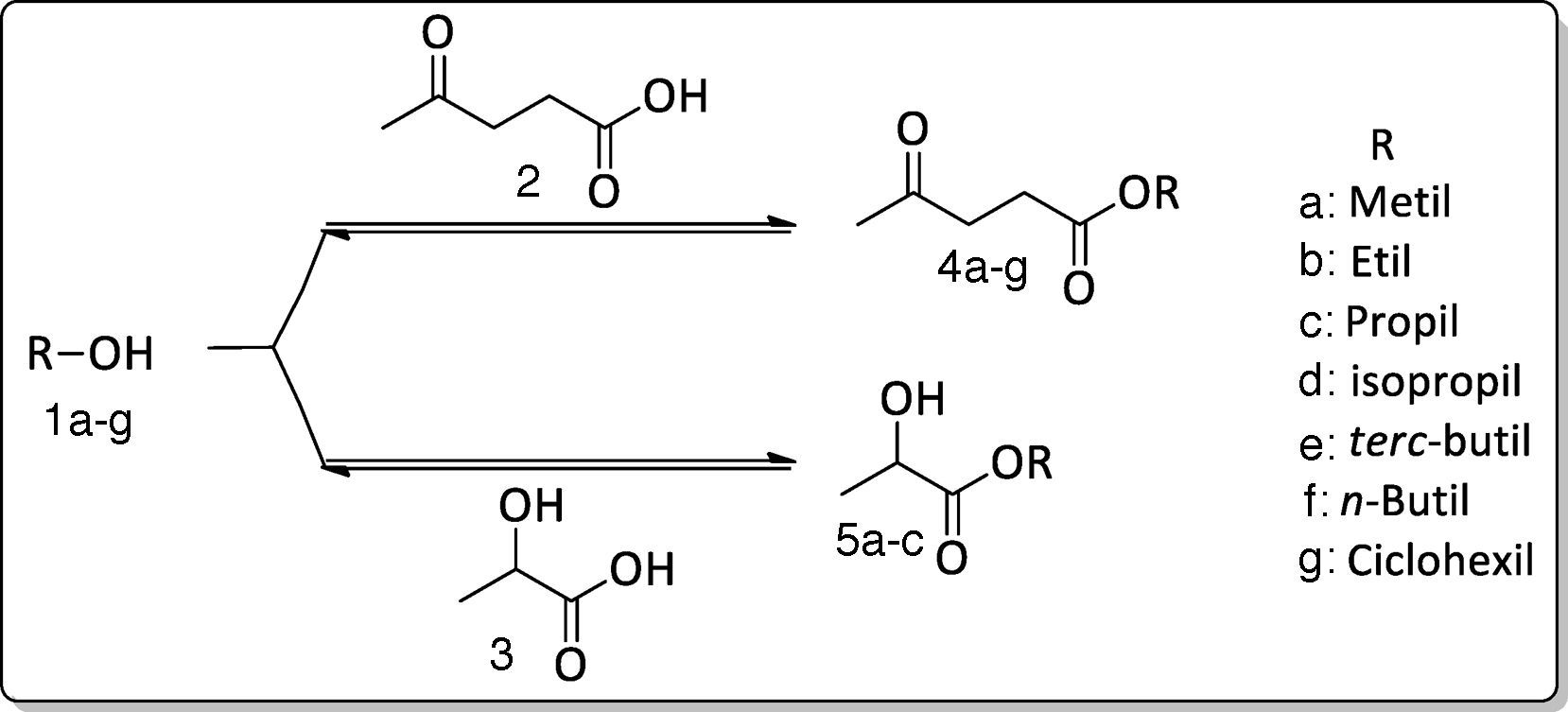
Estratégia de preparaçãoA metodologia consistiu basicamente em reagir o ácido levulínico 2 e ácido (R,S)‐láctico 3 com diferentes álcoois (metanol, etanol, propanol, isopropanol, terc‐butanol, ciclohexanol e n‐butanol), em presença de quantidade catalítica de ácido 4‐tolueno sulfônico sob refluxo (fig. 4).
Procedimento experimentalProcedimento A – Esterificação convencional sob refluxoA uma solução de 99,00 mmol (10 mL, 11,5 g) do ácido levulínico ou ácido láctico (separadamente) em 64 mL de metanol adicionou, a 0 ¿C e sob agitação quantidade catalítica de ácido 4‐tolueno sulfônico mono‐hidratado (0,005 mol/mol do substrato), em seguida a mistura foi aquecida sob agitação a refluxo por 3 horas.. Decorrido o tempo reacional rotaevaporou‐se o excesso de metanol. A seguir neutralizou‐se com 0,25 g de bicarbonato de sódio dissolvido em metanol e hidrolisou com 50 mL de água. Com um funil de separação extraiu‐se a fase orgânica com acetato de etila (3x20 mL), lavou os extratos com água e secou sobre sulfato de sódio. Após evaporação do solvente sobre pressão reduzida o resíduo oleoso foi submetido a uma destilação fracionada fornecendo um líquido oleoso incolor. Usou‐se o mesmo procedimento para o etanol, propanol, isopropanol e terc‐butanol.
Procedimento B – Esterificação usando a vidraria Dean StarkEm um balão de fundo redondo de 250 mL equipado com o agitador magnético, Dean Stark e condensador de refluxo são adicionados 99,00 mmol (10 mL, 11,5 g) do ácido levulínico ou ácido láctico (separadamente), 50 mL de butanol e em seguida adicionou, a 0 ¿C e sob agitação quantidade catalítica de ácido 4‐tolueno sulfônico mono‐hidratado (0,005 mol/mol do substrato). A mistura foi aquecida sob agitação a refluxo até que não se separe mais água no Dean Stark (cerca de 1 h, temperatura do banho de óleo 100‐120¿C, volume de água coletado 2,5 mL). Decorrido o tempo de reação a mistura reacional foi resfriada, e adicionou 50 mL de água, posteriormente transferida para um funil de separação. A fase orgânica foi separada e lavada duas vezes com 50 mL de solução saturada de bicarbonato (liberação de gás) seguida de 20 mL de solução saturada de cloreto de sódio. Dando continuidade, secou a fase orgânica sobre sulfato de sódio e fez‐se uma filtração simples. Após evaporação do solvente sob pressão reduzida o resíduo oleoso foi submetido a uma destilação fracionada ou cromatografia fornecendo um líquido oleoso incolor. Usou‐se o mesmo procedimento para o ciclohexanol.
Estratégia das aulasEsta proposta de experimentação foi desenvolvida no Departamento de Química da Universidade Federal Rural de Pernambuco, envolvendo estudantes do oitavo período do curso de licenciatura em Química. A proposta foi desenvolvida na disciplina Análise Orgânica, por um grupo de 18 estudantes que foram organizados em grupo de 3 estudantes, tendo decorrido durante 4 aulas de 4h e uma aula de 50min.
Neste experimento, além da preparação dos ésteres, trabalhou‐se diversas técnicas de laboratório, tais como, extração, filtração, evaporação, separação e destilação, bem como de métodos de caracterização do produto (infravermelho e ressonância magnética nuclear de próton e carbono).
No primeiro dia de aulas os 6 grupos de trabalho apresentaram oralmente, durante 10min, a proposta de síntese que iam realizar, assim como o material necessário, após leitura do artigo Síntese de Ésteres de Aromas de Frutas: Um Experimento para Cursos de Graduação dentro de um dos Princípios da Química Verde (Oliveira et al., 2014). Após discussão entre o professor e todos os estudantes, acerca do mecanismo da reação de esterificação, deu‐se início ao trabalho, deu‐se início ao trabalho de síntese. Cada grupo realizou a preparação dos ésteres de acordo com o procedimento apresentado detalhadamente no item procedimento experimental, o qual foi construído pelos estudantes coautores do trabalho. Na segunda aula procedeu‐se à neutralização do meio reacional com bicarbonato de sódio e em seguida realizou uma filtração simples e evaporação do solvente. Na terceira aula foi realizada a destilação e separação cromatográfica dos produtos. Convém destacar que a purificação dos ésteres (levulinato de n‐propila, isopropila, n‐buila, terc‐butila e ciclohexila) de alto ponto de ebulição foi realizada por cromatografia coluna, uma vez que os estudantes não conseguiram purificar através de destilação simples.
Na quarta aula os estudantes efetuaram a caracterização recorrendo às técnicas de ressonância magnética nuclear de 1H e de 13C e à espectroscopia de infravermelho, seguindo‐se discussão dos resultados.
Depois da realização da aula experimental cada grupo devia produzir um relatório sobre o experimento, que devia apresentar os seguintes itens: introdução, objetivos, metodologia, resultados e conclusão. Foi explicado aos grupos que os resultados e as conclusões do relatório deveriam responder as perguntas presentes no questionário. O questionário foi composto de 4 perguntas discursivas descritas na seguinte sequência:
- 1.
O que é uma reação de esterificação?
- 2.
O que são ésteres?
- 3.
Quais as metodologias usadas para reação esterificação? Em que consistem?
- 4.
Como elucidar a estrutura de um composto usando as técnicas de IV e RMN?
Posteriormente os relatórios foram entregues ao professor para a correção e análise da contribuição do experimento como ferramenta de avaliação do processo ensino‐aprendizagem. Também foram observados o comportamento e as falas de alguns estudantes durante a aula experimental
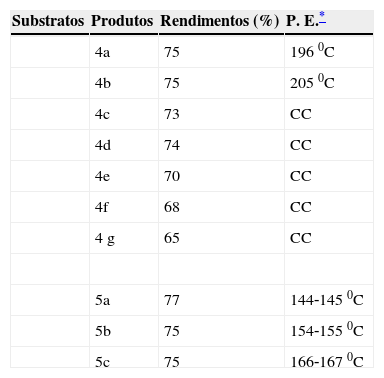
Resultados e discussãoA reação de esterificação foi realizada utilizando o ácido levulínico ou ácido láctico, com diferentes álcoois. Inicialmente o ácido levulínico foi convertido no alquil (metil, etil, n‐propil, isopropil e terc‐butil) levulinato 4a‐e com rendimento variando entre 70‐75% (vide tabela 2), a reação foi realizada em presença do ácido 4‐tolueno sulfônico como catalisador, usando a metodologia de aquecimento sob refluxo convencional. Os resultados acima descritos e apresentados na tabela 2 foram obtidos pelos estudantes.
Rendimentos e ponto de ebulição dos compostos 4a‐g e 5a‐c
| Substratos | Produtos | Rendimentos (%) | P. E.* |
|---|---|---|---|
| 4a | 75 | 1960C | |
| 4b | 75 | 2050C | |
| 4c | 73 | CC | |
| 4d | 74 | CC | |
| 4e | 70 | CC | |
| 4f | 68 | CC | |
| 4g | 65 | CC | |
| 5a | 77 | 144‐1450C | |
| 5b | 75 | 154‐1550C | |
| 5c | 75 | 166‐1670C |
Por outro lado, o ácido láctico foi convertido em alquil (metil, etil e n‐propil) lactato 5a‐c com rendimento de 75‐77%. A reação foi realizada, também em presença do ácido 4‐tolueno sulfônico, como catalisador e aquecimento sob refluxo convencional. Os resultados descritos também foram obtidos pelos estudantes.
O experimento proposto foi realizado partindo‐se do excesso de um dos reagentes, a fim de deslocar o equilíbrio da reação no sentido de formação do éster.
As reações de esterificação também foram realizadas usando aquecimento sob refluxo, empregando uma vidraria denominada Dean Stark, cujo objetivo foi possibilitar a retirada de água do meio, pois em reação de esterificação forma um azeótropo entre os produtos da reação (éster e água), logo a remoção da água do meio desloca o equilíbrio da reação. O tempo reacional foi de 1h. Decorrido este tempo neutralizamos o produto reacional com bicarbonato de sódio, hidrolisamos com água e em seguida extraímos a fase orgânica com acetato de etila. Após evaporar o solvente, obteve‐se um resíduo amarelado que foi submetido a uma destilação ou uma coluna cromatográfica fornecendo um líquido oleoso. Nesta metodologia usou‐se os álcoois n‐butanol e ciclohexanol obtendo os ésteres 4f‐g. Foi explicado aos estudantes que os motivos das escolha dos 2 álcoois foram: a) os ésteres 4f‐g foram obtidos pelo método convencional com rendimento baixo; b) o uso da metodologia empregando a vidraria Dean Stark reduziu o tempo de reação de 3 para 1h; c) devido à redução significativa do tempo de reação, o professor teve condições de discutir com os estudantes o tópico de aula.
A compreensão das reações envolvidas nesse experimento foi alcançada através das discussões pré e pós‐laboratorial em sala de aula, elaboração de relatórios envolvendo algumas questões, tais como o mecanismo da reação de esterificação e reações de hidrólise de éster, catalisada por ácido utilizada nesse experimento.
Salienta‐se a importância da socialização dos resultados entre os grupos para o melhor aproveitamento da experiência, uma vez que cada grupo efetua 3 reações, 2 pelo método de aquecimento convencional e a terceira com auxílio do Dean Stark. Logo, durante o período em que o sistema permanece reagindo, cada grupo observou sua respectiva reação e comparou diferenças com as reações ao utilizar as diferentes metodologias e resultados dos outros grupos.
Na etapa de separação dos produtos o emprego da solução salina provocou o aumento da força iônica do meio, ocasionando a formação de interações intermoleculares entre o sal, os reagentes em excesso, o catalisador e a água formada na reação, uma vez que se trata de substâncias polares. Como os ésteres são compostos de baixa polaridade, eles apresentaram uma menor solubilidade no meio, facilitando sua separação.
Uma vez obtidos, os compostos 4c‐g, foram purificados através de cromatografia em coluna, por apresentar pontos de ebulição elevados. No decorrer da cromatografia foram trabalhados os conceitos de fase móvel, fase estacionária, polaridade de solvente, fator de retenção, cromatografia planar, cromatografia líquida clássica, cromatografia líquida de alta eficiência e cromatografia gasosa de alta resolução. Por outro lado, os compostos 4a‐b e 5a‐c foram submetidos a uma destilação simples, onde foram trabalhados os conceitos de ponto de ebulição, mistura azeotrópica, calor e temperatura.
Após preparação e purificação dos compostos, deu‐se a caracterização estrutural, através de técnicas espectroscópicas. Particularmente, as técnicas espectroscópicas podem ser utilizadas para a caracterização de materiais. Isso significa que com elas é possível obter informações sobre os tipos de ligações entre átomos, a vizinhança atômica desses átomos e ligações, a presença e a concentração de substâncias em amostras, etc. Na escala atômica e molecular, a caracterização de compostos tem um significado especial, pois trata das pequenas peças que formam todas as coisas (os átomos) e como elas estão arranjadas entre si. Finalmente, a espectroscopia é, sim, uma aplicação do conhecimento científico que permite gerar mais conhecimento.
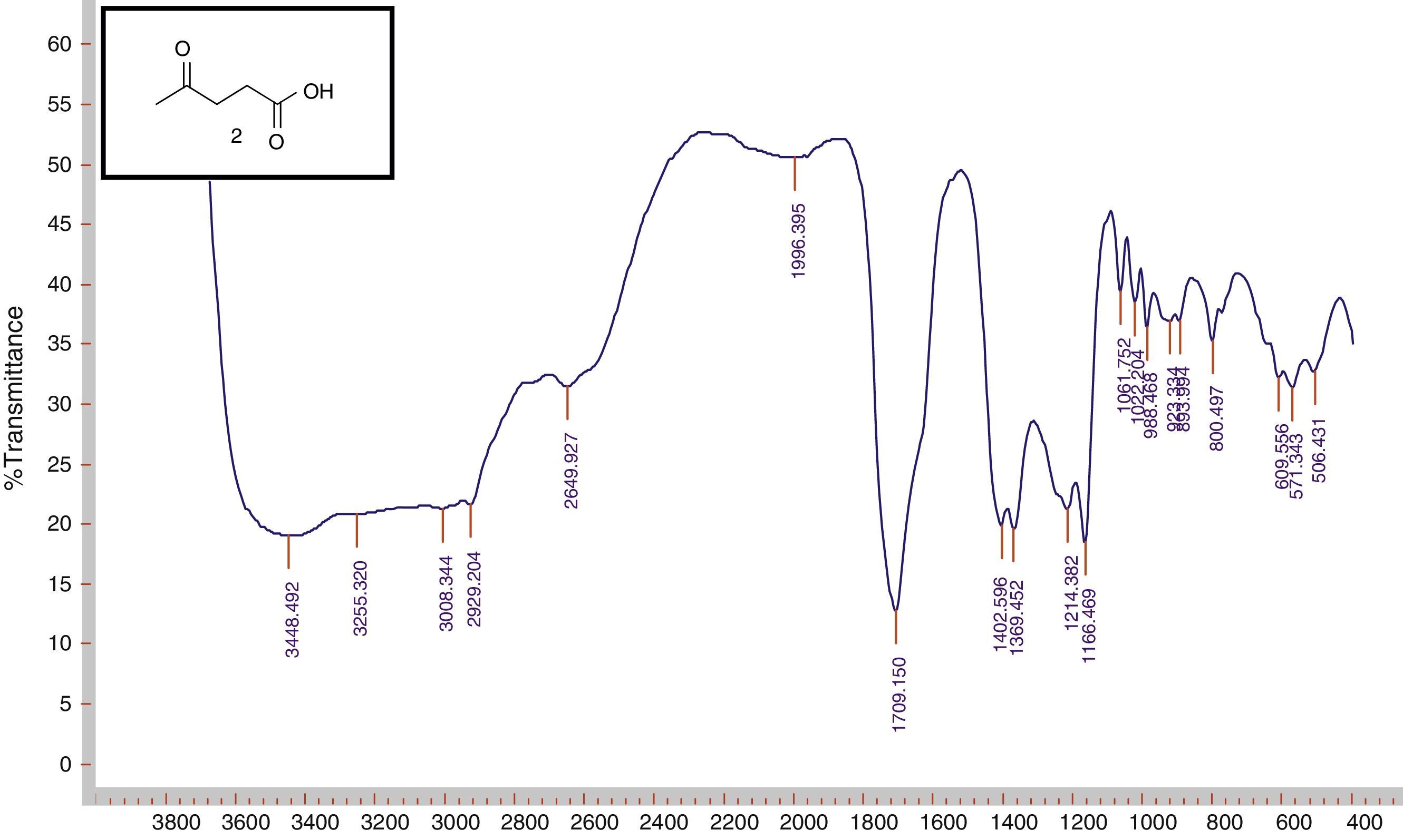
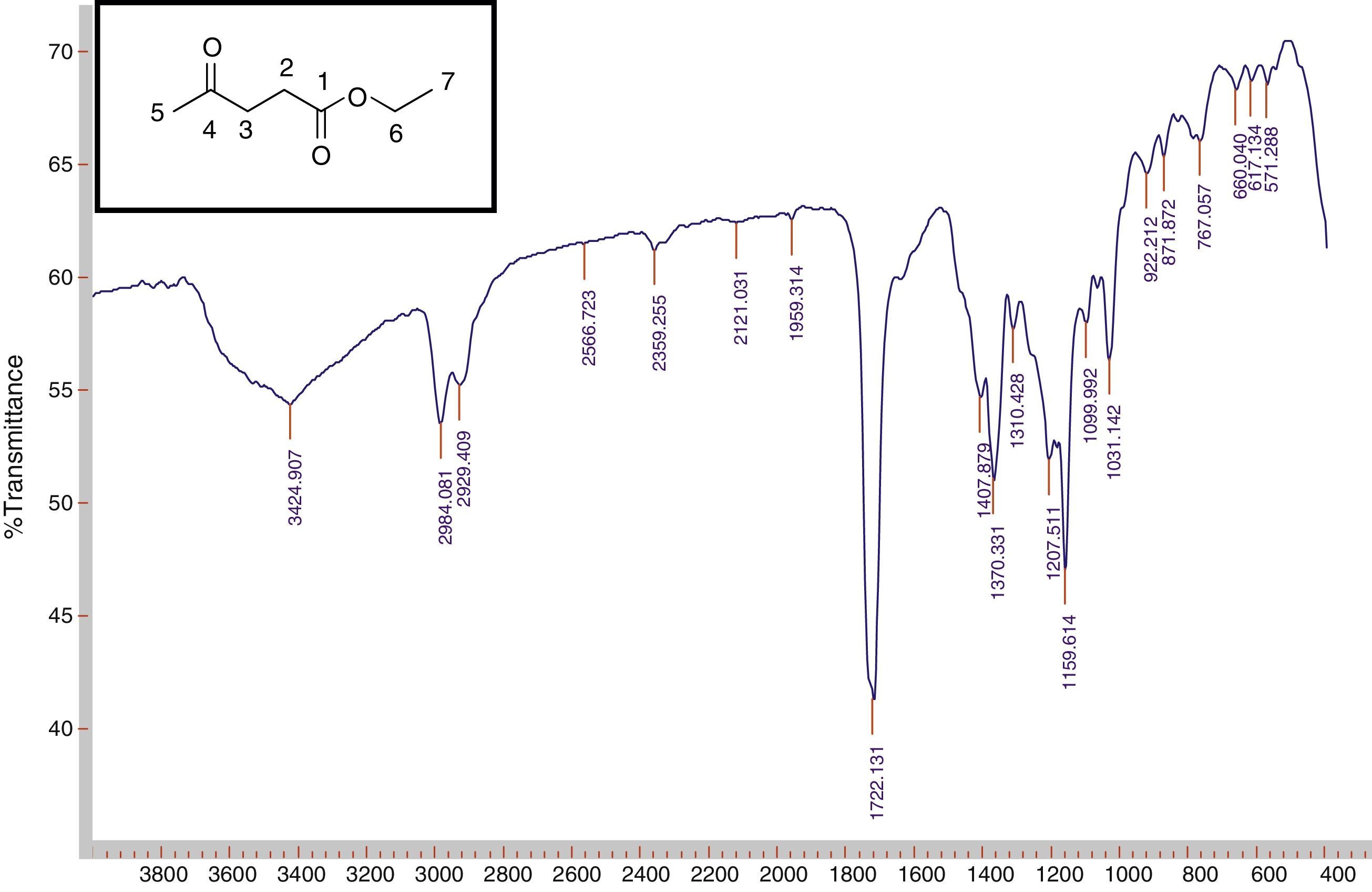
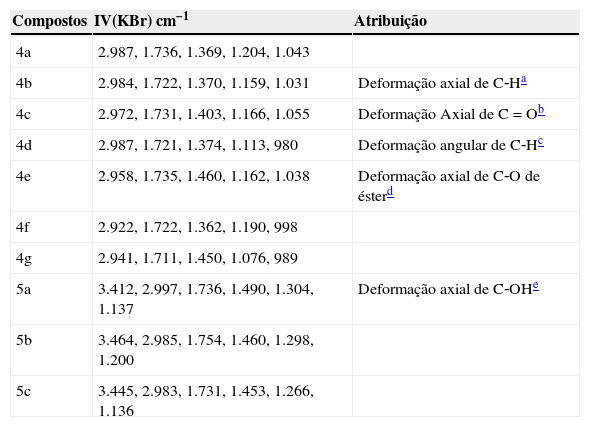
Inicialmente os estudantes analisaram os espectros de infravermelho dos ésteres obtidos. A comparação dos espectros de IV dos compostos de partida (fig. 5) e dos produtos obtidos (fig. 6) permitiu que os estudantes observassem as mudanças estruturais dos compostos finais.
No caso do composto de partida, eles perceberam uma banda larga do grupo OH (hidroxila) na região de 2640‐3500 cm‐1, o que não se observou no composto obtido. Os dados dos ésteres obtidos estão expostos na tabela 3 (anexo 1), a qual foi construídas, após análise do relatório escritos pelos estudantes
Os estudantes também observaram que os espectros de infravermelho dos ésteres derivados do ácido láctico apresentaram uma banda larga do grupo OH, isto por que os ésteres formados possuem na sua cadeia um grupo OH.
No decorrer da análise do espectro de infravermelho os professores abordaram os conceitos de número de onda, frequência, vibração, estiramento simétrico e não simétrico, deformação angular, deformação axial.
Em um momento posterior foram analisados e discutidos os espectros de RMN dos compostos sintetizados. O fenômeno da RMN foi observado experimentalmente pela primeira vez em 1946, por F. Bloch e E. Purcell (Prêmio Nobel de Física de 1952). A RMN é observada quando se incide ondas de rádio frequência em uma amostra que tem isótopos com spin nuclear maior que 0 (por exemplo, 1H) na presença de um campo magnético. A RMN passou a ser de grande importância para análises químicas já na década de 50, com a descoberta de que seu sinal reflete o ambiente químico em que o núcleo se encontra em uma molécula. Esse fenômeno, denominado deslocamento químico, permitiu um grande avanço na área de determinação estrutural de moléculas pequenas e/ou de média massa molecular.
Após análise dos espectros de RMN, os estudantes concluíram que: o espectro de RMN 1H (300MHz, CDCl3) do levulinato de metila 4a apresentou sinais de absorção como um simpleto na região de 3,59ppm, atribuída à metila do éster. Os hidrogênios em C‐3 e C‐2 acoplam entre si e fornecem um tripleto em δ 2,69ppm (J=12,0Hz) atribuído ao hidrogênio em C‐3 e outro tripleto em δ 2,49ppm (J=12,0Hz), atribuído ao hidrogênio de C‐2. O simpleto em δ 2,11ppm foi atribuído aos hidrogênios metílicos em C‐5. A análise de ressonância magnética nuclear de hidrogênio e de carbono‐13, dos outros ésteres, estão sumarizados na tabela 4 (anexo 2).
No decorrer da análise do espectro de ressonância magnética nuclear hidrogênio e de carbono‐13 foram abordados os conceitos de estados de spin, momentos magnéticos nucleares, deslocamento, multiplicidade, constante de acoplamento, solvente, equivalência química, ambiente químico, campo baixo, campo alto, blindagem, desblindagem, desdobramento e anisotropia magnética, carbono‐13.
O experimento foi aplicado no final do semestre, com o objetivo de avaliar os estudantes, no que se refere a todos os conteúdos vivenciados em sala de aula ao logo do semestre. O instrumento usado na avaliação foram os relatórios escritos pelos estudantes. Convém destacar que o experimento pode ser utilizado para ilustrar os seguintes conteúdos em sala de aula, por exemplo: a) ácidos carboxílicos e derivados dos ácidos; b) propriedades físicas e químicas de ácidos e derivados; c) reação de esterificação, mecanismo de formação do éster e velocidades de hidrólise; d) técnica de separação por diferença de solubilidade; e) método instrumental para detecção de grupos funcionais (espectroscopia no infravermelho); e f) elucidação estrutural de um composto (espectro de ressonância magnética nuclear de próton e carbono).
Ao propor a preparação e caracterização de ésteres conseguimos abordar os seguintes conteúdos programáticos na disciplina de Análise Orgânica: a) métodos clássicos de separação e purificação de substâncias orgânicas (filtração, extração e destilação); b) purificação de compostos orgânicos – cromatografia; c) bases teóricas e aspectos históricos da cromatografia; c) cromatografia planar e em coluna; d) determinação estrutural – espectrometria de infravermelho (IV); e) espectros de IV de hidrocarbonetos e outros grupos funcionais; f) interpretação de espectros de infravermelho; g) determinação estrutural – espectrometria de ressonância magnésia nuclear de 1H e 13C; h) o espectro eletromagnético; i) spin nuclear – a origem do sinal; j) o deslocamento químico; k) espectros de RMN de 1H e de 13C; l) determinação estrutural – espectrometria de massas (EM); m) o espectro de massa; n) determinação das fórmulas moleculares e dos pesos moleculares; e o) fragmentação.
Finalizando, o relatório foi escolhido como ferramenta para avaliação do processo ensino‐aprendizagem por permitir a pesquisa e formulação de ideias por parte do estudante envolvido na aula experimental, permitindo ao estudante uma síntese de pensamento, assim como o incentivo a buscar novas fontes de informação em outros meios de comunicação científica.
Os grupos tiveram um período de 7 dias para confeccionar o relatório, sendo que poderiam utilizar todas a fontes de pesquisa possíveis (livros, revistas, sites, etc.). Foi utilizada uma aula (50min) para a exposição por parte dos professores de como seria feito o relatório e que dados deviam constar nesse relatório. A produção do relatório segundo os estudantes auxiliou a aprendizagem dos conteúdos vivenciados.
Após a entrega dos relatórios foram feitas as correções e as análises em cima das respostas para as perguntas feitas no roteiro do experimento. Todos os relatórios apresentaram os itens pedidos (introdução, objetivos, resultados e conclusões) e as respostas foram satisfatórias quanto às perguntas. Além disso, todas as tabelas foram construídas com base no que foi descrito pelos estudantes nos relatórios.
Do ponto de vista de custos, o experimento é acessível, pois emprega apenas 5 reagentes de baixo custo (ácido levulínico, ácido láctico, diferentes álcoois – 2 para cada grupo – e ácido 4‐tolueno sulfônico). Em termos de segurança, é preferível em comparação a uma esterificação tradicional que geralmente emprega como catalisador o ácido sulfúrico concentrado, que em contato com a pele pode provocar queimaduras graves.
Considerações finaisEste trabalho demonstra uma estratégia experimental simples para obtenção de ésteres a partir ácido levulínico e ácido (R,S)‐láctico em aulas experimentais no curso de Química, na disciplina de Análise Orgânica. O principal objetivo deste trabalho foi a realização de um experimento simples no qual o conteúdo referente às reações de esterificação, exigido na ementa da disciplina, fosse aplicado na preparação de ésteres, utilizando ferramentas comuns em um laboratório de química orgânica. Por se tratar de uma reação de duração de uma ou 3h, permitiu que o estudante, enquanto aguardasse o término de uma determinada reação, utilizasse algumas técnicas de laboratório, tais como extração, neutralização, hidrólise, filtração, evaporação e destilação, bem como de métodos de caracterização do produto (infravermelho e ressonância magnética nuclear de próton e carbono), de produtos já preparados e caracterizados pelos 2 estudantes de iniciação científica, coautores do trabalho. Todavia, o experimento proposto contempla o treinamento do graduando em diversas técnicas de laboratório, bem como na síntese, caracterização estrutural, manuseio e reatividade de substância orgânica, e envolve os mecanismos iônicos de eliminação e adição.
O experimento mostrou‐se potencialmente útil para que os estudantes empreguem a espectroscopia na elucidação estrutural de compostos sintetizados, bem como buscar conhecimentos teóricos para sustentar as hipóteses formuladas.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores deste trabalho agradecem a todas as agências que auxiliam financeiramente as nossas pesquisas: a FACEPE, através do financiamento do projeto APQ‐FACEPE (1257‐1.06/2010); a CAPES e CNPq pelas bolsas concedidas aos estudantes de iniciação científica e pós‐graduação.
Análise dos espectros de IV dos ésteres obtidos
| Compostos | IV(KBr) cm−1 | Atribuição |
|---|---|---|
| 4a | 2.987, 1.736, 1.369, 1.204, 1.043 | |
| 4b | 2.984, 1.722, 1.370, 1.159, 1.031 | Deformação axial de C‐Ha |
| 4c | 2.972, 1.731, 1.403, 1.166, 1.055 | Deformação Axial de C=Ob |
| 4d | 2.987, 1.721, 1.374, 1.113, 980 | Deformação angular de C‐Hc |
| 4e | 2.958, 1.735, 1.460, 1.162, 1.038 | Deformação axial de C‐O de ésterd |
| 4f | 2.922, 1.722, 1.362, 1.190, 998 | |
| 4g | 2.941, 1.711, 1.450, 1.076, 989 | |
| 5a | 3.412, 2.997, 1.736, 1.490, 1.304, 1.137 | Deformação axial de C‐OHe |
| 5b | 3.464, 2.985, 1.754, 1.460, 1.298, 1.200 | |
| 5c | 3.445, 2.983, 1.731, 1.453, 1.266, 1.136 |
Análise dos espectros de RMN 1H e RMN 13C dos ésteres obtidos
| Compostos | RMN 1H* | RMN 13C** |
|---|---|---|
| δ 3,59 (s, 3H, CH3 do C‐6); 2,69 (t, 2H, J=12,0Hz, CH2 do C‐3); 2,49 (t, 2H, J=12,0Hz, CH2 do C‐2); 2,11 (s, 3H, CH3, C‐5) | δ 206,6 (C‐4); 173,0 (C‐1); 51,6 (C‐6); 37,7 (C‐3); 29,6 (C‐2); 27,5 (C‐5) | |
| δ 3,80 (m, 2H, CH2CH3 do C‐6); 2,45 (t, 2H, J=6,6Hz, CH2 do C‐3); 2,24 (t, 2H, J=6,6Hz, CH2 do C‐2); 1,87 (s, 3H, CH3 do C‐5); (t, 3H, J=7,2Hz, CH3 do C‐7) | δ 207,1 (C‐4); 172,0 (C‐1); 59,5 (C‐6); 38,4 (C‐3); 26,4 (C‐2); 24,5 (C‐5); 13,6 (C‐7) | |
| δ 3,76 (t, 2H, J=6,6Hz, CH2 do C‐3); 2,50 (t, 2H, J=6,3Hz, CH2 do C‐2); 2,29 (t, 2H, J=6,6Hz, CH2 do C‐8); 1,93 (s, 3H, CH3 do C‐5), 1,39 (q, 2H, C‐7, J=6,6Hz, CH2 do C‐7); 0,69 (t, 3H, C‐8, J=7,2Hz, CH2 do C‐8) | δ 206,0 (C‐4); 172,1 (C‐1); 65,5 (C‐6); 37,2 (C‐3); 29,1 (C‐2); 27,3 (C‐5); 21,3 (C‐7); 9,7 (C‐8) | |
| δ 4,77 (q, 1H, C‐6, J=7,2Hz, CH do C‐6); 2,52 (t, 2H, J=6,3Hz, CH2 do C‐3); 2,31 (t, 3H, J=6,9Hz, CH2 do C‐2); 1,96 (s, 3H, CH3 do C‐5); 1,16 (dd, 3H, C‐7 e C‐8, J=2,4Hz e J=3,3Hz) | δ 206,2 (C‐4); 171,7 (C‐1); 67,3 (C‐6); 37,4 (C‐2); 29,3 (C‐3); 27,8 (C‐5); 21,2 (C‐7, C‐5) | |
| δ 2,74 (t, 2H, J=6,3Hz, CH2 do C‐3); 2,58 (t, 2H, J=6,6Hz, CH2 do C‐2); 2,16 (s, 3H, CH3 do C‐5); 1,40 (s, 9H, CH3) | δ 206,9 (C‐4); 177,7 (C‐1); 77,4 (C‐6); 38,0 (C‐3); 29,2 (C‐2); 28,6 (C‐7, C‐8, C‐9); 24,6 (C‐5) | |
| δ 3,97 (t, 2H, J=6,6Hz, CH2 do C‐6), 2,66 (t, 2H, J=6,3Hz, CH2 do C‐3); 2,47 (t, 2H, J=6,3Hz, CH2 do C‐2); 2,10 (s, 3H, CH3 do C‐5); 1,51 (q, 2H, C‐7, J=7,5Hz, CH2 do C‐7); 1,29 (q, 2H, C‐8, J=7,5Hz, CH2 do C‐8); 0,83 (t, 3H, C‐9, J=7,2Hz, CH2 do C‐9) | δ 206,5 (C‐4); 172,6 (C‐1); 64,3 (C‐6); 37,7 (C‐3); 30,4 (C‐2); 29,6 (C‐7); 27,7 (C‐5); 18,9 (C‐8); 13,4 (C‐9) | |
| δ 3,32 (q, 1H, J=6,9Hz, CH do C‐6); 2,54 (t, 2H, J=6,3Hz, CH2 do C‐3); 2,33 (t, 3H, J=6,6Hz, CH2 do C‐2); 1,96 (s, 3H, CH3, C‐5), 1,66‐0,99 (m, 10H, CH2 do ciclohexil) | δ 206,9 (C‐4); 171,8 (C‐1), 69,4 (C‐6); 34,8 (C‐3); 29,2 (C‐7, C‐7′); 27,8 (C‐2); 24,8 (C‐5); 23,1 (C‐8, C‐8′). | |
| δ 4,20 (q, 1H, J=6,9Hz, CH do C‐2); 3,34 (s largo, 1H, OH); 1,45‐1,32 (d, 3H, J=7,2Hz, CH3 do C‐3) | δ 175,9 (C‐1); 68,8 (C‐2); 52,2 (C‐4); 20,1 (C‐3) | |
| δ 5,15 (q, 2H, J=7,2Hz, CH2 do C‐4); 4,33 (q, 1H, J=6,9Hz, CH do C‐2); 3,58 (s largo, 1H, OH); 1,49 (t, 3H, J=7,2Hz, CH3 do C‐3); 1,26 (t, 3H, J= 7,5Hz, CH3 do C‐5) | δ 175,1 (C‐1); 69,3 (C‐2); 69,0 (C‐4); 20,4 (C‐3); 16,8 (C‐5) | |
| δ 4,90 (m, 1H, CH do C‐4); 4,07 (q, 3H, J=7,2Hz, CH do C‐2); 3,53 (s, largo 1H, OH); 2,11 (d, 3H, J=6,9Hz, CH3 do C‐3); 1,08 (dd, 3H, J=2,1Hz, J=7,1Hz, CH3 do C‐5 e C‐6) | δ 175,3 (C‐1); 80,1 (C‐2); 36,5 (C‐4); 16,9 (C‐3); 16,2 (C‐5, C‐6) |
H: hidrogênio analisado no espectro de RMN 1H.
A revisão por pares é da responsabilidade da Universidad Nacional Autónoma de México.