Las bronquiectasias (BQ) son una enfermedad tanto heterogénea en su presentación como compleja en su naturaleza. Una variable única no es capaz de captar el impacto total que las BQ producen sobre el individuo. Algunos autores han observado la presencia de algunos fenotipos clínicos más homogéneos en su clínica, pronóstico o respuesta al tratamiento, como el paciente con infección bronquial crónica por P. aeruginosa, el paciente «exacerbador» o el overlap (BQ + enfermedad pulmonar obstructiva crónica [EPOC]). Otros autores han desarrollado escalas multidimensionales que tratan de clasificar la gravedad o el pronóstico, teniendo en cuenta diferentes aspectos de la enfermedad como la clínica, la función pulmonar, la extensión radiológica o el perfil microbiológico entre otros. Finalmente, se están desarrollando herramientas clínicas que van un paso más allá y valoran las BQ como una enfermedad compleja, teniendo en cuenta no solo su gravedad, sino también su actividad biológica y la forma que el paciente tiene de vivir la enfermedad (impacto). Para ello, además de las puntuaciones multidimensionales de gravedad, se han venido desarrollando diferentes cuestionarios de calidad de vida específicos o se han validado para esta enfermedad aquellos que eran utilizados en otras patologías respiratorias, fundamentalmente EPOC. Por otro lado, se siguen investigando biomarcadores biológicos válidos que se relacionen con outcomes de importancia en BQ.
Bronchiectasis is a disease that is both heterogeneous in form and complex in nature. The overall impact of bronchiectasis on the individual cannot be captured by a single variable. Some authors have observed the presence of some more homogeneous clinical phenotypes in terms of symptoms, prognosis or response to treatment in, for example, patients with chronic P. aeruginosa bronchial infection, exacerbators or patients with bronchiectasis and COPD overlap. Other authors have developed multidimensional scales that attempt to classify severity or prognosis, taking into account different aspects of the disease, such as symptoms, lung function, radiological extension, and microbiological profile, among others. Finally, clinical tools are being developed that go a step further and consider bronchiectasis as a complex disease, taking into account not only its severity, but also its biological activity and impact on the patient's way of life. To this end, multidimensional severity scores and different specific quality of life questionnaires have been developed, and those used in other respiratory pathologies, mainly COPD, have been validated for this disease. On another front, the search continues for valid biological biomarkers associated with outcomes of importance in bronchiectasis.
Las bronquiectasias (BQ) constituyen un síndrome clínico caracterizado por síntomas respiratorios crónicos, tos con expectoración variable, de mucosa a purulenta, y recurrentes exacerbaciones1-3. Se caracterizan por una dilatación anormal e irreversible del árbol bronquial consecuencia de una inflamación en su pared, a veces amplificada por la infección bronquial crónica (IBC), y son secundarias a múltiples etiologías: postinfecciosa, idiopática, enfermedad pulmonar obstructiva crónica (EPOC), asma, aspergilosis broncopulmonar alérgica (ABPA), inmunodeficiencias, discinesia ciliar primaria y enfermedades sistémicas inflamatorias, entre otras4.
El interés por las BQ va en aumento, ya sea por el incremento progresivo en su prevalencia, fruto de la mayor edad en la población general con más riesgo de presentarlas y las mejoras en el diagnóstico por el uso generalizado de tomografía de alta resolución (TCAR) o por ser las BQ una enfermedad con alta morbimortalidad y consumo de recursos5,6. La pluralidad en su presentación y evolución, la extensión del daño estructural, la tendencia que producen a la infección bronquial, hemoptisis o exacerbación, así como las características del propio sujeto, hacen de las BQ una enfermedad compleja y heterogénea7-9.
Para identificar pacientes con un peor pronóstico o aquellos que van a responder a determinadas terapias, surgió la necesidad de estratificar a los enfermos en fenotipos clínicos. El término «fenotipo» define las características observables en un individuo fruto de la interacción entre genética (genotipo) y el medio ambiente. El término «endotipo», explica los mecanismos fisiopatológicos que condicionan un determinado genotipo. Categorizar a los pacientes en diferentes fenotipos clínicos ayuda a individualizar el seguimiento y el tratamiento10,11. Existe experiencia previa en caracterizar los fenotipos en distintas patologías respiratorias, como la EPOC y el asma. Sin embargo, en BQ, hay descritas distintas tentativas según la serie de enfermos evaluados. Martínez-García et al.12 identificaron cuatro fenotipos en cinco centros españoles: mujeres con enfermedad leve; mujeres de edad avanzada y sobrepeso con BQ leves; varones de edad avanzada con enfermedad grave e IBC, principalmente por Pseudomonas aeruginosa, y frecuentes exacerbaciones; y pacientes de edad avanzada con enfermedad grave sin exacerbaciones. Por su parte, Aliberti et al.13 clasificaron en cuatro fenotipos un grupo de pacientes de cinco centros europeos: pacientes graves con IBC por P. aeruginosa; con enfermedad moderada e IBC por otros microorganismos; pacientes con hipersecreción sin aislamientos bacterianos y, por último, las llamadas BQ secas, es decir, pacientes con imágenes radiológicas de BQ sin síntomas secundarios. Posteriormente, dado que la exacerbación pulmonar es la complicación más frecuente que presentan los enfermos con BQ, con implicaciones en calidad de vida y mortalidad, fue sugerida la existencia de un «fenotipo exacerbador», considerado como aquel que presenta más de dos o tres exacerbaciones anuales, según las series14,15.
En general, los fenotipos publicados12,13 no han sido demasiado útiles en la práctica clínica habitual. Probablemente, los fenotipos más robustos sean el del paciente con IBC por Pseudomonas aeruginosa13 y el del exacerbador frecuente14, a los que podrán sumarse por sus peculiaridades específicas el de los pacientes con BQ asociadas a EPOC16-18 y el de los inmunocomprometidos.
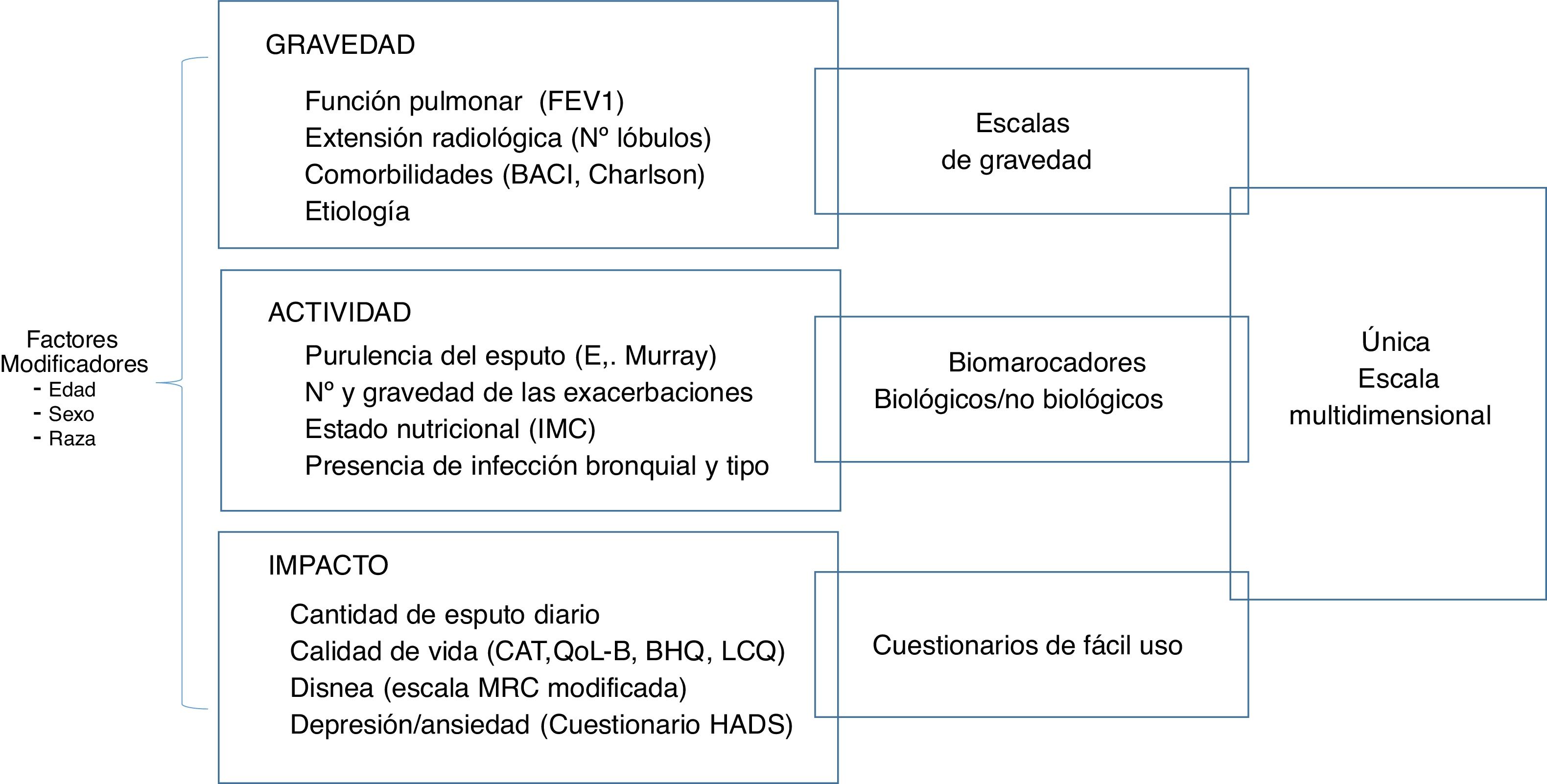
Para aproximarnos al objetivo «medicina de precisión» (definida como terapia individualizada según los rasgos genéticos, biomarcadores, fenotipos y aspectos psicológicos), abordaremos en este capítulo las BQ desde la perspectiva de la gravedad, actividad e impacto (fig. 1), así como de sus rasgos tratables8,9.
GravedadEsta dimensión incluye la medición de aquellas variables asociadas al daño de la enfermedad sobre los órganos diana a los que afecta. En el caso concreto de las BQ, sería importante valorar: etiología, alteración de la función pulmonar, daño estructural pulmonar (extensión en la TCAR), edad y comorbilidades de la persona que las padece. Muchas de estas variables han sido incluidas en diferentes scores multidimensionales publicados9.
EtiologíaNumerosas enfermedades pueden desarrollar BQ, influyendo en sus manifestaciones clínicas, evolución y pronóstico. Dentro de todas las causas que pueden originar esta enfermedad, es relevante identificar aquellas con tratamiento específico ya que podría mejorar el pronóstico. Las diferentes etiologías van a variar en función del país de origen y, de forma más ostensible, en relación al continente de origen. Por esta razón, son importantes los registros nacionales e internacionales, ya que nos permiten conocer la realidad de cada país. En los continentes en vías de desarrollo (algunos países de Asia, América del Sur y África) predominan las causas postinfecciosas y las idiopáticas en mayor proporción16.
Olveira et al.17 publicaron los datos del primer registro español (Registro Histórico) que fue pionero en todo el mundo. Posiblemente, este estudio presentó un sesgo de selección dado que muchos de los centros que incluyeron pacientes eran unidades de referencias en fibrosis quística e inmunodeficiencias, por lo cual el porcentaje relativo de estas enfermedades pudo estar hipertrofiado con respecto a otras series. Las etiologías con mayor riesgo de presentar peor función pulmonar fueron las BQ postinfecciosas y las secundarias a EPOC y asma. Las BQ que se diagnosticaban a mayor edad presentaban una mejor función pulmonar.
De la Rosa et al.18 analizaron en este mismo registro histórico español, las peculiaridades de las BQ asociadas a EPOC en comparación al resto de las etiologías, destacando en los EPOC, mayor edad, peor función pulmonar y mayor mortalidad.
En el Registro Español Informatizado de Pacientes con BQ (RIBRON) más reciente, que recoge datos en el periodo de 2015 a 2019, las causas postinfecciosas, las idiopáticas, las secundarias a EPOC y a asma, las inmunodeficiencias y las relacionadas con enfermedades genéticas e inflamatorias sistémicas, fueron las etiologías más frecuentes. Dos tercios de los pacientes eran mujeres y presentaron peculiaridades propias y menor gravedad que los hombres. En los próximos meses dispondremos de publicaciones interesantes sobre el seguimiento de estos pacientes19.
El European Multicentre Bronchiectasis Audit and Research Collaboration (Registro EMBARC) recogió datos de BQ de 23 países europeos. La etiología más frecuente fue la idiopática, seguida de las postinfecciosa; una alta proporción de pacientes tenían diagnóstico de inmunodeficiencias, ABPA, infección por micobacterias ambientales y déficit de alfa 1 antitripsina16.
Función pulmonarDe los parámetros de función pulmonar, el FEV1 es el más aceptado como marcador de obstrucción al flujo aéreo. En el estudio de Olveira et al. del registro histórico17, los factores de riesgo asociados a una peor función pulmonar fueron: el sexo femenino, la mayor edad, un menor índice de masa corporal (IMC) y la presencia de IBC. Así mismo, las etiologías que se relacionaron con una peor función pulmonar fueron las BQ postinfecciosas, las asociadas a asma y las secundarias a EPOC; las relacionadas con mejor función pulmonar fueron las BQ asociadas a inmunodeficiencias primarias y las idiopáticas.
En el trabajo realizado sobre datos del registro RIBRON, en el que se analizan la pérdida de función pulmonar y los posibles factores que intervienen, se describe una pérdida anual de FEV1 de unos -31,6 mL y factores como la edad, la IBC por P. aeruginosa, las exacerbaciones graves y los valores más altos de FEV1 influían en el deterioro (datos no publicados)20.
Se ha observado un declive en FEV1 superior a 100 mL anuales asociado a la IBC, especialmente por P. aeruginosa u otros microorganismos potencialmente patógenos (MPP)21.
También otro factor que influye en el valor del FEV1 es la existencia de exacerbaciones, especialmente en aquellos enfermos con más de tres exacerbaciones anuales, en los que la mayoría presentan valores por debajo de 70% de FEV114. En los scores de gravedad en BQ, el valor del porcentaje de FEV1 representa un ítem importante en la puntación total en casos con FEV1 ≤ 50%22.
RadiologíaLa TCAR es la técnica de elección tanto para el diagnóstico como para valorar la morfología, extensión y progresión de las bronquiectasias. Por otro lado, también ayuda a la toma de decisiones terapéuticas y al diagnóstico de hallazgos coexistentes. Para el diagnóstico se aconseja seguir los criterios descritos por Webb y Naidich et al.23. Se utilizan comúnmente los protocolos de adquisición de baja radiación (< 1 mSv), volumétricos, sin contraste y con un algoritmo de reconstrucción de alta resolución con espesores de 1-1,25 mm cada 10 mm en inspiración máxima. Las imágenes en espiración pueden ayudar a valorar la presencia de atrapamiento aéreo, de broncomalacia y de alteraciones en la pequeña vía aérea. Se utiliza como signo fundamental, la demostración de una dilatación bronquial tomando como referencia el diámetro de la arteria bronquial adyacente, si bien hasta un 20% de individuos ancianos sanos pueden presentar este criterio radiológico1-3.
De los múltiples sistemas de puntuación radiológica existentes, se recomienda por su sencillez la puntuación de Reiff modificada24. Esta puntuación se basa en el cociente: diámetro de la luz bronquial/diámetro del vaso adyacente (0 puntos ≤ 1; 1 punto = 1-2; 2 puntos = 2-3; 3 puntos ≥ 3) en cada uno de los seis lóbulos pulmonares. En el caso de necesitar información radiológica más detallada, se recomienda el sistema de puntuación modificada de Bhalla et al.25, que contempla además ítems de engrosamiento de la pared bronquial, atrapamiento aéreo, bullas, consolidación y gravedad general. Sin embargo, la correlación entre ambas puntuaciones es muy elevada.
Los hallazgos radiológicos de las BQ se asocian a la etiología, síntomas, frecuencia de exacerbaciones y riesgo de muerte10. Las BQ basales se pueden observar en las formas idiopáticas, asociadas a EPOC o a aspiración. Las BQ en lóbulo medio y língula se asocian a infección por micobacterias ambientales y a la discinesia ciliar primaria, mientras que las centrales con ABPA o traqueobroncomegalia (Síndrome de Mounier-Kuhn). Finalmente, las BQ en lóbulos superiores son más sugestivos de fibrosis quística y etiología post-tuberculosa1-3. Tanto la existencia de BQ quísticas como el número de lóbulos afectos son factores independientes de exacerbaciones graves, por lo cual es importante verificar estos hallazgos10.
Edad y comorbilidadesA medida que avanza la edad se describe un aumento en el número de comorbilidades. La media de edad de los pacientes con BQ se sitúa en torno a los 60-70, aunque presenta grandes variaciones con respecto a la situación geográfica. Así en RIBRON, en el análisis de los 1.912 pacientes19 la edad media fue de 67,6 ± 15,2 años, y también en el Registro EMBARC con 2.596 enfermos analizados, fue de 67 (57-74) años.. Sin embargo, esta edad media varía en regiones con menos recursos económicos en donde existe un menor control y prevención de la infección; así en países como la India la edad media es de 56 (41-66) años26.
Para la valoración de las comorbilidades que acompañan a la enfermedad disponemos de herramientas para su cuantificación conjunta, como el índice de Charlson27, o el índice BACI (Bronchiectasis Aetiology Comorbidities Index)28. El índice BACI, específico de BQ, fue descrito por McDonnell et al. y es útil para estratificar por riesgo a los pacientes diagnosticados de BQ, así como para predecir exacerbaciones e ingresos hospitalarios. El intervalo de puntuación va de 2 a 55 puntos y considera las siguientes comorbilidades: enfermedad metastásica, neoplasias hematológicas, EPOC, deterioro cognitivo, enfermedad inflamatoria intestinal, enfermedad hepática, enfermedad del tejido conectivo, anemia ferropénica, diabetes, asma, hipertensión pulmonar, enfermedad vascular periférica y cardiopatía isquémica. Clasifica en riesgo 0 si no hay ninguna comorbilidad, riesgo intermedio si la puntuación va de 1 a 5 y riesgo alto si es ≥ 6. En un estudio publicado en 2016, se observó una buena correlación entre el índice BACI y otras escalas como BSI y FACED28.
El diagnóstico de BQ aumenta con la edad, al igual que las comorbilidades, por lo cual es interesante contemplarlas a la hora de evaluar la gravedad global de la enfermedad.
Scores multidimensionalesActualmente, se dispone de tres scores multidimensionales que han sido validados para valorar la gravedad de las BQ: FACED20,29,30, E-FACED31 y el BSI32.
El score FACED incluye cinco variables dicotómicas: FEV1 (< 50% o ≥ 50%), edad (< 70 años o ≥ 70 años), presencia de colonización crónica por P. aeruginosa, disnea según la escala mMRC (0-II o III-IV) y número de lóbulos pulmonares afectos en la TAC de tórax (1-2 lóbulos o ≥ 2 lóbulos). La puntuación va de 0 a 7, un mayor valor traduce mayor gravedad de la enfermedad. Mediante este score es posible clasificar las BQ en leves (0-2 puntos), moderadas (3-4 puntos) o severas (5-7 puntos)20.
El score E-FACED surge de añadir al FACED la presencia de exacerbaciones graves pasadas en el último año (sumando en tal caso dos puntos más) y ha demostrado una excelente capacidad para pronosticar exacerbaciones futuras, sobre todo las graves, y el fenotipo exacerbador en las BQ31. Estudios publicados demuestran que estos índices multidimensionales, sencillos de utilizar e interpretar, presentan una capacidad predictiva independientemente de las características de los pacientes y de la etiología de las BQ.
El BSI (Bronchiectasis Severity Index) es un score que tiene en cuenta variables como edad, IMC (índice de masa corporal), FEV1, presencia de colonización crónica por P. aeruginosa, extensión radiológica, tipo de bronquiectasias (cilíndricas o quísticas), grado de disnea según la escala mMRC, ingresos hospitalarios, agudizaciones antes del diagnóstico y colonización por otros microorganismos. El rango de puntuación va de 0 a 26: enfermedad leve 0-4, moderada 5-8 y grave ≥ 932. Este score es más complejo y precisa de calculadora en línea (http://www.bronchiectasisseverity.com), si bien se relaciona con un mayor número de outcomes relevantes en BQ.
ActividadEste parámetro hace referencia al nivel de activación biológica de la enfermedad en un momento determinado y es independiente de su gravedad. Por lo tanto, la «actividad» debe ser valorada por un biomarcador (sea o no biológico), relacionado estrechamente con el sustrato endotípico, que en caso de las BQ se centraría en el binomio inflamación-infección9. Algunos marcadores de inflamación-infección son relativamente fáciles de obtener y se utilizan en la práctica diaria para medir la actividad de la enfermedad, como la purulencia (escala de Murray) y el volumen de esputo, marcadores serológicos como la proteína C reactiva (PCR) o el fibrinógeno, y otros más complejos y costosos como la elastasa del neutrófilo (NE) en esputo33,34. Se incluirían también, dentro del apartado de actividad, la presencia de IBC por los distintos MPP, especialmente P. aeruginosa, por las consecuencias clínicas y aumento de parámetros de inflamación que conlleva. Pero, probablemente la variable más relevante relacionada con una mayor actividad de la enfermedad sería la presencia de exacerbaciones, especialmente las graves que requieren ingreso hospitalario. El estado nutricional se va deteriorando como consecuencia del incremento de actividad de la enfermedad por lo que es un parámetro importante a tener también en cuenta8,9.
Escala de MurrayEl color del esputo es un buen predictor de la colonización bacteriana. Así, en el trabajo de Murray et al.35 describieron la existencia de MPP solo en el 5% de los esputos mucoides, en el 43,5% de los mucopurulentos y en el 86% de los purulentos. También es importante la valoración semicuantitativa de la expectoración diaria, pudiendo emplear como referencia el contenedor estéril (100 mL), la cuchara sopera (10 mL) o de café (5 mL).
Infección bronquial crónicaLa vía aérea en las BQ esta predispuesta a la infección por diferentes patógenos, a ello contribuye la alteración del sistema de aclaramiento mucociliar junto con la disregulación del sistema inmune. Las bacterias más frecuentemente aisladas, llamadas MPP, son Haemophilus influenzae, P. aeruginosa, y otros gramnegativos (Moraxella catarrhalis, Escherichia spp, and Klebsiella spp) y grampositivos (Streptococcus pneumoniae y Staphylococcus aureus)1-3.
La IBC se define como el aislamiento de tres o más cultivos consecutivos positivos para un mismo MPP en un periodo de al menos seis meses en muestras separadas entre sí por al menos un mes. La IBC se considera uno de los factores más importantes que contribuyen al fenotipo de un enfermo con BQ, influyendo en la clínica, las exacerbaciones y el riesgo de muerte1-3. La media de las exacerbaciones anuales es de 1,29 ± 0,9 en pacientes en ausencia de IBC, se elevan a 2,04 ± 1,4 cuando existe IBC y a 2,85 ± 1,5 si la IBC es causada por P. aeruginosa o incluso superior si se trata de S. aureus resistente a meticilina10. Este mal pronóstico que se origina en la IBC por P. aeruginosa19,36,37 se corroboró en el metaanálisis realizado por Finch et al.38, que analizó 21 estudios observacionales que incluyeron 3.683 enfermos con BQ. Los pacientes con IBC por P. aeruginosa en comparación con el resto de los pacientes presentaron: un 15% menos de porcentaje de FEV1, peor calidad de vida (medida por el cuestionario de St. George), una exacerbación adicional pulmonar al año, siete veces más riesgo de hospitalizaciones y tres veces más riesgo de mortalidad. En el trabajo de Araujo et al.39, en el que se analizaron 2.596 pacientes con BQ de 10 centros de Europa e Israel, tras cinco años de seguimiento y un 15% de los enfermos con IBC por P. aeruginosa, concluyeron que este último parámetro contribuyó como factor independiente a una peor calidad de vida, frecuentes exacerbaciones e ingresos hospitalarios, pero solo se acompañó de un incremento de la mortalidad cuando se asociaba a frecuentes exacerbaciones (≥ dos al año). Existe un pequeño subgrupo de pacientes con IBC por P. aeruginosa sin exacerbaciones pulmonares que presenta una menor mobimortalidad pero que hay que vigilar estrechamente por las implicaciones habituales de este patógeno, en cualquier caso, el porcentaje relativo de estos pacientes habitualmente escaso depende de las características epidemiológicas del país en el que se realice el estudio39,40.
Otro factor que contribuye a la patogenia de la enfermedad es la carga bacteriana. Sibila et al.41 realizaron un reanálisis del ensayo clínico fallido de aztreonam lisina en aerosol en pacientes con BQ y diferentes IBC. En él se clasificaron los enfermos de forma arbitraria, según el número de unidades formadoras de colonias (UFC/g). Se consideró carga bacteriana baja, valores inferiores a 105 UFC/g, moderada con 105-106 UFC/g, y alta carga con niveles superiores a 107 UFC/g. Los autores concluyeron que la mejoría en la calidad de vida (objetivo principal del estudio), era solo evidente en los pacientes con carga bacteriana alta, por lo que quizás la medición de la carga bacteriana pueda ser útil y factible a realizar como marcador de gravedad.
Los recientes avances tecnológicos microbiológicos con métodos moleculares de secuenciación masiva han facilitado el conocimiento del microbioma pulmonar, aunque todavía estas técnicas no están implementadas en la práctica clínica habitual, tan solo en estudios de investigación. Trabajos sobre microbioma pulmonar en BQ sugieren que una menor diversidad bacteriana se correlaciona con una menor función pulmonar y un mayor grado de inflamación, posiblemente como consecuencia del frecuente uso de antibióticos en estos enfermos10.
Número y gravedad de las exacerbacionesEl número y la gravedad de las exacerbaciones también podrían considerarse como un parámetro de actividad de la enfermedad no controlada a pesar del tratamiento. Por ello su registro es muy importante, y es posible que estos pacientes «agudizadores» conformen un fenotipo especial con unas peculiaridades pronósticas propias14,15. Las exacerbaciones han mostrado presentar un impacto negativo en la historia natural de las BQ. El número y sobre todo la gravedad de las exacerbaciones se han asociado a una mayor severidad de la enfermedad, peor calidad de vida, más riesgo de IBC, un rápido declive de la función pulmonar, mayor inflamación sistémica, mayor coste y muerte prematura, por lo que constituyen un objetivo prioritario en las estrategias terapéuticas y de prevención de esta enfermedad14,15.
La mayoría de las exacerbaciones son causadas por bacterias y virus. Se han identificado como factores de riesgo para la exacerbación, la elevación de la NE y determinados polimorfismos genéticos. Pacientes con tres o más exacerbaciones al año tienden a ser más hospitalizados y a presentar un incremento de la mortalidad14. Como sucede en otras etiologías como la EPOC o la fibrosis quística, una historia de exacerbaciones es un fuerte predictor de futuras exacerbaciones. Otros factores como comorbilidades, bacteriología, y extensión radiológica explican tan solo una pequeña parte de la frecuencia de exacerbaciones.
Elastasa neutrofílica y proteína C reactivaOtro aspecto que también puede marcar la actividad de la enfermedad es la propia inflamación sistémica, la cual se ha asociado a un mayor grado de inflamación local y gravedad. Si bien no se ha determinado todavía un biomarcador específico y válido, la NE, o quizás la PCR o el fibrinógeno, puedan ser buenos biomarcadores con utilidad clínica.
La medición de la NE se ha relacionado con la gravedad y pronóstico de la enfermedad, y en menor medida con la respuesta al tratamiento. Las desventajas de esta medición son la existencia de otras moléculas con funciones similares (catepsina G y proteinasa 3) que podrían simular la capacidad proteolítica de NE, así como las antiproteasas, que podrían reducir sus niveles plasmáticos. Aunque la determinación de NE puede predecir futuras exacerbaciones y tiempo medio hasta la próxima exacerbación, no es útil para diferenciar la estabilidad de la agudización42. Se ha validado un método NEATstik®, que en unos 10 minutos determina los niveles de actividad NE; este sistema presenta un rango de puntuación de cero (< 8 μg/mL − 1 actividad de la elastasa) a 10 (máxima actividad), considerándose alto niveles de actividad con valores por encima de seis. De momento dado su alto coste no constituye un marcador que pueda emplearse en la práctica clínica habitual43.
La concentración de PCR, especialmente si es superior a 2,7 mg/L, es un buen marcador pronóstico de exacerbaciones graves en pacientes con BQ, independientemente de la gravedad de la propia enfermedad. Es un parámetro fácil de realizar y de medir, podría ser un buen marcador para calcular la actividad de la enfermedad, por lo que su evaluación conjunta con otras variables permitiría una identificación temprana de los pacientes con riesgo elevado de padecer exacerbaciones graves en el futuro y, en tal caso, establecer un tratamiento precoz44.
Estado nutricionalHay pocos trabajos que estudien la relación entre estado nutricional en pacientes con BQ y la mortalidad. La mayor inflamación sistémica, el incremento del gasto energético y la anorexia por las agudizaciones explican la desnutrición observada en las BQ. En el estudio de Qi et al.45 concluyeron que el IMC es un factor independiente de mortalidad cuando está por debajo de 20 kg/m2. Esta asociación podría ser explicada por la alteración del sistema inmune y por la debilidad muscular que origina la desnutrición46. La depleción de masa libre de grasa en los pacientes con BQ se ha observado en un 31% de los enfermos con BQ según Olveira et al. y se ha asociado a un aumento de citocinas proinflamatorias como la IL-647. Por lo tanto, es relevante revaluar y vigilar el estado nutricional en los enfermos con BQ, al menos monitorizando su IMC y la pérdida de peso en el tiempo1. Aunque el IMC no es el parámetro más adecuado para evaluar el estado nutricional, y sería más acertado el cálculo del índice de masa libre de grasa, en la práctica clínica habitual la determinación de este parámetro antropométrico queda reservado para pacientes con mayor riesgo1.
Impacto sobre el pacienteMás allá de la gravedad o de la actividad biológica de las BQ, existe un tercer aspecto que tiene más que ver con la forma en la que el paciente vive su enfermedad. Este tipo de impacto de la enfermedad sobre el paciente en muchas ocasiones no se relaciona (al menos de una forma contundente) con la gravedad de la enfermedad7-9. Martínez-García et al. en un análisis factorial observaron como la disnea (marcador de impacto sobre el paciente), el grado de obstrucción o la extensión radiológica están disociados en muchos pacientes48. Así, por ejemplo, pacientes con un escaso número y tamaño de las BQ observadas en el TCAR presentan sin embargo una gran cantidad de síntomas, especialmente disnea o gran cantidad de esputo, lo cual puede impactar de una forma importante sobre su calidad de vida49. Contrariamente, en ocasiones observamos pacientes con grandes BQ difusas que no presentan un deterioro significativo de sus síntomas, del número de agudizaciones o de su disnea. Es por ello, que la medición del impacto de la enfermedad sobre el paciente es un parámetro que debería ser medido y monitorizado de forma continua dado que, además de ser independiente del resto de variables, también puede presentar implicaciones pronósticas o terapéuticas50. En un reciente estudio en el que se describía una herramienta multidimensional para el análisis global de las bronquiectasias, los autores proponían la existencia de al menos tres parámetros que deben de ser valorados para cuantificar el impacto de la enfermedad sobre el paciente: el grado de disnea, la calidad de vida y el grado de ansiedad- depresión9.
Calidad de vidaLa calidad de vida relacionada con la salud es un parámetro muy importante a la hora de valorar el impacto global de la enfermedad sobre el paciente. En la mayoría de las ocasiones, es además uno de los outcomes principales en muchos de los ensayos clínicos aleatorizados en BQ51. La forma más habitual de valorar la calidad de vida es mediante cuestionarios que incluyen información de diversa índole sobre las dimensiones de la vida habitual que pueden ser afectadas por la enfermedad, ya sea desde un punto de vista personal, colectivo, laboral o psicológico. En general, varios autores han demostrado que los pacientes con BQ presentan una peor calidad de vida que la población general. Diversos factores han sido asociados a esta disminución de calidad de vida como: la edad52,53, la colonización crónica por P. aeruginosa54,55, el grado de disnea49, el número de agudizaciones52,56,57, con una peor función pulmonar49,53,57, la hiperreactividad bronquial58, un mayor daño estructural32,53,57, la broncorrea diaria49, la presencia de insuficiencia respiratoria52,57 y los síntomas de depresión y ansiedad59,60.
Hasta hace unos años, debido a que no existían cuestionarios específicos y validados para su uso en BQ, se utilizaban otros que o bien eran utilizados para la valoración global de la calidad de vida (por ejemplo, el SF36)61, o bien eran más específicos, como el St. George Respiratory Questionnaire (SGRQ)62, que fue inicialmente validado para enfermedades crónicas de las vías aéreas, en especial la EPOC. Posteriormente, debido a la creciente importancia de las BQ, se han venido desarrollando nuevos cuestionarios específicos de esta enfermedad, o bien se han validado para su uso en BQ cuestionarios no desarrollados inicialmente para su uso en esta enfermedad.
Cuestionarios validados para bronquiectasiasProbablemente, el primer cuestionario no creado inicialmente para su uso en BQ, pero validado para diferentes idiomas, incluido el castellano, para esta enfermedad fue el SGRQ. Es un cuestionario autoadministrado (supervisado) que consta de 50 ítems repartidos en tres dimensiones: síntomas, actividad e impacto, y una puntuación total (de 0 a 100 puntos), indicando en sus puntuaciones más altas una peor calidad de vida. La puntuación se obtiene aplicando un algoritmo que precisa de una calculadora que se puede encontrar en la red62.
El SGRQ en español53,63 presenta una fuerte consistencia interna (por lo que se puede utilizar para comparar grupos de pacientes), y discrimina adecuadamente entre los distintos grados de gravedad de la enfermedad. La mínima diferencia clínicamente importante se ha establecido en cuatro unidades64. Su principal problema radica en su longitud y en la dificultad para su valoración.
Como consecuencia de ello, recientemente De la Rosa et al. validaron la versión castellana del CAT (COPD Assessment Test) certificando que puede ser utilizado de una forma eficaz en pacientes con BQ65. El CAT, inicialmente creado para su uso en pacientes con EPOC, es un cuestionario que consta de 10 sencillas preguntas y una única dimensión. Está siendo utilizado como una herramienta clave en algunas guías internacionales de la EPOC como la GOLD66. Posteriormente, CAT también ha sido validado para diferentes idiomas en bronquiectasias67.
Cuestionarios creados específicamente para bronquiectasiasAlgunos autores han construido y validado nuevos cuestionarios para ser utilizados en bronquiectasias (incluidas las debidas a fibrosis quística) entre los que destacan el QoL-B, el LCQ (Leicester Cough Questionnaire) y el BHQ (Bronchiectasis Health Questionnaire).
El Quality-of-life Bronquiectasis (QOL-B)52,68 es un cuestionario autoadministrado que consta de 37 preguntas, repartidas en ocho escalas: capacidad física, limitaciones de rol, vitalidad, percepción de la salud, estado emocional, aislamiento social, carga del tratamiento y síntomas respiratorios. Las puntuaciones están estandarizadas de 0 a 100, indicando las más altas una mejor calidad de vida. No hay una puntuación total que integre todo el cuestionario. La mínima diferencia clínicamente importante se ha establecido entre 7 y 10 puntos, dependiendo de la escala. La versión inglesa se ha traducido al español para su uso en población hispanohablante de Estados Unidos y se ha adaptado, realizando pequeñas modificaciones, para hacerla más adecuada para población española (QOL-B® Spain V 3.0). La versión española ha demostrado su validez y fiabilidad para emplearla en pacientes con bronquiectasias, permite diferenciar adecuadamente los distintos grados de severidad de la enfermedad, es reproducible y tiene buena sensibilidad al cambio52,68.
El Leicester Cough Questionnaire (LCQ)69-72 fue inicialmente diseñado para medir el impacto de la tos crónica en la calidad de vida. Está validado tanto en inglés69 como en castellano72 para su uso en pacientes con BQ. Consta de 19 preguntas repartidas en tres dominios: físico, psicológico y social, y presenta una puntuación total. A menor puntuación, mayor gravedad de la tos. Es capaz de identificar con fiabilidad cambios en la tos tras la administración de diferentes tratamientos como la fisioterapia o tratamientos antibióticos y en las agudizaciones69-72. Se correlaciona bien con el SGRQ. Su principal desventaja radica en que, además de la tos, no valora otros aspectos importantes de la enfermedad.
Más recientemente fue construido y validado a diferentes idiomas el BHQ (Bronchiectasis Health Questionnaire) en su versión inglesa. Actualmente se está trabajando en su validación en español por el grupo de SEPAR. Presenta 10 ítems (cada uno de los cuales con una escala de siete puntos) con un score total de 0-100 puntos, siendo 100 el mejor estado posible. Presenta unas propiedades psicométricas adecuadas para su uso en bronquiectasias73.
DisneaSin duda, la disnea es uno de los síntomas más incapacitantes en aquellos pacientes con enfermedades pulmonares, incluidas las BQ. Es uno de los factores que más influye en la calidad de vida del paciente, y suele relacionarse con un incremento en la mortalidad, generalmente porque aparece en fases más avanzadas de la enfermedad. Si bien existen diferentes escalas para medir la disnea, tanto en reposo como mientras se realiza un determinado ejercicio, es la Medical Research Council Scale (MRC)74 la más utilizada en pacientes con BQ. Esta escala evalúa de 0-4 puntos la disnea según diferentes situaciones: 0-disnea solo ante ejercicios extenuantes, hasta 4-disnea a mínimos esfuerzos.
Ansiedad y depresiónUno de los aspectos más olvidados en la valoración integral del paciente con enfermedades crónicas de la vía aérea es el impacto de la misma sobre el estado psicológico del paciente, o sobre patologías psicológicas ya presentes previas al diagnóstico. Las BQ no son una excepción. La prevalencia de ansiedad y depresión en pacientes con bronquiectasias es muy elevada y de forma sistemática es uno de los factores que más se correlaciona con la calidad de vida del paciente e incluso sobre otros outcomes de importancia59. No existe ningún cuestionario específico para el diagnóstico de depresión o ansiedad para bronquiectasias. Sin embargo, recientemente fue validada la versión en castellano de uno de los más utilizados en estudios con BQ, el Hospital Anxiety and Depression Scale (HADS)75,76. Este cuestionario es breve, sencillo de utilizar y está validado en población española. Ha demostrado una buena especificidad y sensibilidad para identificar trastornos psiquiátricos y ha sido ampliamente utilizado en los diferentes estudios59,60,77-81. Es un cuestionario autoadministrado que se compone de una subescala de depresión y otra de ansiedad con siete ítems cada una. Cada ítem se puntúa de 0 a 3, por lo que 21 es la puntuación máxima de cada una de las subescalas. Una puntuación mayor o igual a 11 indica síntomas moderados-graves de depresión o ansiedad y, por tanto, clínicamente significativos. Una puntuación entre 8 y 10 indica síntomas leves75,76,82.
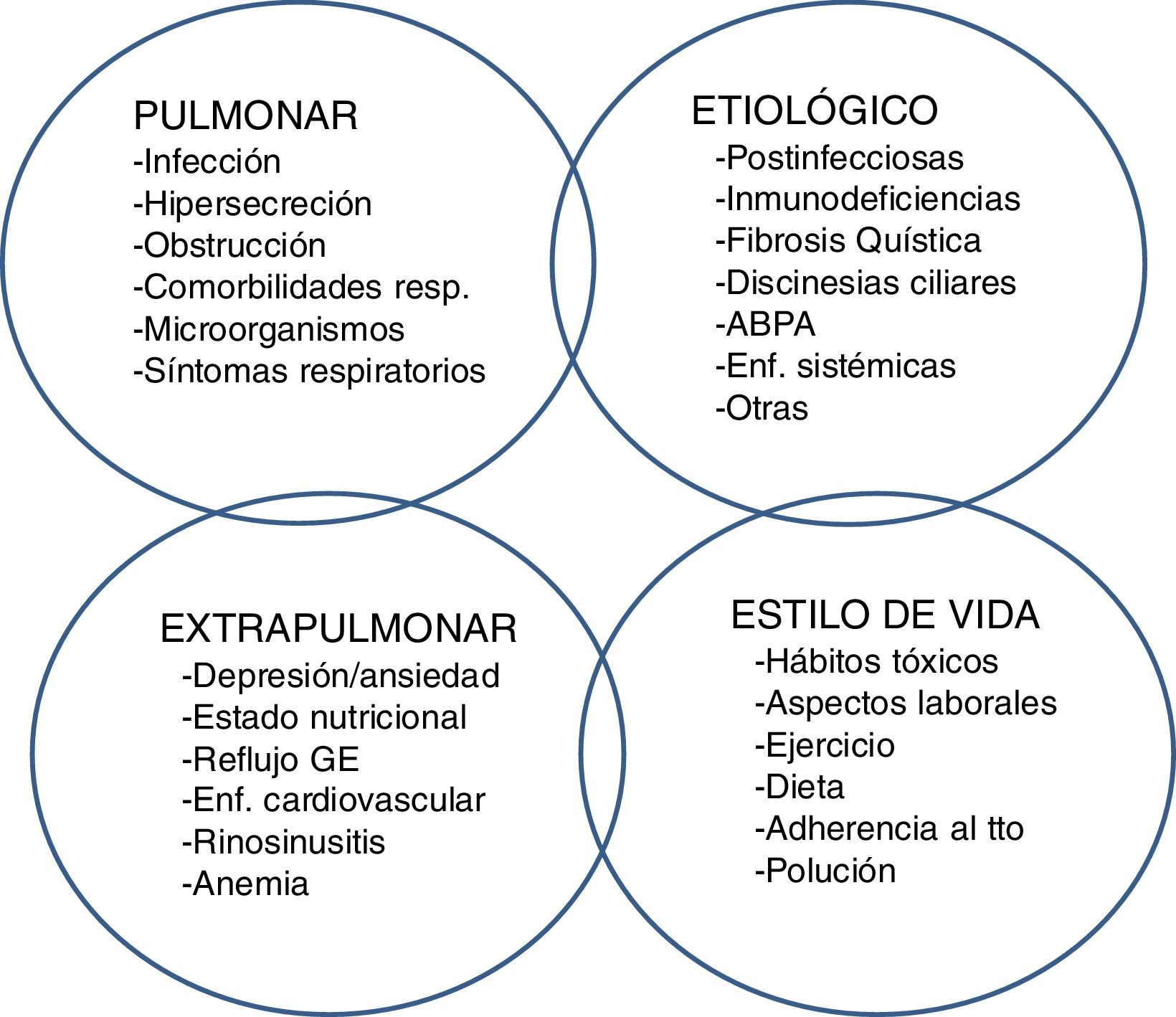
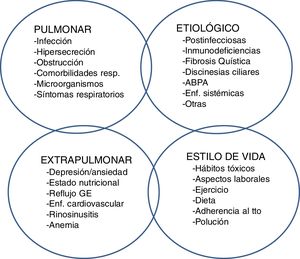
Rasgos tratables en bronquiectasiasUna reciente propuesta en BQ, ya anteriormente descrita para otras enfermedades, es la de «rasgos tratables» (treatable traits)83,84. Este concepto se basa fundamentalmente en el hecho que las BQ son una enfermedad multidimensional con afectación sistémica y que por lo tanto, para obtener un control óptimo del paciente, debe de ser tratada en todos aquellos aspectos (o rasgos) necesarios. En la figura 2 se observa como estos rasgos no solo englobarían el aspecto pulmonar en sus distintas vertientes (tratamiento de la infección bronquial, de la inflamación bronquial, exacerbaciones, etc.), sino también de los aspectos extrapulmonares, etiológicos o de estilo de vida del paciente.
ConclusionesLas BQ son una enfermedad heterogénea en su presentación y compleja en su naturaleza. Ello ha llevado al análisis de diferentes fenotipos clínicos con rasgos clínicos, pronósticos o de respuesta al tratamiento semejantes. Sin embargo, poco se conoce del sustrato endotípico o fisiopatológico que explica estos diferentes grupos de pacientes. Algunos biomarcadores biológicos se han mostrado prometedores para identificar el pronóstico o la respuesta al tratamiento. Tanto la heterogeneidad como la complejidad de las BQ hacen que una variable única no sea capaz de captar el impacto global de la enfermedad sobre el paciente, por lo que algunos autores han propuesto herramientas más complejas pero completas. Por un lado, inicialmente, algunas puntuaciones multidimensionales se utilizan ya en la valoración de la gravedad de las BQ. Posteriormente, han nacido nuevos conceptos como la huella clínica o los rasgos tratables. La primera, hace referencia al esquema personalizado de efecto de la enfermedad sobre tres dimensiones clave que aportan información independiente: la gravedad, la actividad biológica (medida mediante biomarcadores biológicos o no biológicos) y el impacto sobre el paciente. Por otro lado, los rasgos tratables hacen referencia a todos aquellos aspectos que, más allá de la afectación pulmonar de las BQ, deben de ser tratados para conseguir un control óptimo del paciente, como los aspectos extrapulmonares, el estilo de vida, etiología y comorbilidades. Todo ello, no son sino diferentes pasos hacia una medicina personalizada en BQ.
FinanciaciónRealizado con el patrocinio de laboratorios TEVA.
Conflicto de interesesLa presente revisión, así como todo el monográfico del que forma parte, ha sido financiada por laboratorios TEVA. Este laboratorio no ha participado en ninguno de los pasos que se han seguido en la elaboración científica de ninguno de los capítulos.