El objetivo del trabajo fue conocer el comportamiento de los biomarcadores ecográficos de densidad fascicular y fuerza muscular en pacientes con esclerosis lateral amiotrófica (ELA).
MétodosEstudio piloto, observacional y transversal sobre 14 pacientes con ELA (mujeres; 28,6%) y 14 controles. Se tomaron ecografías bilaterales transversales en el abductor corto del pulgar (ACP) y tibial anterior (TA) con registro del grosor muscular (GM) en reposo, en contracción y diferencia de engrosamiento. En los nervios mediano, ciático y peroneo común se analizaron el área de sección transversal (AST), el número de fascículos (NF) y la densidad fascicular (DF). Los análisis se realizaron anidados por lateralidad.
ResultadosEl acuerdo intra-interobservador en los recuentos de fascículos fue muy bueno con un error mínimo detectable<0,7%. El GM del ACP fue menor en los pacientes con ELA tanto en reposo (p = 0,003; g = 1,03) como en contracción (p = 0,017; g = 0,78) y en el TA en reposo (p = 0,002; g = 0,15) y contracción (p = 0,001; g= 0,46), con una menor capacidad de engrosamiento. En los nervios, se detectó una menor AST, con menor NF y una mayor DF. Se encontraron correlaciones significativas entre el GM del ACP y la Medical Research Council (MRC) (r = 0,34; r2 = 12%; p = 0,011) y con la Amyotrophic Lateral Sclerosis Functional Rating Scale (ALSFRS-r) (r = 0,44; r2 = 19%; p < 0,001). La diferencia de engrosamiento del TA se correlacionó con la MRC (r = 0,30; r2 = 15%; p = 0,003) y con la ALSFRS-r (r = 0,26; r2 = 7%; p = 0,049). El NF del nervio ciático mostró una correlación significativa con la MRC (r = 0,35; r2 = 12%; p = 0,008).
ConclusiónLas mediciones del GM derivadas de las pruebas dinámicas junto con el NF y DF podrían ser biomarcadores de utilidad para monitorizar pacientes con ELA y su evaluación pronóstica.
The aim of this study was to determine the behaviour of ultrasound biomarkers of fascicle density and muscle strength in patients with amyotrophic lateral sclerosis (ALS).
MethodsWe conducted an observational, cross-sectional pilot study of 14 patients with ALS (28.6% women) and 14 controls. Bilateral cross-sectional ultrasound scans were performed in the abductor pollicis brevis (APB) and tibialis anterior (TA) muscles, with recording of muscle thickness (MT) at rest and in contraction, and the difference in thickness. In the median, sciatic, and common peroneal nerves, we analysed the cross-sectional area (CSA), number of fascicles (NF) and fascicle density (FD). Analyses were nested by laterality.
ResultsIntra- and interrater agreement regarding NF was very good, with a minimum detectable error of < 0.7%. In patients with ALS, MT was lower in the APB both at rest (P = .003; g-Hedges = 1.03) and in contraction (P = .017; g-Hedges = 0.78) and in TA at rest (P = .002; g-Hedges = 0.15) and in contraction (P = .001; g-Hedges = 0.46), with lower thickening capacity. In the nerves, patients displayed lower CSA, with lower NF and higher FD. Significant correlations were found between MT of the ABP and Medical Research Council (MRC) scores for muscle strength (r = 0.34; r2 = 12%; P = .011) and with revised ALS Functional Rating Scale scores (r = 0.44; r2 = 19%; P < .001). The difference in TA thickening correlated with MRC scores (r = 0.30; r2 = 15%; P = .003) and with revised ALS Functional Rating Scale scores (r = 0.26; r2 = 7%; P = .049). NF in the sciatic nerve showed a significant correlation with MRC scores (r = 0.35; r2 = 12%; P = .008).
ConclusionMT measurements derived from dynamic testing together with NF and FD may be useful biomarkers for monitoring patients with ALS and establishing a prognosis.
La esclerosis lateral amiotrófica (ELA) es la enfermedad neurodegenerativa progresiva y mortal más frecuente en los adultos de entre 65 y 74 años1,2. Se caracteriza por la degeneración de las motoneuronas superiores e inferiores que causa incapacidad manipulativa, alteración de la marcha, de la articulación del lenguaje, de la deglución y de la función ventilatoria3. La disfunción del músculo diafragma toracoabdominal y, finalmente, la insuficiencia respiratoria es la principal causa de muerte unos tres a cinco años después del inicio de los síntomas4.
El diagnóstico de la ELA está basado actualmente en los síntomas y signos clínicos junto a pruebas clínicas y electrodiagnósticas que pueden ser poco sensibles durante la fase inicial de la enfermedad5.
Hasta el momento, no se dispone de biomarcadores diagnósticos específicos para la enfermedad lo que conlleva un retraso diagnóstico de entre ocho y 15 meses. Este retraso es debido, en parte, a la aparición altamente variable y progresiva de los síntomas6 que pueden confundirse con otras patologías (radiculopatías, neuropatías autoinmunes, etc.) así como a las distintas formas de la enfermedad (bulbares, espinales, asociadas a demencia, Parkinson-ELA, fallo diafragmático primario y otras) y a la baja especificidad y sensibilidad inicial de las técnicas diagnósticas.
Por este motivo, es necesaria la búsqueda de nuevos biomarcadores diagnósticos, fenotípicos, evolutivos y pronósticos en la monitorización de los pacientes7.
En este sentido, algunos autores han conseguido importantes avances, haciendo uso de la ecografía muscular cuantitativa para caracterizar biomarcadores para la ELA, y llegaron a la conclusión de que, aunque la ecografía no esté estandarizada para la enfermedad, es una técnica indolora, rápida y fácil de realizar que detecta cambios significativos en los músculos afectados por ELA. Estos estudios han demostrado y visualizado ecográficamente que la progresión de la enfermedad produce una disminución del grosor muscular (GM)8 como consecuencia de la atrofia, un incremento de la ecointensidad7 con cambios sustanciales en su textura9 debido a la formación intramuscular e irregular de tejido no contráctil, fibroso y adiposo10, y un aumento de las fasciculaciones fruto de la denervación11.
También, recientemente, algunos autores han postulado que los cambios en el nervio podrían preceder a los cambios musculares y han conseguido describir ecográficamente la atrofia del nervio periférico en pacientes con ELA mediante la medición del diámetro y del área de sección transversal (AST)12–16. En este sentido, Cartwright et al. y Ridolfi et al. consiguieron analizar con equipos ecográficos de ultra-alta frecuencia, la estructura interna del nervio mediano (NM) en sujetos sanos mediante el análisis de densidad de fascículos (DF) y el número de fascículos (NF), y destacaron su posible utilidad en pacientes con ELA gracias a la alta resolución de los equipos estándar de última generación17,18.
El objetivo principal de nuestro estudio fue conocer el comportamiento de los nuevos y poco estudiados biomarcadores DF y NF de los NM en diferentes niveles, nervio ciático (NC) y del nervio peroneo común (NPC) en un grupo de pacientes con ELA y un grupo control de participantes sanos. Como segundo objetivo, se planteó el análisis de la posible asociación de estas variables con la fuerza muscular y el grado de discapacidad.
Material y métodoDiseño del estudioEstudio observacional transversal y se siguieron los criterios de la recomendación Strengthening the Reporting of Observational studies in Epidemiology (STROBE)19.
Contexto y participantesSe reclutaron 14 pacientes de manera consecutiva e intencional con ELA posible, probable o definitiva, según los criterios diagnósticos de El Escorial20 entre diciembre del 2019 y febrero del 2020. Todos los pacientes fueron diagnosticados, reclutados y examinados por la misma neuróloga experimentada (EMFC) en la Unidad de ELA del Hospital General Universitario Santa Lucía de Cartagena.
Además, se reclutaron 14 participantes sanos sin afecciones neurológicas emparejados por sexo y edad.
El estudio fue aprobado por el Comité de Ética el Hospital General Universitario Santa Lucía de Cartagena y de la Universidad de Murcia. Todos los participantes fueron informados verbalmente y firmaron su consentimiento informado por escrito.
Variables sociodemográficas y clínicasLos pacientes se examinaron el mismo día en el que se les realizaban las exploraciones ecográficas. Se registraron el sexo, la edad, el peso, la talla y el índice de masa corporal (IMC) además de las variables clínicas: tiempo de evolución desde el diagnóstico, forma de inicio la enfermedad, presencia de fasciculaciones, grado de discapacidad medida con la escala Amyotrophic Lateral Sclerosis Functional Rating Scale (ALSFRS-r, puntuación 0-48)21 y la fuerza muscular de forma global y bilateral mediante la escala del Medical Research Council (MRC)22, que varía de 0 a 5 (e incluye los grados 4 y 4 + ) y específicamente para los músculos abductor corto del pulgar (ACP) y tibial anterior (TA).
Exploraciones ecográficasLas exploraciones ecográficas las realizó un ecografista experimentado (JJMP) cegado para los datos clínicos, con un ecógrafo LE R8 de General Electric Company (software 2019) con un transductor lineal 12L-RS (7-13 MHz). Los parámetros de optimización de la imagen como la ganancia, mapa de grises, profundidad y frecuencia de trabajo se mantuvieron constantes para cada una de las estructuras analizadas durante todo el estudio. La zona focal se fijó para cada caso sobre la estructura interna del nervio para garantizar la mejor reflexión posible. En relación a la posición de la sonda, se ajustó la inclinación con el propósito de optimizar la máxima ecointensidad7.
Las exploraciones se realizaron bilateralmente mediante cortes transversales con tres imágenes para cada estructura7,23, según el protocolo que se describe a continuación y en las figuras 1 y 2: 1) exploración del NM en el punto medio de la distancia entre el epicóndilo medial y la axila12; 2) NM en la muñeca inmediatamente proximal al túnel carpiano18; 3) el músculo ACP a lo largo de la línea que conecta el punto medio de la cara volar de la primera articulación metacarpofalángica y la prominencia volar del escafoides13,24; 4) NC en el tercio distal del muslo y proximal a su división en NPC y nervio tibial anterior25; 5) NPC proximal a la cabeza del peroné25 y 6) el músculo TA a la distancia de un cuarto proximal desde el pico de la rótula al maléolo lateral7.
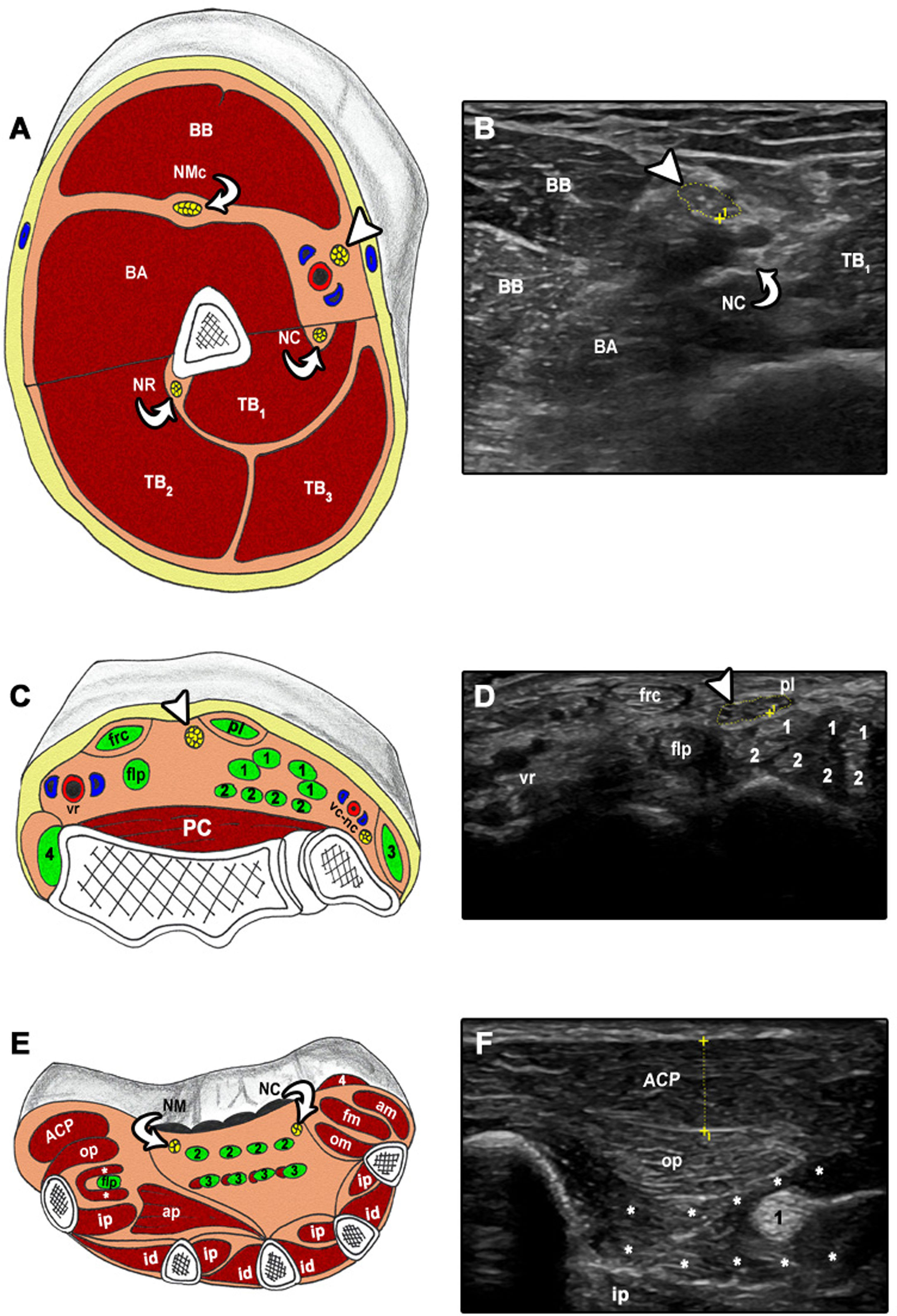
Exploración ecográfica transversal y correspondencia anatómica de la extremidad superior.
A-B) NM a la altura del brazo: BA: braquial anterior; BB: bíceps braquial; NC: nervio cubital; NMc: nervio musculocutáneo; NR: nervio radial; TB: tríceps braquial; cabeza de flecha. NM. C-D) frc: flexor radial del carpo; nc: nervio cubital; PC: pronador cuadrado; pl: palmar largo; vc: paquete vascular cubital; vr: paquete vascular radial; 1. Flexor superficial de los dedos; 2. Flexor profundo de los dedos; 3. Flexor cubital del carpo; 4. Braquiorradial; cabeza de flecha. NM. E-F) ACP: abductor corto del pulgar; am: abductor del meñique; ap: aductor del pulgar; flp/1: flexor largo del pulgar; fm: flexor del meñique; NC: nervio cubital; NM: nervio mediano; om: oponente del meñique; op: oponente del pulgar; id: interóseo dorsal; ip: interóseo palmar; 2. Flexor superficial de los dedos; 3. Flexor profundo de los dedos; 4. Palmar corto; * Flexor corto del pulgar.
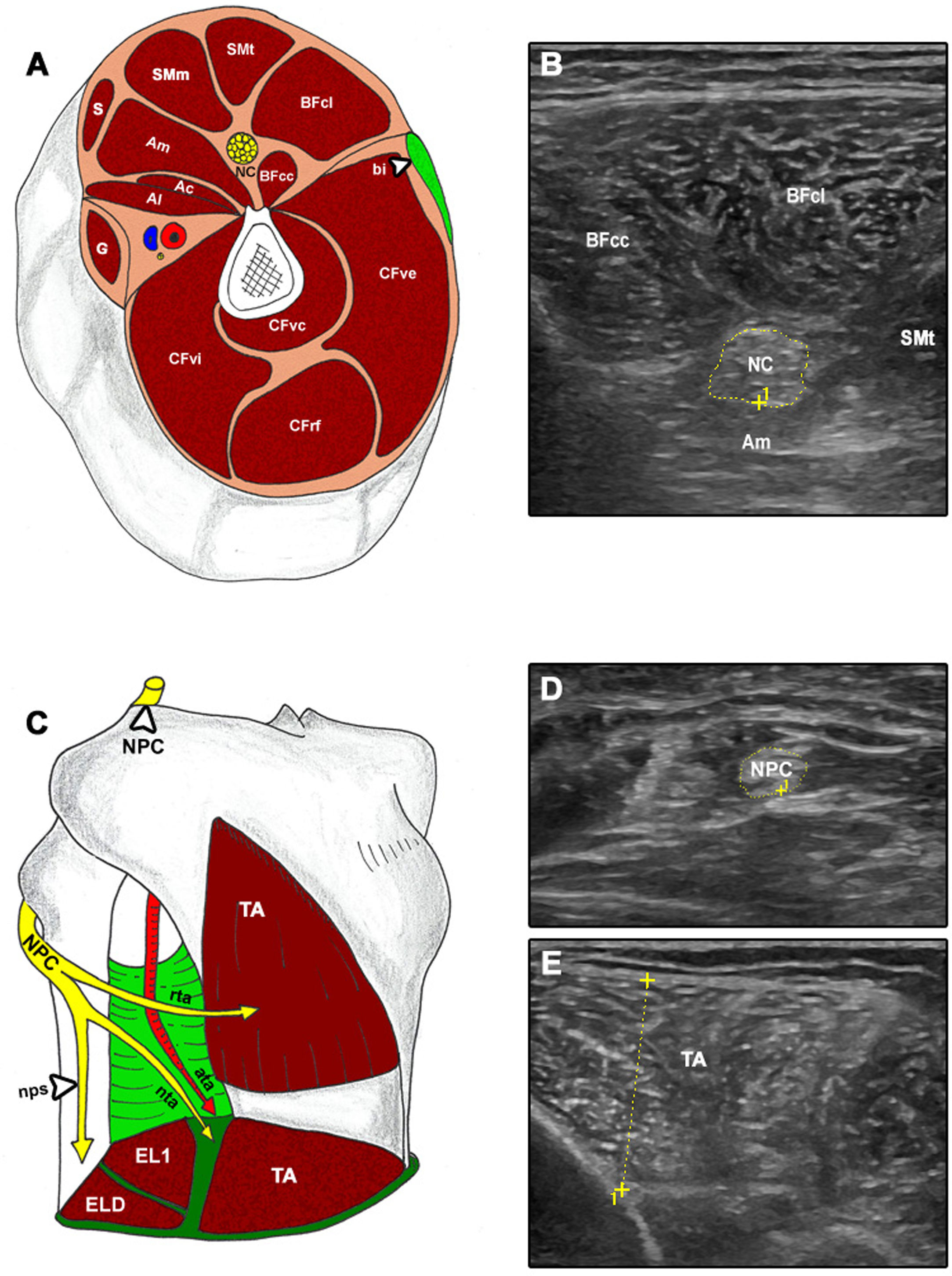
Exploración ecográfica transversal y correspondencia anatómica de la extremidad inferior.
A-B) Ac: aductor corto; Al: aductor largo; Am: aductor mayor; bi: banda iliotibial; BBcc: bíceps femoral_cabeza corta; BFcl: bíceps femoral_cabeza larga; G: grácil; S: sartorio; SMm: semimembranoso; SMt: semitendinoso; CFrf: cuádriceps femoral_recto femoral; CFvc: cuádriceps femoral_vasto crural; CFve: cuádriceps femoral_vasto externo; CFvi: cuádriceps femoral_vasto interno; NC: nervio ciático. C-E) ata: arteria tibial anterior; EL1: extensor largo del dedo gordo; ELD: extensor largo de los dedos; TA: tibial anterior; NPC: nervio peroneo común; nps: nervio peroneo superficial; nta: nervio tibial anterior; rta: rama tibial anterior.
Un investigador con experiencia en análisis de imagen (JJMP) y mediante el calibrador electrónico del ecógrafo midió el AST del NM, NC y NPC, tomando como referencia el borde interno del epineuro más hiperecoico. También, se obtuvo el GM en reposo del ACP y TA. Además, se registró el GM en contracción isométrica máxima, siguiendo la reciente propuesta de algunos autores con el objeto de disponer de la diferencia de engrosamiento contracción-reposo26.
El NF se cuantificó directamente desde el monitor del equipo ecográfico y la DF se calculó dividiendo el NF entre el AST.
La media de los tres valores obtenidos para cada estructura fue empleada para el correspondiente análisis estadístico.
Finalmente, un investigador seleccionó aleatoriamente un conjunto de 30 imágenes de las estructuras nerviosas. Con este conjunto de imágenes, dos investigadores enmascarados estudiaron la fiabilidad y reproducibilidad inter e intraobservador exclusivamente para el NF ya que el resto de biomarcadores analizados en nuestro estudio ya han sido ampliamente estudiados7,13,17,26. Las imágenes fueron evaluadas por ambos investigadores de manera independiente en un período de dos semanas para evitar el efecto recuerdo.
Análisis estadísticoEl análisis descriptivo de las variables cuantitativas se realizó con las medias y desviaciones estándar (DE), así como los rangos y los cuartiles. Las variables cualitativas se resumieron en forma de recuentos y porcentajes. Se comprobó el supuesto de normalidad mediante el test de Shapiro-Wilks y los gráficos de normalidad, así como los coeficientes de asimetría y curtosis.
El análisis de reproducibilidad inter e intraobervador se realizó calculando el coeficiente de correlación intraclase (CCI) con un modelo de efectos aleatorios de dos factores (CCI2,1) y acuerdo absoluto para cada una de las variables de interés27,28. Se consideran acuerdos muy buenos para ICC > 0,90; buenos 0,75-0,90; moderados 0,50-0,70 y deficientes < 0,529. Además, se calcularon los límites de acuerdo (LA) según el método descrito por Bland y Altman30,31 y la presencia de sesgos sumativos o multiplicativos con el método de regresión lineal de Passing-Bablock32,33.
Con el objeto de dotar al análisis de una aplicación clínica, se calcularon el error estándar de la medición [EEm = DE • √ (1-ICC)] y su valor relativo con respecto al promedio de todas las mediciones34,35, así como la diferencia real más pequeña (DRp) para determinar si un cambio en el parámetro se debe a un cambio real o se encuentra dentro de los límites de error del método de medición [DRp = 1,96 • EEm • √2]36.
Finalmente, se aplicó el método gráfico propuesto por Luiz et al., que permite observar para qué porcentaje de casos se alcanza un determinado acuerdo37.
La comparación entre pacientes con ELA y los controles para cada una de las variables descritas en las estructuras nerviosas y musculares se realizó con modelos lineales mixtos anidados por lateralidad para comparar todos los parámetros ecográficos cuantitativos ajustados por edad, sexo e IMC. Además de los intervalos de confianza y los valores de significación estadística (valor p), se calculó el tamaño del efecto de las diferencias entre grupos mediante la g de Hedges38 que considera efectos pequeños g < 0,20; moderados g cercana a 0,50 y grandes g> 0,80.
Para explorar las correlaciones entre las puntuaciones de la escala ALSFRS-r y los valores de MRC se calculó el coeficiente de correlación lineal de Pearson (r) y el coeficiente de determinación (r2 en %) para conocer el porcentaje variabilidad compartida.
Los análisis se realizaron utilizando IBM SPSS Statistics 19.0 (SPSS Inc. IBM Company, 2010) y el paquete jmv (versión 0.9)39 para R (versión 3.5.0; 2018)40.
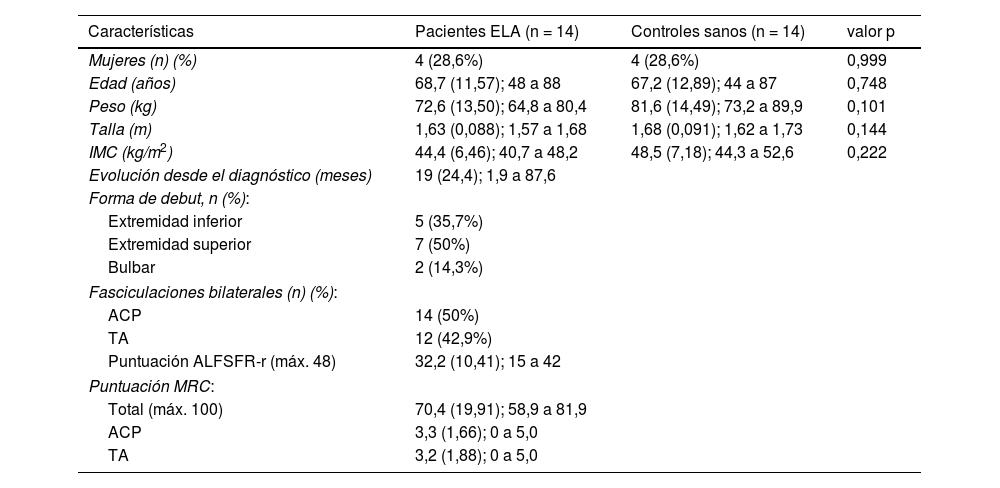
ResultadosCaracterísticas de las muestrasEn este estudio se incluyeron 14 pacientes diagnosticados de ELA (n = 4 mujeres, 29%) y 14 participantes controles sanos emparejados por edad y sexo, sin diferencias significativas entre ambos grupos respecto al peso, la talla y el IMC. Además de los datos sociodemográficos, en la tabla 1 pueden observarse los datos clínicos de los pacientes.
Características de las muestras
| Características | Pacientes ELA (n = 14) | Controles sanos (n = 14) | valor p |
|---|---|---|---|
| Mujeres (n) (%) | 4 (28,6%) | 4 (28,6%) | 0,999 |
| Edad (años) | 68,7 (11,57); 48 a 88 | 67,2 (12,89); 44 a 87 | 0,748 |
| Peso (kg) | 72,6 (13,50); 64,8 a 80,4 | 81,6 (14,49); 73,2 a 89,9 | 0,101 |
| Talla (m) | 1,63 (0,088); 1,57 a 1,68 | 1,68 (0,091); 1,62 a 1,73 | 0,144 |
| IMC (kg/m2) | 44,4 (6,46); 40,7 a 48,2 | 48,5 (7,18); 44,3 a 52,6 | 0,222 |
| Evolución desde el diagnóstico (meses) | 19 (24,4); 1,9 a 87,6 | ||
| Forma de debut, n (%): | |||
| Extremidad inferior | 5 (35,7%) | ||
| Extremidad superior | 7 (50%) | ||
| Bulbar | 2 (14,3%) | ||
| Fasciculaciones bilaterales (n) (%): | |||
| ACP | 14 (50%) | ||
| TA | 12 (42,9%) | ||
| Puntuación ALFSFR-r (máx. 48) | 32,2 (10,41); 15 a 42 | ||
| Puntuación MRC: | |||
| Total (máx. 100) | 70,4 (19,91); 58,9 a 81,9 | ||
| ACP | 3,3 (1,66); 0 a 5,0 | ||
| TA | 3,2 (1,88); 0 a 5,0 | ||
ACP: abductor corto del pulgar; ALSFRS-r: Amyotrophic lateral sclerosis functional rating scalerevised; ELA: esclerosis lateral amiotrófica; IMC: índice de masa corporal; MRC: Medical research council scale; TA: músculo tibial anterior.
Los datos se presentan como media (DE) y rango para variables cuantitativas y recuentos y porcentaje para variables categóricas. Valor p para X2 (sexo) y prueba t de Student para muestras independientes.
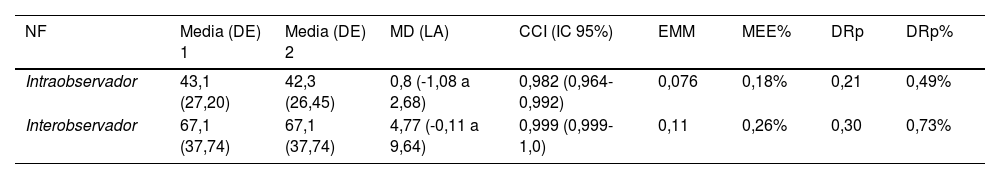
Se obtuvo una muy buena fiabilidad tanto interobservador como intraobservador en la evaluación del NF. No hubo sesgos y las diferencias de medias fueron muy bajas. El EEM y la DRp relativas mostraron que esta medida es confiable, siendo posible detectar cambios por encima del 1%. El método gráfico de Luiz et al. mostró que las discrepancias para el NF estaban por debajo de cinco fascículos para el 50% de las imágenes tanto a nivel intra como interobservador (tabla 2 y fig. 3)37.
Fiabilidad y reproducibilidad intra e interobservador
| NF | Media (DE) 1 | Media (DE) 2 | MD (LA) | CCI (IC 95%) | EMM | MEE% | DRp | DRp% |
|---|---|---|---|---|---|---|---|---|
| Intraobservador | 43,1 (27,20) | 42,3 (26,45) | 0,8 (-1,08 a 2,68) | 0,982 (0,964-0,992) | 0,076 | 0,18% | 0,21 | 0,49% |
| Interobservador | 67,1 (37,74) | 67,1 (37,74) | 4,77 (-0,11 a 9,64) | 0,999 (0,999-1,0) | 0,11 | 0,26% | 0,30 | 0,73% |
CCI (IC 95%): coeficiente de correlación intraclase (intervalo de confianza 95%); DE: desviación estándar; MD (LA): media de la diferencia (límite de acuerdo 95%); EMM: error estándar de la medida; DRp: diferencia real más pequeña; NF: número de fascículos.
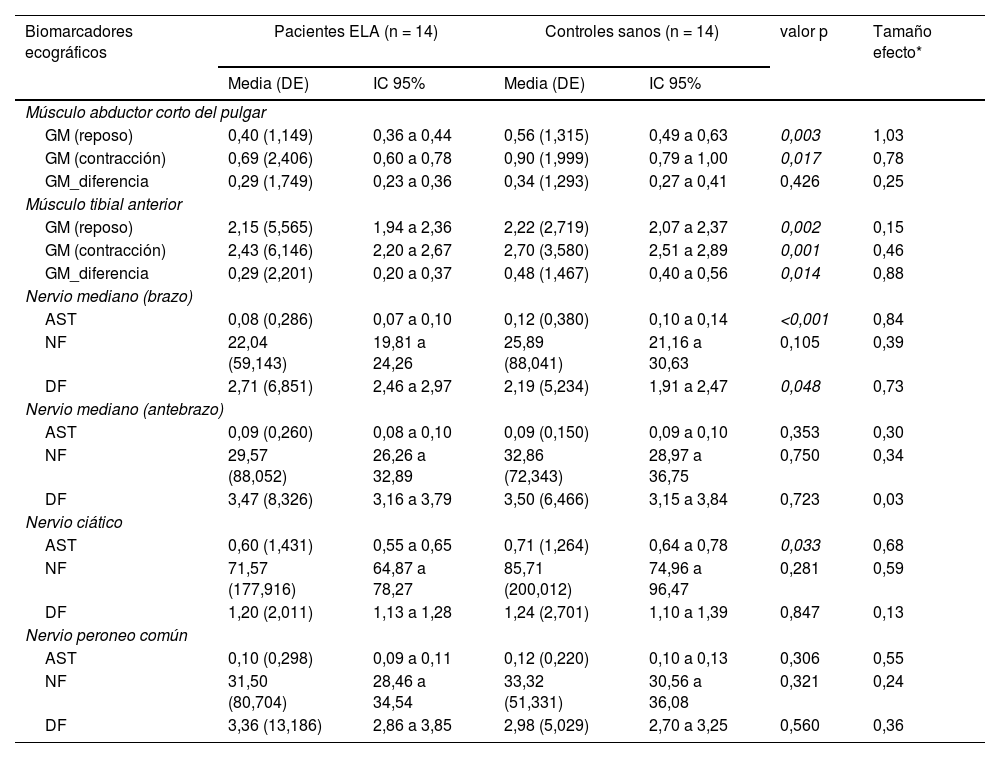
Los resultados de los biomarcadores ecográficos nerviosos y musculares estudiados se presentan en la tabla 3.
Diferencias en los biomarcadores ecográficos entre pacientes con ELA y sujetos controles sanos
| Biomarcadores ecográficos | Pacientes ELA (n = 14) | Controles sanos (n = 14) | valor p | Tamaño efecto* | ||
|---|---|---|---|---|---|---|
| Media (DE) | IC 95% | Media (DE) | IC 95% | |||
| Músculo abductor corto del pulgar | ||||||
| GM (reposo) | 0,40 (1,149) | 0,36 a 0,44 | 0,56 (1,315) | 0,49 a 0,63 | 0,003 | 1,03 |
| GM (contracción) | 0,69 (2,406) | 0,60 a 0,78 | 0,90 (1,999) | 0,79 a 1,00 | 0,017 | 0,78 |
| GM_diferencia | 0,29 (1,749) | 0,23 a 0,36 | 0,34 (1,293) | 0,27 a 0,41 | 0,426 | 0,25 |
| Músculo tibial anterior | ||||||
| GM (reposo) | 2,15 (5,565) | 1,94 a 2,36 | 2,22 (2,719) | 2,07 a 2,37 | 0,002 | 0,15 |
| GM (contracción) | 2,43 (6,146) | 2,20 a 2,67 | 2,70 (3,580) | 2,51 a 2,89 | 0,001 | 0,46 |
| GM_diferencia | 0,29 (2,201) | 0,20 a 0,37 | 0,48 (1,467) | 0,40 a 0,56 | 0,014 | 0,88 |
| Nervio mediano (brazo) | ||||||
| AST | 0,08 (0,286) | 0,07 a 0,10 | 0,12 (0,380) | 0,10 a 0,14 | <0,001 | 0,84 |
| NF | 22,04 (59,143) | 19,81 a 24,26 | 25,89 (88,041) | 21,16 a 30,63 | 0,105 | 0,39 |
| DF | 2,71 (6,851) | 2,46 a 2,97 | 2,19 (5,234) | 1,91 a 2,47 | 0,048 | 0,73 |
| Nervio mediano (antebrazo) | ||||||
| AST | 0,09 (0,260) | 0,08 a 0,10 | 0,09 (0,150) | 0,09 a 0,10 | 0,353 | 0,30 |
| NF | 29,57 (88,052) | 26,26 a 32,89 | 32,86 (72,343) | 28,97 a 36,75 | 0,750 | 0,34 |
| DF | 3,47 (8,326) | 3,16 a 3,79 | 3,50 (6,466) | 3,15 a 3,84 | 0,723 | 0,03 |
| Nervio ciático | ||||||
| AST | 0,60 (1,431) | 0,55 a 0,65 | 0,71 (1,264) | 0,64 a 0,78 | 0,033 | 0,68 |
| NF | 71,57 (177,916) | 64,87 a 78,27 | 85,71 (200,012) | 74,96 a 96,47 | 0,281 | 0,59 |
| DF | 1,20 (2,011) | 1,13 a 1,28 | 1,24 (2,701) | 1,10 a 1,39 | 0,847 | 0,13 |
| Nervio peroneo común | ||||||
| AST | 0,10 (0,298) | 0,09 a 0,11 | 0,12 (0,220) | 0,10 a 0,13 | 0,306 | 0,55 |
| NF | 31,50 (80,704) | 28,46 a 34,54 | 33,32 (51,331) | 30,56 a 36,08 | 0,321 | 0,24 |
| DF | 3,36 (13,186) | 2,86 a 3,85 | 2,98 (5,029) | 2,70 a 3,25 | 0,560 | 0,36 |
AST: área de sección transversal (cm2); DE: desviación estándar; DF: densidad fascicular; ELA: esclerosis lateral amiotrófica; IC 95%: intervalo de confianza 95%; GM: grosor muscular; NF: número de fascículos.
A nivel muscular, el ACP y el TA de los pacientes mostraron un GM significativamente menor, tanto en reposo como en contracción, que los controles. La diferencia de engrosamiento (contracción-reposo) también fue menor en ambos músculos en los pacientes frente a los controles, aunque solamente se encontró significación estadística en el ACP.
Con relación al NM solo se observaron diferencias significativas a la altura del brazo donde los pacientes con ELA presentaron una menor AST y una mayor DF que los controles. Respecto al NF, se halló que los pacientes con ELA mostraban una menor cantidad de fascículos, aunque no de manera significativa.
Finalmente, y respecto a los nervios periféricos de la extremidad inferior, solamente se encontró una significativamente menor AST del NC en los pacientes respecto a los controles.
De manera similar a lo encontrado en la extremidad superior, los pacientes con ELA mostraron un menor NF de forma más acentuada en el NC.
Relación entre los biomarcadores ecográficos y los parámetros clínicos MRC y ALSFRS-rEn la extremidad superior, solo el GM del ACP en reposo mostró una correlación positiva significativa tanto con la MRC total (r-Pearson = 0,34; R2% = 11,6%; p = 0,011) como con la ALSFRS-r (r-Pearson = 0,44; R2% = 19,4%; p ≤ 0,001).
Por otro lado, en la extremidad inferior la diferencia de engrosamiento del TA mostró una asociación significativamente positiva tanto con la MRC (r-Pearson = 0,30; R2% = 15,2%; p = 0,003) como con la ALSFRS-r (r-Pearson = 0,26; R2% = 6,8%; p = 0,049). Finalmente, el NF del NC mostró una significativa asociación positiva con la MRC (r-Pearson = 0,35; R2% = 12,3%; p = 0,008).
DiscusiónEn este estudio, se ha podido constatar que es posible la cuantificación fascicular del nervio periférico como un biomarcador ecográfico fiable y reproducible, junto a otros ya estudiados como el diámetro, el AST en el nervio y el NF o el GM, la ecointensidad, ecovariación del músculo en pacientes con ELA7,9,12,13,41.
En esta investigación, se ha confirmado la capacidad discriminatoria de algunas variables dependientes del GM, no solamente en reposo sino también en contracción, de manera que podrían ser útiles en la monitorización de la progresión de la enfermedad26. Por otro lado, se ha observado una clara tendencia en la reducción del número de fascículos de los nervios afectados en los pacientes con ELA, especialmente en los tramos proximales del nervio, tal y como ya definieron otros autores, pero en relación exclusivamente a variables morfológicas14,15,42.
Fiabilidad y reproducibilidad de los biomarcadores ecográficosComo consecuencia de la aparición de equipos ecográficos de alta resolución, ha sido en los últimos 15 años cuando se ha empezado a estudiar el comportamiento de los biomarcadores ecográficos neuromusculares en la ELA. Durante estos años, diferentes grupos han puesto a prueba la fiabilidad y reproducibilidad de estos métodos de evaluación7,13,41–43. Sin embargo, en relación a la cuantificación fascicular del nervio periférico la literatura es muy escasa y los estudios no evalúan su fiabilidad. En este estudio se ha encontrado una muy buena concordancia en la cuantificación del NF tanto intra como interobservador.
Biomarcadores ecográficos entre pacientes con ELA y sujetos controles sanosEn relación a la musculatura, y al igual que otros autores, hemos observado que la medida del GM en reposo discrimina entre sujetos controles sanos y pacientes con ELA, especialmente si se encuentran en una fase avanzada donde la atrofia muscular y la reducción de la fuerza están más presentes9,44. Sin embargo, esta medida parece presentar limitaciones como herramienta de monitorización, especialmente a partir de una fase intermedia del proceso evolutivo donde la atrofia está muy acentuada8,44.
Por los motivos antes expuestos, y de manera análoga a los estudios que se centran en la evaluación de la contracción diafragmática45,46 comienzan a aparecer investigaciones donde las evaluaciones dinámicas de los músculos periféricos adquieren un mayor protagonismo como herramientas de monitorización en pacientes con ELA26. En nuestro estudio, hemos analizado como biomarcadores dinámicos el GM en contracción y la diferencia de engrosamiento muscular que muestran capacidad discriminatoria. Sin embargo, serían necesarios nuevos estudios para poder comprobar su potencial en el seguimiento evolutivo de estos pacientes.
En relación a la evaluación del nervio periférico y pese al interés que se le está mostrando en los últimos años en el aspecto morfológico15,47, hasta donde llega el conocimiento de los autores, no existe ningún estudio que haya evaluado el NF y la DF en pacientes con ELA. Cartwright et al. y Ridolfi et al. estudiaron esta medida exclusivamente sobre el nervio mediano a su paso por la muñeca en sujetos sanos y con un equipo de ultra-alta frecuencia poco accesible en el ámbito clínico17,18. Nuestros resultados muestran una clara tendencia de pérdida de fascículos en los nervios afectados por ELA, posiblemente como resultado de la pérdida de motoneuronas y un significativo aumento de la DF del NM a la altura del brazo como consecuencia de la significativa reducción del AST. Recuérdese que la DF es el cociente entre el NF y el AST, por lo que si esta se reduce, aumentará la DF. Estos mismos patrones se encuentran también presentes en el resto de los nervios evaluados. Aun así, serán necesarios estudios posteriores con mayor potencia estadística y que incluyan también la evaluación de las raíces nerviosas para poder determinar la auténtica capacidad de estos nuevos biomarcadores nerviosos frente a las clásicas mediciones musculares.
Relación entre los biomarcadores ecográficos y los parámetros clínicos MRC y ALSFRS-rLa correlación positiva entre el GM tanto con la fuerza muscular como con el grado de discapacidad ya ha sido observada por otros autores7. En nuestro estudio, hemos analizado una correlación también positiva entre estas variables clínicas y el GM en reposo del ACP y la diferencia de engrosamiento del TA, pudiendo generar esta última un gran interés para futuros estudios.
Pese a nuestra limitación en el tamaño muestral y, a diferencia de lo observado por otros autores48, hemos apreciado una interesante correlación significativamente positiva entre el NF y la fuerza muscular, observada fundamentalmente en el NC en relación al músculo TA.
Limitaciones e interés clínicoConsideramos que los biomarcadores, NF y DF del nervio periférico, al igual que las variables dinámicas dependientes del GM, pueden marcar las próximas investigaciones en lo que respecta al comportamiento de los biomarcadores ecográficos en la ELA, sin embargo, es necesario explorar poblaciones de pacientes más grandes y con diferentes estadios evolutivos que permitan confirmar los patrones observados.
El reducido tamaño muestral representa la mayor limitación de nuestro estudio piloto que, pese a los interesantes resultados obtenidos, no nos ha permitido llevar a cabo otros análisis más robustos que pudieran aportar mayor claridad sobre la capacidad de los biomarcadores estudiados. Sin embargo, en este trabajo se ha evaluado por primera vez la estructura interna, no solo la morfología, del nervio periférico en pacientes con ELA, dejando constancia de su fiabilidad, reproducibilidad y su potencial de cara a futuras investigaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.