El diagnóstico precoz de la enfermedad de Alzheimer mediante la utilización de biomarcadores podría facilitar la instauración y monitorización de intervenciones terapéuticas tempranas con potencial capacidad para modificar significativamente el curso de la enfermedad.
DesarrolloLos biomarcadores clásicos de líquido cefalorraquídeo y de neuroimagen estructural y funcional aprobados tienen una aplicación clínica limitada, dado su carácter invasivo o su elevado coste. La identificación de biomarcadores más accesibles y menos costosos, como los sanguíneos, facilitaría su aplicación en la práctica clínica. Se presenta una revisión bibliográfica de los principales biomarcadores bioquímicos sanguíneos con potencial utilidad para el diagnóstico de la enfermedad de Alzheimer.
ConclusionesLos biomarcadores sanguíneos son coste y tiempo efectivos con respecto a los marcadores de líquido cefalorraquídeo. Sin embargo, la aplicabilidad inmediata de los biomarcadores bioquímicos sanguíneos en la práctica clínica es poco esperable. Las principales limitaciones estriban en la dificultad para la medición y estandarización de los umbrales entre los diferentes laboratorios y en los fallos de replicación de resultados. Entre todas las moléculas estudiadas, los biomarcadores de apoptosis y neurodegeneración, al igual que los paneles de biomarcadores obtenidos mediante aproximaciones ómicas —como la metabolómica de forma aislada o combinada— ofrecen los resultados más prometedores.
The early diagnosis of Alzheimer's disease (AD) via the use of biomarkers could facilitate the implementation and monitoring of early therapeutic interventions with the potential capacity to significantly modify the course of the disease.
DevelopmentClassic cerebrospinal fluid biomarkers and approved structural and functional neuroimaging have a limited clinical application given their invasive nature and/or high cost. The identification of more accessible and less costly biomarkers, such as blood biomarkers, would facilitate application in clinical practice. We present a literature review of the main blood biochemical biomarkers with potential use for diagnosing Alzheimer's disease.
ConclusionsBlood biomarkers are cost and time effective with regard to cerebrospinal fluid biomarkers. However, the immediate applicability of blood biochemical biomarkers in clinical practice is not very likely. The main limitations come from the difficulties in measuring and standardising thresholds between different laboratories and in failures to replicate results. Among all the molecules studied, apoptosis and neurodegeneration biomarkers and the biomarker panels obtained through omics approaches, such as isolated or combined metabolomics, offer the most promising results.
La enfermedad de Alzheimer (EA) es la enfermedad neurodegenerativa más frecuente, responsable del 50-70% de los casos de demencia1-7, con una previsión de hasta 115 millones de personas afectadas para el año 20508-10. En la actualidad, la demencia es la tercera causa de muerte tras las enfermedades cardiovasculares y el cáncer3.
A pesar de su gran impacto, la patogénesis de la EA permanece en gran medida desconocida. La hipótesis más aceptada es la de la cascada amiloidea10-13, aunque también se han descritos trastornos de la homeostasis del calcio, colesterol y glucosa como factores contribuyentes a la patogenia de la EA4. Además, se ha postulado que la enfermedad micro- y macrovascular podría contribuir a la generación de enfermedad amiloidea y neurodegeneración, precediendo al desarrollo de la demencia asociada a la EA11.
Por otro lado, se estima que los procesos neurodegenerativos pueden comenzar hasta 20-30 años antes del inicio de los síntomas3,14. La detección precoz de la EA en etapas presintomáticas ofrecería una gran oportunidad para establecer intervenciones terapéuticas tempranas y con mayor probabilidad de éxito, puesto que se realizarían antes de que el daño sináptico y la pérdida neuronal estuvieran extendidos. En este escenario, resultaría muy útil la incorporación a la práctica clínica de nuevos biomarcadores, más accesibles y menos costosos que los biomarcadores clásicos15.
En este trabajo, se presenta una revisión bibliográfica de los principales biomarcadores bioquímicos sanguíneos con potencial utilidad en la práctica clínica para el diagnóstico de la EA.
Utilidad y limitaciones de los biomarcadores sanguíneos en la enfermedad de AlzheimerLa principal limitación de los biomarcadores clásicos de la EA —biomarcadores «core» en líquido cefalorraquídeo (LCR), Aß, tau-total (tau-t) y tau fosforilada (tau-p), y PET de metabolismo de glucosa y depósito amiloide4,16-23— es su carácter invasivo y coste excesivo, lo que dificulta su aplicación en la práctica clínica24.
La sangre es un fluido accesible que puede utilizarse como origen de potenciales biomarcadores de cribado o diagnóstico para EA. Además, los biomarcadores sanguíneos son coste y tiempo efectivos con respecto a los marcadores de LCR2,18,25,26. Los biomarcadores deben estar relacionados con características específicas de la enfermedad, tener gran sensibilidad y especificidad para EA y ser reproducibles, no invasivos, fáciles de realizar y de bajo coste9. Cumpliendo los anteriores postulados, los biomarcadores sanguíneos podrían identificar a pacientes en riesgo de presentar EA, de progresión de deterioro cognitivo leve (DCL) a EA y de progresión rápida dentro de la EA clínicamente establecida8.
Una de las dificultades para la identificación de biomarcadores sanguíneos en la EA estriba en que es una enfermedad lentamente progresiva y que se desconoce el grado de pérdida de integridad de la barrera hematoencefálica. Sin embargo, se ha descrito la existencia de disfunción de la barrera hematoencefálica en los pacientes con EA, lo que implicaría la existencia de intercambio de proteínas y otras moléculas entre el LCR y la sangre16.
Otra limitación es que la sangre es un fluido complejo con múltiples factores de confusión: son necesarios protocolos estandarizados para la preparación de la muestra y su análisis17,25. Las diferencias descritas en concentraciones de analitos específicos podrían deberse a falta de estandarización de los métodos de calibración, a diferentes diluciones de muestras biológicas, a variabilidad en los anticuerpos utilizados y a diferencias de sensibilidad y fiabilidad instrumental2,25.
Las aproximaciones para identificar biomarcadores sanguíneos de EA se pueden dividir en dirigidas a identificar moléculas concretas (candidatas) relacionadas con mecanismos patogénicos conocidos y a explorar de forma no sesgada un perfil sérico o plasmático de moléculas mediante tecnologías ómicas25.
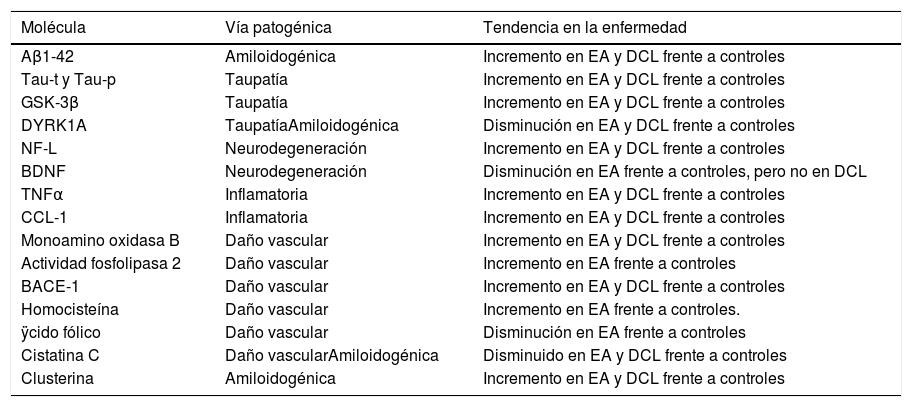
Identificación de biomarcadores sanguíneos en la enfermedad de Alzheimer con aproximación «molécula candidata»Péptidos AβSe han intentado identificar marcadores de enfermedad amiloidea en sangre periférica, dada la creencia de que la amiloidogénesis es el centro de la patogenia de la EA9 (tabla 1).
Listado de biomarcadores identificados con aproximación molécula candidata con posible finalidad diagnóstica en EA
| Molécula | Vía patogénica | Tendencia en la enfermedad |
|---|---|---|
| Aβ1-42 | Amiloidogénica | Incremento en EA y DCL frente a controles |
| Tau-t y Tau-p | Taupatía | Incremento en EA y DCL frente a controles |
| GSK-3β | Taupatía | Incremento en EA y DCL frente a controles |
| DYRK1A | TaupatíaAmiloidogénica | Disminución en EA y DCL frente a controles |
| NF-L | Neurodegeneración | Incremento en EA y DCL frente a controles |
| BDNF | Neurodegeneración | Disminución en EA frente a controles, pero no en DCL |
| TNFα | Inflamatoria | Incremento en EA y DCL frente a controles |
| CCL-1 | Inflamatoria | Incremento en EA y DCL frente a controles |
| Monoamino oxidasa B | Daño vascular | Incremento en EA y DCL frente a controles |
| Actividad fosfolipasa 2 | Daño vascular | Incremento en EA frente a controles |
| BACE-1 | Daño vascular | Incremento en EA y DCL frente a controles |
| Homocisteína | Daño vascular | Incremento en EA frente a controles. |
| ÿcido fólico | Daño vascular | Disminución en EA frente a controles |
| Cistatina C | Daño vascularAmiloidogénica | Disminuido en EA y DCL frente a controles |
| Clusterina | Amiloidogénica | Incremento en EA y DCL frente a controles |
BDNF: factor neurotrófico derivado de cerebro
La isoforma de Aβ-42 es el principal componente de placas seniles1. Es un producto de degradación de la proteína precursora de amiloide y puede producir daño en el ácido desoxirribonucleico (ADN) mediante mecanismos de estrés oxidativo. El Aβ circulante tiene origen tanto periférico como central. Se ha observado que diferentes factores bioquímicos, técnicos, clínicos, demográficos y genéticos afectan a los niveles de péptido Aβ. Por ejemplo, el Aβ circulante se une a proteínas plasmáticas y a las paredes de los tubos de ensayo, dado su carácter hidrofóbico, e induce enmascaramiento de epítopos e interferencia analítica16.
Existe una pobre correlación entre los niveles de Aβ en sangre y el LCR1. Aun así, se ha detectado un incremento de Aβ1-42 sérico en pacientes con EA con respecto a controles, que es más llamativo en pacientes con EA familiar o asociada3,17 a trisomía 21. Los niveles plasmáticos elevados de Aβ-42, bajos de Aβ-40 y un ratio Aβ-42/Aβ-40 reducido en pacientes con edad avanzada podrían indicar conversión de normalidad cognitiva a DCL o EA3.
Sin embargo, debido a la influencia de múltiples factores, la imposibilidad para reproducir muchos de los resultados y su controversia, actualmente no se puede establecer un claro papel de Aβ como biomarcador plasmático3,25.
Proteína tau y enzimas relacionadas con su fosforilaciónLa fosforilación de la proteína tau en diferentes residuos regula su capacidad para formar oligómeros y agregados3,9 que contribuirán a la formación de ovillos neurofibrilares.
Los métodos basados en la técnica de inmunoanálisis ELISA no tienen suficiente sensibilidad para detectar concentraciones bajas de tau plasmática1,2, pero sí una nueva técnica ultrasensible de inmunoanálisis. Mediante esta técnica se han detectado concentraciones plasmáticas de tau más elevadas en pacientes con EA con respecto a DCL y controles. La correlación entre tau plasmática y tau en LCR es muy débil, prácticamente inexistente27.
La detección de proteína tau en plasma se ha asociado con una mayor pérdida longitudinal de volumen hipocámpico y de grosor cortical en regiones específicamente afectas en EA, como la corteza entorrinal, la región inferomedial del lóbulo temporal, el giro fusiforme y el precuneus26,28,29.
Se ha postulado que los niveles de tau-t y tau-p se correlacionarían con las puntuaciones en test neuropsicológicos y podrían discriminar a pacientes con EA de los de DCL, y estos de los controles1,4,8,25,27. Sin embargo, la existencia de un gran solapamiento entre los valores de controles y pacientes dificulta su empleo como biomarcador25,26.
La proteína tau plasmática podría ser un marcador inespecífico de neurodegeneración, al objetivarse incrementado en pacientes con ictus isquémico, traumatismo craneoencefálico y prionopatías16. Pero la asociación descrita entre niveles de tau plasmático y atrofia en regiones específicamente afectas en la EA permite plantearla como un potencial marcador de cribado de EA precoz17.
Algunas proteína-cinasas, entre ellas la cinasa-glicógeno-sintetasa-3β (GSK-3β), se han relacionado con la hiperfosforalización de proteína tau3. Los niveles plasmáticos de GSK-3β estarían significativamente incrementados en pacientes con EA y DCL frente a controles de la misma edad, lo que lo convierte en un potencial biomarcador17.
Por otra parte, DYRK1A (dual specificity tyrosine-phosphorylation regulated kinase A) está implicada en la hiperfosforilación de tau. Esta enzima vincula la enfermedad amiloidea y tau, al regularse los niveles de DYRK1A por los niveles de Aβ. Los niveles sanguíneos de DYRK1A son significativamente menores en pacientes con EA respecto a controles, incluso en estadios precoces de la enfermedad9, lo que lo habilita como potencial biomarcador de diagnóstico precoz. También se ha relacionado DYRK1A con la disregulación de vías neurotróficas, sobre todo, del factor neurotrófico derivado de cerebro, molécula con múltiples funciones en la plasticidad sináptica y la supervivencia neuronal, y cuyos niveles sanguíneos están disminuidos en fases moderadas-avanzadas de la EA9,30.
Neurofilamento ligeroLos pacientes con EA presentan concentraciones elevadas de neurofilamento ligero (NF-L), marcador de daño neuronal, en el LCR26. Además, existe una excelente correlación entre los niveles plasmáticos y en LCR1,17. Los niveles plasmáticos de NF-L están elevados en pacientes con EA y DCL Aβ positivos y están asociados con el grado de deterioro cognitivo (puntuación en MiniMental Test y Trail Making Test parte B) y con alteraciones descritas en neuroimagen al diagnóstico y evolución de la enfermedad. Sin embargo, la elevación plasmática de NF-L no es específica de la EA: se detecta en otras enfermedades neurodegenerativas y se considera, por tanto, como un marcador de neurodegeneración26.
Biomarcadores basados en la hipótesis inflamatoria de la enfermedad de AlzheimerEn la hipótesis inflamatoria, la neuroinflamación no es consecuencia de la neurodegeneración, sino un factor patogénico en fases iniciales y en la progresión de la enfermedad que perpetuaría el daño neuronal, con activación de microglía y linfocitos T periféricos e implicación del sistema inmune innato10. El depósito de tau activaría la microglía y los astrocitos. Además, las formas insolubles de Aβ actuarían sobre los receptores toll-like, mientras que las Aβ solubles serían fagocitadas por la microglía, activando las proteína-cinasas-mitógeno-activadas y estimulando la producción de genes proinflamatorios y citocinas, lo que perpeturaría la inflamación. Las citocinas, a su vez, atraerían a células del sistema inmune periférico y producirían alteraciones en la permeabilidad de la barrera hematoencefálica.
Los mediadores inflamatorios presentes en LCR y sangre, y particularmente citocinas y quimocinas, podrían ser utilizados como biomarcadores para el diagnóstico precoz de la EA. En el cerebro de pacientes con EA, como citocinas mediadoras de respuesta inmune, destacan las interleucinas (IL-1, IL-4, IL-6, IL-10), el interferón-γ y el factor de necrosis tumoral α (TNFα)4,22,30.
La citocina I-309 es una glicoproteína secretada por linfocitos T activados. Su función principal es atraer linfocitos B inmaduros, monocitos, células natural killers y dendríticas con receptores CCR8. Se ha postulado como posible predictor de progresión de DCL a EA25.
AutoanticuerposLa presencia de autoanticuerpos en la EA está bien establecida, pero no así su papel patogénico. Su aplicación como posibles biomarcadores es de gran interés, dada su presencia en sangre y LCR.
Se han estudiado anticuerpos anti-Aβ sin concluir su utilidad clínica y se ha planteado el uso de perfiles de autoanticuerpos sanguíneos con prometedores resultados16,31,32.
Existe evidencia de que determinados los anticuerpos antifosfólipido obtenidos mediante oxidorreducción están disminuidos en el LCR de pacientes con EA, pero no claramente en sangre. Los niveles de anticuerpos antifosfolípido obtenidos mediante oxidorreducción tienen un incremento inicial en fases de DCL y posterior disminución con la evolución de la enfermedad. Por tanto, se postulan como marcadores del estadio y no como diagnósticos13.
Biomarcadores de apoptosisLa clusterina está relacionada con procesos de neurodegeneración y sus niveles sanguíneos están incrementados en pacientes con EA. Los niveles de clusterina se correlacionan con el depósito de amiloide objetivado mediante PET y con el grado de atrofia hipocámpica. Se ha postulado que la clusterina podría actuar como transportadora de proteínas extracelulares, entre ellas Aβ, y que dicha unión disminuiría su toxicidad25,33.
Biomarcadores de plaquetasSe ha detectado un incremento de la actividad β-secretasa-1, expresión elevada de monoamino oxidasa B y actividad fosfolipasa A2 en plaquetas sanguíneas y en el cerebro de pacientes con EA3,17.
Biomarcadores de daño microvascularLos factores de riesgo vascular clásicamente se han implicado en el incremento de riesgo de la EA. Se ha detectado una elevación sanguínea del péptido natriurético auricular y la adrenomedulina desde las fases prodrómicas. Además, la adrenomedulina se ha encontrado elevada en el cerebro de pacientes con EA34, confirmándose como potencial biomarcador relacionado con la patogenia de la enfermedad. Por el contrario, no se han detectado diferencias en la expresión de las moléculas de adhesión (VCAM-1 e ICAM-1), ni en selectinas35.
Los niveles plasmáticos de homocisteína estarían relacionados directamente con los niveles de Aβ-42. La hiperhomocisteinemia reduce la neurogénesis mediante un mecanismo que implica el factor del crecimiento de fibroblastos. La homocisteína moderadamente elevada es un factor de riesgo para demencia vascular y EA: se ha objetivado un incremento significativo en los niveles plasmáticos de homocisteína en pacientes con EA9.
Por otra parte, se ha descrito asociación entre EA y niveles plasmáticos bajos de ácido fólico. El ácido fólico es esencial para el metabolismo de la homocisteína. En la EA, la reparación del ADN se encuentra inhibida por el daño oxidativo inducido por Aβ acompañado de deficiencia de ácido fólico. El ácido fólico regula la actividad ADN-metil-transferasa atenuando la producción de Aβ. La actividad ADN-metil-transferasa se correlaciona con la formación de la memoria reciente y el mantenimiento de la memoria remota. Se ha postulado que la combinación de niveles de folato, hemoglobina y APOE incrementaría la sensibilidad predictiva respecto al nivel de folato usado de forma aislada como biomarcador diagnóstico de la EA. También se ha documentado que la hemoglobina se uniría a Aβ y favorecería su agregación; por tanto, cifras elevadas de hemoglobina podrían considerarse un factor de riesgo de la EA12.
La cistatina C es un inhibidor endógeno de cisteína, producida por casi todas las células humanas y disponible prácticamente en todos los fluidos corporales y es considerada como uno de los potenciales marcadores de daño vascular. La cistatina C impide la agregación de Aβ y su depósito de forma concentración-dependiente por su unión a la proteína precursora de amiloide y a los péptidos Aβ1-40 y Aβ1-42. Los niveles séricos y en LCR de cistatina C estarían disminuidos en pacientes con EA desde fases iniciales36.
Identificación de biomarcadores sanguíneos en la enfermedad de Alzheimer mediante tecnologías ómicasProteómica plasmáticaCon el objetivo de discriminar pacientes con EA de sujetos sanos, varios estudios han aportado paneles de biomarcadores compuestos por gran cantidad de proteínas con diferentes combinaciones de alta sensibilidad y especificidad. Sin embargo, los resultados muestran un alcance limitado, dada la dificultad de replicarlos17,25,37(tabla 2).
Listado de biomarcadores identificados con aproximación proteómica con posible finalidad diagnóstica en EA
| Molécula | Vía patogénica | Tendencia en la enfermedad |
|---|---|---|
| Apolipoproteína A1 | Amiloidogénica | Disminuido en EA y DCL frente a controles |
| Alfa-2-HS-glicoproteína | Inflamatoria | Disminuido en EA y DCL frente a controles |
| Afamina | Amiloidogénica | Disminuido en EA frente a controles |
| Plasminógeno | Daño vascular | Disminuido en EA frente a controles |
| Apolipoproteína A4 | Daño vascular | Aumentado en EA y DCL frente a controles |
| Cadenas gamma fibrinógeno | Daño vascular | Aumentado en EA y DCL frente a controles |
| α-1-antitripsina | Amiloidogénica | Incremento en EA frente a controles |
| α-2-macroglobulina | Amiloidogénica | Incremento en EA frente a controles |
| Complemento C3 | Inflamatoria | Incremento en EA frente a controles |
Comparando los perfiles proteómicos en sangre periférica, se ha objetivado desde fases precoces de la EA que los niveles de apolipoproteína A-1 (que inhibe la agregación de oligómeros Aβ disminuyendo su acúmulo extracelular), α-2-HS-glicoproteína (con funciones antiinflamatorias y efecto neuroprotector), afamina (proteína de unión específica a vitamina E que permite su transporte por la barrera hematoencefálica con potencial efecto beneficioso sobre el daño ocasionado por Aβ o estrés oxidativo) y plasminógeno están significativamente más bajos en pacientes respecto a controles. Los niveles de apolipoproteína A-4 y cadenas gamma de fibrinógeno, propuestos como responsables de anomalías vasculares en la EA, están significativamente más elevados con respecto a controles3,16,18. Por ello, se podrían convertir en biomarcadores para el diagnóstico precoz de EA. Al igual que α-1-antitripsina, α-2-macroglobulina, apolipoproteína E y complemento C3, propuestos como biomarcadores diagnósticos de EA tras una revisión sistemática con replicación posterior38.
Metabolómica plasmáticaLa metabolómica permite identificar alteraciones metabólicas monitorizando simultáneamente una gran variedad de metabolitos, lo que contribuye a comprender mejor la patogenia de la enfermedad. Así, los estudios de perfiles de lipidómica en pacientes con EA esporádica han mostrado la existencia de déficits significativos en 2 categorías importantes de lípidos estructurales: glicerofosfolípidos y esfingolípidos, junto con modificaciones en su metabolismo16,17,39-41.
ConclusionesEn la actualidad, existe un amplio consenso sobre la necesidad de aplicación de terapias anti-Aβ en fases tempranas, posiblemente preclínicas, de la EA. El lento depósito de Aβ enfatiza la existencia de una amplia ventana temporal en la que modificar la acumulación de Aβ, pero su identificación clínica requiere el uso de biomarcardores. De elección serían los no invasivos y no excesivamente costosos, como los biomarcadores sanguíneos.
Históricamente, la sensibilidad y especificidad de los biomarcadores sanguíneos ha sido menor que las de los de LCR. La gran dificultad para reproducir y validar con adecuada sensibilidad y especificidad los resultados de biomarcadores sanguíneos ha limitado su aplicación en la práctica clínica hasta la fecha. No obstante, es obvio que existe evidencia creciente sobre la existencia de una especie de firma biológica sanguínea de la EA15. Los biomarcadores sanguíneos de neurodegeneración, y entre ellos tau y NF-L más que AB; de apoptosis como la clusterina; paneles de proteómica y metabolómica probablemente sean los más prometedores. En cambio, es más discutible en la actualidad la utilidad de biomarcadores inflamatorios, de plaquetas o daño microvascular.
La identificación de biomarcadores sanguíneos fiables para el diagnóstico de la EA sigue limitada en la actualidad por problemas técnicos: es muy difícil estandarizar un biomarcador sanguíneo para su uso mundial, dadas las diferencias de muestra, de población estudiada, etc. Pero, gracias a que existen iniciativas globales para superar dichas limitaciones, es probable que, en un futuro próximo, se podrán aplicar en la práctica clínica. Además, dada las limitaciones encontradas en los biomarcadores sanguíneos individuales en cuanto a su sensibilidad, especificidad y valores predictivos, su combinación en paneles de biomarcadores surge como la opción más realista para su aplicación en la práctica clínica.
Por otra parte, nuevos campos del conocimiento están emergiendo como fuentes de potenciales herramientas diagnósticas, como es el caso de los biomarcadores epigenéticos, entre ellos las marcas de metilación del ADN y ciertos ARN no codificantes, como los microARN.
En el futuro, los estudios de aproximación ómica permitirán nuevos niveles de conocimiento y análisis. Por ejemplo, mediante la aplicación simultánea de diferentes tecnologías ómicas al mismo conjunto de muestras o por medio de nuevos métodos de análisis de datos, combinando técnicas bioinformáticas, estadísticas y de inteligencia artificial, se podrán identificar nuevas vías biológicas alteradas en la EA. La identificación de nuevos patrones de biomarcadores junto con las cascadas moleculares afectadas podría ser utilizada para el descubrimiento de futuras dianas terapéuticas para tratamiento de la EA.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.