En la actualidad, las infecciones de piel y partes blandas forman parte de un alto porcentaje de las consultas en salud. Estas van desde infecciones leves, donde el manejo se realiza con tratamiento tópico, hasta aquellas con severo compromiso sistémico, requiriendo terapia antibiótica sistémica e incluso el desbridaje quirúrgico. En general, son producto de un desbalance entre los mecanismos de defensa de la barrera cutánea y los factores de virulencia y patogenicidad de los microorganismos que la afectan. Se pueden clasificar según distintos criterios, como por ejemplo, profundidad, gravedad, microorganismos involucrados y si estas son purulentas o no. El reconocer estas entidades clínicas es de suma importancia para llevar a cabo un adecuado tratamiento en los pacientes que presentan estas afecciones, ya que los diagnósticos erróneos llevan a las múltiples consultas con el consiguiente aumento de costos asociados en atención en salud.
Currently, skin and soft tissue infections are part of a high percentage of health consultations. These range from mild infections, where management is performed with topical treatment, to those with severe systemic compromise requiring systemic antibiotic therapy and even surgical debridement. In general, they are the product of an imbalance between the defense mechanisms of the skin barrier and the virulence and pathogenicity factors of the microorganisms that affect it, which can vary from bacterial, viral, fungal and parasites agents. Skin and soft tissue infections can be classified according to different criteria, such as depth, severity, microorganisms involved and whether they are purulent or not. Recognizing these clinical entities is of utmost importance to carry out adequate treatment in patients with these conditions, since erroneous diagnoses lead to multiple consultations with the consequent increase in costs associated with health care.
Las infecciones que comprometen la piel son producto de un desbalance entre los mecanismos de defensa de la barrera cutánea y los factores de virulencia y patogenicidad de los microorganismos que la afectan1. Los principales organismos que generan las infecciones de piel y partes blandas son de origen bacteriano, sin embargo, otros agentes como los virus, parásitos y hongos también tienen un rol no menor, por lo que el clínico al momento de generar sus hipótesis de trabajo, debe incluirlos dentro de sus diagnósticos diferenciales y ser capaz de sospecharlos. El objetivo de esta revisión es describir las principales y más frecuentes patologías infecciosas que afectan a la piel, por lo que se hará énfasis en la clínica de cada una de ellas, entregando diversas claves diagnósticas para el adecuado enfrentamiento en la práctica, así como en los principales agentes involucrados y los tratamientos más adecuados para cada uno de estos. Esto último toma gran importancia en la actualidad debido al aumento de la resistencia antibiótica a nivel mundial, favorecido por el mal uso y abuso de los antimicrobianos que disponemos a la fecha. Para la presente revisión se analizaron los artículos más relevantes y recientes en cuanto a patología infecciosa cutánea, de forma de poner a disposición el conocimiento más actualizado posible.
ClasificaciónLas infecciones de piel y tejidos blandos se pueden clasificar según distintos criterios, entre los que encontramos profundidad, gravedad, microorganismos involucrados y si estas son purulentas o no. En especial, este último criterio ayuda a determinar el enfoque terapéutico inicial para enfrentar dichas patologías2 (Tabla 1).
Agentes Patógenos- 1.
Infecciones Bacterianas: Dos son las más importantes cuando se hace referencia a infecciones cutáneas y de partes blandas, estas son las causadas por el Staphylococcus aureus (S. aureus) y el Streptococcus pyogenes (S. pyogenes). Los bacilos Gram negativos son otro grupo bacteriano importante sobre todo en pacientes hospitalizados.
- •
Staphylococcus aureus: bacteria cocácea Gram positiva que se agrupa formando racimos. Es el principal microorganismo patógeno involucrado en las infecciones de piel y tejidos blandos, se encuentra en un 30-40% de los hisopados nasales en la población general3. Son determinantes del daño causado al hospedero, factores ambientales como traumatismos, comorbilidades, infecciones activas, sumado a factores de virulencia específicos del microorganismo. Una de las ventajas de este agente es su capacidad de evasión del sistema inmune, específicamente debido a que secreta moléculas que inhiben la diapedesis y, por ende, la migración de los neutrófilos, bloquean la fagocitosis o alteran las vías apoptóticas de los polimorfonucleares. Estos fenómenos permiten a este patógeno generar una gran variedad de manifestaciones clínicas desde foliculitis aisladas a infecciones necrotizantes con riesgo vital4. La prevalencia del S. aureus meticilino resistente (SAMR) no ha sido establecida de forma clara, los datos de países sudamericanos son escasos. La prevalencia más alta reportada de la región es de un 88% en Argentina y las más bajas son de Brasil, con 4,5 a 8,6% y Bolivia con 1,5% de casos reportados5. En la Tabla 2 se mencionan varios factores asociados al hospedero y al agente patógeno que determinan mayor riesgo de colonización tanto por el SAMR, como por el SAMR adquirido en la comunidad (SAMR-AC)6–8.
Tabla 2.Factores de riesgo para colonización por SAMR/SAMR-AC 6–8
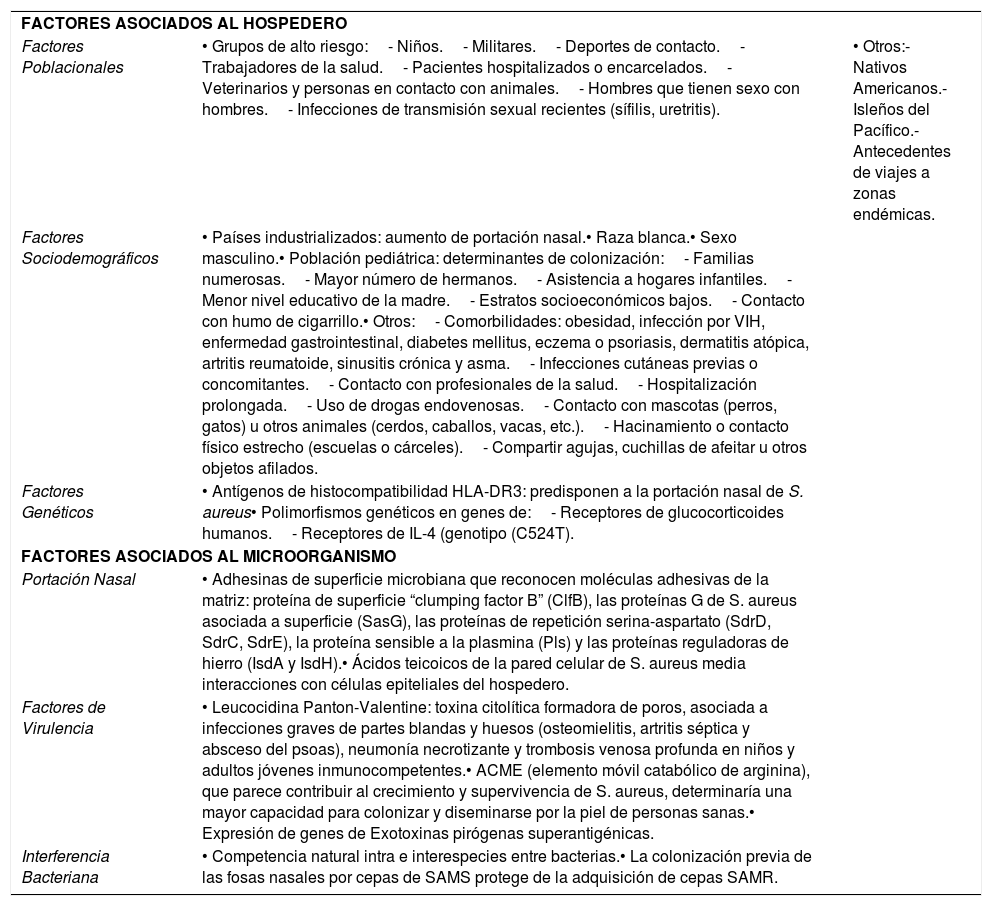
FACTORES ASOCIADOS AL HOSPEDERO Factores Poblacionales • Grupos de alto riesgo:- Niños.- Militares.- Deportes de contacto.- Trabajadores de la salud.- Pacientes hospitalizados o encarcelados.- Veterinarios y personas en contacto con animales.- Hombres que tienen sexo con hombres.- Infecciones de transmisión sexual recientes (sífilis, uretritis). • Otros:- Nativos Americanos.- Isleños del Pacífico.- Antecedentes de viajes a zonas endémicas. Factores Sociodemográficos • Países industrializados: aumento de portación nasal.• Raza blanca.• Sexo masculino.• Población pediátrica: determinantes de colonización:- Familias numerosas.- Mayor número de hermanos.- Asistencia a hogares infantiles.- Menor nivel educativo de la madre.- Estratos socioeconómicos bajos.- Contacto con humo de cigarrillo.• Otros:- Comorbilidades: obesidad, infección por VIH, enfermedad gastrointestinal, diabetes mellitus, eczema o psoriasis, dermatitis atópica, artritis reumatoide, sinusitis crónica y asma.- Infecciones cutáneas previas o concomitantes.- Contacto con profesionales de la salud.- Hospitalización prolongada.- Uso de drogas endovenosas.- Contacto con mascotas (perros, gatos) u otros animales (cerdos, caballos, vacas, etc.).- Hacinamiento o contacto físico estrecho (escuelas o cárceles).- Compartir agujas, cuchillas de afeitar u otros objetos afilados. Factores Genéticos • Antígenos de histocompatibilidad HLA-DR3: predisponen a la portación nasal de S. aureus• Polimorfismos genéticos en genes de:- Receptores de glucocorticoides humanos.- Receptores de IL-4 (genotipo (C524T). FACTORES ASOCIADOS AL MICROORGANISMO Portación Nasal • Adhesinas de superficie microbiana que reconocen moléculas adhesivas de la matriz: proteína de superficie “clumping factor B” (ClfB), las proteínas G de S. aureus asociada a superficie (SasG), las proteínas de repetición serina-aspartato (SdrD, SdrC, SdrE), la proteína sensible a la plasmina (Pls) y las proteínas reguladoras de hierro (IsdA y IsdH).• Ácidos teicoicos de la pared celular de S. aureus media interacciones con células epiteliales del hospedero. Factores de Virulencia • Leucocidina Panton-Valentine: toxina citolítica formadora de poros, asociada a infecciones graves de partes blandas y huesos (osteomielitis, artritis séptica y absceso del psoas), neumonía necrotizante y trombosis venosa profunda en niños y adultos jóvenes inmunocompetentes.• ACME (elemento móvil catabólico de arginina), que parece contribuir al crecimiento y supervivencia de S. aureus, determinaría una mayor capacidad para colonizar y diseminarse por la piel de personas sanas.• Expresión de genes de Exotoxinas pirógenas superantigénicas. Interferencia Bacteriana • Competencia natural intra e interespecies entre bacterias.• La colonización previa de las fosas nasales por cepas de SAMS protege de la adquisición de cepas SAMR. SAMR: Staphylococcus aureus Metilicino-Resistente.
SAMR-AC: Staphylococcus aureus Metilicino-Resistente Adquirido en la comunidad.
IL: Interleuquinas.
- •
Streptococcus pyogenes: Es la segunda bacteria patógena más importante que afecta la piel y el tejido subcutáneo. Morfológicamente, es una cocácea Gram positiva que se agrupa en cadenas, se encuentra tanto en las mucosas como en la piel y puede causar gran variedad de manifestaciones, desde erisipela hasta neumonías o meningitis bacteriana severas. Dentro de sus mecanismos patogénicos se encuentran la estreptolisina S y O, hialuronidasa, estreptoquinasa, exotoxinas pirogénicas, entre otras que favorecen la virulencia de esta bacteria.
- •
Bacilos Gram negativos: Este grupo bacteriano ocupa un rol no menor en la génesis de infecciones cutáneas, que en su mayoría se hacen presente en el ambiente hospitalario, principalmente en cuadros de infecciones asociadas al sitio quirúrgico y en gran proporción en los pies diabéticos. Los agentes que más comúnmente han sido aislados son Escherichia coli, Pseudomona aeruginosa, Proteus spp. y Klebsiella pneumoniae9.
- •
- 2.
Infecciones Virales: Múltiples infecciones cutáneas son producidas por virus, destacándose principalmente virus herpes simplex tipo 1 y 2, virus varicela zoster, Pox virus y virus papiloma humano. Pacientes con algún grado de inmunocompromiso pueden desarrollar una infección diseminada y causar formas graves de la enfermedad como el eccema herpeticum, que puede ocurrir hasta en el 3% de los pacientes con dermatitis atópica10.
- 3.
Infecciones Parasitarias: Existen varios ectoparásitos capaces de comprometer la piel y fanéreos en el humano, siendo las enfermedades más frecuentes la pediculosis y la escabiosis11. En el último tiempo en la población chilena estas infecciones han ido aumentando, en contexto de la migración y el hacinamiento de la población. Con menor frecuencia, también destacan las enfermedades del viajero como las producidas por rickettsias, como por ejemplo la tungiasis y larva migrans12.
- 4.
Infecciones Micóticas: Tanto las infecciones micóticas superficiales, como las profundas, pueden presentar un sin número de manifestaciones cutáneas. Las micosis superficiales son producidas por dos grandes grupos de hongos: las levaduras y los dermatofitos (tiñas). Las primeras ocurren por una alteración de la microbiota que lleva a una proliferación del hongo y las segundas son infecciones exógenas en que el contagio está dado por transmisión de un animal u otra persona13. Las micosis profundas son infecciones poco frecuentes que abarcan las micosis subcutáneas y las sistémicas. Las micosis subcutáneas o por implantación, son producidas por hongos saprofitos cuyo hábitat es el suelo y las plantas, incluyen diversas entidades clínicas caracterizadas por la invasión de la piel y el tejido subcutáneo, mientras que las micosis sistémicas solo presentan lesiones en la piel en algunas ocasiones, ya sea por afectación directa de ella, como puerta de entrada, o tras la diseminación hematógena de la infección a partir de un foco profundo como pulmón, tubo digestivo o senos paranasales14,15.
- -
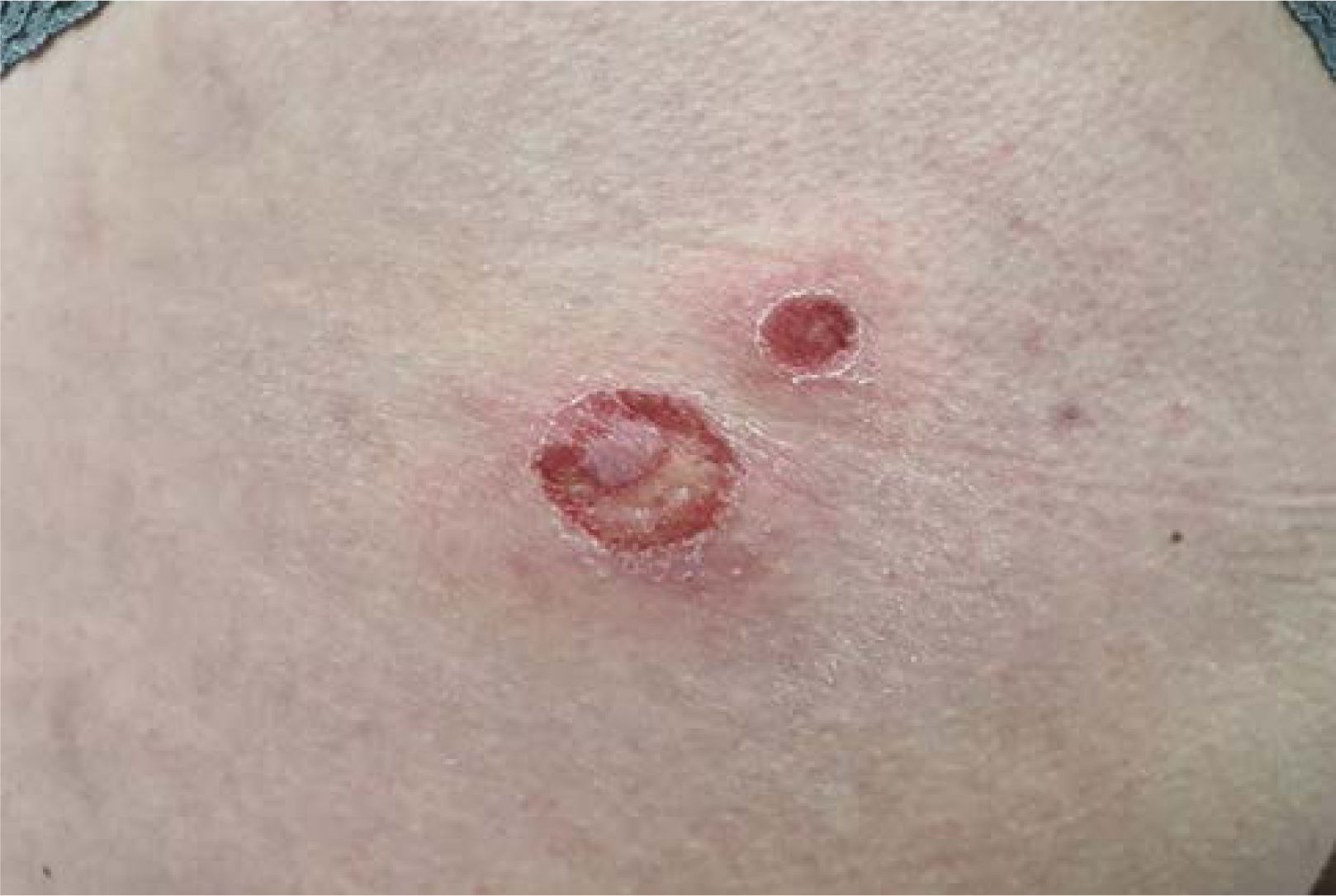
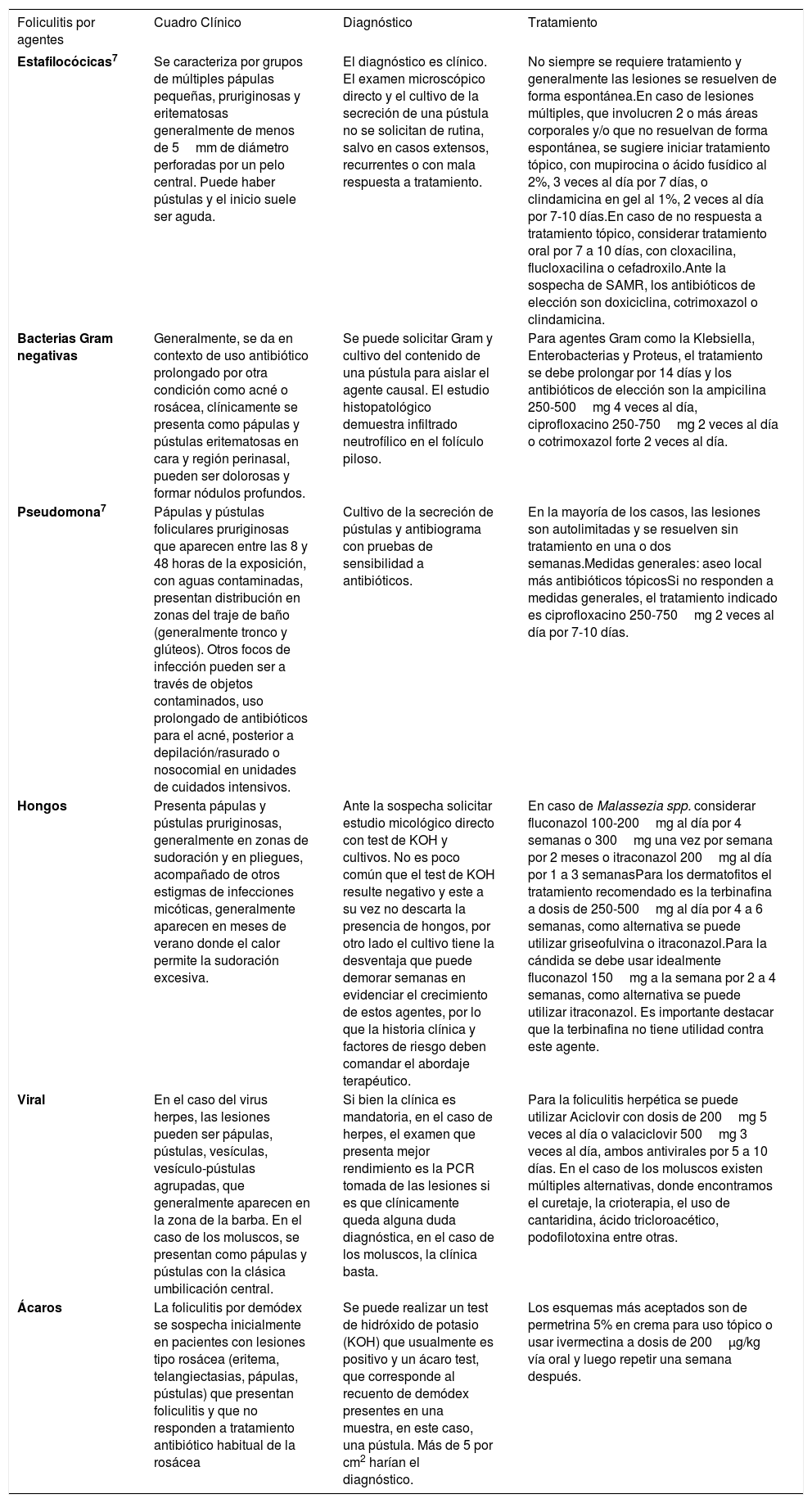
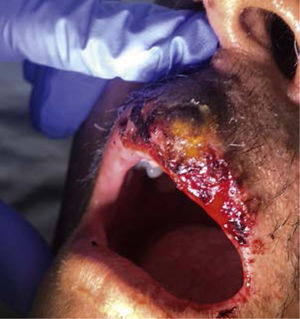
Definición: El impétigo es una infección de las capas superficiales de la piel hasta la dermis, altamente contagiosa que afecta generalmente a niños menores de 5 años, aunque puede presentarse a cualquier edad. La prevalencia media global del impétigo en la infancia se estima en 12,3%16 y de un 4,9% en adultos17, principalmente en países tropicales y de bajos ingresos. Existen, en general, dos tipos de impétigo, el no buloso (INB) y el buloso (IB). El INB se clasifica como primario cuando la invasión bacteriana se produce de manera directa sobre piel previamente sana y como INB secundario o impétigo común, si la infección es secundaria a alguna otra dermatosis subyacente que altera la barrera epidérmica, como por ejemplo sarna o eccema (Figura 1). Por otro lado, el IB se caracteriza por la erupción cutánea de ampollas producidas por la acción de exotoxinas exfoliativas del S. aureus fagotipo II, exfoliatina A y B, sobre la desmogleina 1 en la epidermis2 (Figura 2).
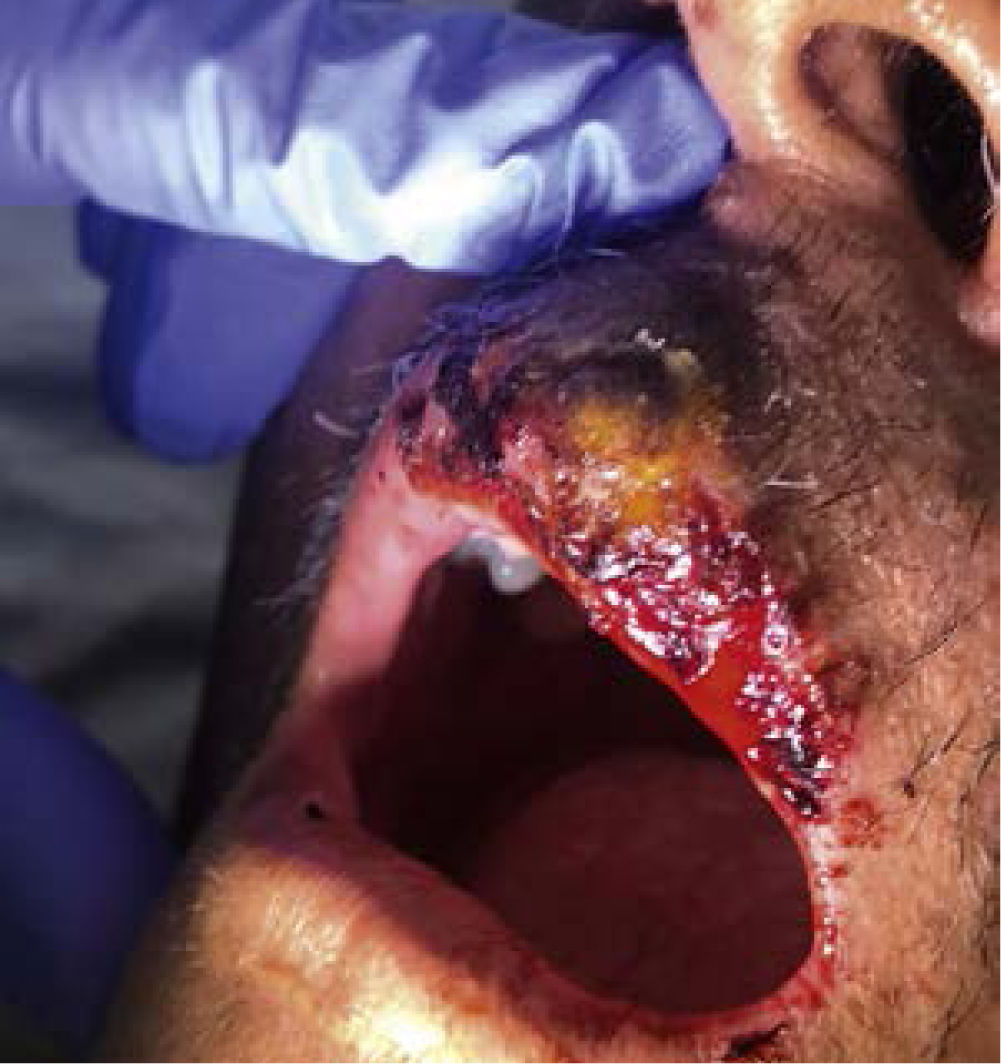
Figura 1.Herpes labial impetiginizado en paciente inmunocomprometido
El impétigo no buloso (INB) secundario representa el 70% de los casos de impétigo y es causado principalmente por S. aureus o Streptococcus pyogenes. Se produce sobre otra dermatosis subyacente que alteran la barrera cutánea.
(0.13MB). - -
Epidemiología y Etiología: Se ha estimado que más de 162 millones de niños sufren de impétigo en algún momento de sus vidas, determinado por la conjunción de varios factores predisponentes como climas de alta humedad, ingresos bajos, sumado al hacinamiento y la falta de higiene, al igual que la portación cutánea de los agentes causales. El INB representa el 70% de los casos y es causado principalmente por S. aureus o Streptococcus pyogenes, variando según la época y la región. En climas tropicales, predomina el estreptococo β-hemolítico grupo A (SBHGA) y en climas templados, el S. aureus16,17. Es importante destacar el aumento preocupante de SAMR asociado a la comunidad como agente etiológico del impétigo a nivel mundial, según reportes de varios estudios epidemiológicos8.
- -
Cuadro clínico: La lesión inicial de cualquier tipo de impétigo es una vesícula de paredes delgadas, rodeada de un halo eritematoso en piel previamente sana de extremidades y cara (región nasal y perioral) que se rompe rápidamente, dejando una erosión superficial, a veces dolorosa, cubierta por costras de color marrón-amarillento o color miel (mielicéricas). Las costras se secan y se separan, luego la erosión se repara sin dejar cicatrices (Figura 1). Por lo demás, no hay síntomas sistémicos asociados como fiebre, malestar general o anorexia, pero es común la inflamación de los ganglios linfáticos regionales que drenan el área infectada. El IB se caracteriza por vesículas o ampollas, con contenido a veces purulento, más grandes y resistentes, pudiendo persistir durante varios días. Por lo general, hay menos lesiones, concentrándose con mayor frecuencia en regiones intertriginosas, axilas y cuello, aunque cualquier zona cutánea puede verse afectada, incluyendo palmas y plantas. El tronco se afecta con mayor frecuencia que en el INB18.
- -
Diagnóstico: Es fundamentalmente clínico por las manifestaciones de las lesiones cutáneas y los antecedentes epidemiológicos asociados a factores condicionantes. Se recomienda realizar tinción de Gram y cultivo de la secreción o exudado para identificar el agente causal, pero es razonable iniciar tratamiento antibiótico empírico frente a presentaciones clásicas19.
- -
Manejo: El tratamiento antibiótico acelera la curación de las lesiones, aunque en casos leves y sin comorbilidades, la resolución espontánea se produce en dos o tres semanas. Tanto el IB como el INB se pueden tratar con antimicrobianos tópicos, principalmente con mupirocina, ácido fusídico o retapamulina, aplicados localmente 2 veces al día por 5 días19,20. Recientemente, la ozenoxacina, un nuevo agente antibacteriano tópico con potente actividad bactericida contra bacterias Gram positivas, ha demostrado ser eficaz y bien tolerado en el tratamiento del impétigo en pacientes desde los dos meses de vida21. Se recomienda la terapia con antibióticos vía oral en pacientes con numerosas lesiones (5 o más) o frente a brotes epidémicos de glomerulonefritis postestreptocócica, con el objetivo de disminuir la transmisión de la enfermedad, prefiriendo cefadroxilo o cloxacilina como tratamientos de primera línea para SAMS o SBHGA. Considerar antibióticos activos contra SAMR como clindamicina, doxiciclina o trimetoprim-sulfametoxazol en aquellas situaciones mencionadas en la Tabla 2. En caso de compromiso sistémico, progresión rápida del eritema o intolerancia a vía oral, se deberá contemplar el uso de antibioterapia empírica por vía parenteral, cuyo espectro de acción cubra de forma adecuada tanto Streptococcus spp., como S. aureus19,22–25 (Tabla 3). En países de menores ingresos, evidencia de alta calidad apoya el uso de cotrimoxazol oral o penicilina G benzatina intramuscular como primeras opciones de tratamiento para el impétigo16.
Tabla 3.Indicaciones de antibioterapia parenteral25
• Signos sistémicos de toxicidad (fiebre mayor de 38°C, hipotensión o taquicardia sostenida) • Progresión rápida del eritema • Progresión clínica después de 48 horas de antibióticos orales • Incapacidad para tolerar la terapia oral. • Proximidad de la lesión a un dispositivo médico permanente (prótesis articulares o injerto vascular) • Inmunocompromiso importante (neutropenia, trasplante de órgano reciente, infección avanzada por VIH, deficiencia de células B o T, uso de agentes inmunosupresores)
El ectima es una forma inhabitual ulcerativa de impétigo, causado por Streptococcus pyogenes, principalmente en niños con mala higiene, pacientes diabéticos o inmunocomprometidos. Por lo general, se trata de un impétigo no tratado que se extiende en profundidad a través de la epidermis y la dermis, dando lugar a úlceras cubiertas por una costra amarilla y rodeada por márgenes violáceos elevados que curan dejando cicatriz residual. Se acompaña de linfangitis y linfadenitis regional. La localización más frecuente es en brazos y piernas, aunque pueden afectar casi toda la superficie cutánea. Las complicaciones son infrecuentes, pero podría extenderse a otras áreas de la piel, desarrollar bacteriemia y glomerulonefritis secundarias. El diagnóstico es clínico y se confirma con Gram y cultivo de frotis de la úlcera. Como diagnósticos diferenciales, hay que descartar el ectima gangrenoso producido por Pseudomonas ante la presencia de una escara necrótica con centro verdoso y un paciente que clínicamente se ve enfermo. Otro diagnóstico a considerar, es el pioderma gangrenoso, en especial frente a una lesión ulcerosa cutánea de evolución rápida, en un paciente que no mejora con el tratamiento local, con cultivos negativos y sin respuesta al tratamiento antibiótico. A diferencia del impétigo, el ectima siempre debe tratarse con terapia antibiótica vía oral26.
CELULITIS Y ERISIPELAS- -
Definición: La celulitis y la erisipela son términos que pueden llevar a confusión, corresponden a infecciones localizadas de partes blandas que se desarrollan como resultado de la entrada de bacterias a través de una barrera cutánea alterada. Excepcionalmente, la causa es una bacteriemia desde otro sitio de infección, sobre todo en pacientes inmunocomprometidos6. La celulitis afecta la dermis más profunda y la grasa subcutánea, lo que determina compromiso más difuso con limites mal definido. Puede o no haber presencia de pus con un curso clínico más indolente, determinando el desarrollo de síntomas localizados en unos pocos días. El origen estreptocócico es más frecuente, pero no único, se pueden encontrar otras bacterias, ya sea solas o sinérgicas. Por otra parte, la erisipela afecta la dermis superior, los vasos linfáticos superficiales y no es purulenta, los síntomas de compromiso sistémico aparecen de forma aguda, en minutos u horas19,20,27.
- -
Epidemiología: La celulitis y la erisipela son diagnósticos clínicos comunes tanto en pacientes ambulatorios como en hospitalizados, representando cerca de 2,3 millones de visitas al servicio de urgencia, con una incidencia de unos 200 casos por cada 100.000 personas por año, siendo responsable de hasta un 10% de todos los ingresos hospitalarios anuales relacionados con enfermedades infecciosas en los Estados Unidos28. Comprometen las extremidades inferiores en el 70-80% de los casos, afectando de igual manera a hombres y a mujeres. La celulitis se presenta generalmente en individuos de edad media y adultos mayores, mientras que la erisipela se da en edades extremas de la vida6. Cualquier condición que genere una ruptura, trauma y/o inflamación/infección de la barrera cutánea, podría actuar como factor predisponente para desarrollar alguna de estas entidades29 (Tabla 4). El principal factor de riesgo asociado a la celulitis es el edema, especialmente el linfedema, porque se cree que la linfa facilita el crecimiento bacteriano. Revisiones internacionales reportan una puerta de entrada hasta en un 77% de los pacientes con celulitis, siendo esta en el 50% de las veces una infección micótica superficial, generalmente tiña pedis, con o sin onicomicosis concomitante30. Las dermatomicosis son un factor de riesgo significativo para celulitis (OR 2,4; p<0,001); como son individualmente la tiña interdigital de los pies (OR 3,2; p<0,001), la tiña plantar de los pies (OR 1,7; p=0,005) y la onicomicosis (OR 2,2; p<0,001)31. Independiente de la causa, una celulitis no tratada puede provocar complicaciones que incluyen daño tisular extenso, necrosis, infección diseminada, shock séptico y muerte32.
Tabla 4.Factores predisponentes de celulitis/erisipelaa
FACTORES LOCALES Dermatomicosisb • Intértrigo interdigital• Tiña plantar• Onicomicosis Disrupción de la barrera cutánea • Trauma• Herida penetrante• Lesiones por presión• Úlceras varicosas• Picadura de insectos• Drogas endovenosas Edema • Obstrucción al drenaje venoso• Postquirúrgico:- Safenectomía- Linfadenectomías• Anomalías congénitas• Insuficiencia venosa Inflamación cutánea • Dermatitis atópica• Psoriasis• Radioterapia Infecciones cutáneas • Celulitis previac• Varicela FACTORES SISTÉMICOS Inmunosupresión • VIH Obesidad • Favorece la oclusión y maceraciónd Otros • Tabaco (factor de riesgo para recurrencias)• Se ha descrito susceptibilidad genética aNo se han asociado a mayor riesgo de celulitis aguda: inmunosupresión, consumo de alcohol, diabetes y tabaquismo. Este último factor se ha relacionado a mayor riesgo de recurrencias25.
bPrincipal puerta de entrada clínicamente evidente, ya sea para reservorio o colonización por Streptococcus o por S. aureus6.
cUn episodio de celulitis en EEII tiene una tasa de recurrencia anual de 8-20% en los siguientes 1-3 años, especialmente en el mismo lugar o el área pretibial podría predisponer a episodios recurrentes23.
- -
Microbiología: los principales agentes involucrados en la celulitis no purulenta/no complicada en adultos inmunocompetentes son los estreptococos β-hemolíticos productores de estreptocinasa y DNasa B, fundamentalmente del grupo G, seguido del grupo A o Streptococcus pyogenes, presentes en hasta el 75 a 80% de los casos. El S. aureus sería el agente causal en aproximadamente el 10% de los restantes. Los bacilos aerobios Gram negativos cobran importancia en la población de pacientes inmunocomprometidos. En diabéticos con úlceras crónicas se deben sospechar anaerobios y Gram negativos; en celulitis purulenta, es más probable la infección por S. aureus, en especial SAMR hasta en un 59% de los pacientes, SAMS en el 17% y estreptococos β-hemolíticos en 2,6%. El SAMR-AC debiera considerarse en aquellas situaciones descritas en la Tabla 2. Las causas menos comunes de celulitis incluyen Haemophilus influenzae tipo b (celulitis bucal), clostridios y anaerobios no formadores de esporas (celulitis crepitante), Streptococcus pneumoniae y Neisseria meningitidis5,29. Las mordeduras de animales pueden asociarse a celulitis por Gram negativos como Pasteurella spp. y Capnocytophaga. Los estreptococos del grupo A pueden vincularse a desarrollo de fascitis necrotizante, aunque esta también puede deberse a infección polimicrobiana por microorganismos Gram negativos y anaerobios, particularmente en adultos mayores e inmunocomprometidos32.
- -
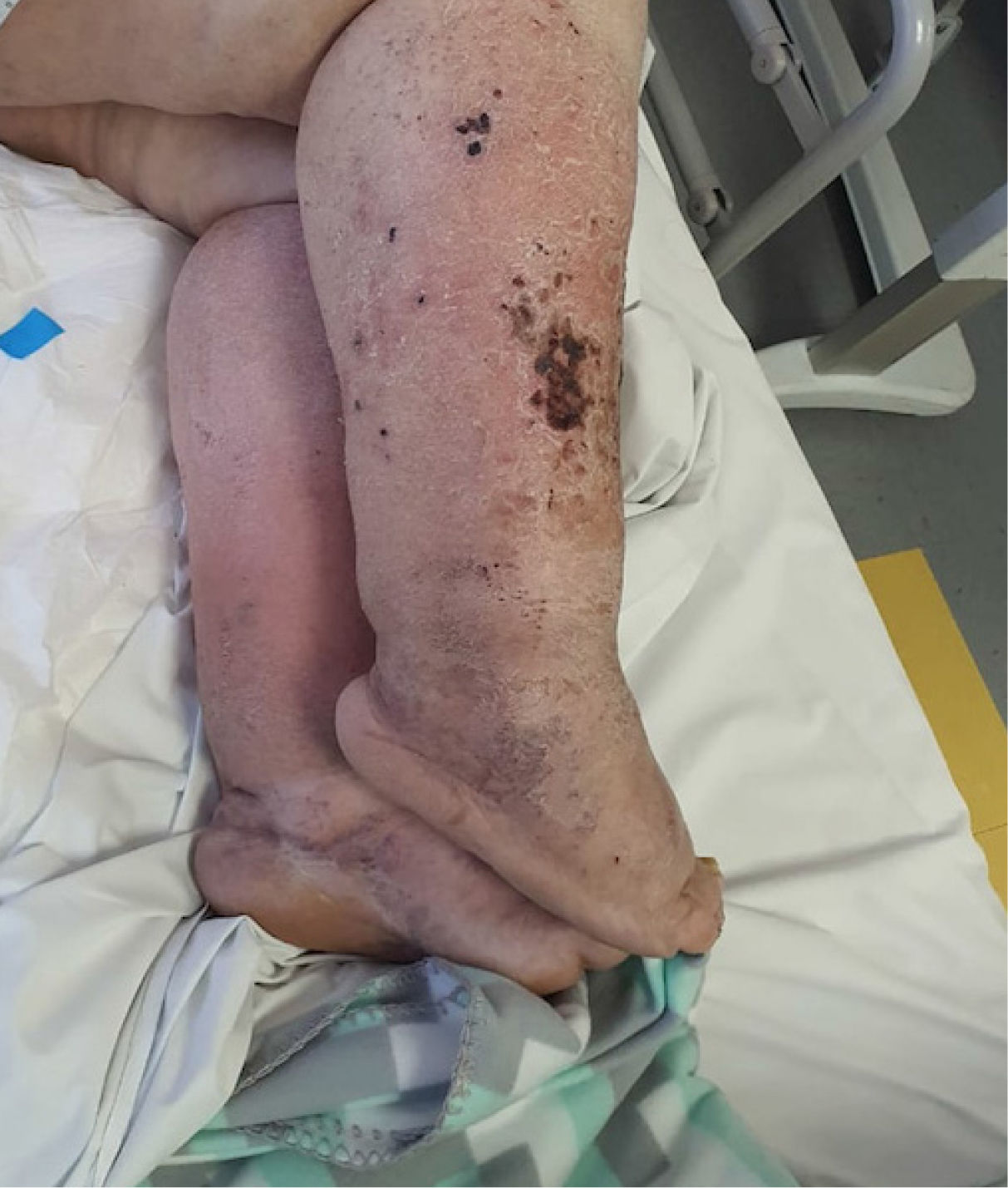
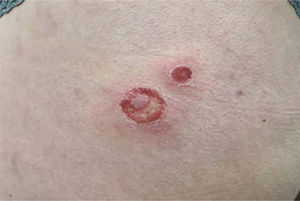
Cuadro clínico: Tanto la celulitis como la erisipela se manifiestan inicialmente con áreas de eritema, edema, dolor y calor de la piel afectada, acompañadas algunas veces de petequias y/o hemorragias en la piel eritematosa e incluso ampollas superficiales. La celulitis suele presentarse como un área de eritema aguda, diseminada y mal delimitada, el compromiso casi siempre es unilateral y las extremidades inferiores son el sitio más comúnmente afectado. La afectación bilateral debe hacer pensar en otros diagnósticos diferenciales. Adicionalmente, pueden encontrarse vasos linfáticos cutáneos dilatados y edematosos (linfangitis) y linfadenopatías regionales dolorosas. Un punto distintivo entre estas dos entidades clínicas, es el desarrollo de síntomas sistémicos de inicio agudo en pacientes con erisipela, como fiebre, escalofríos, malestar general severo y dolor de cabeza, precediendo incluso a los signos y síntomas inflamatorios locales. Además, clínicamente se describe una clara demarcación entre el tejido afectado y el sano, ya sea como un borde solevantado que avanza o un eritema con aclaramiento central. El compromiso de la oreja es un claro signo de erisipela, ya que la celulitis no la afecta, debido a la ausencia de tejido dérmico profundo y de grasa subcutánea en la zona. La apariencia de piel de naranja se produce por edema alrededor de los folículos pilosos en el área afectada29 (Figura 3).
- -
Diagnóstico: La historia y examen físico son claves para establecer el diagnóstico de celulitis/erisipela, no se requieren pruebas de laboratorio en casos de infección no complicada, en ausencia de comorbilidades o complicaciones. Los cultivos (hemocultivo, cultivos por aspiración con aguja o biopsia por punción) tienen bajo rendimiento y la Sociedad de Enfermedades Infecciosas de América, IDSA (del inglés, Infectious Diseases Society of America), en la última actualización del 2014 de sus Guías Prácticas, no los recomienda19. En la Tabla 5 se describen las indicaciones actuales de hemocultivos y cultivo de tejido en infecciones de piel y partes blandas25. Al respecto, tampoco deberían solicitarse frotis de superficie cutánea afectada, que muchas veces se informan como polimicrobianos o colonización por patógenos resistentes a múltiples drogas, a diferencia del drenaje y cultivo de secreción de pústulas o abscesos que tendrían mayor rendimiento, en especial en pacientes con factores agravantes o mala respuesta a antibióticos. Los estudios de imágenes no son diagnósticos, pero ayudan a distinguir formas más graves de infección (fascitis necrotizantes) e identificar colecciones o abscesos. Respecto a la ultrasonografía, una revisión sistemática y metanálisis reciente que incluyó 14 estudios y 2.656 pacientes, destacó la buena precisión diagnóstica de la ecografía para detectar abscesos cutáneos ocultos, evitar procedimientos invasivos innecesarios y orientar otro tipo de estudios con imágenes33.
Tabla 5.Indicaciones de hemocultivos y cultivo de tejido en infecciones de piel y partes blandas
• Infección local grave (p. ej.: celulitis extensa) • Signos sistémicos de infección (p. ej.: fiebre) • Historial de abscesos recurrentes o múltiples • Fracaso de la terapia antibiótica inicial • Edades extremas • Factores agravantes (linfedema, malignidad, neutropenia, inmunodeficiencia, esplenectomía, diabetes) • Exposiciones especiales (mordedura de animales, lesiones asociadas al agua) • Pacientes con indicación de profilaxis contra endocarditis infecciosa • Situaciones en que los patrones de susceptibilidad a S. aureus adquirido en la comunidad son desconocidos o cambian rápidamente. - -
Manejo: Existe poco consenso a la fecha respecto a protocolos de tratamiento, se han propuesto diversos esquemas con algunas variaciones referente a recomendaciones según las diferentes guías consultadas. Proponemos un enfoque clínico basado en datos epidemiológicos locales y en la forma de presentación:
- •
Celulitis No Purulenta: celulitis leve, sin signos sistémicos de infección, debe tratarse con terapia empírica que incluya agentes anti Streptococcus β-hemolítico y anti SAMS como cefadroxilo, cloxacilina / flucloxacilina / dicloxacilina, amoxicilina+ácido clavulánico o, en casos de alergia a la penicilina, clindamicina o trimetoprim/sulfametoxazol. En aquellos pacientes con manifestaciones clásicas de erisipela, se recomienda cobertura para Streptococcus β-hemolítico6. La presencia de celulitis no purulenta más cualquier criterio clínico de síndrome de respuesta inflamatoria sistémica (SIRS), como temperatura corporal superior a 38°C o inferior a 36°C, frecuencia cardíaca superior a 90 latidos por minuto, frecuencia respiratoria superior a 20 por minuto o recuento de glóbulos blancos mayor a 12.000 células/mm3 o menor a 4000 células mm3, se considera como celulitis moderada. Cumpliendo un solo criterio de SIRS, podrían iniciarse agentes orales, con 2 o más criterios o falla en la respuesta al tratamiento oral, se debe considerar iniciar o cambiar a un régimen intravenoso con cefazolina, ceftriaxona, penicilina G o, en casos de alergia a la penicilina, clindamicina19. En caso de celulitis grave, trauma penetrante, infección o colonización por SAMR en algún otro sitio o infección en el contexto de uso de drogas endovenosas, considerar uso de vancomicina, linezolid u otros agentes con cobertura anti estreptococos y SAMR. Los pacientes con celulitis y signos de shock deben recibir penicilina G y clindamicina ante la sospecha de síndrome de shock tóxico estreptocócico. Frente a signos de SIRS e hipotensión, inmunodepresión o progresión rápida (celulitis grave), ampliar la cobertura empírica con vancomicina intravenosa más piperacilina/tazobactam, imipenem o meropenem. En aquellos casos que se sospeche celulitis necrotizante, se debe considerar el desbridamiento quirúrgico con toma de muestra para terapia agente-específica según cultivo y antibiograma del tejido obtenido7,19,20.
- •
Celulitis Purulenta: celulitis asociadas a exudado purulento, en ausencia de absceso drenable. Como mencionamos anteriormente, la presencia de pus orienta a la infección por S. aureus, en estos casos debe iniciarse terapia empírica que cubra SAMR, mientras se esperan los resultados del cultivo de secreción. Se recomienda considerar cobertura adicional para SAMR-AC en pacientes con factores de riesgo para infección por este agente y en poblaciones en las que la prevalencia de este sea mayor al 30%7 (Tabla 2). Cuando se sospeche infección polimicrobiana (abscesos grandes, heridas traumáticas, pie diabético o infecciones en región pélvica y/o perianal) se justifica la cobertura con antibióticos de amplio espectro. Moxifloxacino es una fluoroquinolona con potente actividad contra patógenos aeróbicos Gram-positivos y negativos, particularmente útil en estos casos, al lograr buena penetración en músculo, tejido adiposo subcutáneo y líquido inflamatorio en ampollas o bulas en casos más complicados34.
- •
- -
Definición: La foliculitis corresponde a la inflamación superficial de uno o más folículos pilosos. Es una patología que tiene un impacto importante en la calidad de vida de las personas que la padecen. Puede ocurrir secundario a diversas etiologías, infecciosas y no infecciosas. La foliculitis infecciosa puede ser de origen bacteriano, viral, fúngico o parasitario (Tabla 6). En cambio, la foliculitis no infecciosa puede ocurrir como consecuencia de un traumatismo folicular u oclusión y suelen ser más profundas y de evolución crónica7,34,35.
Tabla 6.Foliculitis infecciosas
Foliculitis por agentes Cuadro Clínico Diagnóstico Tratamiento Estafilocócicas7 Se caracteriza por grupos de múltiples pápulas pequeñas, pruriginosas y eritematosas generalmente de menos de 5mm de diámetro perforadas por un pelo central. Puede haber pústulas y el inicio suele ser aguda. El diagnóstico es clínico. El examen microscópico directo y el cultivo de la secreción de una pústula no se solicitan de rutina, salvo en casos extensos, recurrentes o con mala respuesta a tratamiento. No siempre se requiere tratamiento y generalmente las lesiones se resuelven de forma espontánea.En caso de lesiones múltiples, que involucren 2 o más áreas corporales y/o que no resuelvan de forma espontánea, se sugiere iniciar tratamiento tópico, con mupirocina o ácido fusídico al 2%, 3 veces al día por 7 días, o clindamicina en gel al 1%, 2 veces al día por 7-10 días.En caso de no respuesta a tratamiento tópico, considerar tratamiento oral por 7 a 10 días, con cloxacilina, flucloxacilina o cefadroxilo.Ante la sospecha de SAMR, los antibióticos de elección son doxiciclina, cotrimoxazol o clindamicina. Bacterias Gram negativas Generalmente, se da en contexto de uso antibiótico prolongado por otra condición como acné o rosácea, clínicamente se presenta como pápulas y pústulas eritematosas en cara y región perinasal, pueden ser dolorosas y formar nódulos profundos. Se puede solicitar Gram y cultivo del contenido de una pústula para aislar el agente causal. El estudio histopatológico demuestra infiltrado neutrofílico en el folículo piloso. Para agentes Gram como la Klebsiella, Enterobacterias y Proteus, el tratamiento se debe prolongar por 14 días y los antibióticos de elección son la ampicilina 250-500mg 4 veces al día, ciprofloxacino 250-750mg 2 veces al día o cotrimoxazol forte 2 veces al día. Pseudomona7 Pápulas y pústulas foliculares pruriginosas que aparecen entre las 8 y 48 horas de la exposición, con aguas contaminadas, presentan distribución en zonas del traje de baño (generalmente tronco y glúteos). Otros focos de infección pueden ser a través de objetos contaminados, uso prolongado de antibióticos para el acné, posterior a depilación/rasurado o nosocomial en unidades de cuidados intensivos. Cultivo de la secreción de pústulas y antibiograma con pruebas de sensibilidad a antibióticos. En la mayoría de los casos, las lesiones son autolimitadas y se resuelven sin tratamiento en una o dos semanas.Medidas generales: aseo local más antibióticos tópicosSi no responden a medidas generales, el tratamiento indicado es ciprofloxacino 250-750mg 2 veces al día por 7-10 días. Hongos Presenta pápulas y pústulas pruriginosas, generalmente en zonas de sudoración y en pliegues, acompañado de otros estigmas de infecciones micóticas, generalmente aparecen en meses de verano donde el calor permite la sudoración excesiva. Ante la sospecha solicitar estudio micológico directo con test de KOH y cultivos. No es poco común que el test de KOH resulte negativo y este a su vez no descarta la presencia de hongos, por otro lado el cultivo tiene la desventaja que puede demorar semanas en evidenciar el crecimiento de estos agentes, por lo que la historia clínica y factores de riesgo deben comandar el abordaje terapéutico. En caso de Malassezia spp. considerar fluconazol 100-200mg al día por 4 semanas o 300mg una vez por semana por 2 meses o itraconazol 200mg al día por 1 a 3 semanasPara los dermatofitos el tratamiento recomendado es la terbinafina a dosis de 250-500mg al día por 4 a 6 semanas, como alternativa se puede utilizar griseofulvina o itraconazol.Para la cándida se debe usar idealmente fluconazol 150mg a la semana por 2 a 4 semanas, como alternativa se puede utilizar itraconazol. Es importante destacar que la terbinafina no tiene utilidad contra este agente. Viral En el caso del virus herpes, las lesiones pueden ser pápulas, pústulas, vesículas, vesículo-pústulas agrupadas, que generalmente aparecen en la zona de la barba. En el caso de los moluscos, se presentan como pápulas y pústulas con la clásica umbilicación central. Si bien la clínica es mandatoria, en el caso de herpes, el examen que presenta mejor rendimiento es la PCR tomada de las lesiones si es que clínicamente queda alguna duda diagnóstica, en el caso de los moluscos, la clínica basta. Para la foliculitis herpética se puede utilizar Aciclovir con dosis de 200mg 5 veces al día o valaciclovir 500mg 3 veces al día, ambos antivirales por 5 a 10 días. En el caso de los moluscos existen múltiples alternativas, donde encontramos el curetaje, la crioterapia, el uso de cantaridina, ácido tricloroacético, podofilotoxina entre otras. Ácaros La foliculitis por demódex se sospecha inicialmente en pacientes con lesiones tipo rosácea (eritema, telangiectasias, pápulas, pústulas) que presentan foliculitis y que no responden a tratamiento antibiótico habitual de la rosácea Se puede realizar un test de hidróxido de potasio (KOH) que usualmente es positivo y un ácaro test, que corresponde al recuento de demódex presentes en una muestra, en este caso, una pústula. Más de 5 por cm2 harían el diagnóstico. Los esquemas más aceptados son de permetrina 5% en crema para uso tópico o usar ivermectina a dosis de 200μg/kg vía oral y luego repetir una semana después. - -
Epidemiología: La foliculitis superficial más común es la producida por bacterias, principalmente por el S. aureus, también denominada como “impétigo de Bockhart”. Es una patología muy frecuente, tanto en población pediátrica como en los adultos. Otros agentes como el S. epidermidis, pueden estar involucrados en la génesis de esta entidad. La foliculitis recurrente es usualmente producida por el SAMR-AC y se debe tener en consideración al momento de la entrevista clínica donde se debe investigar los factores de riesgo asociados a la colonización por este agente (Tabla 2). Otros agentes involucrados de manera muy infrecuente son las bacterias Gram negativas, donde un factor de riesgo importante es el género masculino; hongos y parásitos, estas últimas suelen evolucionar de forma crónica y pueden estar asociadas a traumatismos y a fenómenos oclusivos35,36.
- -
Microbiología: En cuanto a la etiología bacteriana podemos dividirlas en dos grupos, la más frecuente, causada por Gram positivos, siendo los agentes más destacados el SAMS y el SAMR. Por otra parte, los Gram negativos, donde podemos encontrar la Pseudomona aeruginosa, responsable de las foliculitis por “Hot tub”, producto de baños en aguas calientes contaminadas37,38 y Klebsiella, Enterobacterias y Proteus, involucradas en foliculitis y en contexto de uso crónico de antibióticos sistémicos. Las especies de hongos más frecuentemente involucrados en foliculitis son Malassezia, Candida y Dermatofitos que frecuentemente ocurren en contexto de uso de antibióticos previos, inmunosupresión u oclusión que afectan generalmente zonas de sudoración excesiva. Las infecciones virales son menos frecuentes y se producen principalmente por virus herpes y, en menor proporción, por molusco contagioso. El Demodex folliculorum es un ácaro comensal en la piel normal en alrededor del 80-90% de las personas sanas y que, debido a una sobrepoblación de este, genera la aparición de pápulas y pústulas foliculares características de la rosácea inflamatoria y la demodicosis36.
- -
Cuadro clínico: Clínicamente se caracteriza por pápulas y pústulas foliculares inflamadas. Los sitios más comúnmente afectados son el cuero cabelludo, cara, tronco superior, glúteos, piernas y axilas. Generalmente, se desarrollan secundarias a trauma que genera una puerta de entrada para los agentes que se encuentran en la piel. Según los agentes etiológicos involucrados se presentan claves diagnósticas para la diferenciar entre ciertos patógenos7,34 (Tabla 6).
- -
Diagnóstico: La clínica, factores de riesgo y la distribución de las lesiones es de gran importancia, generalmente no se requiere más estudio para establecer el diagnóstico2.
- -
Manejo: El tratamiento se debe orientar según el agente involucrado, además de medidas generales, que incluyen el aseo y humectación diaria de la piel, sin utilizar agentes irritantes, desinfección adecuada de afeitadoras, mantener una buena técnica del afeitado evitando, en lo posible, el trauma mecánico entre otras39.
El forúnculo corresponde a un nódulo inflamatorio, supurativo, doloroso, bien circunscrito que usualmente se genera a partir de una foliculitis previa. Por lo tanto, un forúnculo puede aparecer en cualquier zona pilosa del cuerpo, en especial, en zonas donde se produce fricción y maceración como en cara, cuello, axilas, ingle, muslos y glúteos. Estas lesiones se extienden hasta la dermis y tejido subcutáneo, permitiendo la aparición de celulitis y abscesos40. El carbunclo es la coalescencia de múltiples foliculitis y forúnculos en una masa inflamatoria única, purulenta que drena por múltiples aperturas foliculares. La localización más característica de este es en la nuca y se da en mayor frecuencia en pacientes diabéticos. El diagnóstico de ambas entidades es eminentemente clínico, si bien la mayor parte de estas lesiones es secundaria a S. aureus, se recomienda realizar cultivos de la secreción para estudio de susceptibilidad antimicrobiana, sin retrasar el tratamiento antibiótico. Según la IDSA, el manejo de estas lesiones involucra el drenaje y aseo quirúrgico, reservando la indicación de antibióticos orales en caso de signos sistémicos de inflamación, como en el caso de carbúnculo19. De forma empírica se puede iniciar cotrimoxazol o doxiciclina para infecciones moderadas y para casos severos con compromiso sistémico, vancomicina, daptomicina o linezolid, siempre ajustando el tratamiento según cultivos con estudios de susceptibilidad antimicrobiana41.
Abscesos- -
Definición: Los abscesos son colecciones de pus que se ubican en la dermis y tejidos profundos, contenido por una cápsula denominada membrana piógena que evita su diseminación42
- -
Epidemiología: Presentan los mismos factores de riesgo para la celulitis, se pueden presentar de igual forma en pacientes sanos, sin factores predisponentes. Un factor importante es la presencia del SAMR, que se ha visto involucrado en una gran proporción de infecciones purulentas43 (Tabla 2).
- -
Microbiología: El agente principal involucrado en la génesis de los abscesos cutáneos es el S. aureus, tanto el meticilino sensible como resistente, reportándose en más del 75% de los casos. No es poco común que los abscesos sean producto de infecciones polimicrobianos, especialmente cuando se encuentran en localizaciones como la zona perioral, perirectal y/o vulvovaginal. Otros agentes causales de abscesos que podemos encontrar son las micobacterias no tuberculosas, blastomyces, nocardia y criptococo3.
- -
Cuadro clínico: Los abscesos cutáneos se manifiestan como nódulos dolorosos, sensibles, fluctuantes y eritematosos, habitualmente coronado por una pústula y rodeado por un reborde edematizado y eritematoso7. Inicialmente, el aumento de volumen es fijo; más tarde, la piel suprayacente se vuelve fina y parece fluctuante, en este punto puede ocurrir drenaje espontáneo de material purulento. Los abscesos se presentan en diferentes tamaños, típicamente de 1 a 3cm de largo, pero a veces son mucho más grandes y puede ocurrir en cualquier superficie de la piel. Pueden asociarse a adenopatías regionales en las zonas de drenaje linfático44.
- -
Diagnóstico: Fundamentalmente clínico. Según las recomendaciones de la IDSA, se aconseja la realización de Gram y cultivo en todo absceso, uno de los diagnósticos diferenciales más importantes es el quiste epidérmico inflamado, que al romperse, vierte su contenido (queratina y microbiota comensal) a la dermis9.
- -
Manejo: El tratamiento de los abscesos cutáneos es la incisión y drenaje de su contenido de forma abierta, aunque en casos de abscesos pequeños se podría esperar el drenaje espontáneo sin mayor tratamiento. Estudios randomizados han comparado el drenaje con aguja fina guiada por ultrasonografía con solo el 25% de éxito y una alta tasa de recurrencia, por lo que actualmente se desaconseja33,45. Si bien, las guías clínicas más recientes no apoyan el uso de rutina de antibióticos sistémicos luego de la incisión y drenaje de abscesos cutáneos simples, un curso asociado de trimetropim-sulfametoxazol de 7 a 10 días, sería más eficaz en la prevención del fracaso del tratamiento y las recurrencia en niños y adultos con factores de riesgo, como obesidad, diabetes mellitus, inmunocompromiso o hacinamiento, entre otros19,20.
Las infecciones de piel y partes blandas abarcan desde patologías auto resolutivas, hasta condiciones que comprometen la vida del paciente, dependiendo de múltiples factores de riesgo asociados tanto al paciente, al ambiente, como a los agentes infecciosos involucrados en cada una de las manifestaciones clínicas que provocan. Se debe remarcar la importancia de tener un alto grado de sospecha clínica frente a de cada una de estas enfermedades, ya que el tratamiento oportuno, en muchas instancias, puede ser crítico en el pronóstico y evolución de los pacientes. Con el objetivo de orientar la terapia en forma específica, las recomendaciones actuales de guías internacionales de sociedades de infectología, sugieren realizar, en lo posible, estudio microbiológico y de susceptibilidad antibiótica (tinción de Gram y cultivo con antibiograma) frente a infecciones cutáneas, no sólo para la identificación de los microorganismos, si no que también para el seguimiento e identificación epidemiológica de agentes multirresistentes.
Declaración de conflicto de interésAutores declaran no tener conflictos de interés alguno.