La nefrolitiasis es una enfermedad urológica de prevalencia mundial asociada a una importante morbilidad y malestar para el paciente. El tratamiento actual de los cálculos renales se basa en intervenciones quirúrgicas y farmacológicas. Aunque la cirugía puede ser necesaria en casos determinados, el tratamiento farmacológico es una opción más asequible, fácilmente disponible y menos invasiva para el paciente. Se realizó una revisión exhaustiva para resumir la bibliografía disponible sobre las estrategias de manejo farmacológico de los principales tipos de litiasis: oxalato cálcico, fosfato cálcico, ácido úrico, estruvita y cistina. La regulación de factores como el pH urinario, la cristalización de los cálculos y los trastornos metabólicos del paciente que precipitan el desarrollo y el crecimiento de los cálculos es fundamental para estos enfoques terapéuticos. Esta revisión hace hincapié en las opciones farmacológicas disponibles para el tratamiento según el tipo de litiasis y destaca la importancia de un tratamiento médico personalizado para cada paciente, aspecto que debe ser tenido en cuenta por todos los médicos.
Nephrolithiasis is a globally prevalent urologic condition associated with significant morbidity and patient discomfort. Current management of kidney stones includes both surgical and pharmacologic interventions. Though surgery may be necessary under certain circumstances, pharmacologic treatment is a more affordable, readily available, and a less invasive option for patients. A comprehensive scoping review was conducted to summarize the available literature on the pharmacologic strategies for managing the predominant stone types including calcium oxalate, calcium phosphate, uric acid, struvite, and cystine stones. Central to these therapeutic approaches is the regulation of factors such as urine pH, stone crystallization, and patient metabolics that precipitate stone development and growth. This review highlights the pharmacological options available for treating each kidney stone type, emphasizing the importance of patient tailored medical management that should be considered by every physician.
La nefrolitiasis es una enfermedad urológica frecuente que se remonta a siglos pasados1. Entre los factores de riesgo de la litiasis se incluyen los antecedentes familiares, las enfermedades sistémicas subyacentes, las anomalías del riñón y del tracto urinario, y los hábitos de vida y alimentación. Los pacientes que han tenido un cálculo renal en el pasado corren el riesgo de padecerlo en el futuro. La tasa de recurrencia puede superar el 50% en los 10 años siguientes al primer episodio2.
Tanto la Asociación Americana de Urología como la Asociación Europea de Urología han publicado directrices para el tratamiento médico de la litiasis renal3,4. Estas incluyen recomendaciones para la evaluación de los formadores de cálculos recurrentes, así como para el tratamiento dietético y farmacológico, con el objetivo de reducir el riesgo de formación de cálculos en el futuro. Los regímenes de tratamiento médico y su eficacia varían en función de los factores de riesgo del paciente y del tipo de cálculo formado, y se evaluarán en profundidad en esta revisión.
Además del tratamiento médico y la suplementación tratados en esta revisión, los cambios en el estilo de vida como los hábitos alimenticios y el ejercicio físico desempeñan un papel importante en la prevención o reducción de la carga litiásica. Aunque esta revisión se centra principalmente en los diferentes medicamentos de prescripción disponibles y su eficacia en el tratamiento de la litiasis renal, es importante señalar que la ingesta de líquidos para producir un volumen urinario de al menos 2,5l al día es el pilar fundamental del tratamiento para todos los tipos de litiasis3. También se ha demostrado la utilidad de reducir la ingesta de sodio por debajo de los 2.300mg en los formadores de cálculos de calcio5.
Cálculos de oxalato cálcicoFisiopatología/factores metabólicos y tratamiento farmacológicoAl menos el 70-85% de los pacientes que presentan cálculos renales tienen un cálculo que contiene calcio6. El tratamiento de los cálculos de calcio se consigue tratando la fisiopatología subyacente y los factores metabólicos que influyen en la composición de la orina del paciente. Para determinar la mejor opción de tratamiento farmacológico para la nefrolitiasis cálcica, es fundamental comprender las diferentes bioquímicas y composiciones urinarias que aumentan el riesgo de desarrollar cálculos en un paciente. Entre ellas se incluyen la hipercalciuria, la hipocitraturia, la hiperoxaluria, la hiperuricosuria y la hipomagnesuria.
HipercalciuriaLa hipercalciuria se define generalmente como una excreción urinaria de calcio >300mg/día en los varones y >250mg/día en las mujeres7. En muchos pacientes, la hipercalciuria tiene un origen idiopático y puede presentarse como parte de un desequilibrio de calcio en múltiples áreas del organismo, como el aumento de la absorción intestinal, la disminución de la reabsorción tubular renal y la disminución de la mineralización ósea8. La hipercalciuria con otras presentaciones sistémicas puede deberse a una fisiopatología subyacente identificable y se ha asociado a sarcoidosis, hiperparatiroidismo y a causas renales como la acidosis tubular renal (ATR) y el riñón con médula en esponja. Los niveles elevados de calcio sérico y urinario pueden sugerir la existencia de un hiperparatiroidismo primario. Otras anomalías séricas que podrían ser indicativas de enfermedad son la combinación de bicarbonato sérico bajo, potasio sérico bajo y cloruro sérico alto, pudiendo ser sugerentes de una ATR distal9. La tabla 1 ofrece una visión general de las diferentes causas de hipercalciuria.
Causas de hipercalciuria
| Sistema | Ejemplos |
|---|---|
| Endocrino | Hiperparatiroidismo, hipotiroidismo, diabetes mellitus, síndrome de Cushing, síndromes paraneoplásicos (PTHrP) |
| Renal | ATR distal, riñón con médula en esponja |
| Reumatológico y musculoesquelético | Sarcoidosis, osteoporosis, enfermedad de Paget |
| Iatrogénica | Efectos secundarios del tratamiento farmacológico, hipervitaminosis D |
| Idiopática | Hipercalciuria idiopática |
ATR: acidosis tubular renal; PTHrP: parathyroid hormone related peptide.
Para reducir el riesgo de formación de cálculos en los pacientes con hipercalciuria idiopática, se suelen prescribir tiazidas o diuréticos similares a las tiazidas3. Los diuréticos tiazídicos favorecen la absorción renal de calcio, reduciendo así la excreción y concentración de calcio en la orina.
Varios ensayos controlados aleatorizados han demostrado su eficacia en la prevención de la formación de cálculos de calcio de cualquier tipo3. Una revisión de la base de datos Cochrane realizada en el año 2009 analizó 5 de estos estudios con un total de 316 pacientes. Entre los resultados se encontró una reducción del 60% en la formación de nuevos cálculos en pacientes tratados con tiazidas en comparación con placebo10. Por otro lado, las tiazidas también pueden desenmascarar de forma inadvertida un hiperparatiroidismo subyacente. En los pacientes con niveles elevados de calcio sérico después de interrumpir el tratamiento con tiazidas debe descartarse la presencia de hiperparatiroidismo primario. Las tiazidas también pueden ser útiles en el diagnóstico diferencial del hiperparatiroidismo primario o secundario subyacente3.
Algunos efectos secundarios de las tiazidas incluyen disminución de los niveles de potasio, intolerancia a la glucosa, dislipidemia y ácido úrico elevado. Para prevenir la hipopotasemia, se pueden prescribir tiazidas junto con diuréticos ahorradores de potasio como la amilorida y la espironolactona, o con suplementos como el citrato de potasio o el cloruro de potasio8.
La dosis de tiazidas y medicamentos similares a las tiazidas depende del fármaco concreto elegido para tratar la hipercalciuria del paciente. La hidroclorotiazida se recomienda en dosis de 25mg/2 veces al día (BID) o 50mg al día, aunque muchos optan por tomar una dosis de 50mg para reducir la nicturia. La clortalidona se prescribe a los pacientes en dosis de 25 a 50mg/día, teniendo en cuenta el riesgo de hipopotasemia del paciente, y la indapamida se administra en dosis de 1,2 a 2,5mg/día11. Varios estudios han sugerido la prescripción de dosis más bajas de tiazidas que las utilizadas en muchos de los ECA, y un reciente estudio retrospectivo de cohortes ha demostrado que las dosis bajas de tiazidas pueden conferir un beneficio similar al obtenido con dosis altas de diuréticos en la prevención del desarrollo de cálculos de calcio12.
Aunque la mayoría de los ECA han mostrado resultados positivos con las tiazidas, es importante señalar que un estudio reciente, el ensayo «NOSTONE», demostró que los diuréticos tiazídicos no previenen la recurrencia de los cálculos cálcicos. Este ensayo doble ciego no encontró diferencias en la formación de cálculos entre los grupos que recibían hidroclorotiazida en dosis de 12,5, 25 y 50mg o placebo una vez al día13. Se requieren más estudios para esclarecer el beneficio de las tiazidas en pacientes con cálculos de calcio.
HipocitraturiaLa segunda alteración metabólica más frecuente es la hipocitraturia, definida por algunos autores como una excreción <550mg/día en las mujeres y <450mg/día en los hombres14, mientras que otros indican un valor límite de 320mg/día tanto en mujeres como en varones15. La concentración de citrato en la orina está condicionada por muchos procesos. En algunos pacientes, la hipocitraturia es de origen idiopático, mientras que otros pueden experimentar un desequilibrio debido al uso de diuréticos tiazídicos, infecciones del tracto urinario o enfermedades sistémicas como la diarrea crónica y, sobre todo, una ATR distal1.
CitratoEl citrato, un inhibidor de la formación de cálculos de oxalato cálcico (CaOx), actúa formando complejos solubles con el calcio y reduciendo el nivel de calcio en la orina. En ciertos casos se pueden recetar sales de citrato para aumentar el citrato urinario, estas se metabolizan en el hígado generando bicarbonato, lo que aumenta la excreción de bicarbonato en la orina y a su vez incrementa la carga de citrato urinario1. Varios ensayos controlados aleatorizados con placebo que evalúan los tratamientos con citrato alcalino han demostrado que tanto el citrato potásico como el citrato potásico magnésico reducen la formación de cálculos recurrentes16. Las directrices de la AUA recomiendan el tratamiento con citrato potásico no solo en pacientes con cálculos de calcio recurrentes e hipocitraturia, sino también como opción de tratamiento empírico para los CaOx en los pacientes que no presentan anomalías en la orina de 24h3.
Un factor importante que debe tenerse en cuenta a la hora de utilizar citrato es su impacto en el pH urinario. Aunque el citrato eleva un pH ácido a un estado alcalino más favorable, la alcalinización excesiva puede crear un entorno propicio para la formación de cálculos de fosfato cálcico. Aunque no se han realizado ensayos controlados aleatorizados que aborden directamente la tasa de formación de cálculos de fosfato cálcico en pacientes tratados con citrato, teóricamente sigue siendo un riesgo que la alcalinización excesiva de la orina —en los pacientes con hipocitraturia y cálculos de CaOx— pueda aumentar el riesgo de formación de cálculos de fosfato cálcico. Por ello, los pacientes con antecedentes de formación de cálculos de fosfato cálcico deberían someterse a un seguimiento riguroso del pH urinario después de empezar el tratamiento con citrato1.
Históricamente, la suplementación con citrato de potasio también ha resultado beneficiosa en los pacientes con ATR distal. Esto se debe a que el potasio actúa sobre la hipopotasemia que sufren los pacientes con ATR distal, mientras que la alcalinización urinaria del metabolismo del citrato actúa sobre la acidosis de estos pacientes.
El citrato de potasio se prescribe a los pacientes a una dosis inicial de 40 a 60mEq que se puede aumentar en los casos que lo requieran. Es importante vigilar estrechamente los niveles de potasio en los pacientes que toman citrato potásico, especialmente en aquellos con una función renal deteriorada. Algunos pacientes pueden experimentar efectos secundarios gastrointestinales adversos con el citrato potásico, por lo que este tratamiento no es adecuado para aquellos con úlceras pépticas preexistentes8. En pacientes con insuficiencia renal o con riesgo de hiperpotasemia puede utilizarse citrato sódico o bicarbonato sódico para aumentar los niveles de citrato. En este sentido, el hecho de que el exceso de sodio también pueda contribuir a la formación de cálculos y empeorar afecciones como la insuficiencia cardiaca, la hipertensión y la retención de líquidos, es motivo de preocupación17. Sin embargo, hasta donde sabemos, no existen publicaciones que demuestren un aumento de la presión arterial o un empeoramiento de la enfermedad litiásica en pacientes que toman bicarbonato sódico para la prevención de la litiasis. Algunos pacientes utilizan fármacos alcalinizantes de venta libre, ya que son más económicos y más fáciles de conseguir que el citrato potásico de prescripción, y no producen los efectos secundarios gastrointestinales indeseables como náuseas, dolor abdominal, vómitos y diarrea. Sin embargo, una revisión de estas opciones de venta libre demostró una menor cantidad de equivalentes alcalinos de citrato por día y su eficacia no ha sido probada18. El contenido de citrato en las bebidas también puede aumentar significativamente los niveles de citrato en la orina19.
HiperuricosuriaLa hiperuricosuria se define como la excreción de ácido úrico en orina de >800mg en los varones y 750mg en las mujeres20. En un pH urinario de 5,5 o inferior, esto puede provocar la formación de cálculos de ácido úrico, mientras que por encima de 5,7 la hiperuricosuria favorece la formación de cálculos de CaOx21. Los métodos para alcalinizar la orina, como la ingesta de citrato, también han sido útiles para reducir el nivel de acidez de la orina.
Alopurinol y febuxostatLos pacientes con cálculos de CaOx e hiperuricosuria concurrente pueden recibir tratamiento con alopurinol, un medicamento que inhibe la producción de ácido úrico y reduce su excreción urinaria22. Esta recomendación se basó en un ECA del año 1986 que demostró los beneficios del alopurinol frente al grupo de placebo. Sin embargo, en el ensayo no se incluyó a individuos con hipercalciuria, por lo que la eficacia del alopurinol en estos pacientes no ha sido probada22.
El alopurinol puede causar efectos secundarios poco frecuentes, como el síndrome de Stevens-Johnson y la elevación de las enzimas hepáticas, por lo que deben realizarse pruebas de la función hepática tras iniciar el tratamiento. Un fármaco alternativo es el febuxostat, que puede ser eficaz para reducir los niveles de ácido úrico sérico y también puede ser una opción más potente para evitar los ataques de gota en pacientes con hiperuricemia además de hiperuricosuria23.
La dosis de alopurinol depende de la excreción de ácido úrico en la orina. En pacientes cuya excreción diaria excede los 600mg/día se prescribe una dosis inicial de 300mg/día de alopurinol. Cabe mencionar que, en el caso de los varones, el límite de excreción diaria suele ser de 700mg. Febuxostat (80mg/día) se ha comparado con alopurinol en ensayos comparativos23.
HiperoxaluriaEl incremento del oxalato urinario aumenta el riesgo de formación de cálculos de CaOx. La hiperoxaluria suele ser entérica y puede deberse a una absorción excesiva de oxalato en el intestino por trastornos como la enfermedad inflamatoria intestinal o el síndrome del intestino corto8. Los pacientes también pueden estar genéticamente predispuestos a la hiperoxaluria primaria por una mutación hereditaria que altera el metabolismo del glioxilato1.
HipomagnesuriaLa hipomagnesuria, definida como un nivel de magnesio en orina inferior a 3,0mmol/día, se ha observado en el 7-23% de los formadores de cálculos de calcio4. La hipomagnesuria puede estar causada por una ingesta dietética deficiente de magnesio o por una absorción intestinal reducida secundaria a la diarrea crónica4. Cabe destacar que son pocos los estudios clínicos que demuestran una clara relación causa/efecto entre el nivel bajo de magnesio y la formación de cálculos.
Otros suplementosSe recomienda a los pacientes limitar el oxalato en su dieta y aumentar la ingesta de calcio. El calcio derivado de la dieta, tanto de origen lácteo como no lácteo, tiene un efecto protector contra la formación de cálculos al impedir la absorción intestinal de oxalato24.
Cálculos de fosfato cálcicoFisiopatologíaAunque la hipercalciuria puede estar presente en los formadores de cálculos de fosfato cálcico, la fisiopatología que predispone a los pacientes a la formación de cálculos de fosfato en lugar de oxalato, varía. El fosfato precipita en el sistema colector cuando el pH se eleva por encima de 6,5, lo que provoca un aumento de cálculos de fosfato cálcico. La ATR distal y la hipocitraturia también están implicadas en la patogenia de los cálculos de fosfato cálcico25.
Tratamiento farmacológicoLa EAU recomienda las tiazidas para los pacientes con cálculos de fosfato cálcico e hipercalciuria concurrente4. Sin embargo, preocupa el hecho de que la alcalinización excesiva de la orina en un paciente con cálculos de fosfato cálcico pueda precipitar aún más estos cálculos. En el caso de los pacientes que además tienen un nivel bajo de citrato en la orina, se cree que los suplementos de citrato tratan la acidosis subyacente (p. ej., ATR incompleta) y reducen el riesgo de formación de cálculos26.
Litiasis de ácido úricoFisiopatología y pH urinarioLa prevalencia de cálculos de ácido úrico ha aumentado del 7 al 14% entre los años 1980 y 201527. Entre los factores asociados, el pH urinario es el indicador clínico más potente del tipo de cálculo. Cuando el pH urinario desciende por debajo de 5,5, el ácido úrico se vuelve menos soluble en la orina, lo que puede conducir a la formación de cálculos de ácido úrico. De hecho, un paciente puede desarrollar cálculos de ácido úrico a pesar de tener un nivel normal de ácido úrico en orina de 24h si su pH urinario es demasiado bajo de forma persistente8. Otros indicadores clínicos de la formación de cálculos de ácido úrico son la hiperuricosuria y un volumen bajo de orina. El desarrollo de cálculos renales por hiperuricosuria suele ser de origen idiopático, pero entre los pacientes predispuestos a estos factores determinantes se encuentran los pacientes con diarrea crónica, enfermedad inflamatoria intestinal, ileostomía, síndromes mieloproliferativos, ingesta elevada de proteínas animales, medicamentos inductores de uricosuria como probenecid, rasburicase y enalapril entre otros, gota primaria, obesidad, síndrome metabólico, diabetes mellitus tipo 2 y síndrome de Lesch-Nyhan1.
Tratamiento farmacológicoEl ácido úrico es un ácido débil con un pKa de 5,35, por lo que a medida que el pH pierde acidez, el ácido úrico se convierte en anión urato soluble. El citrato potásico o el bicarbonato sódico consiguen la alcalinización urinaria para los cálculos de ácido úrico, con un pH de orina objetivo de 6,5. Un aspecto importante es que los pacientes deben evitar un pH urinario demasiado alto, ya que un pH urinario de 8 puede precipitar la apatita y a la vez disminuir la solubilidad28. Los inhibidores de la xantina oxidasa como el alopurinol y el febuxostat no son eficaces en pacientes con un pH crónicamente bajo, y dejan de serlo a un pH alto. Por lo tanto, el objetivo principal es alcalinizar la orina con citrato alcalino8.
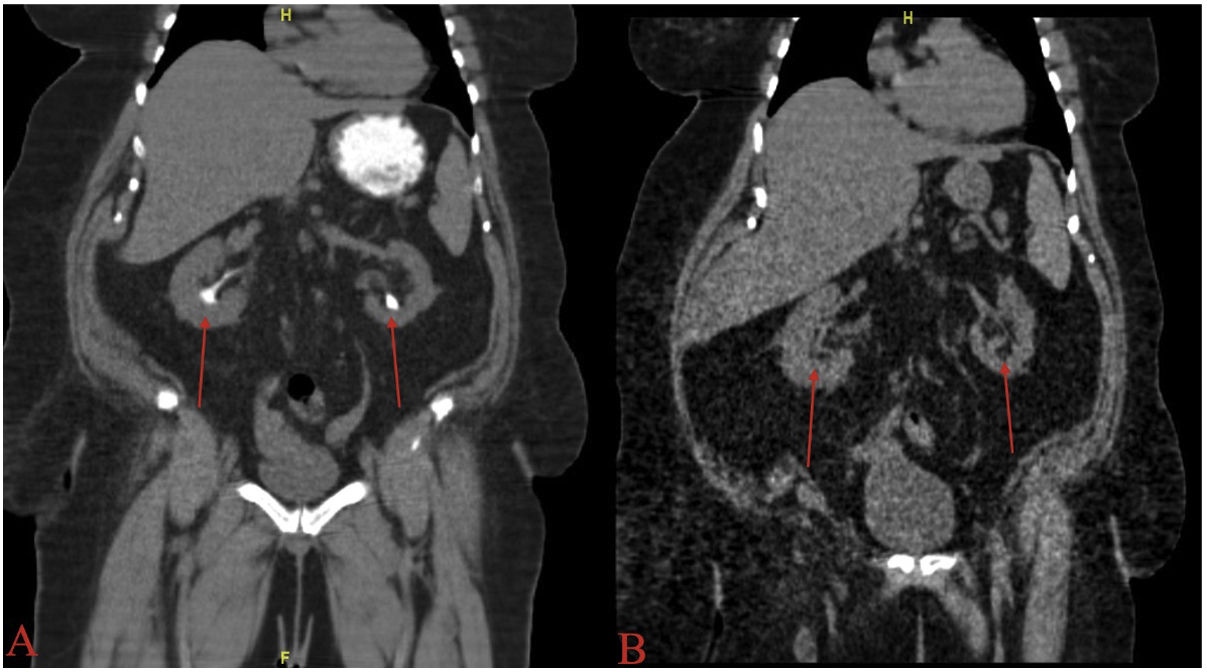
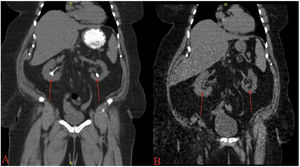
El bicarbonato sódico es una buena alternativa al citrato potásico para pacientes con alteraciones renales u otros factores de riesgo de hiperpotasemia29. La Figura 1 muestra el efecto de la quimiólisis oral en un paciente antes de recibir la terapia (fig. 1A) y el éxito de la disolución una vez finalizado el tratamiento (fig. 1B). El ajuste de la dosis de cualquiera de los dos fármacos puede realizarse controlando el pH urinario en la consulta del médico o en casa, utilizando papel de nitrazina con el fin de mantener el nivel de pH adecuado para la disolución y a la vez evitar la alcalinización excesiva8.
Dado que el pH urinario bajo se asocia a la resistencia a la insulina en los túbulos renales, las intervenciones farmacológicas dirigidas a la resistencia a la insulina, como la pioglitazona, también pueden ayudar a elevar el pH urinario30. En los pacientes con nefrolitiasis por ácido úrico y diabetes mellitus tipo 2 o síndrome metabólico, la intervención farmacológica debe combinarse con actividad física, pérdida de peso y control de la glucosa31.
Cálculos de estruvitaFisiopatologíaLos cálculos de estruvita o de origen infeccioso se forman por acumulación de magnesio, amonio y fosfato, y suelen estar asociados a la presencia de bacterias32. Estos cálculos necesitan un entorno alcalino para su formación, y las bacterias capaces de producir la ureasa son responsables de crear estas condiciones. Los cálculos de estruvita crecen rápidamente, a menudo formando cálculos coraliformes y creando una obstrucción considerable. Casi siempre están formados por bacterias productoras de ureasa, principalmente Proteus mirabilis33. Sin embargo, estudios más recientes han hallado la presencia de organismos que no producen ureasa como E. coli y Enterococcus en cultivos de estruvita, con una frecuencia similar a la de los cálculos de estruvita con organismos productores de ureasa34.
Tratamiento farmacológicoTratamiento antibióticoTanto la EAU como la AUA recomiendan el tratamiento antibiótico de los cálculos infecciosos antes y después de la intervención quirúrgica hasta conseguir la esterilización4. Para los cálculos infecciosos se recomienda el uso de antibióticos específicos determinados a partir del cultivo4. Existen pocos datos sobre la frecuencia y duración del tratamiento antibiótico, pero suelen administrarse durante 1-2 semanas antes de la NLPC o la LEOCh35.
Es interesante el hecho de que unos pocos estudios han demostrado que el tratamiento antibiótico puede ayudar a reducir el tamaño de los cálculos de estruvita o promover su expulsión espontánea sin requerir procedimientos invasivos31. Aunque los antibióticos para los organismos productores de ureasa causantes de los cálculos de estruvita ayudan a reducir la producción de una orina alcalina para la formación de cálculos de estruvita, no se recomienda el uso de antibióticos a largo plazo, ya que pueden provocar resistencia.
Inhibidores de la ureasaLos inhibidores de la ureasa reducen la producción de amoníaco y, por consiguiente, el pH urinario. Hasta la fecha, el ácido acetohidroxámico (AHA, Lithostat®) es el inhibidor de la ureasa más eficaz. Este actúa provocando una inhibición irreversible y no competitiva de la ureasa. También se ha observado que el AHA evita el crecimiento de cálculos y retrasa su recurrencia en comparación con el placebo36. Sin embargo, debido a los efectos secundarios asociados al AHA, como temblores y anemia hemolítica, se desaconseja su uso36.
Cálculos de cistinaFisiopatologíaLos cálculos renales de cistina se desarrollan a partir de la cistinuria como resultado de una mutación genética que causa un transporte defectuoso de aminoácidos en los riñones y el intestino delgado37. La cistina es altamente insoluble al pH fisiológico de la orina y, por tanto, cristaliza originando cálculos renales. Estos cálculos representan solo el 1-2% de todos los casos de litiasis renal, pero constituyen el 6-8% de los cálculos pediátricos37. Su etiología genética provoca altas tasas de recurrencia, especialmente en ausencia de tratamiento preventivo. La hiperhidratación y la restricción de sodio y proteínas combinadas con la alcalinización urinaria constituyen el primer enfoque terapéutico, cuyo objetivo es aumentar la solubilidad de los cálculos de cistina.
Tratamiento farmacológicoLa alcalinización tiene un pH objetivo de 7-7,5, un nivel en el que la cistina es soluble, pero no lo suficientemente alcalino como para permitir la formación de fosfato cálcico. El citrato potásico es el tratamiento de alcalinización habitual para los pacientes con cistinuria. Se recomienda una dosis de 30-60mEq/día, y el pH debe controlarse a diario para alcanzar un pH objetivo de 7,0-7,538.
Si no se consigue la alcalinización y la excreción de cistina sigue superando los 3mmol/día, se considerará el tratamiento de segunda línea con agentes quelantes, conocidos como cystine binding thiol drugs (CBTD). Estos agentes incluyen los compuestos tiólicos, como D-penicilamina y la α-mercaptopropionil-glicina (MPG, tiopronina), que contienen un grupo sulfhidrilo que se une a la cistina y forma cisteína, una molécula 50 veces más soluble en la orina. Aunque eficaz, la D-penicilamina se ha asociado a efectos secundarios graves como trombocitopenia y artropatía, que han limitado su uso (Pak 1986). En un ensayo clínico multicéntrico, se determinó que la tiopronina era igual de eficaz que la D-penicilamina, pero con menos efectos secundarios39, por lo que la AUA aconseja la utilización de tiopronina antes que la D-penicilamina3. La pauta recomendada de tiopronina para adultos es de 600-900mg/día, dividida en 2 o 3 dosis y de 15mg/kg/día en niños con un peso superior a 20kg. Curiosamente, en un amplio estudio reciente en el que se evaluó la calidad de vida relacionada con la salud (CVRS) en pacientes con cistinuria, los pacientes que tomaban tiopronina obtuvieron puntuaciones significativamente mejores en todos los dominios excepto en el rendimiento físico, en el que no se encontraron diferencias significativas en comparación con los pacientes que no tomaban tiopronina40. Cabe destacar que el mantenimiento de una hidratación adecuada, con un volumen medio de orina de 3,15l, se relacionó con un mejor éxito del tratamiento con todos los regímenes médicos de cistina. Este volumen es superior a la diuresis recomendada de 2 a 2,5l para todos los formadores de cálculos41.
Otra opción farmacológica para los cálculos de cistina es captopril, un inhibidor de la enzima convertidora de la angiotensina que, de forma similar a los agentes tiólicos, contiene grupos sulfhidrilos libres que se unen a la cistina. Se ha observado que el complejo cisteína-captopril resultante es 200 veces más soluble en la orina. Sin embargo, sus resultados de eficacia son contradictorios41. Por lo tanto, el captopril solo se ofrece a pacientes con hipertensión o, posiblemente, como complemento de la tiopronina en pacientes con una excreción elevada de cistina42.
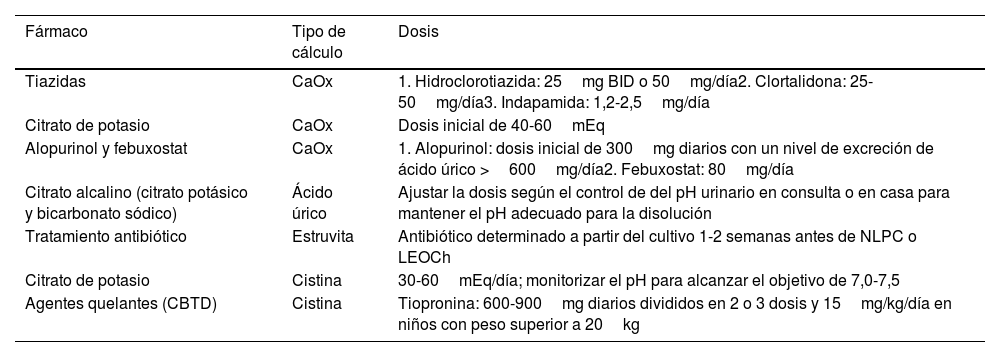
En la tabla 2 se resumen los regímenes farmacológicos recomendados según el tipo de cálculo.
Recomendaciones de tratamiento farmacológico según el tipo de cálculo renal
| Fármaco | Tipo de cálculo | Dosis |
|---|---|---|
| Tiazidas | CaOx | 1. Hidroclorotiazida: 25mg BID o 50mg/día2. Clortalidona: 25-50mg/día3. Indapamida: 1,2-2,5mg/día |
| Citrato de potasio | CaOx | Dosis inicial de 40-60mEq |
| Alopurinol y febuxostat | CaOx | 1. Alopurinol: dosis inicial de 300mg diarios con un nivel de excreción de ácido úrico >600mg/día2. Febuxostat: 80mg/día |
| Citrato alcalino (citrato potásico y bicarbonato sódico) | Ácido úrico | Ajustar la dosis según el control de del pH urinario en consulta o en casa para mantener el pH adecuado para la disolución |
| Tratamiento antibiótico | Estruvita | Antibiótico determinado a partir del cultivo 1-2 semanas antes de NLPC o LEOCh |
| Citrato de potasio | Cistina | 30-60mEq/día; monitorizar el pH para alcanzar el objetivo de 7,0-7,5 |
| Agentes quelantes (CBTD) | Cistina | Tiopronina: 600-900mg diarios divididos en 2 o 3 dosis y 15mg/kg/día en niños con peso superior a 20kg |
BID: 2 veces al día; CaOx: cálculos de oxalato cálcico; CBTD: cystine binding thiol drugs; LEOCh: litotricia extracorpórea por ondas de choque; NLPC: nefrolitotomía percutánea.
El número de personas que recurren al consumo de medicamentos de venta libre y suplementos alimenticios medicinales para tratar de forma independiente los cálculos renales es cada vez mayor. Además de ser opciones más económicas que los medicamentos con receta, resulta fácil incorporarlas al estilo de vida y a la dieta diaria del paciente. Sin embargo, la mayoría de las opciones disponibles no han sido evaluadas mediante ensayos controlados aleatorizados ni aprobadas por organismos reguladores oficiales como la Autoridad Europea de Seguridad Alimentaria (EFSA) o la Administración de Alimentos y Medicamentos (FDA) de los EEE. UU.
Existen varios suplementos de venta libre18 y, aunque la eficacia de estos suplementos en el tratamiento de los cálculos renales sigue siendo incierta, algunos estudios han investigado sus posibles efectos. En dos estudios se observó que muchos suplementos poseían suficiente álcali para estimular un efecto citruratúrico43.
ConclusiónEl tratamiento farmacológico de los cálculos renales ha demostrado su eficacia para reducir la recurrencia de los cálculos y tratar anomalías metabólicas específicas que contribuyen a la formación de los cálculos de calcio, ácido úrico, estruvita y cistina.
Sin embargo, es importante reconocer las limitaciones inherentes al tratamiento médico de los cálculos renales. Las diferencias en la composición de los cálculos y en el perfil de los pacientes exigen estrategias personalizadas, y el cumplimiento a largo plazo de las modificaciones dietéticas y los regímenes farmacológicos puede suponer un desafío para algunos pacientes. Por ello, la educación y el apoyo a los pacientes por parte de los médicos es un componente esencial del tratamiento médico de la litiasis renal. Mediante la implementación de un enfoque holístico que incluya la prevención, las intervenciones conservadoras, la farmacoterapia específica y los suplementos económicamente asequibles, los facultativos pueden aliviar los efectos derivados de la litiasis renal, optimizar los resultados de los pacientes y mejorar la calidad de vida general de las personas con nefrolitiasis. La investigación continua, la colaboración y la educación de los pacientes son vitales para perfeccionar y optimizar las técnicas de tratamiento farmacológico de la litiasis renal en el futuro.
Conflicto de interesesBrian H. Eisner es consultor de Boston Scientific, Cook, Olympus, Ambu y asesor de Sonomotion, Dr. Arnie's LLC, Vibronix y Calyxo Medical.