Analizar los resultados clínicos y la supervivencia tras el implante de asistencia ventricular de larga duración en pacientes pediátricos en situación de insuficiencia cardiaca terminal.
MétodosEntre enero de 2006 y noviembre 2021 se implantaron 34 dispositivos Berlin Heart EXCOR® en pacientes pediátricos. Analizamos las características preoperatorias, las intraoperatorias y las complicaciones tras el implante, así como la evolución de los pacientes (trasplante o fallecimiento). Estudio estadístico con STATAIC15.
ResultadosEdad media 51±53 meses (1-180), peso medio 17±16kg (2,2-65). La cardiopatía de base fue miocardiopatía en el 68% y cardiopatía congénita en el 32%. Inicialmente el Berlin Heart EXCOR® implantado fue univentricular en el 65% de los pacientes. La indicación de implante fue puente a trasplante en el 97%. Duración media de soporte 92±105 días (1-511). Complicaciones frecuentes: 62% infecciosas, 44% neurológicas (29% isquémicas y 15% hemorrágicas). Mortalidad de ictus hemorrágicos 80% y de isquémicos 20%. A partir de 2019, cuando se sustituyó la heparina por bivalirudina, los eventos neurológicos disminuyeron y no ha habido muertes por causa neurológica. El 71% han sido trasplantados y el 29% han fallecido.
ConclusionesAnte el creciente número de pacientes pediátricos en situación de insuficiencia cardiaca terminal, ha aumentado el uso del dispositivo Berlin Heart EXCOR®, especialmente como puente a trasplante. Los eventos neurológicos, sobre todo hemorrágicos, son los más temidos por su alta mortalidad. Por eso, la terapia antitrombótica continúa siendo el principal reto. A pesar de ello, supone una alternativa esperanzadora como asistencia de larga duración en población pediátrica, y permite llegar al trasplantarse al 71% de ellos.
The aim is to analyse clinical and survival results after the implant of a long-term mechanical assist device in pediatric patients in the end stages of heart failure.
MethodsBetween January 2006 and November 2021 34 Berlin Heart EXCOR® devices were implanted in pediatric patients. We analysed preoperative and intraoperative characteristics, together with complications after implant. Outcomes were also evaluated (transplant vs. death). Statistical analysis with STATAIC15.
ResultsThe mean age was 51±53 months (1-180), mean weight 17±16kg (2.2-65). Underlying heart disease was myocardiopathy in 68% and congenital heart disease in 32%. The Berlin Heart EXCOR® device was univentricular in 64% of the patients. Surgical indication was bridge to transplant in 97%. Mean duration of mechanical support was 92±105 days (1-511). Postoperative complications were common: 62% infectious and 44% neurological (29% ischaemic and 15% haemorrhagic). Mortality of haemorrhagic strokes 80%, ischaemic 20%. Since 2019, when heparin was changed to bivalirudin, no mortal strokes were observed. 71% of the patients has been transplanted, 29% has died.
ConclusionsAs a response to the increasing number of paediatric patients in end stages of congestive heart failure, the use of the Berlin Heart EXCOR® device has spread, especially if the intention is to use it as bridge to transplant. Neurological events, mostly haemorrhagic, are the most feared because of high mortality. Nevertheless, it is an encouraging alternative as a long-term mechanical assist device in children, allowing them to reach the transplant in 71% of the cases.
La asistencia ventricular es una terapia indicada para el tratamiento del fallo cardiaco refractario. Su uso ha experimentado un aumento considerable en las últimas décadas por el aumento de pacientes que desarrollan insuficiencia cardiaca terminal a lo largo de su vida1. La prevalencia de insuficiencia cardiaca terminal es claramente mayor en la población adulta con respecto a la pediátrica2. Sin embargo, la mejor comprensión y manejo en pacientes pediátricos con cardiopatías congénitas, y la mayor supervivencia tras el tratamiento quirúrgico, han supuesto un aumento de población pediátrica con disfunción ventricular2,3. Esto supone una situación de fracaso a diferentes niveles, con una mortalidad aproximada del 10%, y alrededor del 10 al 15% terminan necesitando un dispositivo de asistencia mecánica circulatoria2.
Durante mucho tiempo, la extracorporeal membrane oxygenation (ECMO) ha sido el único sistema de soporte circulatorio en la población pediátrica, pero es un dispositivo de corta duración y, a pesar de que tiene buenos resultados a corto plazo como puente al trasplante, presenta severas complicaciones cuando su uso se excede en el tiempo (hemorragia, infecciones, eventos neurológicos…)4. Además, obliga al paciente a permanecer en una unidad de cuidados intensivos.
Por ello, y por las largas listas de espera de trasplante pediátrico, se ha hecho imperativo el desarrollo de dispositivos de asistencia de larga duración en este grupo de población, aunque este hecho ha ocurrido de una forma francamente más lenta que en el caso de los adultos5.
El dispositivo Berlin Heart EXCOR® (BHE) es el más implantado de larga duración en niños, siendo el único en neonatos y en lactantes. Desde el primer implante en Alemania en 1990 en un niño de 8años (con un dispositivo de tamaño adulto: 50ml), se han desarrollado dispositivos BHE de menor tamaño, más adecuados para pacientes pediátricos6.
EL BHE se trata de una bomba neumática, de localización paracorpórea y flujo pulsátil. Puede dar asistencia tanto univentricular como biventricular y, de manera transitoria, puede intercalarse un oxigenador en el circuito derecho (ECMO). Presenta unos resultados postrasplante comparables con pacientes que no han requerido soporte mecánico circulatorio7.
Revisamos en este artículo la experiencia de nuestro centro en el implante del BHE como dispositivo de asistencia ventricular de larga duración en la población pediátrica, y analizamos nuestros resultados en el postoperatorio inmediato y su evolución posterior.
MétodosNuestro hospital es uno de los centros de referencia de nuestro país para la atención integral del paciente con cardiopatía congénita, y contamos con un hospital pediátrico que atiende prácticamente la totalidad de enfermedades en niños de cualquier grado de complejidad. Tenemos un programa de trasplante desde el año 1994, y junto a este se ha ido desarrollando también el programa de asistencia ventricular, que inicialmente solo contaba con ECMO. Posteriormente implementamos la asistencia ventricular a largo plazo con el dispositivo BHE desde al año 2006 hasta la actualidad.
El implante del dispositivo se realiza en quirófano bajo anestesia general, guiado por ecocardiograma. Se realiza primero la esternotomía media y tras una disección cuidadosa se hepariniza de forma completa, a dosis sistémica. Se establece la circulación extracorpórea con canulación aórtica y bicava, bajo hipotermia leve, y se detiene la ventilación mecánica. Si es posible se realiza el procedimiento fibrilando. En el caso de que sea necesario cerrar algún defecto septal o realizar una cirugía izquierda, el implante del dispositivo se haría clampando. Se realizan orificios de salida de las cánulas en la pared abdominal anterior. La canulación del dispositivo se realiza de la siguiente forma:
- •
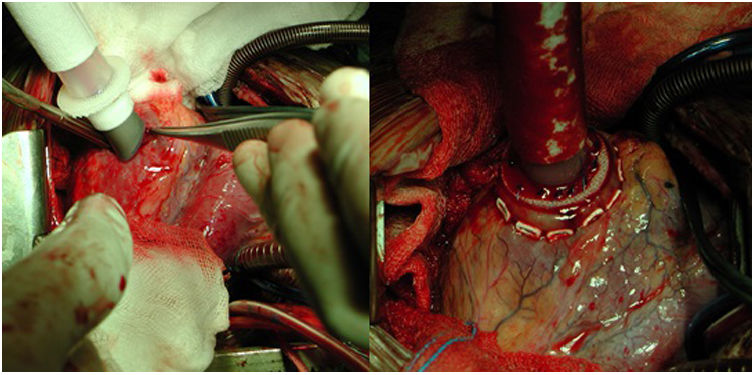
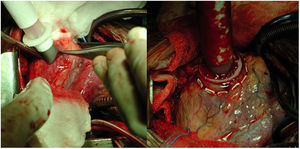
BHE izquierdo: inserción de una cánula en el ápex ventricular izquierdo, sobre una corona de pledgets, y se tuneliza hacia el exterior a través del orificio realizado previamente en la pared abdominal (fig. 1). Tras ello, se tuneliza la cánula aórtica a través del subcutáneo y posteriormente se coloca en la aorta, con ayuda de un clamp parcial. Esta canulación puede hacerse de forma directa o a través de un tubo de dacrón, según el calibre de la aorta y la cánula.
- •
BHE derecho: se coloca inicialmente la cánula de salida en el tronco pulmonar distal. Posteriormente se implanta otra cánula en la aurícula derecha, apoyada en dos bolsas de tabaco. No debemos olvidar, de la misma forma que antes, tunelizar las cánulas a través del subcutáneo, por su salida en la pared abdominal anterior.
Antes de poner en marcha el circuito es imprescindible purgar el mismo para eliminar todo el aire. Se reinicia la ventilación mecánica y se inicia la asistencia con el BHE. Si todo es correcto, se va desconectando progresivamente de circulación extracorpórea hasta detenerla completamente, momento en el cual el paciente se queda únicamente con el soporte proporcionado por el BHE. Si se mantiene la estabilidad hemodinámica, revertimos la heparina con protamina y, tras una hemostasia cuidadosa, damos por finalizado el procedimiento.
Es importante tener en cuenta, a la hora del implante del dispositivo, la presencia de shunts intracardíacos (p.ej., comunicaciones interauriculares, interventriculares), ya que, de existir, habría que cerrarlos. Del mismo modo, es importante detectar la presencia de insuficiencia severa de las válvulas pulmonar o aórtica. En caso de existir deberían repararse (cerrarse) o sustituirse, para un mejor funcionamiento del dispositivo.
En este estudio se recogieron de forma retrospectiva aquellos pacientes pediátricos que requirieron el implante de una asistencia tipo BHE desde el inicio del programa en el año 2006 hasta noviembre de 2021.
Se han revisado datos demográficos, diagnósticos, tipo de asistencia (univentricular o biventricular), duración de la asistencia, complicaciones postoperatorias y supervivencia. Dentro de las complicaciones postoperatorias hemos considerado las siguientes:
- •
Sangrados mayores: cuando han requerido reexploración quirúrgica o politransfusión. Los hemos recogido a nivel intestinal, mediastínico (taponamiento), pulmonar y tracto respiratorio.
- •
Eventos tromboembólicos: infarto a cualquier nivel demostrado por la presencia de trombo en alguna prueba de imagen. Se excluyen los eventos neurológicos, que se analizarán de forma independiente.
- •
Complicaciones infecciosas: presencia de cultivo positivo para un microorganismo (sangre, esputo, orina, exudado) que se correlaciona con clínica (p.ej., exudado purulento de herida, shock séptico) y/o con prueba radiológica (p.ej., consolidación pulmonar en prueba radiológica).
- •
Eventos neurológicos, tanto hemorrágicos como isquémicos. Cualquier clínica neurológica que se asocia a hallazgo en prueba de imagen, correlacionándose ambos en el tiempo.
- •
Complicaciones mecánicas del dispositivo: trombosis que ha requerido recambio de la bomba.
Consideramos la mortalidad hospitalaria como la muerte por cualquier causa durante o después de la intervención y hasta el alta hospitalaria, o dentro de un periodo de 30días después de la intervención.
El protocolo antitrombótico usado cuando empezó a implantarse el dispositivo en 2006 fue el «protocolo Edmonton», que defendía el uso de heparina junto con dipiridamol y aspirina. Posteriormente, a partir del año 2016 y hasta el 2019 se usó el «protocolo Stanford», que añadía clopidogrel en combinación con la aspirina. En el año 2019 se inició un nuevo protocolo, que combinaba el uso de bivalirudina en lugar de heparina como anticoagulante junto a dipiridamol y aspirina como antiagregantes. Desde entonces, es nuestro protocolo de elección.
El programa estadístico utilizado fue STATAIC15. Las variables continuas fueron expresadas como media y desviación estándar. Los datos categóricos se presentaron mediante frecuencias y porcentajes.
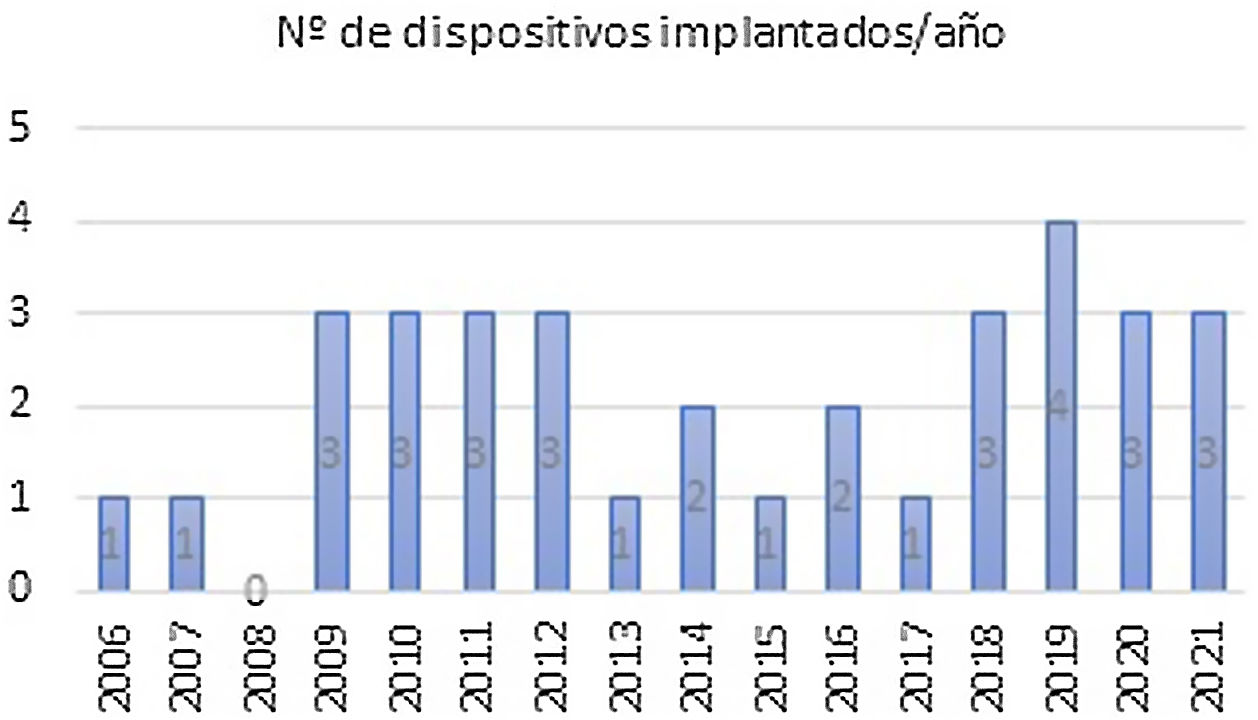
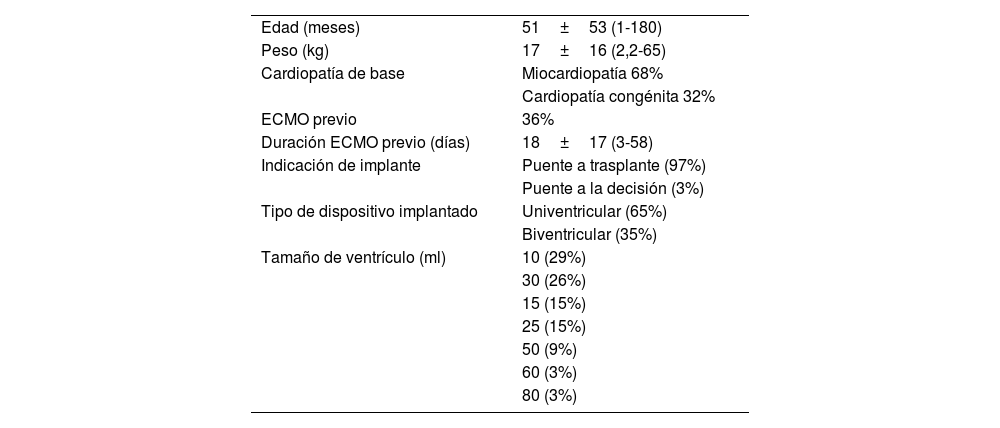
ResultadosPreoperatoriosDesde el año 2006 hasta noviembre de 2021 se han implantado 34 BHE en pacientes pediátricos, con edad media de 51±53 meses (rango 1-180) y un peso medio de 17±16kg (rango 2,2-65) (fig. 2).
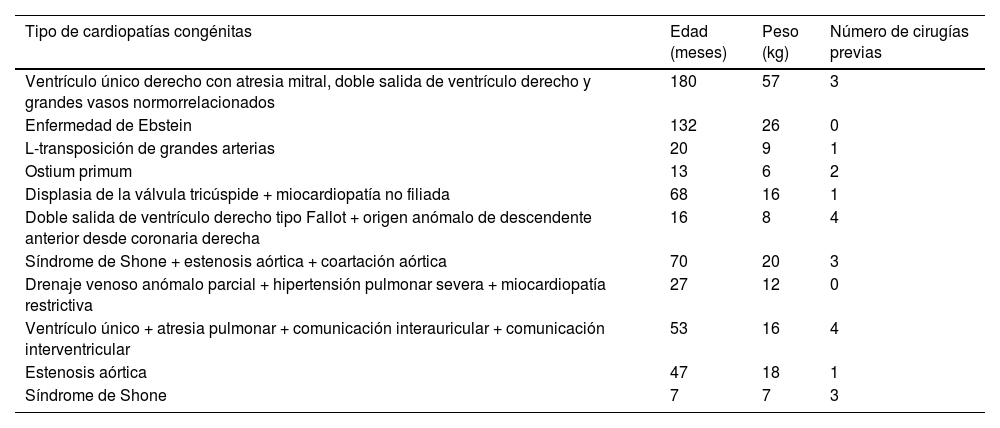
La cardiopatía de base fue la miocardiopatía en el 68% (19 miocardiopatías dilatadas y 4 restrictivas) y cardiopatía congénita estructural en el 32% (tabla 1). Requirieron ECMO previo 13 pacientes (38%), con una media de días de soporte de 18±17 días (rango 3-58). En la gran mayoría de los casos, la indicación de implante fue como puente a trasplante (97%) (tabla 2).
Tipos de cardiopatías congénitas de nuestros pacientes
| Tipo de cardiopatías congénitas | Edad (meses) | Peso (kg) | Número de cirugías previas |
|---|---|---|---|
| Ventrículo único derecho con atresia mitral, doble salida de ventrículo derecho y grandes vasos normorrelacionados | 180 | 57 | 3 |
| Enfermedad de Ebstein | 132 | 26 | 0 |
| L-transposición de grandes arterias | 20 | 9 | 1 |
| Ostium primum | 13 | 6 | 2 |
| Displasia de la válvula tricúspide + miocardiopatía no filiada | 68 | 16 | 1 |
| Doble salida de ventrículo derecho tipo Fallot + origen anómalo de descendente anterior desde coronaria derecha | 16 | 8 | 4 |
| Síndrome de Shone + estenosis aórtica + coartación aórtica | 70 | 20 | 3 |
| Drenaje venoso anómalo parcial + hipertensión pulmonar severa + miocardiopatía restrictiva | 27 | 12 | 0 |
| Ventrículo único + atresia pulmonar + comunicación interauricular + comunicación interventricular | 53 | 16 | 4 |
| Estenosis aórtica | 47 | 18 | 1 |
| Síndrome de Shone | 7 | 7 | 3 |
Características preoperatorias e intraoperatorias
| Edad (meses) | 51±53 (1-180) |
| Peso (kg) | 17±16 (2,2-65) |
| Cardiopatía de base | Miocardiopatía 68% |
| Cardiopatía congénita 32% | |
| ECMO previo | 36% |
| Duración ECMO previo (días) | 18±17 (3-58) |
| Indicación de implante | Puente a trasplante (97%) |
| Puente a la decisión (3%) | |
| Tipo de dispositivo implantado | Univentricular (65%) |
| Biventricular (35%) | |
| Tamaño de ventrículo (ml) | 10 (29%) |
| 30 (26%) | |
| 15 (15%) | |
| 25 (15%) | |
| 50 (9%) | |
| 60 (3%) | |
| 80 (3%) |
ECMO: extracorporeal membrane oxygenation.
Inicialmente en 22 pacientes (65%) el BHE implantado fue univentricular. En su evolución dos de ellos posteriormente pasaron a ser biventriculares tras presentar cuadro de arritmias refractario asociado a disfunción ventricular derecha.
Los ventrículos más frecuentemente implantados fueron los de 10ml (10 casos [29%]), 30ml (9 casos [26%]), seguidos del 15 y 25ml (5 casos cada uno [15%]). Los tamaños 50 (3 pacientes), 60 (1 paciente) y 80ml (1 paciente) fueron los menos empleados (9%, 3% y 3%, respectivamente).
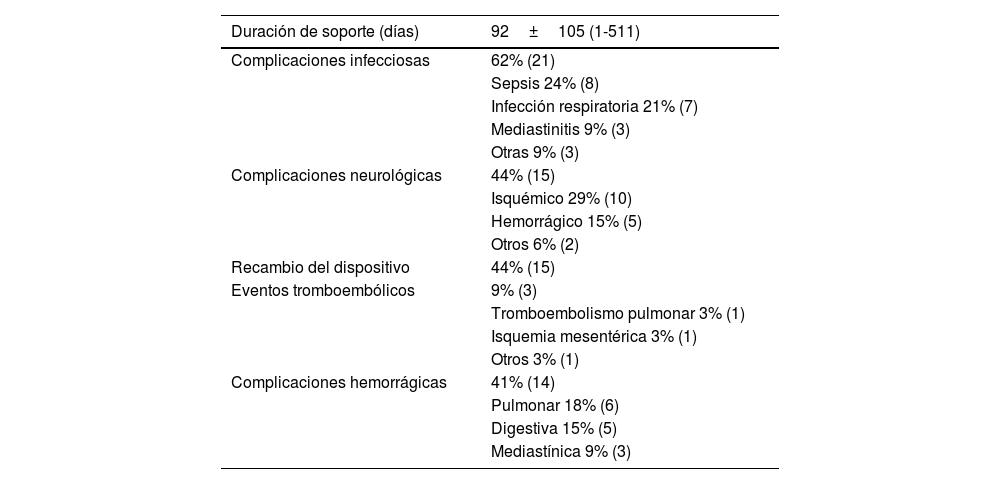
PostoperatoriosLa duración media de soporte fue 92±105 días (rango 1-511). El 88% de los pacientes (30) tuvo algún tipo de complicación tras el implante. Las complicaciones infecciosas fueron las más frecuentes (62%), seguidas de las neurológicas (44%). Aproximadamente el 44% de los pacientes (15) requirieron recambio del dispositivo (principalmente por trombosis del mismo, y el 9% (3 pacientes) presentaron un evento tromboembólico en el seguimiento (tabla 3).
Resultados postoperatorios
| Duración de soporte (días) | 92±105 (1-511) |
|---|---|
| Complicaciones infecciosas | 62% (21) |
| Sepsis 24% (8) | |
| Infección respiratoria 21% (7) | |
| Mediastinitis 9% (3) | |
| Otras 9% (3) | |
| Complicaciones neurológicas | 44% (15) |
| Isquémico 29% (10) | |
| Hemorrágico 15% (5) | |
| Otros 6% (2) | |
| Recambio del dispositivo | 44% (15) |
| Eventos tromboembólicos | 9% (3) |
| Tromboembolismo pulmonar 3% (1) | |
| Isquemia mesentérica 3% (1) | |
| Otros 3% (1) | |
| Complicaciones hemorrágicas | 41% (14) |
| Pulmonar 18% (6) | |
| Digestiva 15% (5) | |
| Mediastínica 9% (3) |
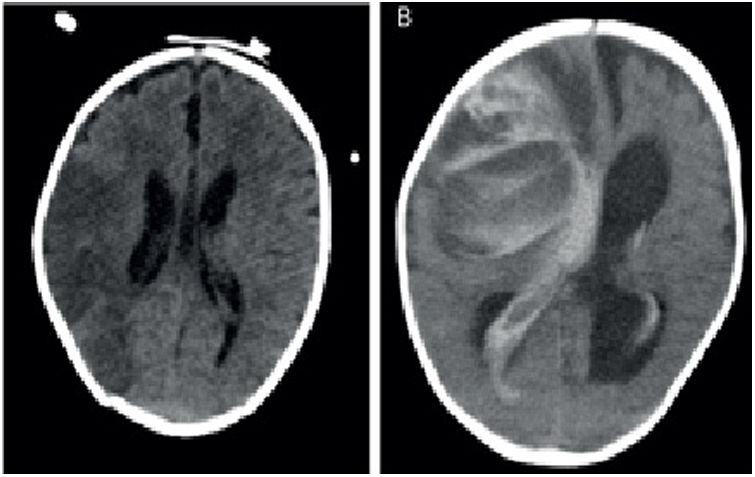
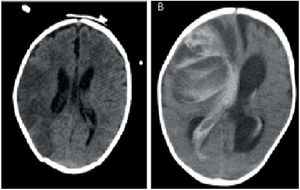
Principalmente los ictus fueron isquémicos (29%), mayoritariamente de etiología tromboembólica (menos frecuentemente hipóxica). Aparecieron más en los BHE univentriculares. En el caso de los isquémicos, en 7 de los 10 pacientes se encontraron depósitos de fibrina previamente en las bombas. Hubo un 20% de mortalidad hospitalaria. En los ictus hemorrágicos la mortalidad fue mayor, llegando hasta el 80% de los pacientes (fig. 3).
Estos 15 eventos neurológicos son los que sabemos con bastante certeza que son complicaciones directas del BHE. Hay dos pacientes que también han presentado un evento neurológico pero que no han sido incluidos en el análisis: el primero porque es un paciente con ECMO previa al BHE, que no se sabe realmente si la lesión se produjo antes o después del implante del BHE, y el segundo porque el cuadro de pérdida de nivel de consciencia no se correlaciona con ninguna lesión neurológica en ninguna prueba de imagen.
La tasa y la densidad de incidencia de ictus isquémico desde que se comenzó a usar la bivalirudina en el año 2019 son 11,1% y 0,76 por 1.000 días de asistencia, respectivamente, cifras significativamente menores que las de la era anterior con heparina, que fueron 37% y 6,2 por 1.000 días de asistencia, respectivamente. Cabe destacar que desde que se empezó a usar la bivalirudina no ha habido ningún ictus (ni isquémico ni hemorrágico) en los niños tratados con BHE. No ha ocurrido ningún fallecimiento secundario a complicación intracraneal isquémica o hemorrágica.
En su evolución, el 71% (24 pacientes) han sido trasplantado y el 29% (10 pacientes) han fallecido.
De entre los 24 pacientes trasplantados, 5 (22%) han fallecido posteriormente:
- •
Ha habido únicamente una muerte intrahospitalaria, debido a una situación de fracaso multiorgánico refractario en el contexto de una aspergilosis cerebral.
- •
Los otros 4 pacientes han fallecido en el seguimiento en la evolución postrasplante, tras el alta a domicilio:
- -
Dos fallecimientos por muerte súbita: uno al año de ser trasplantado y el segundo a los 10 años.
- -
Un caso de linfoma de alto grado con aplasia medular severa a los 5 meses del trasplante.
- -
Un caso de fracaso multiorgánico secundario a insuficiencia cardiaca y fallo hepático refractarios, 10 meses después del trasplante.
Centrándonos en los pacientes fallecidos portadores de BHE (10 pacientes), observamos que las complicaciones neurológicas, isquémicas y sobre todo hemorrágicas son la principal causa de muerte (60%) (tabla 4). Otro dato a destacar es que no solo las hemorragias a nivel cerebral son causantes del fallecimiento de estos pacientes, sino que también sangrados severos a otros niveles pueden llevar a provocar su muerte (sangrados digestivos, pulmonares).
Causas de muerte en pacientes portadores de Berlin Heart EXCOR® (BHE)
| Paciente 1. Hemorragia cerebral |
| Paciente 2. Hemorragia cerebral |
| Paciente 3. Lesión neurológica hipóxica |
| Paciente 4. Infarto cerebral izquierdo extenso |
| Paciente 5. Hemorragia cerebral posterior |
| Paciente 6. Hemorragia cerebral frontotemporal |
| Paciente 7. Hemorragia digestiva y pulmonar severas |
| Paciente 8. FMO progresivo: hemorragia digestiva, fracaso renal, insuficiencia respiratoria |
| Paciente 9. FMO irreversible: enteropatía, fracaso renal, crisis convulsivas |
| Paciente 10. FMO irreversible: insuficiencia cardiaca, respiratoria y renal, fallo hepático, hemorragias pulmonar y mediastínica |
FMO: fracaso multiorgánico.
El uso de asistencias ventriculares de larga duración en niños ha aumentado de forma sustancial en los últimos años. El Pediatric Interagency Registry for Mechanical Circulatory Support (PediMACS), el registro más grande de población pediátrica en asistencia ventricular de larga duración en Norteamérica, publicó en su último informe de 2020 un aumento de hasta el doble de pacientes en dicho registro desde el anterior reporte en 20188.
A diferencia de la población adulta, en niños es más difícil establecer el momento adecuado para el implante, así como decidir el candidato más adecuado para el implante del dispositivo. Asimismo, supone un reto quirúrgico, puesto que los niños constituyen un grupo muy heterogéneo, con cardiopatías congénitas fisiológica y estructuralmente muy complejas9-11, y existen pocas alternativas técnicas para pacientes pequeños, ya que la mayoría de los dispositivos fueron diseñados en primer lugar para adultos, y de ahí han ido progresivamente adaptándose a la población pediátrica1,2. De hecho, el peso mediano de nuestros pacientes es de 18kg, siendo el menor de 2,2kg. Actualmente, el único sistema capaz de asistir de forma prolongada a los pacientes pediátricos con independencia de su edad, peso o diagnóstico es el BHE3. Su principal indicación es como puente al trasplante, con el 73%, ofreciendo un resultado muy optimista, con un 74,4% de éxito al año del implante8.
La disposición de este dispositivo (paracorpóreo, con cánulas que se conectan a una bomba externa) hace posible la combinación con otros dispositivos, como el ECMO. De hecho, hasta el 36% de nuestros pacientes presentaban ECMO en el momento del implante del BHE. Esto permite un manejo más optimizado, según los requerimientos del paciente en cada momento.
Se han identificado ciertos factores de riesgo que conllevan mayor riesgo de mortalidad: bajo peso del paciente (<5kg), fallo renal o hepático preimplante o el implante de un BHE biventricular4,12. La presencia de una cardiopatía congénita de base vs. miocardiopatía (33% vs. 67% en nuestra serie, respectivamente) ha demostrado ser un factor bastante importante, ya que estos pacientes suelen presentar mayor inestabilidad hemodinámica, peor situación clínica y mayor complejidad técnica a la hora del implante1,5,8.
La presencia de efectos adversos no es desdeñable; en nuestra serie hasta el 88% de los pacientes presentaron algún evento en el postoperatorio.
A pesar de que no han sido las más frecuentes, las complicaciones neurológicas son el evento más temido y de mayor mortalidad. Aparecen hasta en el 44% de la serie, un porcentaje algo mayor que en otras1,2,8. Los ictus isquémicos son menos frecuentes que los hemorrágicos, los cuales tienen una mortalidad muy alta y han sido la causa de muerte de, al menos, la mitad de nuestros pacientes fallecidos durante el periodo de asistencia con el BHE.
Por ello, no es de extrañar que la terapia antitrombótica sea uno de los retos más difíciles de estos dispositivos. Actualmente el protocolo que se sigue en nuestro centro consiste en doble antiagregación con aspirina y clopidogrel y anticoagulación con bivalirudina. Esta combinación, propuesta por el grupo del Boston Childreńs Hospital y que sustituyó la heparina por bivalirudina, ha demostrado una tasa de ictus y de complicaciones hemorrágicas menor que con cualquier otra terapia anticoagulante en pacientes portadores de BHE13, hecho que se ha demostrado también en nuestra serie a partir de su introducción en 2019.
A pesar de todo ello, más del 70% de nuestros pacientes han podido ser trasplantados, porcentaje similar al de otros centros4,8. Esto resulta muy alentador si tenemos en cuenta que en estos pacientes se había llegado al techo terapéutico y que la posibilidad de asistirlos con el dispositivo BHE constituía la única alternativa para intentar cambiar la evolución natural de su patología y darles una oportunidad.
ConclusionesLa asistencia mecánica circulatoria de larga evolución va tomando cada vez más importancia dentro de la población pediátrica debido al aumento de pacientes en situación de insuficiencia cardiaca terminal refractaria. Dispositivos como el Berlin Heart EXCOR® proporcionan una posibilidad real y eficaz, sobre todo en los pacientes más pequeños. A pesar de sus temidas complicaciones (especialmente las neurológicas), los resultados como puente al trasplante son esperanzadores, y arrojan algo de luz en la evolución, de otra forma infausta, de estos pacientes.
Responsabilidades éticasTodos los padres y/o tutores legales de nuestros pacientes fueron informados y firmaron el consentimiento autorizando el uso de datos e imágenes con fines docentes y de investigación aprobado por el comité de ética de nuestro hospital. La recogida de datos se hizo de forma anónima, siguiendo los protocolos del hospital para la realización de estudios clínicos y respetando la ley de protección de datos vigente en nuestro país.
FinanciaciónLos autores declaran no haber recibido financiación alguna para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses para la realización de este trabajo.