La cirugía de la válvula mitral ha experimentado cambios muy significativos en los últimos años, desde el reemplazo valvular relativamente sencillo, hasta la reparación compleja de la válvula mitral que incluye el uso de neocuerdas. La reparación de la válvula mitral mínimamente invasiva es un componente del concepto de recuperación postoperatoria intensificada (ERAS, por sus siglas en inglés), es un avance más en el manejo de la enfermedad de la válvula mitral que se aleja del abordaje de la esternotomía media clásica y, por lo tanto, exige un enfoque diferente desde el punto de vista anestésico. Es esencial la evaluación preoperatoria con una optimización de varios sistemas, tal como se documenta minuciosamente en el consenso SEDAR, SECCE y AEP. La selección y preparación adecuada del paciente, junto con un enfoque sistemático planificado para el manejo intraoperatorio, es primordial que no haya complicaciones durante la fase intraoperatoria y una recuperación rápida en el período postoperatorio, lo que garantizará un buen resultado para el paciente.
Mitral valve surgery has undergone very significant changes over the last few years from relatively straightforward mitral valve replacement to complex mitral valve repair including insertion of neo-chordae. Minimally invasive mitral valve repair, a constituent of the cardiac enhanced recovery after surgery (ERAS) concept, is a further development in the management of mitral valve disease which involves moving away from the classical midline sternotomy and thus demands a different approach to the anesthetic management. Preanesthetic evaluation with optimising various organ systems is essential as thoroughly documented in the SEDAR, SECCE and the AEP consensus guidelines. Appropriate patient selection and preparation along with a planned systematic approach to the intraoperative management is essential for a smooth intraoperative period and rapid recovery in the postoperative period which would result in a good patient outcome.
La cirugía cardiaca valvular ha recorrido un largo camino desde la introducción del bypass cardiopulmonar en 1953. Los avances en el diseño de las prótesis valvulares han permitido mejorar los resultados en comparación con hace unos años. Sin embargo, la necesidad de anticoagulación oral de forma indefinida en pacientes jóvenes portadores de válvulas mecánicas, especialmente las prótesis mitrales, sigue siendo paca la cirugía mínimamente invasiva (CMI) un desafío. El desarrollo reciente de nuevas técnicas en la cirugía de reparación valvular mitral utilizando neocuerdas e injertos junto con la CMI ha ayudado a resolver este problema hasta cierto punto, especialmente en un grupo seleccionado de pacientes. En este artículo de revisión hablaremos del manejo anestésico de la cirugía de reparación de la válvula mitral, la evaluación y optimización preoperatoria, el manejo intraoperatorio y postoperatorio, incluidos los principios de la «cirugía fast-track», con especial énfasis en el abordaje mínimamente invasivo.
Evaluación y preparación preoperatoriaEsta fase implica una cuidadosa evaluación y selección de los pacientes candidatos a cirugía de reparación de la válvula mitral. También implica la optimización del estado físico del paciente antes de la operación cuando el tiempo lo permite. Por lo general, hay un período aproximadamente de 4 a 6 semanas desde que se realiza la indicación de cirugía hasta la intervención. Este período se puede utilizar para una evaluación preanestésica exhaustiva y la planificación de la cirugía, así como la preparación del paciente antes de la cirugía.
El documento de consenso de la SEDAR, la SECCE y la AEP, «Vía cínica de recuperación intensificada en cirugía cardiaca (RICC)» proporciona una guía útil basada en la evidencia con respecto a la evaluación preoperatoria y la preparación del paciente1.
Al igual que cualquier otro procedimiento quirúrgico mayor, la evaluación preoperatoria de los antecedentes personales, el examen físico, las pruebas complementarias y la ecocardiografía. El estudio ecocardiográfico debe incluir una evaluación exhaustiva de la válvula mitral y el aparato subvalvular utilizando la ecocardiografía tridimensional en tiempo real para evaluar con precisión el tipo y la extensión de la enfermedad de la válvula mitral y planificar la reparación valvular2.
Evaluación general del riesgo anestésico y quirúrgicoClasificación ASAEn la consulta de preanestesia se establece la clase ASA para cada paciente según el sistema de clasificación ASA3. Esta escala usada para predecir el riesgo quirúrgico combina la edad, las comorbilidades, la complejidad de la cirugía, su duración y los cuidados postoperatorios requeridos.
Euroscore IIEs la escala más utilizada para calcular el riesgo quirúrgico en cirugía cardiaca y debe ser utilizada preferentemente para determinar el riesgo perioperatorio y la morbimortalidad4.
Sistema cardiovascularAdemás de la enfermedad valvular mitral, es esencial evaluar la presencia de anomalías cardiacas o vasculares concomitantes5. La presencia de placas, aneurismas, disecciones, tortuosidad o material vascular extraño (injertos o stents) podría impedir la canulación periférica en la CMI. La disfunción ventricular severa, el foramen oval permeable (PFO), la presencia de una vena cava superior izquierda (SVC) y otras anomalías venosas pueden impedir o alterar significativamente la técnica mínimamente invasiva. La presencia de fibrilación auricular también aumenta el riesgo perioperatorio.
Sistema respiratorioEs esencial evaluar la función respiratoria especialmente en la reparación por CMI donde la técnica anestésica implica ventilación unipulmonar. El volumen espiratorio forzado (FEV1) resulta útil para la detección inicial. Existe un mayor riesgo de complicaciones postoperatorias en pacientes con FEV1<40% estimado6. Se realiza una evaluación adicional mediante gasometría arterial y capacidad de difusión de monóxido de carbono (DLCO). Tradicionalmente, una PaO2<60mmHg o una PaCO2>50mmHg contraindican el uso de ventilación unipulmonar (OLV)6. Los valores de DLCO<40% se asocian con una mayor incidencia de complicaciones pulmonares postoperatorias6. Es importante evaluar el grado de hipertensión pulmonar ya que, aunque la hipertensión pulmonar no es una contraindicación absoluta, el aumento transitorio y brusco de la presión arterial pulmonar puede desencadenar un fallo cardiaco derecho e inestabilidad hemodinámica. También se deben identificar los pacientes sometidos a tratamiento con radioterapia, adherencias pleurales y o cirugía torácica previas, así como deformidades de la pared torácica o traumatismos torácicos, ya que pueden dificultar el abordaje quirúrgico.
Sistema gastrointestinalLa capacidad de realizar ecocardiografía transesofágica (ETE) intraoperatoria es parte integral de muchos procedimientos de CMI, y una contraindicación para ETE es una contraindicación de facto para el procedimiento quirúrgico en sí. La presencia de adherencias o estenosis esofágicas, tumores, laceraciones, divertículos o hemorragia digestiva alta activa son contraindicaciones absolutas establecidas para la realización de ETE7.
Los antecedentes de radiación de cabeza y cuello o del mediastino, cirugía previa del tracto gastrointestinal superior, várices esofágicas, úlcera péptica activa y hernia de hiato se encuentran entre las contraindicaciones relativas más comunes para ETE7. Si alguna de estas está presente, los riesgos y beneficios de la ETE deben evaluarse de forma individualizada.
Sistema musculoesqueléticoLos pacientes con obesidad mórbida representan un desafío para la cirugía cardiaca mínimamente invasiva (CMIV), sobre lo que respecta a la colocación en la mesa quirúrgica para obtener un abordaje quirúrgico óptimo8. Los pacientes deben ser examinados para detectar alteraciones ortopédicas o musculoesqueléticas preexistentes, ya que pueden influir tanto en la técnica quirúrgica como en la anestésica. Las deformidades de la pared torácica y la cifoescoliosis pueden complicar el acceso quirúrgico. La exposición quirúrgica adecuada puede ser imposible en pacientes pequeños con una cavidad torácica pequeña9. La colocación de un tubo endotraqueal de doble luz puede ser complicada en pacientes con obesidad mórbida, y pueden tener dificultades para tolerar la ventilación unipulmonar8. Aunque estos pacientes presentan el mayor desafío para la CMIV, al mismo tiempo son los que podrían beneficiarse más de este procedimiento, ya que estos pacientes tienen un mayor riesgo de complicaciones en cirugía con esternotomía media convencional5.
Sistema endocrinoDiabetes mellitusEs fundamental conocer el estado del control de la diabetes mellitus para estratificar el riesgo quirúrgico. Los niveles de HbA1c deben determinarse en todos los pacientes, y se debe establecer una estrategia para optimizar el control de la glucemia antes de la intervención para prevenir complicaciones postoperatorias relacionadas con la diabetes mal controlada1,10.
La optimización de otros trastornos endocrinos como el hipotiroidismo también requiere revisión previa.
Evaluación del estado nutricional y pre-habilitaciónSe recomienda que el estado nutricional y la pérdida de peso del paciente se evalúen antes del procedimiento quirúrgico utilizando escalas de nutrición y niveles de albúmina sérica. El estado nutricional de los pacientes debe optimizarse siempre que sea posible antes de la cirugía para evitar una estancia prolongada en la UCI. Un estado nutricional deficiente se asocia a una necesidad de ventilación mecánica prolongada y a mayores tasas de infección, como se ha demostrado en varios estudios11.
El cribado preoperatorio de la anemia y la optimización de la hemoglobina deben realizarse antes del procedimiento quirúrgico. Existe evidencia de que los pacientes con Hb<13g/dl, independientemente del sexo, tienen un mayor riesgo de transfusión de hemoderivados12,13. La anemia debe tratarse con hierro, ácido fólico, vitamina B12 y eritropoyetina si la cirugía puede retrasarse 6 semanas12. En la cirugía urgente planificada en el plazo de 2 semanas, se puede usar hierro intravenoso con eritropoyetina para tratar esta anemia en el preoperatorio14.
Se han implementado programas de pre-habilitación cardiaca para mejorar los resultados postoperatorios. A pesar de la limitada evidencia actual, se consideran una estrategia preventiva multidisciplinaria muy prometedora para mejorar la capacidad aeróbica y aumentar la capacidad funcional cardiorrespiratoria de los pacientes mediante el seguimiento de un programa de entrenamiento preoperatorio, especialmente cuando hay un tiempo de espera para la cirugía15,16. Se debe fomentar el abandono del hábito tabáquico y el consumo de alcohol durante el período preoperatorio. Cuanto más largo sea el período libre de tabaquismo, menores serán las complicaciones postoperatorias y, por lo tanto, mejores serán los resultados17. El consumo de tabaco debe cesar al menos 6 semanas antes del día de la cirugía cuando sea posible18.
Fase preoperatoria inmediataTratamiento antiagregante y anticoagulanteLos pacientes en tratamiento con antiagregantes plaquetarios deben ser evaluados desde el punto de vista del riesgo hemorrágico y cuando esté indicado, el antiagregante debe suspenderse dependiendo respetando los tiempos de eliminación y de acuerdo al aclaramiento renal. Se recomienda suspender el ticagrelol 3 días, el clopidogrel 5 días y el prasugrel 7 días antes de la cirugía19,20. El inicio de tratamiento sustitutivo de la antiagregación con heparina de bajo peso molecular justo antes de la cirugía está contraindicado.
Los pacientes anticoagulados con antagonistas de la vitamina K (p. ej., acenocumarol) necesitan suspender de 3 a 5 días antes de la cirugía para permitir que el INR sea <1,521,22. Los anticoagulantes orales de acción directa (p. ej., dabigatrán, apixabán, rivaroxabán, edoxabán) deben suspenderse de 48 a 96h antes de la cirugía, dependiendo de su farmacocinética y aclaramiento renal23. En pacientes que precisan una intervención urgente, es necesario revertir la anticoagulación con vitamina K, complejo protrombínico o el agente procoagulante apropiado24.
Ansiolisis preoperatoriaLos procedimientos quirúrgicos cardiacos se engloban en la categoría de cirugía mayor, y es bastante habitual que los pacientes sometidos a procedimientos como la reparación de la válvula mitral estén muy ansiosos y estresados debido al miedo, la incertidumbre y la falta de entendimiento o comprensión de la información proporcionada al paciente15. Esto puede manifestarse en forma de insomnio e incapacidad de realizar de manera normal las actividades cotidianas semanas antes del procedimiento. Es imperativo que se proporcione información adecuada al paciente para mitigar la ansiedad y evitar la toma en exceso de agentes farmacológicos. Si se requieren fármacos ansiolíticos, se deben evitar aquellas benzodiazepinas de acción prolongada, especialmente en pacientes mayores de 65 años para reducir la incidencia de somnolencia excesiva o delirio en el período postoperatorio25. La noche antes de la cirugía podría administrarse una dosis única de una benzodiazepina de acción intermedia como el lorazepam para tratar la ansiedad y ayudar a conciliar el sueño.
Manejo anestésico intraoperatorio en la cirugía de reparación mitralLa cirugía cardiaca ha avanzado adaptándose a las nuevas demandas y a los avances tecnológicos y bajo esa premisa se ha desarrollado la CMIV26. En particular este abordaje ha sido aplicado a la cirugía sobre la válvula mitral con éxito y de forma extendida si bien el procedimiento convencional por esternotomía media sigue siendo el más utilizado.
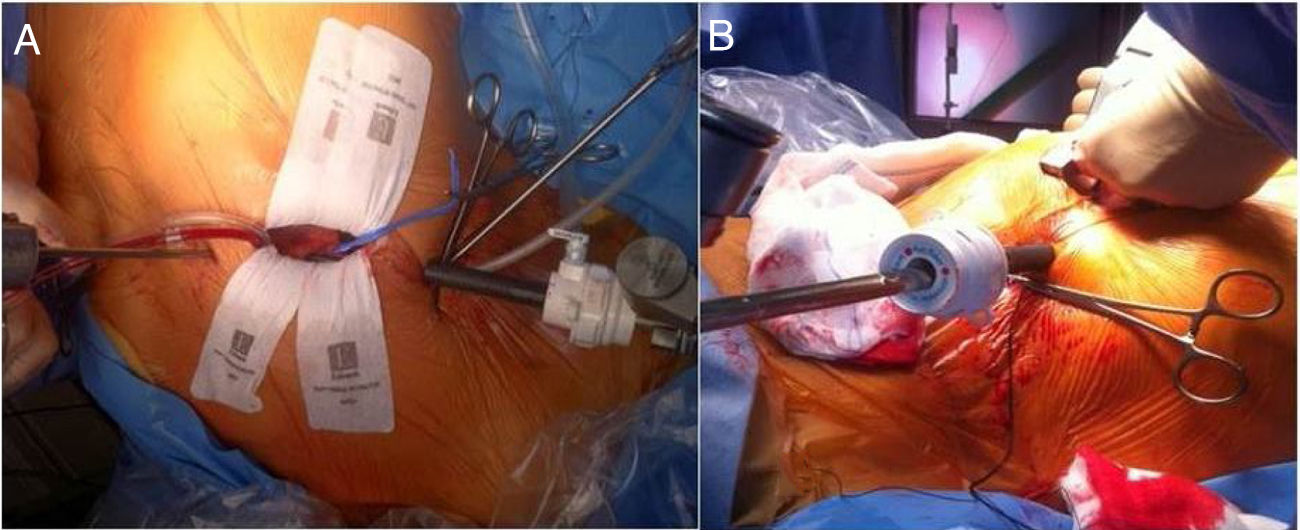
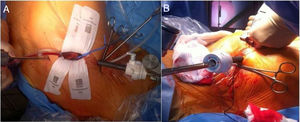
El manejo intraoperatorio de la cirugía reparadora mitral no difiere esencialmente de cualquier otra cirugía cardiaca por lo que nos vamos a centrar en aspectos anestésicos relevantes del abordaje por CMIV. La cirugía CMIV vía minitoracotomía difiere de la esternotomía media en que se realiza mediante incisiones de 5-7cm en el hemitórax derecho a nivel del cuarto o quinto espacio intercostal y en la línea medioclavicular (fig. 1). La circulación extracorpórea (CEC) se realiza mediante canulación periférica de la arteria femoral, vena femoral y vena yugular interna derecha. Una vez establecida la CEC la técnica más usada es la realización del pinzamiento aórtico mediante clampaje transtorácico externo y la administración de cardioplejia anterógrada mediante aguja.
La CMIV ha demostrado superioridad con respecto a la cirugía convencional en cuanto a un mejor control del dolor postoperatorio, movilización más precoz, menor requerimientos transfusionales, estancias hospitalarias más cortas, recuperación e integración más precoz en la actividades rutinarias y resultados estéticos más favorables. Como potenciales desventajas de la técnica se ha descrito que no todos los pacientes son potenciales candidatos y la curva de aprendizaje puede ser larga por lo que los resultados son esencialmente operador dependiente27,28.
Técnica anestésica intraoperatoria en cirugía de reparación mitralDe acuerdo con las últimas recomendaciones de la vía clínica de recuperación intensificada en cirugía cardiaca, la inducción anestésica, momento especialmente crítico, se recomienda con fármacos cardioestables, especialmente el etomidato, evitando las benzodiazepinas especialmente en los pacientes mayores de 65 años. Como mantenimiento anestésico, se recomiendan los fármacos halogenados e infusión de opiáceos de corta acción (p. ej., remifentanilo), por su cardioestabilidad y contribución a la extubación precoz1.
La monitorización continua de la profundidad anestésica, así como de la saturación regional de oxígeno es altamente recomendable. En cuanto a la monitorización hemodinámica avanzada con sistemas de gasto cardiaco continuo, el catéter de arteria pulmonar queda reservado para pacientes con fracción de eyección del VI deprimida FEVI<35% (si está presente insuficiencia mitral severa se considera FEVI<45%) o pacientes con presión de arteria pulmonar >40mmHg y depresión de la función sistólica del ventrículo derecho (VD). La indicación de ETE intraoperatoria resulta indiscutible en ausencia de contraindicaciones.
En cuanto a los sistemas de CEC las guías actuales recomiendan diferentes estrategias encaminadas a reducir la hemodilución y la respuesta inflamatoria: CEC mínimamente invasiva (MiECC), recebado sanguíneo del circuito venoso activo por vacío (DVAV), hemodilución aguda normovolémica y la ultrafiltración modificada (MUF) y la ultrafiltración de balance cero (ZBUF) si las características del paciente lo permiten. El mantenimiento de la normotermia y normoglucemia, así como la administración sistemática de antifibrinolíticos ajustados a la edad y la función renal se consideran las principales recomendaciones en la CIMV.
Los pacientes sometidos a reparación mitral asocian con frecuencia hipertensión pulmonar significativa y una función ventricular izquierda infraestimada por las medidas habituales de valoración de la función sistólica dada la reducción de la poscarga en los casos de insuficiencia mitral severa. Tras la salida de CEC es frecuente la necesidad de inotrópicos tales como dobutamina, milrinona, noradrenalina o adrenalina para la optimización del gasto cardiaco y las presiones de perfusión periférica. Los factores de riesgo más relevantes para desarrollar un síndrome poscardiotomía refractario al tratamiento médico y tener que considerar el soporte circulatorio con oxigenación por membrana de circulación extracorpórea (ECMO, por sus siglas en inglés) son: Disfunción ventricular previa, hipertensión pulmonar severa, endocarditis aguda o proceso séptico asociado, edad avanzada, procedimientos combinados complejos y la duración de la cirugía29.
Particularidades intraoperatorias de la cirugía cardiaca mínimamente invasivaEl papel del anestesiólogo durante la CMIV es fundamental, y su aportación tiene relevancia en el manejo de las técnicas de anestesia locorregionales, adecuado manejo de la ventilación unipulmonar, manejo hemodinámico óptimo durante el procedimiento quirúrgico, así como en la realización de la ETE para guiar las diferentes fases del procedimiento30.
La preparación e inducción anestésica de este procedimiento no varían con respecto a los procedimientos habituales con la excepción de la necesidad de ventilación unipulmonar y, por lo tanto, la necesidad de intubación con tubo de doble luz o bloqueadores bronquiales para la ventilación selectiva del pulmón izquierdo durante la cirugía que precisará colapso del pulmón derecho. Se recomienda una ventilación portectora pulmonar durante el tiempo bajo ventilación mecánica.
La monitorización avanzada incluye la saturación regional de oxígeno cerebral (ScrO2) bilateral es relevante fundamentalmente al inicio de la CEC y si se emplea Endoclamp® aórtico para el pinzamiento aórtico. Dado que el drenaje venoso puede ser inicialmente insuficiente, es posible que se produzca una perfusión con sangre desoxigenada eyectada por el corazón hacia el hemisferio cerebral derecho y de sangre oxigenada procedente de la circulación extracorpórea retrógrada hacia el hemisferio izdo. Es el llamado síndrome de Harlequin. Es fácilmente diagnosticado mediante la variación bilateral de ScrO2 y el tratamiento es mantener la ventilación unipulmonar con FIO2 elevada hasta obtener la parada cardiaca completa31.
La colocación de parches autoadhesivos multifunción desfibrilación/marcapasos es necesaria dada la dificultad para la introducción de palas internas en el campo quirúrgico.
Papel de la ecocardiografía intraoperatoria en la cirugía cardiaca mínimamente invasivaLa utilización de la ETE es mandatoria en la CMIV, fundamentalmente si se trata de un procedimiento sobre la válvula mitral. En ocasiones excepcionales la ecografía epicárdica puede aplicarse a través de las incisiones y es una alternativa cuando no se puede introducir la sonda transesofágica.
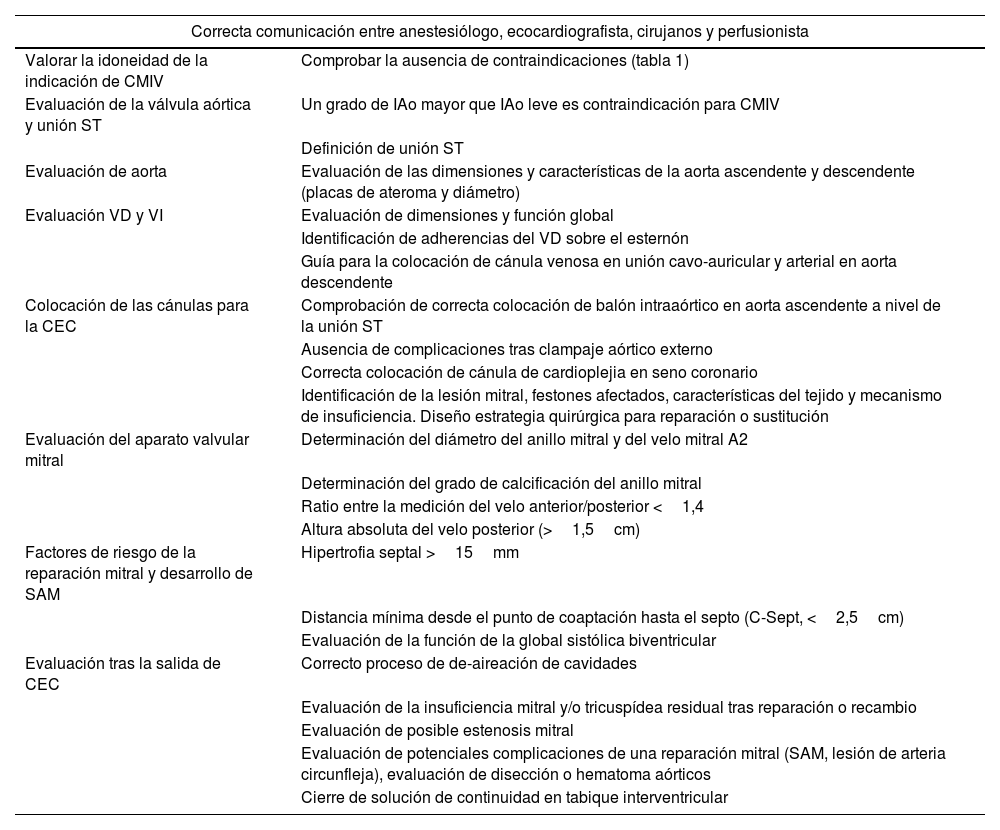
La realización de un estudio ecocardiográfico exhaustivo que incluya los 11 y 20 planos estándares recomendados por las sociedades científicas permite la valoración de los siguientes puntos de especial relevancia en la indicación de CMIV32:
- •
Valorar la idoneidad de la indicación de CMIV.
- •
Evaluación de la insuficiencia aórtica y tamaño de aorta ascendente.
- •
Colocación de las cánulas para la CEC.
- •
Evaluación de la estructura a reparar o recambiar (remitimos al artículo correspondiente a la valoración ecocardiográfica de la válvula mitral o tricúspide).
- •
Factores de riesgo de la reparación.
- •
Evaluación tras la salida de CEC.
En pacientes con insuficiencia aórtica superior a grado I o ligera, la CMIV debería ser considerada con cautela por los riesgos de una inadecuada administración de la cardioplejia y los riesgos de distensión ventricular. Por ello la evaluación intraoperatoria de la severidad de la lesión es importante para modificar la técnica.
La dilatación de la aorta ascendente por encima de los 40mm se considera una contraindicación relativa para esta técnica. El estudio que identifica placas de ateroma significativas en la aorta descendente que pudieran ser movilizadas por la perfusión retrógrada (cánula arterial femoral) constituye una contraindicación relativa para la CMIV y/o cambio en la elección del sitio de canulación. La presencia de trombos intramurales es también otra contraindicación para la introducción de guías en aorta descendente por el alto riesgo de movilización y eventos tromboembólicos.
Canulación para la cirugía cardiaca mínimamente invasivaCanulación venosaEn el abordaje por toracotomía el drenaje venoso del circuito se obtiene mediante la canulación femoral en conjunción con la canulación de la vena yugular interna derecha (VYID) para una canulación bicava.
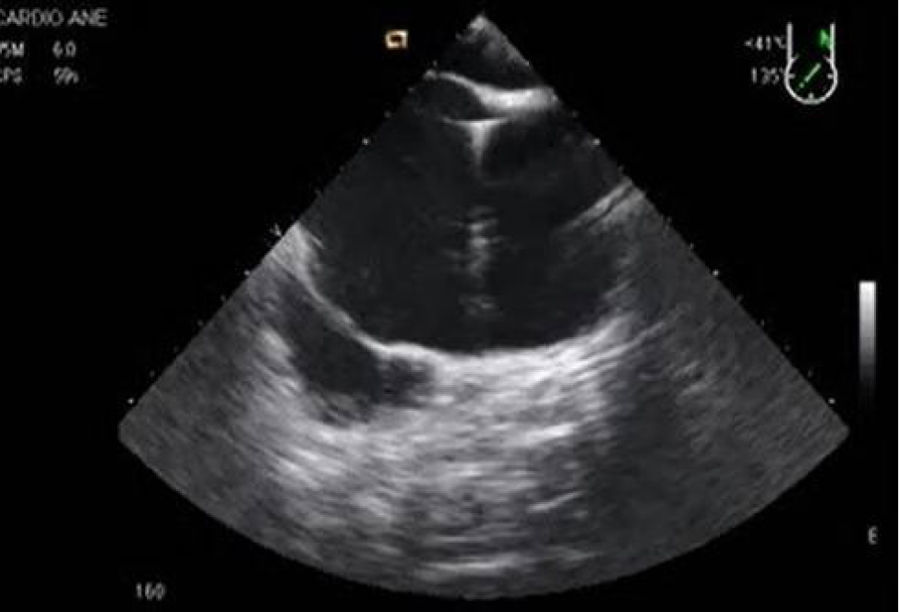
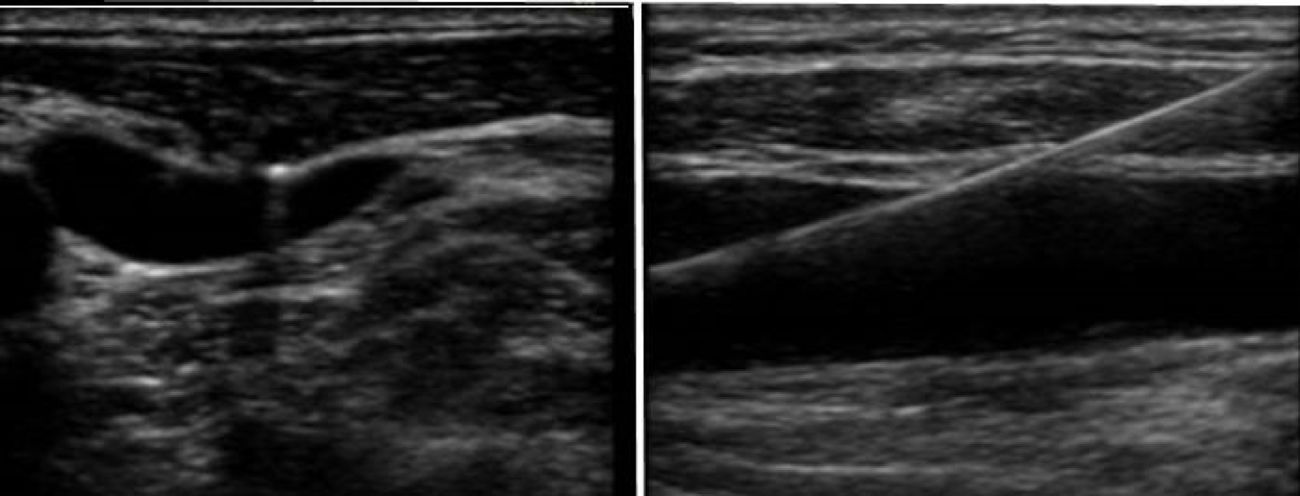
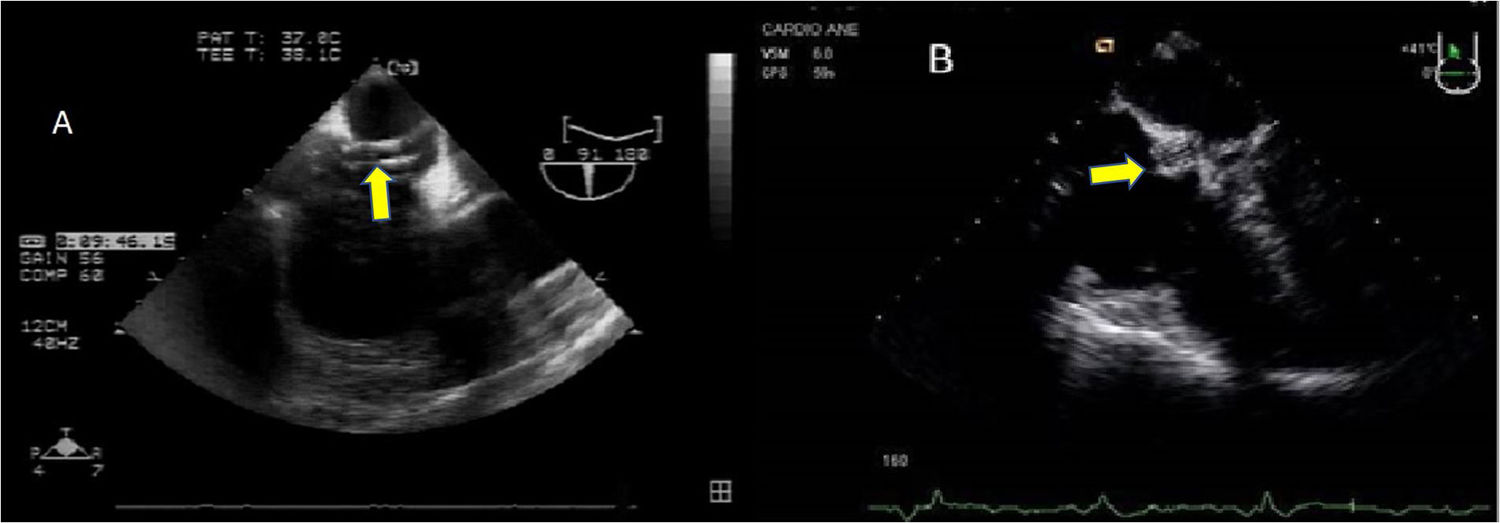
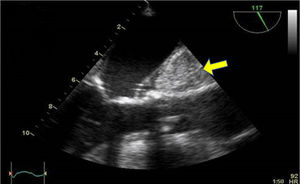
Se dispone de varios tipos de cánulas largas de inserción percutánea a través de la vena femoral y que alcanzan la AD o la VCI. Tras la canalización de la vena femoral se inserta una guía que debe ser visualizada en AD o en la VC y posteriormente se introduce la cánula de drenaje en VCI y se confirma la adecuada posición mediante la ETE en plano medioesofágico 90°, bicava (fig. 2). Frecuentemente la localización de la cánula es en la unión cavoauricular. En la mayor parte de los centros se emplea un drenaje suplementario introducido en la vena yugular interna derecha hasta la vena cava superior para el drenaje del territorio superior (fig. 3)33.
La inserción de estos catéteres aumenta el riesgo de lesiones vasculares que es proporcional al tamaño de las cánulas. Como en cualquier acceso vascular, pueden ocurrir lesiones traumáticas locales, así como lesiones de grandes vasos. La perforación de la AD, las venas cavas u otras estructuras vasculares dentro del pericardio puede dar lugar a un taponamiento cardiaco. Es recomendable la visualización de la guía intravascular y en AD tras la localización del acceso vascular y antes de proceder a las dilataciones e inserción del catéter.
Canulación arterialLa canulación arterial incluye la canulación de la aorta ascendente, la arteria femoral o la axilar. El control se realizará mediante la observación de las guías y posteriormente de la cánula en la aorta descendente en plano medioesofágico aorta descendente eje largo y corto.
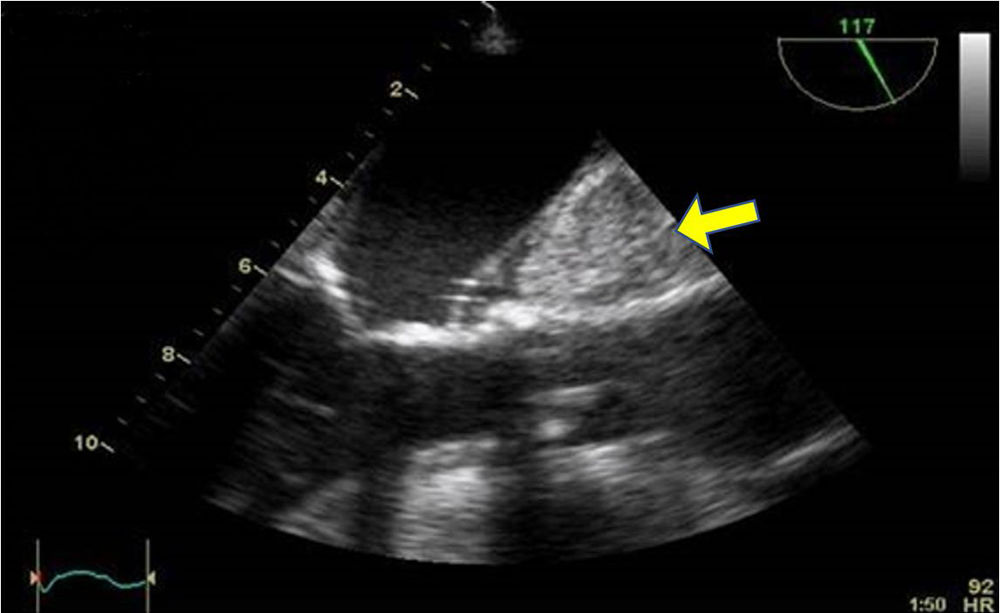
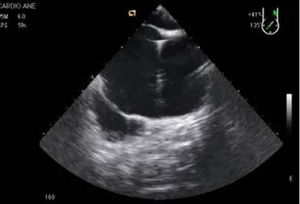
Como elemento diferencial de esta técnica quirúrgica, inicialmente se utilizaba el balón aórtico intraluminal (endoclamp aortic catheter, Edwards Lifesciences, Irvine, CA, EE. UU.) para el clampaje aórtico localizándose en aorta ascendente. Aunque con modificaciones, el concepto sigue siendo el mismo hoy en día. El balón intraaórtico se coloca a través de un puerto lateral en forma de Y en la cánula arterial y se avanza en la aorta descendente hasta llegar a la aorta ascendente. Este proceso requiere la monitorización continua con ETE y la medición previa de los diámetros de la aorta. Por las dificultades que entraña esta técnica, está cada vez más extendida la aplicación de un pinzamiento externo utilizando un clamp transtorácico angulado denominado de Chitwood (Scanlan International Inc, Minneapolis MN, EE. UU.) que es guiado hacia la aorta ascendente mediante visión directa o mediante visión endoscópica. Se coloca también el catéter para la administración de cardioplejia anterógrada. La elevación de la presión arterial puede ser el primer signo de alarma y la evaluación ecocardiográfica de la aorta tras la instauración del bypass puede descartar una disección o un hematoma intramural en evolución cuyos signos externos son más tardíos (fig. 4).
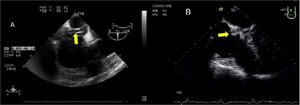
Administración de cardioplejia en la cirugía cardiaca mínimamente invasivaEn la CMIV la administración de cardioplejia retrógrada vía catéter en el seno coronario puede ser difícil por la dificultad de su inserción, pero tiene la ventaja de permitir administrar la cardioplejia y realizar una cirugía completamente endoscópica. La canulación del seno coronario a través de un puerto desde una posición quirúrgica es factible, aunque es imprescindible la confirmación de la posición exacta de la cánula mediante ecocardiografía. La inserción del catéter de forma percutánea en el seno coronario es otra opción, aunque compleja y que consume tiempo. (fig. 5). Las indicaciones especiales, aunque no absolutas, para la administración de cardioplejia retrógrada podrían ser los pacientes con hipertrofia ventricular muy significativa, casos en los que se prevé tiempos quirúrgicos largos, pacientes con historia previa de revascularización coronaria, en especial en aquellos con un injerto permeable de mamaria y en los pacientes con insuficiencia aórtica severa.
A) Plano medioesofágico bicava modificado cánula de cardioplejia retrograda protruyendo sobre septo interauricular y alcanzando AD. B) Plano cuatro cámaras 0° próximo a diafragma enfocando seno coronario, balón del catéter de cardioplejia retrógrada introduciéndose en el seno coronario.
Tras la salida de CEC es necesario la correcta valoración de la reparación mitral, así como la evaluación del resto de estructuras cardiacas (remitimos al artículo correspondiente de valoración ecográfica). En la tabla 1 se resumen la información ecográfica más relevante.
Puntos clave en la valoración ecocardiográfica en CMIV para la cirugía valvular mitral
| Correcta comunicación entre anestesiólogo, ecocardiografista, cirujanos y perfusionista | |
|---|---|
| Valorar la idoneidad de la indicación de CMIV | Comprobar la ausencia de contraindicaciones (tabla 1) |
| Evaluación de la válvula aórtica y unión ST | Un grado de IAo mayor que IAo leve es contraindicación para CMIV |
| Definición de unión ST | |
| Evaluación de aorta | Evaluación de las dimensiones y características de la aorta ascendente y descendente (placas de ateroma y diámetro) |
| Evaluación VD y VI | Evaluación de dimensiones y función global |
| Identificación de adherencias del VD sobre el esternón | |
| Guía para la colocación de cánula venosa en unión cavo-auricular y arterial en aorta descendente | |
| Colocación de las cánulas para la CEC | Comprobación de correcta colocación de balón intraaórtico en aorta ascendente a nivel de la unión ST |
| Ausencia de complicaciones tras clampaje aórtico externo | |
| Correcta colocación de cánula de cardioplejia en seno coronario | |
| Identificación de la lesión mitral, festones afectados, características del tejido y mecanismo de insuficiencia. Diseño estrategia quirúrgica para reparación o sustitución | |
| Evaluación del aparato valvular mitral | Determinación del diámetro del anillo mitral y del velo mitral A2 |
| Determinación del grado de calcificación del anillo mitral | |
| Ratio entre la medición del velo anterior/posterior <1,4 | |
| Altura absoluta del velo posterior (>1,5cm) | |
| Factores de riesgo de la reparación mitral y desarrollo de SAM | Hipertrofia septal >15mm |
| Distancia mínima desde el punto de coaptación hasta el septo (C-Sept, <2,5cm) | |
| Evaluación de la función de la global sistólica biventricular | |
| Evaluación tras la salida de CEC | Correcto proceso de de-aireación de cavidades |
| Evaluación de la insuficiencia mitral y/o tricuspídea residual tras reparación o recambio | |
| Evaluación de posible estenosis mitral | |
| Evaluación de potenciales complicaciones de una reparación mitral (SAM, lesión de arteria circunfleja), evaluación de disección o hematoma aórticos | |
| Cierre de solución de continuidad en tabique interventricular | |
CEC: circulación extracorpórea; CMIV: cirugía cardiaca mínimamente invasiva; SAM: movimiento sistólico anterior; ST: sinotubular; VD: entrículo derecho; VI: ventrículo izquierdo.
El concepto de anestesia Fast-track (en inglés Fast-track cardiac anestesia [FTCA] o enhaced recovery after surgery [ERAS]) se introdujo en los años 90 en cirugía cardiaca con el objetivo de extubar de forma temprana a los pacientes reduciendo la estancia en la UCI, y también la estancia y costes hospitalarios34,35. Se trata de un concepto complejo que incluye múltiples componentes del cuidado de los pacientes durante el manejo preoperatorio, intraoperatorio y postoperatorio36. Los protocolos FTCA o ERAS han sido ampliamente estudiados y han demostrado buenos resultados en el campo de la coloproctología, y otras especialidades quirúrgicas están aplicando la misma dinámica de trabajo. Sin embargo, la cirugía cardiaca presenta diferencias muy importantes que hacen que se tengan que adaptar de manera específica1.
No existe una definición estándar de FTCA, se trata esencialmente de técnicas anestésicas basadas en bajas dosis de opioides asociados a un hipnótico de acción corta (propofol o anestésicos inhalatorios), con el objetivo de extubar a los pacientes en las primeras 4-8h postoperatorias (dependiendo de los autores y los distintos centros hospitalarios). Se ha demostrado que en pacientes de riesgo bajo-moderado la FTCA es segura, disminuyendo los tiempos de extubación y el tiempo de estancia en la UCI sin aumentar la morbimortalidad8. A pesar de que la mayoría de los estudios se han realizado en pacientes de riesgo bajo-moderado, hoy en día el manejo intraoperatorio con dosis bajas de opioides e hipnóticos de acción corta es el abordaje estándar en todo tipo de pacientes ya que confiere una adecuada estabilidad hemodinámica intraoperatoria.
Un adecuado manejo anestésico siempre debe ir asociado a un protocolo de analgesia multimodal. El dolor tiene un origen multifactorial, y además existen diversidad de vías de transmisión del dolor, por lo que hay que actuar a diversos niveles para su prevención y tratamiento, con el objetivo de reducir el estrés quirúrgico y los efectos secundarios derivados de las altas dosis de opioides. Se han sugerido múltiples opciones analgésicas desde un punto de vista multimodal (analgesia epidural, regional, pregabalina, dexmedetomidina, magnesio, oxicodona, ketamina, lidocaína) aunque no existe evidencia para su recomendación de forma generalizada37.
Particularidades del postoperatorio tras la cirugía cardiaca mínimamente invasivaTras la finalización de la cirugía, el paciente puede ser extubado en quirófano si cumple los criterios establecidos de extubación (estabilidad hemodinámica, correcto intercambio gaseoso, normotermia, correcto nivel de conciencia y ausencia de signos de sangrado) o proceder a cambiar el tubo endotraqueal de doble luz por un tubo endotraqueal convencional. El manejo postoperatorio no difiere de cualquier otra cirugía cardiaca, y de acuerdo con las recientes guías RICC, la recuperación intensificada precoz es lo recomendado junto con la extubación en las 6 primeras horas del postoperatorio1.
Según la literatura, la CMIV permite la incorporación precoz a la vida diaria con un manejo del dolor óptimo. Las técnicas analgésicas para la CMIV han evolucionado hacia técnicas libres de opiáceos, basadas en bloqueos nerviosos con anestésicos. La epidural torácica proporciona un control del dolor excelente y una menor estancia en las unidades de críticos, pero las consideraciones de punción del neuroeje en pacientes sometidos a anticoagulación es siempre objeto de debate. Los bloqueos paravertebrales torácicos guiados por ecografía son tan efectivos como la epidural torácica y el riesgo de hematoma pudiera ser menor. En los últimos años la difusión del bloqueo del músculo serrato anterior ha demostrado proporcionar un control adecuado del dolor, aunque inferior al bloqueo paravertebral. Los bloqueos intrapleurales proporcionan suficiente control del dolor y pueden ser colocados por el cirujano. Los bloqueos fasciales pectorales, bloqueos intercostales y bloqueo del músculo erector de la columna también se han descrito en la literatura con efectos favorables38,39.
Complicaciones perioperatorias específicas de la cirugía cardiaca mínimamente invasiva de reparación mitralConversión a esternotomíaLa conversión a esternotomía media se ha descrito hasta en el 1% de los casos. Las razones principales son el sangrado no controlado, adhesiones pulmonares, disección aórtica y exposición insuficiente de las estructuras, especialmente la válvula mitral40.
Sangrado postoperatorioLa valoración del sangrado postoperatorio puede ser difícil dada la apertura parcial del pericardio, la dificultad para valorar por ecocardiografía transtorácica las estructuras posteriores y la posibilidad de acumulación en el hemitórax derecho. Por todo ello, la evaluación mediante ETE debe ser rápida ante la sospecha de sangrado. La reapertura de la toracotomía para la revisión quirúrgica es a menudo suficiente para la revisión dado que frecuentemente el origen del sangrado proviene de los vasos intercostales.
Complicaciones relacionadas con la canulación periféricaEl incremento de las complicaciones neurológicas tales como ACV (2,1 vs. 1,2%), disección aórtica (2 vs. 0%), lesiones de nervio periférico están asociadas a la canulación periférica y a la perfusión periférica retrógrada41.
La posibilidad de síndrome compartimental de miembro inferior, así como lesión vascular mayor con sangrado retroperitoneal o lesiones aneurismáticas se han descrito con una incidencia de hasta del 6%42.
Complicaciones relacionadas con la ventilación unipulmonarLa posibilidad de lesión pulmonar aguda con dificultades para el intercambio gaseoso, fuga aérea persistente e incluso edema pulmonar tras reexpansión pulmonar se han descrito hasta en un 2,1% con un incremento de la mortalidad43. Los factores de riesgo asociados fueron la administración preoperatoria de corticoides e inmunosupresores y tiempos prolongados de pinzamiento aórtico (>156min).
- •
La anestesia para la cirugía de reparación mitral debe tener en cuenta las particularidades de cada paciente.
- •
Los factores de riesgo más frecuentes son la hipertensión pulmonar y la disfunción ventricular asociada.
- •
La optimización preoperatoria, la monitorización hemodinámica invasiva con ETE, así como el manejo de fluidos, hemoderivados e inotrópicos exquisito son fundamentales para garantizar el éxito de la cirugía y reducir la morbimortalidad asociada.
- •
El abordaje mínimamente invasivo vía toracotomía derecha para la reparación mitral está en expansión y presenta implicaciones relevantes en el manejo anestésico intraoperatorio.
- •
Las técnicas de recuperación intensificada tienen como objetivo lograr la extubación precoz y han demostrado eficacia en reducir costes y acelerar la incorporación precoz a la vida diaria.
Ninguna entidad ha financiado este trabajo, ni se ha recibido ninguna beca.
Conflicto de interesesDeclaramos que ningún autor tiene conflicto de intereses.