El implante de válvulas transcatéter como tratamiento para la estenosis aórtica se posiciona como la terapia de elección para una determinada población de pacientes que va en constante aumento, y ya no se trata únicamente de pacientes con riesgo quirúrgico prohibitivo. Esto deriva del avance y el perfeccionamiento de los dispositivos, así como del desarrollo de las diferentes vías de acceso. Es nuestro objetivo compartir y estandarizar la técnica del acceso transcarotídeo, que hemos implementado y desarrollado desde 2019 con muy buenos resultados.
Método y resultadosEntre el 01/01/2019 y el 31/12/2023 se implantaron 79 válvulas transcatéter por vía carotídea (21,43% del total de implantes en nuestro centro), con nula mortalidad intraoperatoria y una mortalidad menor al 1% durante el primer mes de intervención. La incidencia de ictus establecidos en estos pacientes es del 0%.
ConclusionesHemos adoptado la vía transcarotídea como una alternativa igualmente válida al acceso transaxilar. Debido a los recientes cambios en los criterios de selección de pacientes, creemos que el cirujano cardiovascular debe tener un rol activo en la toma de decisiones y del implante de este tipo de prótesis, dado que muchos pacientes tienen bajo riesgo quirúrgico y, en consecuencia, son susceptibles de ser intervenidos ante complicaciones del procedimiento.
Transcatheter aortic valve implantation as a treatment for aortic stenosis is positioned as the therapy of choice for a specific population of patients, which is steadily increasing and is no longer limited to patients with prohibitively high surgical risk. This stems from the advancement and refinement of devices, as well as the development of different access routes. Our goal is to share and standardize the transcarotid access technique, which we have implemented and developed since 2019 with very good results.
Method and resultsBetween 01/01/2019 and 31/12/2023, 79 transcatheter valves were implanted via the carotid route (21.43% of the total implants in our center), with no intraoperative mortality and less than 1% mortality during the first month of intervention. The incidence of established strokes in these patients is 0%.
ConclusionsWe have adopted the transcarotid route as an equally valid alternative to the transaxillary access. Due to recent changes in patient selection criteria, we believe that the cardiovascular surgeon should have an active role in decision-making and implantation of this type of prosthesis, since many patients have low surgical risk and are consequently susceptible to intervention in case of procedure complications.
El primer implante de una válvula transcatéter realizado en Rouen (Francia) en 2002 por el profesor Alain Cribier1 fue, sin lugar a dudas, un hito en el tratamiento de la estenosis aórtica severa sintomática; y el inicio de un arduo debate en torno a cuál es la vía de acceso más adecuada para el paciente. Los dispositivos han ido evolucionando y mejorando su perfil, de modo que el acceso que se ha impuesto por su facilidad de manejo ha sido mayoritariamente la vía transarterial respecto a la transapical o transtorácica, y dentro de ellas, la vía de acceso transfemoral derecha es la que se utiliza mayoritariamente. Existen diversas patologías que impiden el acceso por la vía femoral, como pacientes con arteriopatía periférica del eje iliofemoral o de la aorta aorta abdominal o torácica, que actualmente representan en torno al 10-15% del total de pacientes candidatos a implante de válvula aórtica transcatéter (transcatheter aortic valve implantation [TAVI])2.
Todas las vías de acceso distintas de la vía transfemoral han sido catalogadas en las guías clínicas bajo la tipología de «TAVI no femoral», aunque son sustancialmente distintas las transarteriales (axilar y carotídea) de las transtorácicas (apical y transaórtica), las cuales representan indudablemente una mayor agresión y, consecuentemente, peores resultados
Así, cuando, en un paciente se encuentra un eje iliofemoral subóptimo, se abre un nuevo abanico de posibilidades en torno a las vías de acceso, cuya elección final dependerá de los resultados y de la experiencia de cada centro y de cada cirujano.
Inicialmente, se comenzó por el acceso transfemoral abierto y el transapical por mini toracotomía izquierda, dado que los dispositivos eran bastante gruesos3. Tras la mejora del calibre de los dispositivos aparecieron los accesos femoral percutáneo, aórtico, axilar y carotídeo paulatinamente. No hay estudios comparativos doble ciego entre las distintas vías de acceso transarterial periférico como la axilar o carotídea. Los estudios que se han hecho comparando ambos accesos son cuando la vía transfemoral no es factible, y a pesar de ser pacientes peores, los resultados son similares, e incluso en algunos parámetros se vislumbra incluso mejores4,5.
Así llegamos al primer implante de válvula transcatéter por vía carotídea, realizado en 20096. Este implante obtuvo buenos resultados iniciales, y ello a pesar del «miedo» inicial a las complicaciones que pudieran derivarse de la manipulación de esta arteria, especialmente en lo que se refiere a las complicaciones neurológicas. Sin embargo, no podemos olvidar que los pacientes implantados a través de la vía transfemoral también pueden sufrir estas complicaciones neurológicas, como así muestran las principales series. Así, por ejemplo, de acuerdo con el Registro Francés5, se han visto incidencias de ictus o de accidente isquémico transitorio en torno al 1,6% de los pacientes sometidos a implante a través de la vía carotídea, siendo estas cifras incluso superiores en aquellos pacientes en los que la vía de acceso principal fue la vía transfemoral, de conformidad con el estudio PARTNER2 o PARTNER37.
En el Hospital Universitario Puerta del Mar aplicamos la técnica TAVI desde el año 2010 y hemos pasado por todos los accesos, desde el apical, el transaórtico y el femoral abierto al femoral percutáneo, axilar8 y, finalmente, el acceso transcarotídeo desde el año 2019, con muy buenos resultados, muy similares a los obtenidos con la vía transaxilar, o incluso mejores en algunos parámetros, como comentaremos más adelante. El objetivo de este artículo es compartir nuestra experiencia y explicar la técnica estandarizada para su realización, de forma que pueda ser implementada en otros centros, en muchas ocasiones incluso como alternativa a la femoral.
MétodosEstudio preoperatorioUna vez el paciente ha sido diagnosticado de estenosis aórtica severa, se completa el estudio preoperatorio con una analítica completa, cateterismo coronario y un angioTC toracoabdominal que incluya troncos supraaórticos.
Para ello, es importante informar al servicio de radiología de cada centro de las principales características particulares que requerimos del angioTC para el estudio TAVI (tabla 1).
Características de un angioTC con contraste i.v. para realización de estudio preoperatorio TAVI
| • Debe incluir desde troncos supraaórticos hasta arterias femorales |
| • Cortes de, al menos, 0,3mm |
| • Sincronizado con el R-R, al menos en un 40% |
| • Preferentemente el contraste deberá ser administrado por el brazo derecho, ya que las últimas vías de acceso preferidas para el TAVI son la subclavia derecha y la carótida derecha |
Fuente: elaboración propia
Posteriormente, el paciente debe ser obligatoriamente presentado en el comité médico-quirúrgico (Heart Team), compuesto por cardiólogos intervencionistas, cirujanos cardiovasculares, intensivistas y anestesiólogos, donde se decidirá la indicación de TAVI y la vía de acceso más idónea.
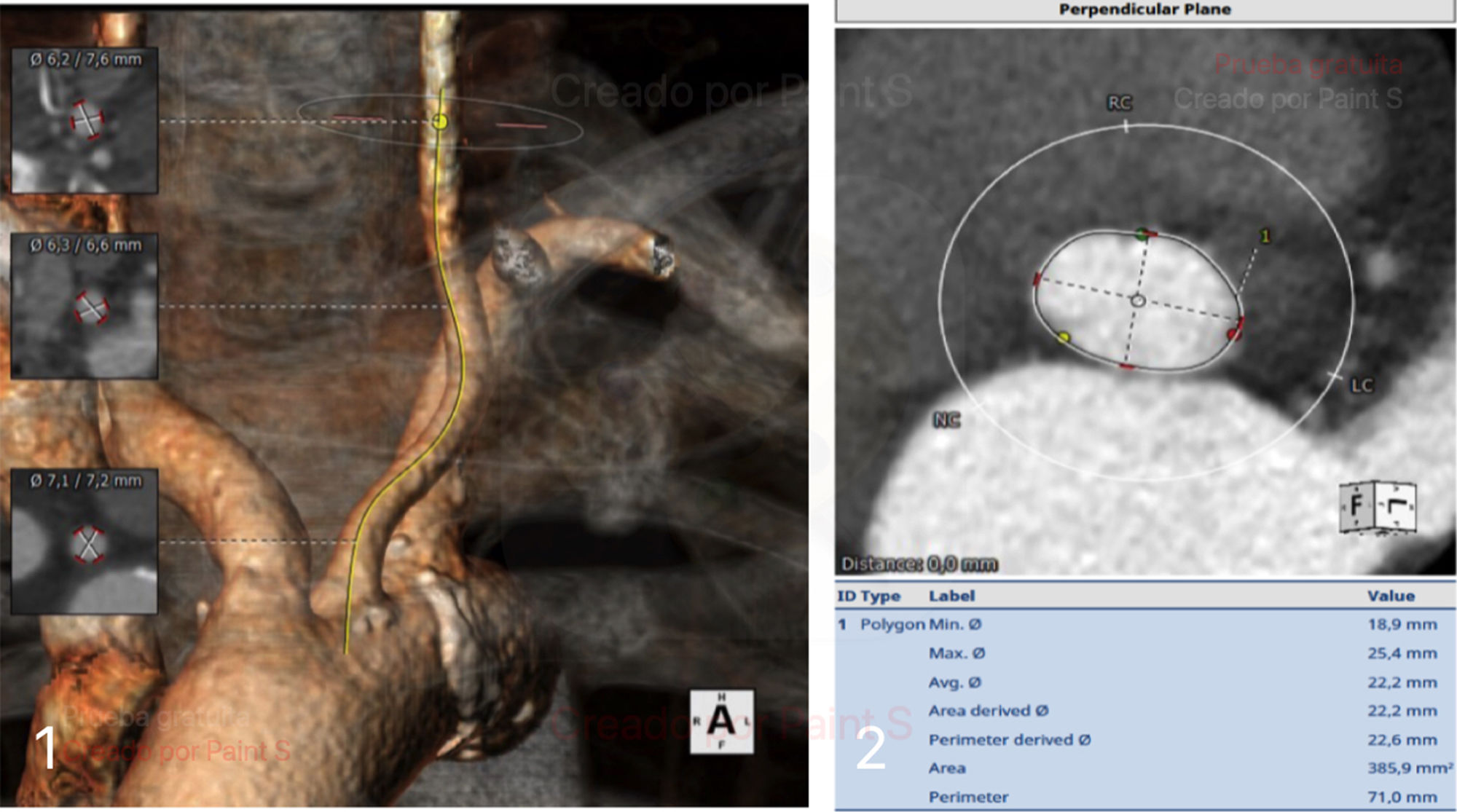
En todos los pacientes se deben realizar las mediciones para la planificación con un software específico; en nuestro caso utilizamos el denominado 3mensio™ (fig. 1), donde principalmente se evalúa:
- -
Calibre, tortuosidad y calcificaciones parietales de arterias femorales, axilares, subclavias y carótidas bilaterales.
- -
Medidas del anillo aórtico; tracto de salida del ventrículo izquierdo (TSVI), senos y unión sinotubular (UST).
- -
Altura de las arterias coronarias.
- -
Proyecciones radiológicas donde se verán alineados los velos (comúnmente denominadas «proyecciones de trabajo») y que deberán ser utilizadas durante el procedimiento.
El acceso carotídeo será considerado cuando el acceso femoral sea subóptimo o encontremos inconvenientes en el recorrido, bien sea aorta abdominal o torácica, y la arteria carótida tenga un diámetro adecuado en su trayecto y características anatómicas iguales o mejores a la arteria axilar izquierda.
En nuestro centro no utilizamos de manera protocolizada un estudio preoperatorio de circulación cerebral, sino que realizamos una prueba intraoperatoria de adaptación a la isquemia, como comentaremos más adelante.
Procedimiento quirúrgicoCaracterísticas de la intervenciónUna vez realizado el estudio y elegido el procedimiento quirúrgico a través del acceso carotídeo, en nuestro centro la intervención tiene las siguientes características:
- 1.
La intervención se realiza en quirófano y bajo anestesia general.
- 2.
La bomba de circulación extracorpórea (CEC) se encuentra siempre disponible y preparada para entrar en funcionamiento en caso de que exista una emergencia derivada de una complicación y se deba cambiar a cirugía convencional. Este punto es de especial importancia, sobre todo en la medida en que la edad indicada de los pacientes es cada vez menor y, por tanto, son pacientes operables.
- 3.
La intervención también se realiza bajo control ecocardiográfico transesofágico, para evaluar el nivel de altura de la prótesis, o la presencia de fugas periprotésicas de forma más fidedigna. Este control ofrece la posibilidad de valorar posibles inconvenientes o complicaciones durante el procedimiento.
- 4.
A diferencia de otros accesos vasculares para TAVI, resulta primordial contar con oximetría cerebral (INVOS™) que permita la monitorización intraoperatoria continua, en tanto que vamos a pinzar una de las carótidas.
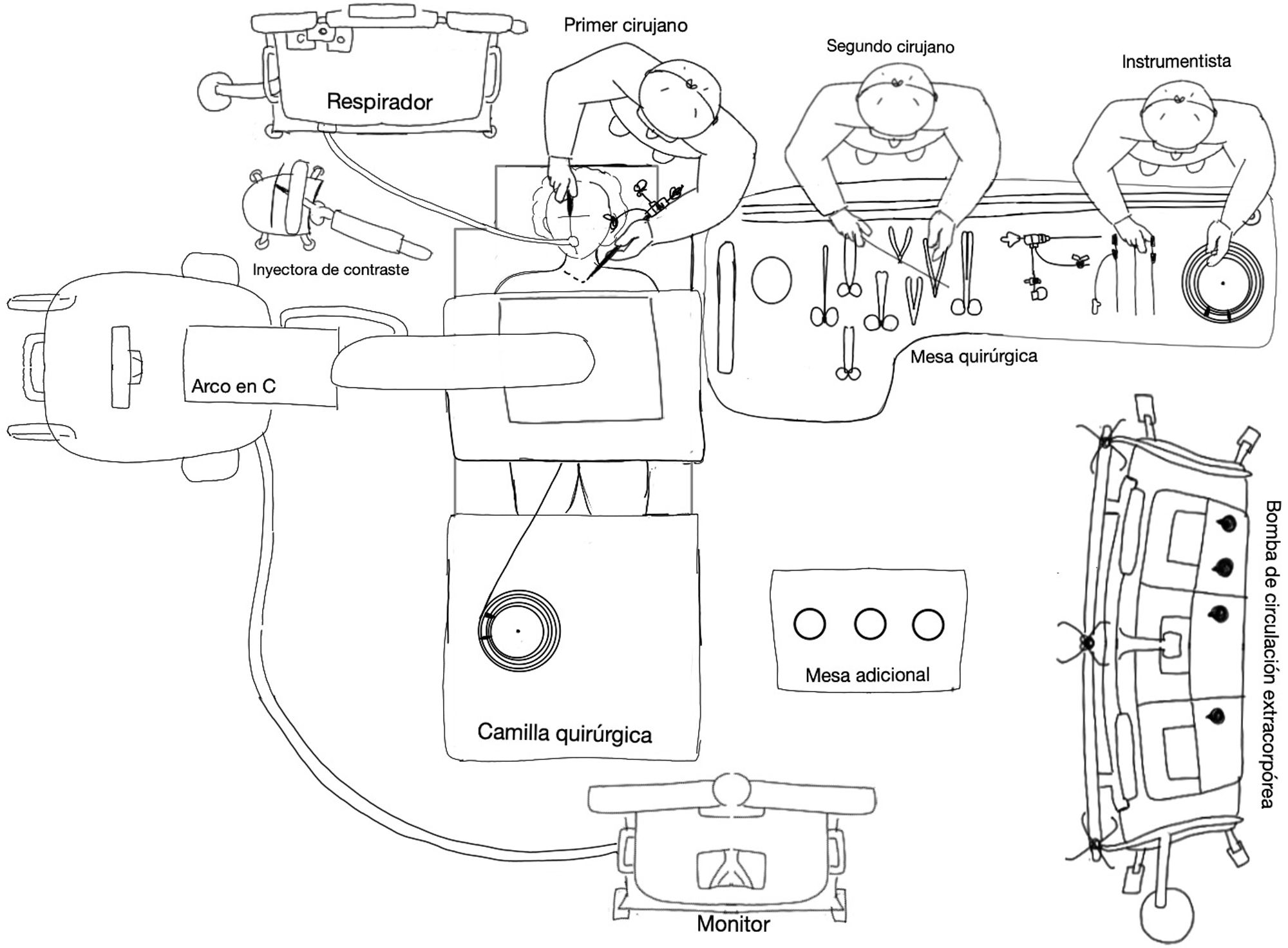
Como sucede en todo procedimiento transcatéter, se debe contar con un equipo de rayosX. En nuestro caso, utilizamos un equipo tipo arco móvil (Siemens™ Cyos Alpha) con software específico para TAVI.
La mesa quirúrgica estéril debe ser de tipo larga rectangular (fig. 2), perpendicular a la cabeza del paciente, para mejor manejo del instrumental, guías y catéteres.
Técnica quirúrgicaLa intervención quirúrgica debe ser realizada por ambos cirujanos simultáneamente.
- •
Primer cirujano. Se sitúa de frente a la cabeza del paciente y realiza las siguientes acciones:
- 1.
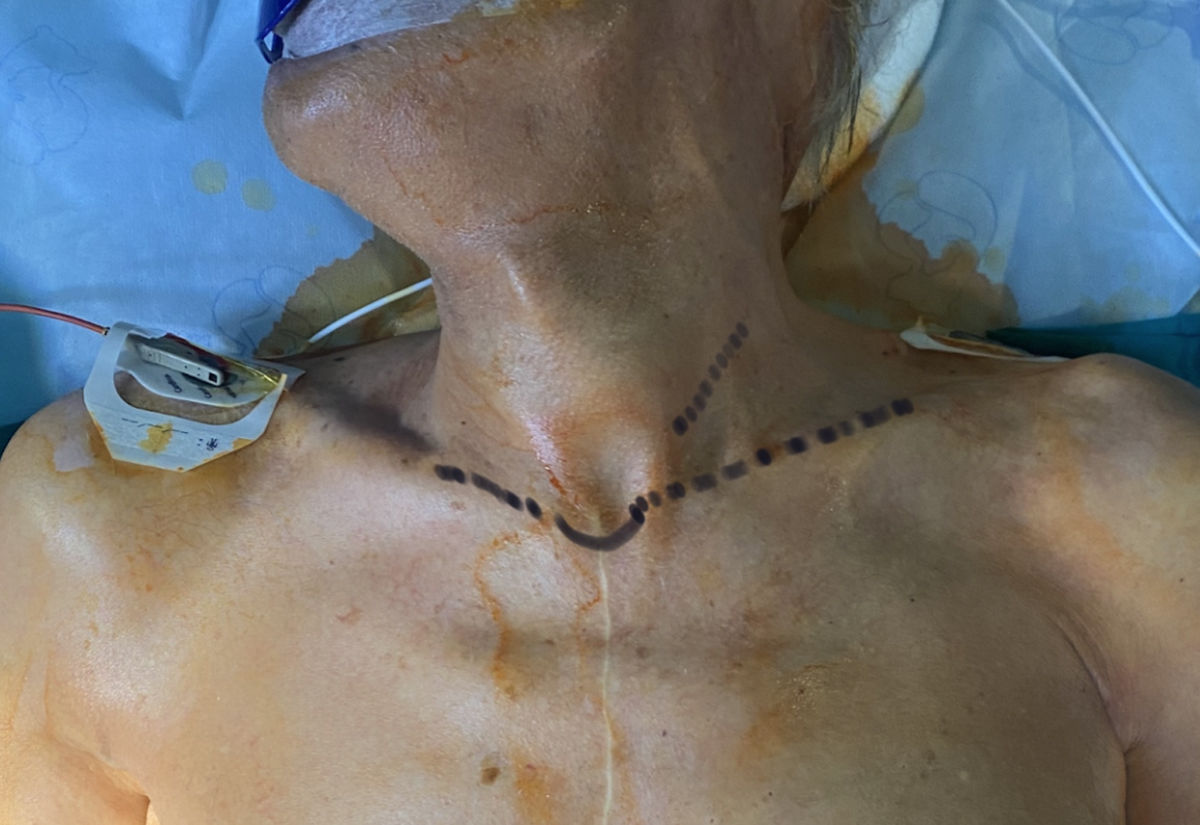
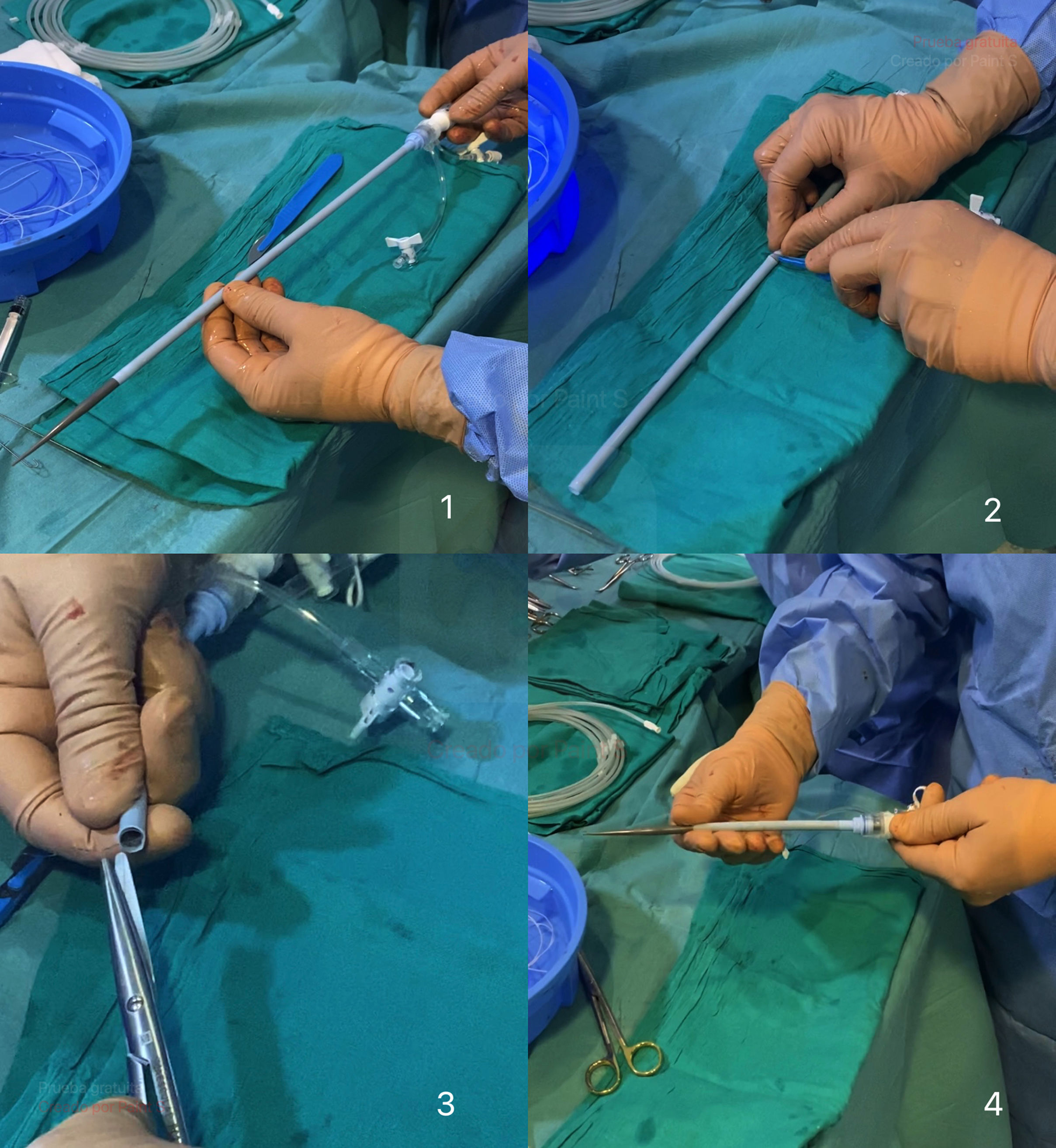
Incisión (fig. 3) entre uno (1) y tres (3) cm por encima de la clavícula izquierda, de un largo aproximado de 5cm, sobre el borde anterior del esternocleidomastoideo (ECM).
- 2.
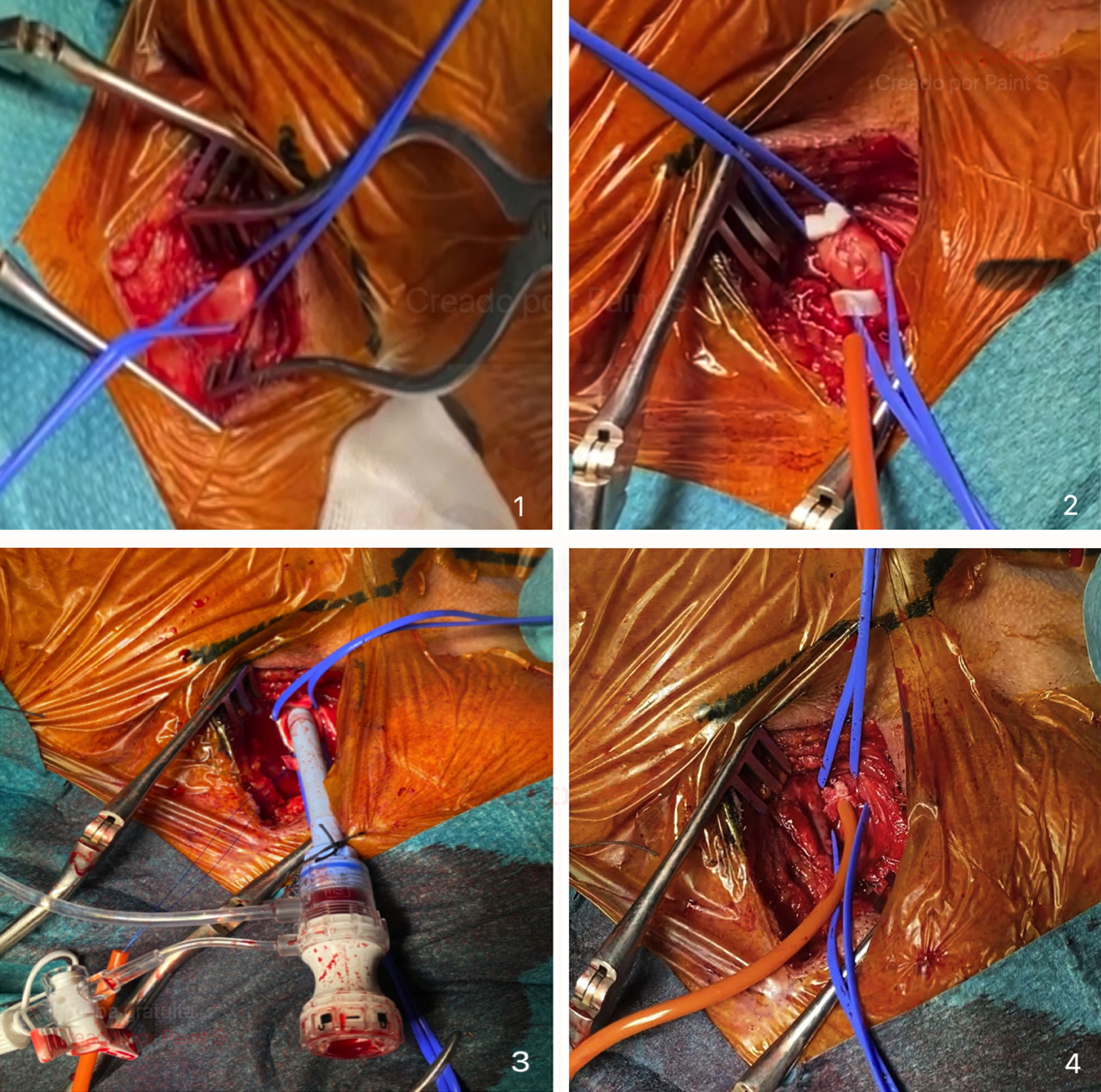
Disección por planos, en el siguiente orden: a)tejido celular subcutáneo; b)músculo platisma, y c)disección roma de ECM, con la ayuda de separador de Adson, de forma que el ECM se tracciona lateralmente y se abre el paquete vasculonervioso. Se diseca la arteria carótida común (ACC) separándola con delicadeza de la vena yugular interna, hacia la cara externa de la misma (en algunos casos es útil la ligadura de vena facial o tronco tiroideo facial, si cruza la línea media).
- 3.
Control de ACC (fig. 4) utilizando dos (2) vessel loop. Exponemos el vaso y realizamos una bolsa de tabaco en el eje longitudinal a la arteria, utilizando un monofilamento 4-0, de una longitud aproximada de 10mm y una separación de 2mm, el diámetro justo para poder colocar la aguja de 18G y la guía para el introductor inicial (5F). En la utilización de esta bolsa no hemos registrado ninguna complicación de tipo estenosis al finalizar el procedimiento.
- 4.
Prueba de circulación colateral cerebral. Se procede al pinzamiento durante cinco (5) minutos de la carótida expuesta, evaluando mediante oximetría cerebral/somática (INVOS™ Somanetics de Medtronic) la compensación del hemisferio ipsilateral, gracias a la circulación colateral cerebral y del polígono de Willis. Hacemos especial hincapié en esta sección de la técnica, dado que, en nuestro centro, no se utiliza estudio preoperatorio de circulación cerebral.
Solo en un caso de nuestra serie la oximetría del lado homolateral bajó más del 20% del valor inicial, y nos planteamos utilizar shunt. Finalmente decidimos no utilizarlo, y seguimos el implante sin consecuencia alguna para el paciente. Por lo que en la actualidad seguimos sin haber utilizado en ningún caso el shunt de carótida para estos procedimientos que son relativamente rápidos, incluso más que los implantes transfemorales, al minimizarse la navegación con catéteres y estar a corta distancia de la válvula aórtica.
- 1.
- •
Segundo cirujano. Se encuentra inicialmente situado a nivel de la pelvis del paciente o del brazo contralateral, dependiendo de los accesos vasculares que se utilicen para subir el pigtail de referencia, y realiza las siguientes acciones:
- 1.
Punción de arteria femoral común o radial izquierda mediante técnica de Seldinger, bajo control ecocardiográfico. También es plausible la realización de la punción en arteria humeral, para colocación de introductor 6F.
- 2.
Subida de guía teflonada curva hasta válvula aórtica y colocación, en el seno no coronariano, el catéter pigtail que nos servirá como referencia anatómica e inyección de contraste. En este punto, podemos realizar aortografía de referencia para evaluar posición del pigtail, la altura de las coronarias y el grado visible de regurgitación valvular, si se trata de una doble lesión.
- 3.
Punción venosa femoral contralateral, a modo de protección en caso de complicación y entrada con emergencia en CEC. Durante el procedimiento dejamos introducida una guía teflonada larga para canular el eje iliocavo-femoral.
- 4.
Punción venosa ipsilateral, colocación de vía central (útil para anestesiología) y colocación de marcapasos transitorio bajo control radioscópico, para estimulación rápida durante el procedimiento, y que mantendrá el paciente durante las primeras 24-48 horas del postoperatorio. En caso de presentar bloqueo AV de alto grado permanente, se retira el marcapasos transitorio, tras la colocación de un marcapasos definitivo. Este punto puede ser realizado por anestesiología, por vía subclavia derecha, previo al inicio del procedimiento, a elección del equipo quirúrgico.
- 1.
A continuación detallamos el procedimiento de implante de la prótesis.
- 1.
Mediante técnica de Seldinger, colocamos un introductor 5F dentro de la bolsa de tabaco. Posteriormente, introducimos una guía teflonada curva hasta la válvula aórtica y avanzamos con un catéter Boston Amplatz Left (AL1) para acercarlo y orientarlo hacia el orificio valvular.
- 2.
Tras intercambiar por una guía recta bien sea teflonada o hidrofílica, atravesamos la válvula aórtica estenótica, tratando de sincronizar el movimiento de la guía con la sístole cardiaca, para lograr atravesar en un latido. Para ello solemos utilizar el catéter AL1; podemos hacer el intercambio por un catéter AL2 o un Judkins right 4 (JR), útiles en válvulas aórticas más verticalizadas al cambiar la angulación (8).
- 3.
Una vez atravesada, avanzamos el catéter al interior del ventrículo. En este punto, es importante recalcar la importancia del reflujo de sangre a través del catéter, para asegurarnos que se encuentra en la cavidad ventricular y que no está haciendo pared con el endocardio. Debemos prestar especial cuidado en esta maniobra, ya que puede causar una elevada tasa de arritmias por la manipulación endocárdica.
- 4.
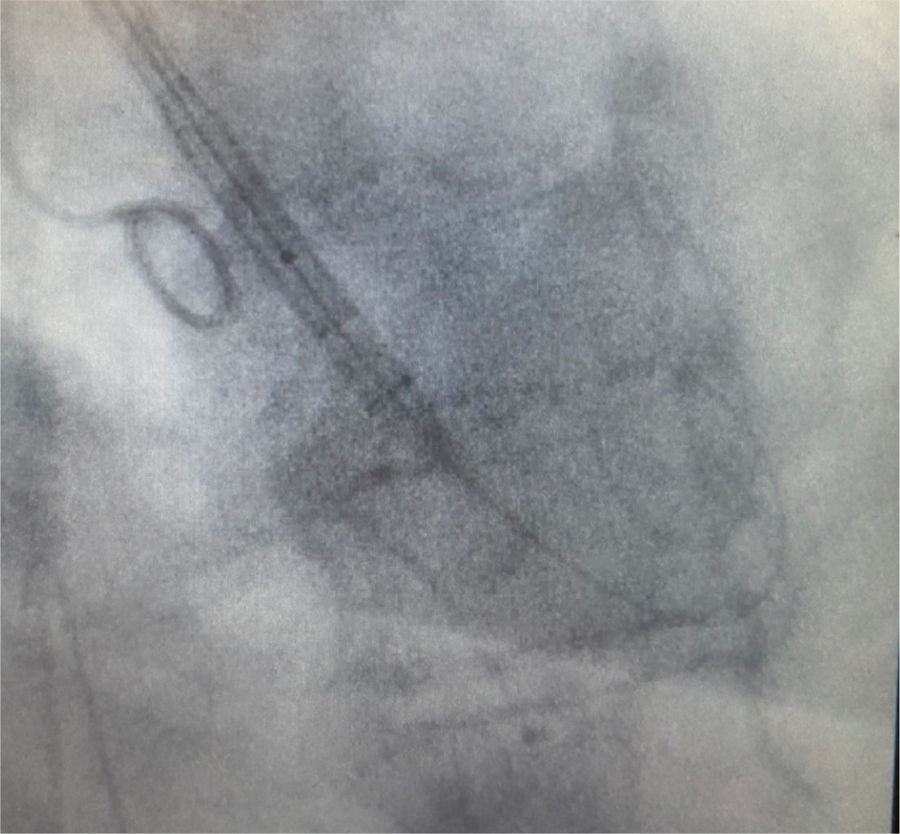
Sustituimos la guía teflonada recta por una de alto soporte preformada. En nuestro caso, utilizamos Boston Safari™. Al introducirla por el catéter, obtenemos su característica forma de caracol (fig. 5).
- 5.
Cambiamos el introductor. Retiramos el introductor de 5F, dejando la guía rígida, por medio de la cual colocamos un introductor de Gore (Dry Seal™). El tamaño dependerá del tamaño de la prótesis (18F o 20F), en los casos de prótesis Navitor 23-25 y Navitor 27,29, respectivamente.
En nuestro centro, al ser el acceso carotídeo más corto y más cercano a la válvula aórtica, cortamos el introductor con bisturí para lograr una longitud de 13-15cm y, por tanto, mayor comodidad a la hora de la manipulación (fig. 6). La colocación del introductor debe ser en eje longitudinal a la arteria, ayudándonos con bisturí del n.°11 para lograr una apertura controlada del vaso, punto clave para la hemostasia posterior.
- 6.
Dilatación previa con balón, en el supuesto de ser requerido en el caso (útil en válvulas muy calcificadas). En nuestro centro utilizamos catéter de valvuloplastia OPSIKA VACSII™ compliante, para lo cual usamos como medida del balón el diámetro mínimo medido por reconstrucción 3D en el estudio del caso. Realizamos la valvuloplastia durante estimulación rápida con el marcapasos transitorio a 160-180lpm.
- 7.
Introducción del delivery del dispositivo. Se progresa en dirección a la válvula aórtica, utilizando como referencia el pigtail, que siempre debe quedar posicionado en el nadir del seno no coronariano, hasta situar el punto de referencia inferior de la válvula aproximadamente 1-2mm por debajo del pigtail. Durante el despliegue la prótesis tiende a bucear hacia el ventrículo y quedar finalmente a 3-5mm, que es nuestro objetivo.
- 8.
En nuestro centro utilizamos estimulación moderada (120-140) en las prótesis autoexpandibles, para tener una presión arterial sistólica en torno a 80, puesto que, aunque no es estrictamente necesario, en nuestra experiencia, ayuda a un mejor control del despliegue de la prótesis. Este tipo de prótesis tiene dos fases de despliegue. La primera fase se hace progresiva y lenta, y es parcial hasta alcanzar el 70%. En este punto la prótesis es funcionante (es decir, produce estabilidad hemodinámica en el paciente, permite al cirujano mantener la calma y, en caso de que la posición no sea la deseada, o se evidencie una altura inadecuada, nos permite plegar nuevamente y re-colocarla).
Si estamos conformes con la posición, continuamos con la segunda fase del despliegue.
Este sería ya el punto «de no retorno».
El objetivo de este despliegue es que la prótesis quede entre 3 y 5mm por debajo del anillo aórtico nativo.
En el caso de prótesis o balón expansible el sistema de implante es diferente y es obligatorio utilizar estimulación rápida en los casos que utilicemos una válvula balón expandible (Sapien Edwards™, MyValve Meril™), donde además se realiza inyección de contraste durante el despliegue. Estas prótesis tienen una desventaja: no tienen posibilidad de re-colocación una vez implantadas, y el objetivo en altura es diferente. Se deben dejar un 40% en ventrículo izquierdo (VI), 60% en aorta o 30/70, aunque la tendencia actual y de nuestros últimos casos es dejarlas más altas, 20/80.
- 9.
A continuación hacemos control del resultado. Mediante ecocardiografía transesofágica y arteriografía directa, evaluamos la posición de la prótesis y si hay presencia o no de fugas periprotésicas.
Si utilizamos una prótesis Navitor™ y Evolut, para fugas leves, en nuestra experiencia, es conveniente esperar unos 5 o 10 minutos y reevaluar, puesto que tienen una cubierta externa que se amolda al tracto de salida del ventrículo izquierdo (TSVI) para reducción de fugas periprotésicas.
En caso de fugas medio-severas se puede optar por post dilatación con balón, para la cual no retiramos la guía de soporte, evitando así tener que introducir nuevamente una guía teflonada o pigtail por la prótesis recién implantada. En este supuesto se repetiría lo explicado en el paso 6.
- 10.
Retirada del sistema de liberación de guías y catéteres. Como en cualquier otro procedimiento endovascular, retiramos el sistema de liberación de la prótesis teniendo en cuenta que la nariz del mismo no choque con la prótesis implantada, ya que podría engancharse y movilizarse inadvertidamente.
Así mismo debemos recoger el sistema, aunque en los casos que usamos introductor Dryseal™ podemos obviar este paso, pues todo el acceso queda protegido por el introductor.
Finalmente retiramos el introductor, cerrando la bolsa de tabaco, y evaluamos la permeabilidad de la arteria por palpación, y si fuera necesario o tuviéramos dudas, haciendo angiografía con el pigtail o bien canalizando la carótida selectivamente. Realizamos control de hemostasia y cierre por planos con sutura intradérmica para mejor resultado estético. Si la vía para subir el pigtail fue femoral, se suele hacer cierre percutáneo de este vaso con Angioseal™.
Todos los pacientes que forman parte del presente estudio firman con carácter previo un consentimiento informado que incluye, entre otras cuestiones, el uso de imágenes con fines docentes o de difusión del conocimiento científico.
ResultadosNuestro servicio comenzó su programa de TAVI propio en 2011. Hasta diciembre del año 2023, llevamos implantados 379 prótesis, siendo 79 de ellas por vía transcarotídea (21,43%), con nula mortalidad intraoperatoria y una mortalidad menor al 1% durante el primer mes de intervención. A día de hoy, la incidencia de ictus establecidos en estos pacientes es del 0%.
DiscusiónSegún el último Registro de Hemodinámica y Cardiología Intervencionista en España, en el año 20219 se implantaron un total de 5.270 prótesis transcatéter, siendo el 94% por vía transfemoral derecha, mientras que, en el mismo año, los resultados del Registro de Intervenciones de la Sociedad Española de Cirugía Cardiovascular y Endovascular (RECC)10 indican que los implantes por vía «no femoral» en nuestro país cayeron a 654, siendo el 84% de ellos por vía transaxilar o transcarotídea, y el 16% por vía transapical o transaórtica. Como puede verse, existe una gran diferencia entre el número de implantes de prótesis transcatéter por vía transfemoral o por vía no femoral, consecuencia de la situación desigual y la falta de consenso en el Heart Team para la toma de decisiones.
ConclusionesA continuación, recogemos las principales conclusiones que hemos extraído, en nuestro centro, en torno al uso de la vía transcarotídea:
- 1.
Hemos adoptado la vía transcarotídea como una alternativa igualmente válida al acceso transaxilar (y en algunas ocasiones preferencial sobre ella y con mejores resultados), cuyo uso dependerá de las características individuales de cada paciente, y de la evaluación por separado de cada una de sus arterias, para lo cual el estudio preoperatorio resulta esencial. No existe una vía única que se pueda estandarizar para todos los pacientes y, por tanto, no debemos adaptar el paciente a la vía de acceso, sino la vía de acceso a cada paciente8.
- 2.
Al igual que sucede con la vía transaxilar, la vía transcarotídea debe abordarse quirúrgicamente, ya que el acceso representa un agresión mínima, en este caso con disección solo de piel y tejido celular subcutáneo y sin sección de músculos, siempre bajo visión directa para el control del vaso; además, las posibles curvas que pudieran verse en la TAC son absolutamente salvables, ya que es una arteria sin sustentación y simplemente traccionando del vessel loop distal se corrigen las tortuosidades.
- 3.
Creemos que la carótida en un vaso alternativo a la femoral y en algunos casos preferible en pacientes con acceso femoral favorable pero con tortuosidades y elongaciones de las iliacas y la aorta torácica, que complican y hacen menos predecible el implante óptimo de la prótesis, por las dificultades de navegación y control del implante a mucha distancia. El acceso carotídeo nos permite la transmisión directa de movimiento sobre el sistema de liberación y un control muy exacto de su posición. Solo un estudio comparativo a doble ciego nos sacaría de estas dudas.
- 4.
Creemos de vital importancia la implicación del cirujano cardiovascular en el proceso de toma de decisiones y de implante de TAVI, siendo necesario realizar el implante en quirófano para contar con esta «posibilidad de rescate». La tendencia es implantar válvulas transcatéter cada vez en pacientes de menor edad y de menor riesgo quirúrgico, dados los resultados de recientes estudios como el Evolut Low Risk11 o el PARTNER3. Y por ello el nivel de seguridad y la posibilidad de rescate toman una especial relevancia en estos pacientes de bajo riesgo.
El Dr. Miguel Ángel Gómez Vidal es proctor de Abbott y Edwards.