Existe controversia respecto a la técnica ideal de reconstrucción pancreático-yeyunal posresección duodeno-pancreática. La tutorización externa del Wirsung se ha considerado por muchos autores como una técnica con menor incidencia de fístulas y morbimortalidad. Analizamos nuestra experiencia con esta técnica.
Pacientes y métodosAnálisis retrospectivo de la morbimortalidad, de una serie de 80 pacientes consecutivos intervenidos, durante 6,5 años, por tumores pancreáticos cefálicos o periampulares realizando resección y pancreático-yeyunostomía con tutorización externa del Wirsung.
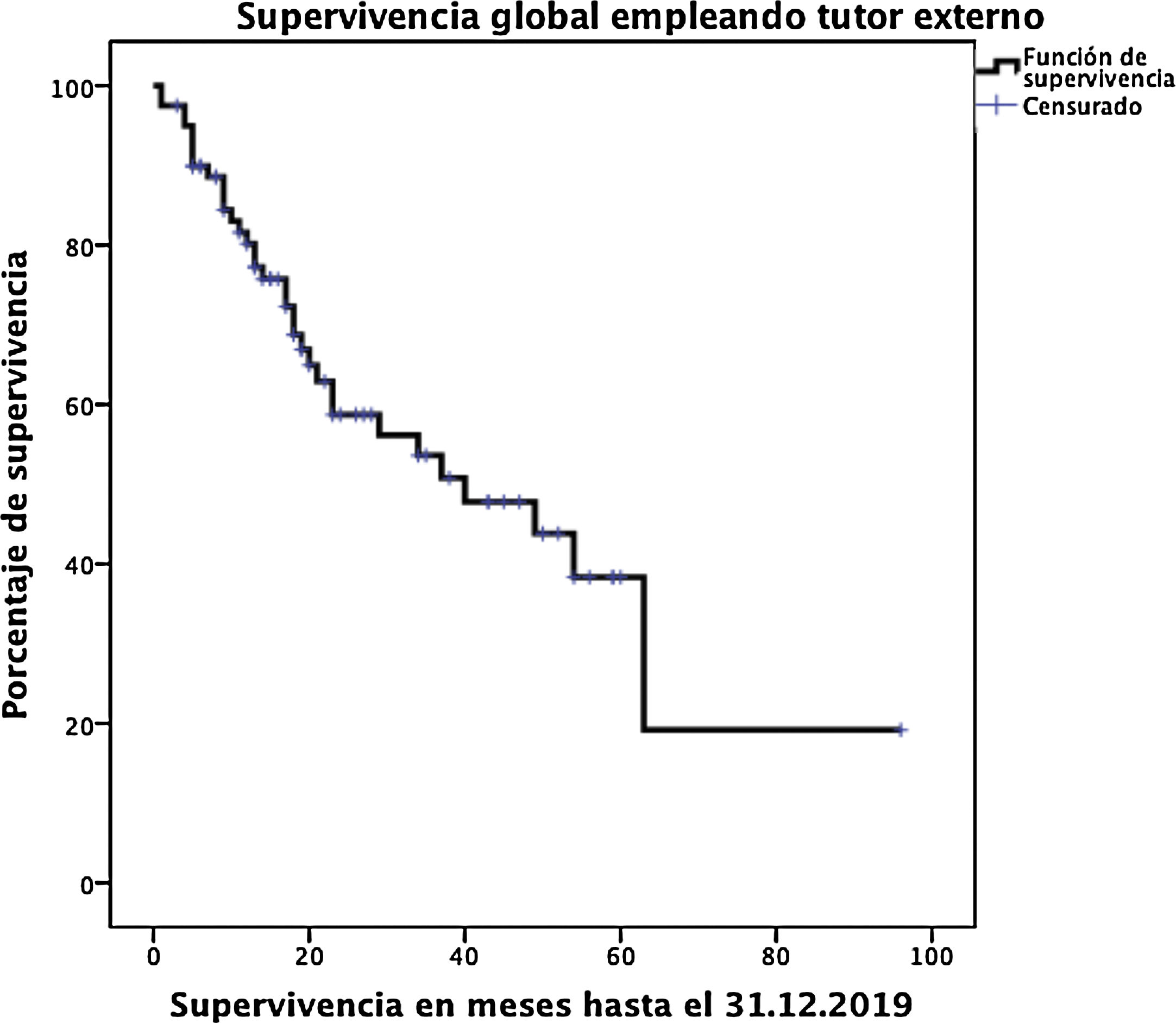
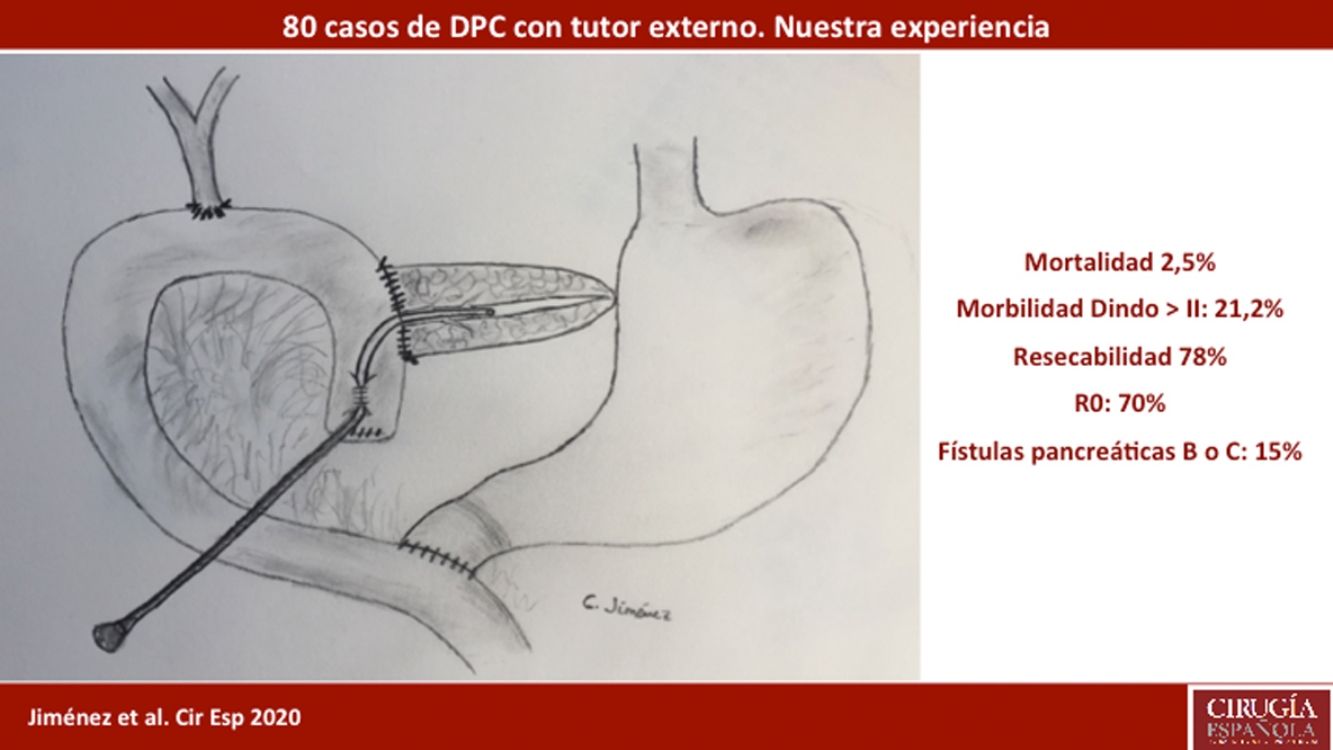
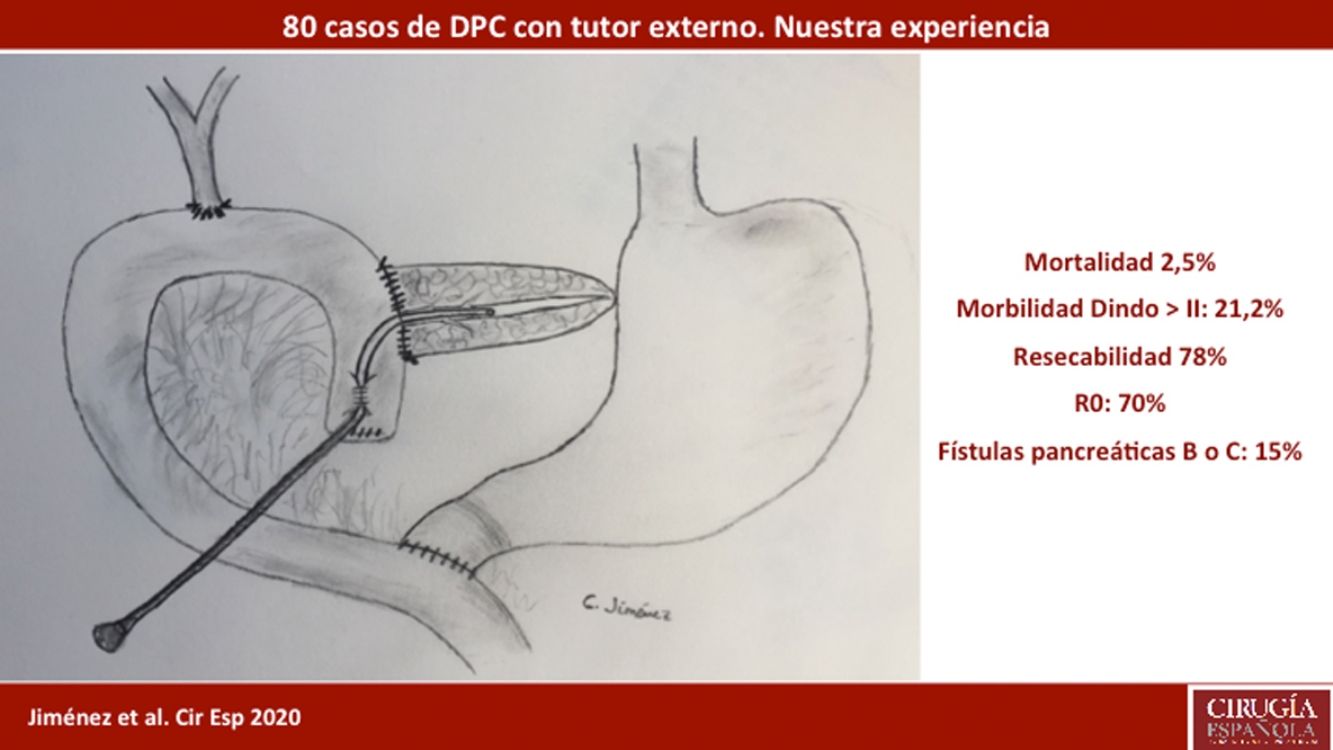
ResultadosLa edad media de los pacientes fue 68,3 ± 9 años y la tasa de resecabilidad del 78%. La consistencia del páncreas era blanda en 51,2% de pacientes y dura en 48,8%. Se preservó el píloro en 43,8%. El tumor más frecuente fue el adenocarcinoma (68,8%) y se consiguió un R0 en 70%. La fístula bioquímica se presentó en 11,2%, la fístula pancreática grado B en 12,5% y la C en 2,5%, mientras que la tasa de reintervención abdominal fue del 10%. La mediana de estancia hospitalaria fue de 16 días y la mortalidad postoperatoria y a 90 días fue del 2,5%. La tasa de retraso del vaciamiento gástrico fue del 36,3%, diabetes de novo del 12,5% e insuficiencia exocrina del 30%. La supervivencia a uno, tres y cinco años fue 80,2, 53,6 y 19,2%.
ConclusionesAunque nuestras tasas de morbimortalidad con la tutorización externa del Wirsung son bajas, coincidiendo con series más amplias recientemente publicadas, se precisa un análisis comparativo con otras técnicas reconstructivas, con más casos, para elegir la mejor opción después de una duodenopancreatectomía cefálica.
There is controversy regarding the ideal pancreaticojejunostomy technique after pancreaticoduodenectomy. Many authors consider the external Wirsung stenting technique to be associated with a low incidence of fistula, morbidity and mortality. We analyse our experience with this technique.
Patients and methodsA retrospective analysis of the morbidity and mortality of a series of 80 consecutive patients who had been treated surgically over a 6.5-year period for pancreatic head or periampullary tumors, performing pancreaticoduodenectomy and pancreaticojejunostomy with external Wirsung duct stenting.
ResultsMean patient age was 68.3 ± 9 years, and the resectability rate was 78%. The texture of the pancreas was soft in 51.2% of patients and hard in 48.8%. Pylorus-preserving resection was performed in 43.8%. Adenocarcinoma was the most frequent tumor (68.8%), and R0 was confirmed in 70% of patients. Biochemical fistula was observed in 11.2%, pancreatic fistula grade B in 12.5% and C in 2.5%, whereas the abdominal reoperation rate was 10%. Median postoperative hospital stay was 16 days, and postoperative and 90-day mortality was 2.5%. Delayed gastric emptying was observed in 36.3% of patients, de novo diabetes in 12.5%, and exocrine insufficiency in 3. Patient survival rates after 1, 3 and 5 years were 80.2, 53.6 and 19.2%, respectively.
ConclusionsAlthough our low rates of postoperative complications and mortality using external Wirsung duct stenting coincides with other more numerous recent series, it is necessary to perform a comparative analysis with other techniques, including more cases, to choose the best reconstruction technique after pancreaticoduodenectomy.
Debido a los avances en la técnica quirúrgica, manejo perioperatorio y centralización de la cirugía pancreática, en hospitales especializados con importante número de casos se ha conseguido que la mortalidad asociada a la duodenopancreatectomía cefálica (DPC) sea inferior al 5%1-6. Sin embargo, según recientes series, la morbilidad post-DPC sigue manteniéndose entre el 31 y 53%4-7, fundamentalmente a expensas de la incidencia de fístulas pancreáticas (FP) como complicaciones postoperatorias más graves, que se presentan del 17,8-34,9%5,6,8-13. A la hora de elegir una técnica derivativa pancreática-digestiva no se han observado diferencias significativas en cuanto a la incidencia de FP o morbilidad global al comparar la pancreático-yeyunostomía con la pancreático-gastrostomía14-16.
Como consecuencia de las FP pueden presentarse complicaciones como abscesos, peritonitis, sepsis o hemorragia intraabdominal, que se asocian con una estancia hospitalaria prolongada y mortalidad elevada17-19. La patogenia de las FP se atribuye a la filtración de la secreción exocrina pancreática a través de la anastomosis pancreático-yeyunal, siendo el mecanismo más probable la autodigestión y destrucción del tejido perianastomótico que conlleva una dehiscencia y filtración del contenido bilioentérico dentro de la cavidad abdominal20.
El objetivo de este estudio, descriptivo y retrospectivo, es analizar los resultados obtenidos en tumores de cabeza de páncreas y periampulares tratados mediante DPC y pancreático-yeyunostomía utilizando una tutorización externa del conducto de Wirsung.
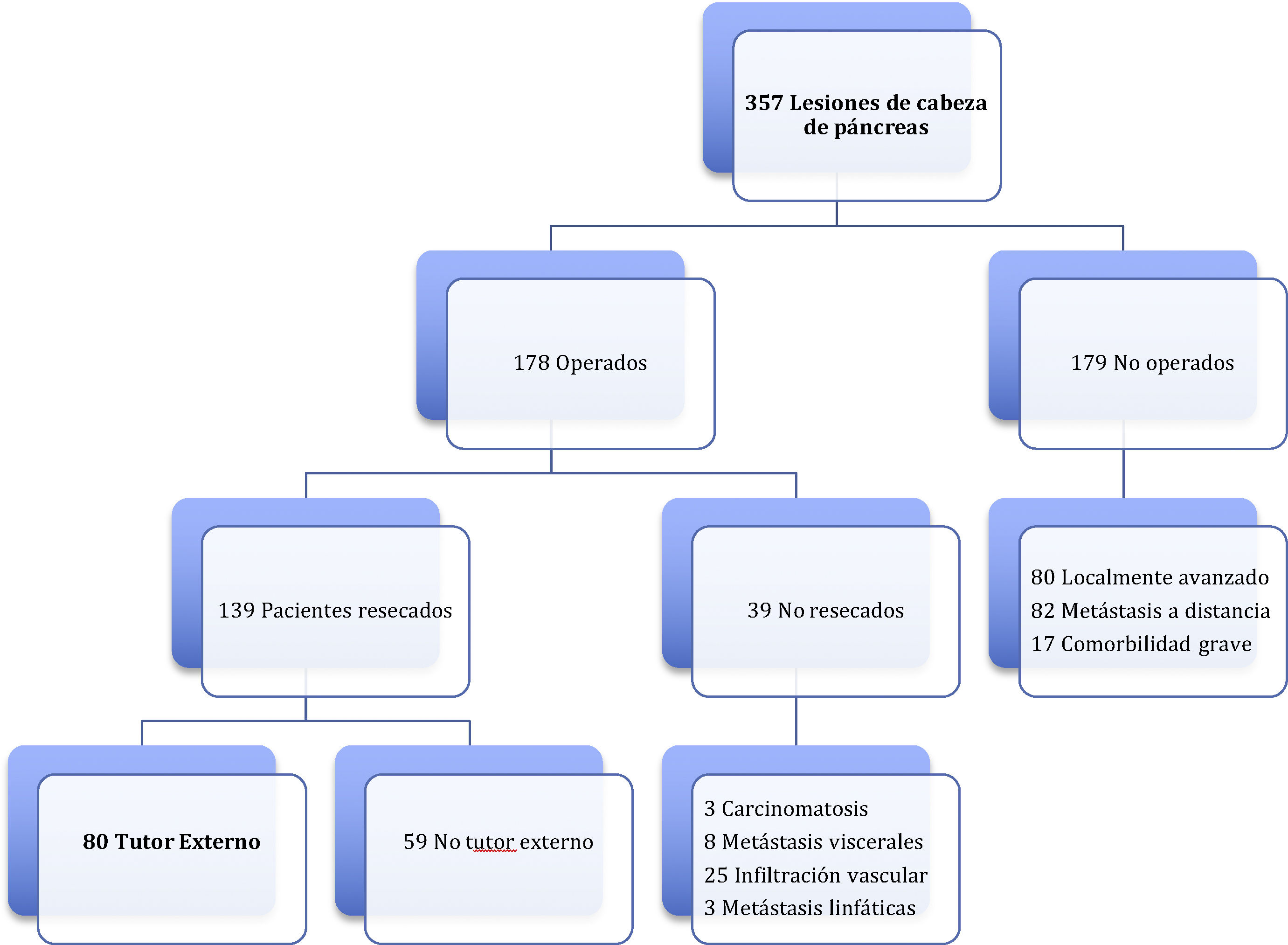
Pacientes y métodosDesde el 19 de enero de 2012 hasta el 31 de junio de 2019, en la Unidad de Cirugía HBP, se indicó una laparotomía con intención de realizar una DPC en 178 pacientes con lesiones de cabeza de páncreas, duodeno o región periampular. La DPC se llevó a cabo en 139 (78%) pacientes, realizándose la reconstrucción pancreático-yeyunal término-lateral con tutorización externa del conducto de Wirsung en 80 pacientes. Los 59 pacientes restantes resecados se manejaron con tutor interno o sin tutor. El presente estudio consiste en el análisis de una serie de 80 pacientes consecutivos, intervenidos por cuatro cirujanos de la Unidad de Cirugía HBP. La técnica de reconstrucción con tutor externo fue de libre elección por los cirujanos y sistemáticamente realizada en todos los casos con indicación de DPC, sin excluir ningún paciente, aunque pudiera presentar un potencial riesgo de FP. El seguimiento mínimo de la serie es de siete meses post-DPC.
Protocolo diagnóstico preoperatorioDesde que se inicio esta serie ha habido ciertos cambios en cuanto a utilización de pruebas diagnósticas, aunque básicamente para el diagnóstico y estadificación se ha realizado una tomografía axial computarizada (TAC) a casi todos los pacientes, complementando con colangiopancreatorresonancia magnética (CRM), ecoendoscopia, así como colangiopancreatografía retrógrada endoscópica (CPRE) y colangiografía transparietohepática (CTPH) para drenaje biliar. Actualmente, en líneas generales el protocolo estandarizado para tumores pancreáticos, periampulares y de vía biliar distal consiste en: TAC toraco-abdomino-pélvico y/o CRM, ecoendoscopia y biopsia y marcadores tumorales (CEA y CA.19.9), utilizando para drenaje biliar la CTPH y la CPRE para drenar la vía biliar y diagnóstico de lesiones periampulares.
Técnica quirúrgicaEn todos los pacientes se realizó una laparotomía media supraumbilical, colecistectomía, sección de la unión del conducto hepático común con el colédoco y resección de cabeza de páncreas y duodeno incluyendo además unos 15 cm del yeyuno proximal. En patología maligna se efectuó una linfadenectomía del ligamento hepatoduodenal, arteria hepática común y vertiente lateral derecha de la arteria mesentérica superior. Cuando el tumor estaba alejado del duodeno se realizó preservación pilórica, o una antrectomía si el tumor estaba próximo al duodeno. En casos de infiltración tumoral de vena porta o vena mesentérica superior se efectuó una resección venosa segmentaria y anastomosis término-terminal sin interposición de injerto.
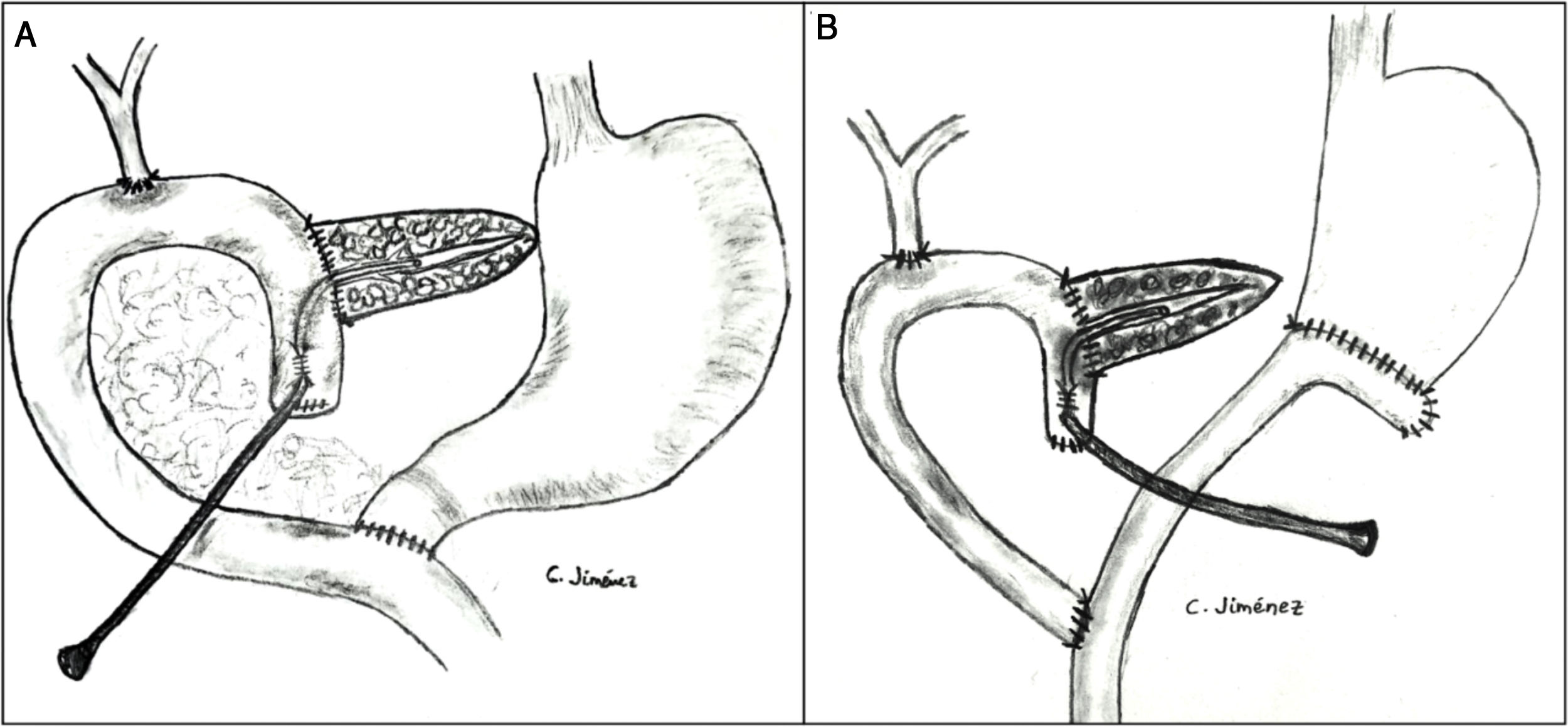
La pancreático-yeyunostomía se realizó en dos planos: el interno suturando la mucosa del Wirsung con la mucosa yeyunal mediante 6-8 puntos entrecortados con material reabsorbible, monofilamento (poligluconato de 5/6-0), y el externo mediante puntos entrecortados de polipropileno de 3/4-0, que atraviesan el parénquima pancreático y 0,5 cm de la seromuscular del asa yeyunal, sin invaginación del páncreas dentro del yeyuno. El extremo del tutor transanastomótico [sonda uretral cilíndrica de polivinilo (Drenoplex-DICLISA®), con tres orificios distales, de 2,0-390 mm, calibres 6 u 8, dependiendo del diámetro del Wirsung] se introdujo unos 4-5 cm en el conducto de Wirsung, pasando a la luz yeyunal y exteriorizándolo después a través del asa yeyunal aferente proximal ascendida, fijándose la salida intestinal del tutor según técnica de Witzel. El extremo distal del catéter se exteriorizó a través de la pared abdominal anterior izquierda, donde se fijó con dos puntos de seda 3/0 (fig. 1A). Una vez descartada una FP mediante un nivel de amilasa < 400 UI por el orificio de drenaje de Penrose, y antes del alta, se tapona el tubo de tutorización del Wirsung hasta su extracción en la consulta ambulatoria a las 5-6 semanas de la cirugía.
La reconstrucción clásica de Child (con un asa yeyunal) se realizó en 65 casos y la técnica con dos asas en 15 casos. La anastomosis hepático-yeyunal se confeccionó a 10-15 cm de la pancreática con puntos entrecortados de poligluconato, de 4/5-0. La anastomosis duodeno-yeyunal o la gastro-yeyunal se realizó a unos 55-60 cm de la bilio-yeyunal, en posición término-lateral, en dos planos (interno con sutura continua de poligluconato 4/0 y externo con continua de polipropileno 4/0). Por otro lado, la reconstrucción con dos asas es igual a la anterior en cuanto a la anastomosis pancreática y biliar, difiriendo de la anterior en que, después de una antrectomía, se hizo una anastomosis gastroyeyunal término-lateral y, a 70 cm de esta y de la bilio-yeyunal, se efectuó otra anastomosis yeyuno-yeyunal término-lateral, en Y, con la intención de evitar el reflujo de la secreción pancreático-yeyunal hacia el estómago (fig. 1B).
El drenaje de la cavidad abdominal se realizó con dos Penrose (uno por encima y otro por debajo de la anastomosis pancreática), que se exteriorizaron por flanco derecho y flanco izquierdo, respectivamente.
Manejo postoperatorio y seguimientoLos pacientes permanecieron entre 24-48 horas en reanimación después de la cirugía. La profilaxis antibiótica se realizó con 2 g de cefazolina iv. En los pacientes con prótesis biliares, ictericia o colangitis se realizó tratamiento con piperacilina + tazobactam 4/0,5, iv, cada seis horas durante cinco días.
Los drenajes intraabdominales se retiraron a partir del 5°-6° día, siempre en ausencia de fístula, hemorragia o infección y con cifras de amilasa < 400 UI.
Las fístulas pancreáticas se han clasificado según la actualización del ISGPF21: grado A o fístulas bioquímicas (FB); grado B (precisan cambio de tratamiento o drenaje percutáneo de colecciones) y grado C (presentan inestabilidad clínica y desembocan en fallo orgánico y/o mortalidad, precisando drenaje de colecciones o reintervenciones). Las fístulas biliares se definieron según los criterios de Burkhart et al.22. La hemorragia post-DPC se clasificó según la definición del ISGPS23 y el retraso del vaciamiento gástrico (RVG) post-DPC según los criterios de Wente el al.24. Se registraron las complicaciones según la clasificación de Clavien et al.25. Se realizaron revisiones al mes y después cada tres meses.
Análisis estadísticoLas variables cualitativas se expresaron mediante números absolutos y frecuencias relativas en forma de porcentaje. Las variables cuantitativas con distribución normal se expresaron mediante la media y la desviación estándar y, cuando la distribución no era normal, se utilizó la mediana y los percentiles 0 y 100. Previamente se estudió la normalidad de las variables cuantitativas mediante el test de Kolmogorov-Smirnov. La relación entre variables cuantitativas se analizó mediante la prueba t de Student en caso de distribución normal y, en caso de incumplir la normalidad, se utilizó la prueba de Mann-Whitney. La supervivencia de los pacientes se calculó según el método actuarial de Kaplan-Meier. El valor de p < 0,05 se consideró estadísticamente significativo.
ResultadosLa edad media fue de 68,3 ± 9 años y el 97,5% presentaba un ASA II-III. En cuanto a la clínica se destacó la presencia de ictericia en 56 (70%) pacientes, dolor abdominal en 43 (53,8%), pérdida de peso en 42 (52,5%), colangitis en 15 (18,8%) y pancreatitis en siete (8,8%). Las pruebas diagnósticas y sus hallazgos, así como los valores analíticos antes de la cirugía se muestran en la tabla 1. Previamente a la cirugía se colocó una prótesis metálica en 12 (15%) pacientes, una prótesis plástica en 11 (13,8%) y un catéter interno-externo en siete (8,8%). La tasa de resecabilidad global entre los pacientes con indicación quirúrgica fue del 78%, desestimándose la resección por los motivos indicados en el diagrama de flujo (fig. 2). En relación con las variables perioperatorias, se transfundieron nueve (11,3%) pacientes con una mediana de 800 mL, hallándose un páncreas de consistencia blanda en 41 (51,2%) y dura en 39 (48,8%). Se realizó una pancreático-yeyunostomía y drenaje abdominal con dos Penrose en todos los pacientes, preservación pilórica en 35 (43,8%), tratamiento con nutrición parenteral en 78 (97,5%) y con octreotida en 14 (17,5%) pacientes con FP fundamentalmente de grado B o C, en los cuales no se observó mejoría. No se realizó profilaxis con octreotida en ningún caso. El tumor más frecuente fue el adenocarcinoma (68,8%), seguido del colangiocarcinoma (7,5%), tumor neuroendocrino (6,3%) y neoplasia mucinosa papilar intraductal (6,3%). Con una mediana de 15 ganglios linfáticos aislados en la pieza resecada, se detectaron metástasis en 47 (58,8%) pacientes. El grado de invasión tumoral del páncreas, ganglionar, neural y vascular, y tasa de resección portal se reflejan en la tabla 2. Una resección R0 se consiguió en 56 (70%) pacientes.
Características y datos preoperatorios
| Edad (años) | 68,3 ± 9 |
| Sexo (H/M) | 42 (52,5%) /38 (47,5%) |
| ASA | |
| I | 1 (1,3%) |
| II | 33 (41,3%) |
| III | 45 (56,3%) |
| IV | 1 (1,3%) |
| IMC (kg/m2) | 26,9 ± 5 |
| Antecedentes personales | |
| Cardiovascular | 46 (57,5%) |
| HTA | 36 (45%) |
| Fumador | 19 (23,8%) |
| DMID | 15 (18,8%) |
| Bebedor | 13 (16,3%) |
| Clínica | |
| Ictericia | 56 (70%) |
| Dolor abdominal | 43 (53,8%) |
| Pérdida de peso | 42 (52,5%) |
| Hallazgo incidental | 16(20%) |
| Colangitis | 15 (18,8%) |
| Obstrucción duodenal | 7 (8,8%) |
| Pancreatitis | 7 (8,8%) |
| HDA | 5 (6,3%) |
| Pruebas diagnósticas. Hallazgos | |
| TAC | 77 (96,3%) |
| RM | 48 (60%) |
| Invasión vascular (imagen) | 9 (11,3%) |
| VMS | 6 (7,5%) |
| AMS | 1 (1,3%) |
| AH | 1 (1,3%) |
| Vena porta | 1 (1,3%) |
| Tamaño máximo tumor (cm) | 2,5 (0,6-5,) |
| Calibre de vía biliar (cm) | 1,1 (0,3-2,5) |
| Calibre del Wirsung (mm) | 4 (2-10) |
| CPRE precirugía | 35 (43,8%) |
| CTPH precirugía | 13 (16,3%) |
| Ecoendoscopia y biopsia | 42 (52,5%) |
| Prótesis metálica previa | 12 (15%) |
| Prótesis plástica previa | 11 (13,8%) |
| Catéter interno-externo previo | 7 (8,8%) |
| Laboratorio (pre-cirugía) | |
| Hemoglobina (g/dL) | 13,2 ± 1,2 |
| Plaquetas ×103 | 242 (59-431) |
| INR | 1,02 ± 0,13 |
| Creatinina (mg/dL) | 0,74 ± 0,17 |
| Glucemia (mg/dL) | 121 ± 41 |
| Albúmina (g/dL) | 4,1 (2,5-4,8) |
| Bilirrubina total (mg/dL) | 1 (0,2-16,2) |
| CA 19-9 (U/mL) | 43 (0-1.420) |
| CEA (ng/mL) | 2,9 (0-831) |
| Quimioterapia neoadyuvante | 9 (11,2%) |
CPRE: colangiopancreatografía retrógrada endoscópica; CEA: antígeno carcinoembrionario; CTPH: colangiografía transparietohepática; DMID: diabetes mellitus insulinodependiente; HDA: hemorragia digestiva alta; HTA: hipertensión arterial; IMC: índice de masa corporal; RM: resonancia magnética; TAC: tomografía axial computarizada.
Datos perioperatorios e histológicos
| Tiempo de cirugía (h) | 6,4 ± 1 |
| Transfusión (núm. pacientes) | 9 (11,3%) |
| Volumen transfundido (mL) | 800 (400-2.400) |
| Consistencia del páncreas | |
| Duro | 41 (51,2%) |
| Blando | 39 (48,8%) |
| Pancreato-yeyunostomía | 80 (100%) |
| Reconstrucción con un asa intestinal | 65 (81,3%) |
| Reconstrucción con dos asas intestinales | 15 (18,8%) |
| Preservación pilórica | 35 (43,8%) |
| Drenajes de Penrose (2) | 80 (100%) |
| Citología intraoperatoria | 14 (17,5%) |
| Nutrición parenteral | 78 (97,5%) |
| Uso de octreotida | 14 (17,5%) |
| Amilasa por drenaje al tercer día (UI/L) | 31 (11-2.319) |
| Datos histológicos | |
| Histología tumoral | |
| Adenocarcinoma | 55 (68,8%) |
| Colangiocarcinoma | 6 (7,5%) |
| Neuroendocrino | 5 (6,3%) |
| Neoplasia mucinosa papilar intraductal (NMPI) | 5 (6,3%) |
| Tumor duodenal | 3 (3,8%) |
| Carcinoma in situ | 3 (3,8%) |
| Adenocarcinoma de células escamosas | 1 (1,3%) |
| Metástasis de cáncer renal | 1 (1,3%) |
| Pancreatitis crónica | 1 (1,3%) |
| Grado de diferenciación | |
| Bien diferenciado | 19 (23,8%) |
| Moderadamente diferenciado | 23 (28,8%) |
| Pobremente diferenciado | 15 (18,8%) |
| No valorable | 23 (28,8%) |
| Invasión T | |
| In situ | 3 (3,8%) |
| < 2cm | 10 (12,5%) |
| > 2 cm limitado al páncreas | 20 (25%) |
| Invasión peripancreática | 30 (37,5%) |
| Invasión tumoral peritronco celíaco o peri-AMS | 6 (7,5%) |
| Invasión ganglionar (N +) | 47 (58,8%) |
| N° ganglios resecados | 15 (4-42) |
| N° ganglios positivos | 1 (1-11) |
| Invasión neural | 43 (53,8%) |
| Invasión microvascular | 32 (40%) |
| Invasión macrovascular | 13 (16,3%) |
| Resección R0 | 56 (70%) |
| Resección hepática | 3 (3,8%) |
| Resección vascular | 10 (12,5%) |
| Vena mesentérica superior (parche de pared) | 5 (6,3%) |
| Vena porta (parche de pared) | 2 (2,5%) |
| Vena porta (cilindro completo de 1 cm) | 2 (2,5%) |
| Confluencia de AGD, AHC y AHP | 1 (1,3%) |
Se realizó una resección hepática mínima en cuña (máximo de 3 cm), hallándose una metástasis de pequeño tamaño en dos pacientes (previamente tratados con neoadyuvancia) y un hemangioma en otro.
Resección vascular por infiltración tumoral se realizó en 10 pacientes: vena mesentérica superior en cinco (parche de 1 cm en todos), vena porta en cuatro (parche de 1 cm en dos y resección de un cilindro de vena de aproximadamente 1 cm en otros dos con anastomosis portal término-terminal) y resección en un paciente de la confluencia de arteria gastro-duodenal, arteria hepática común y propia con posterior anastomosis término-terminal entre arteria hepática común y propia. Cuatro de estos pacientes se reintervinieron por hemorragia, pero ninguno desarrolló FP.
En 10 (12,5%) pacientes se presentó más de una complicación. Entre las complicaciones postoperatorias la FB (antes denominada FP grado A) se presentó en nueve (11,3%) pacientes, FP grado B en 10 (12,5%) y FP grado C en dos (2,5%). En páncreas de consistencia dura la FB se presentó en un (2,4%) caso frente a ocho (20,5%) en páncreas de consistencia blanda (p = 0,02); mientras que la tasa de FP tipos B + C fue de cinco (12,2%) casos en páncreas de consistencia dura frente a siete (17,9%) en páncreas de consistencia blanda (p = 0,51).
La fístula biliar se observó en cinco (6,3%) pacientes: grado A en 1, B en tres y C en uno. Hemorragia postoperatoria la presentaron nueve (11,3%) pacientes: grado A en dos, B en cuatro y C en tres. La reintervención quirúrgica se indicó en ocho pacientes: cinco por hemoperitoneo no relacionado con FP, dos por FP y uno por evisceración, precisando siete (8,8%) pacientes el drenaje de una colección intraabdominal mediante TAC-punción. La mediana de la estancia hospitalaria fue 16 días y la mortalidad hospitalaria fue 2,5% (dos pacientes). Se realizó neoadyuvancia en nueve (11,2%) pacientes y quimioterapia adyuvante en 38 (47,5%), detectándose insuficiencia exocrina de novo en 24 (30%) e insuficiencia endocrina de novo en 10 (12,5%). También se diagnosticó RVG en 29 (36,3%) pacientes. La morbilidad a los 90 días era del 46,3% y la mortalidad permaneció en 2,5%. Las complicaciones, según la clasificación de Clavien et al.25, quedan también reflejadas en la tabla 3. La supervivencia de los pacientes a 1, 3 y 5 años es del 80,2, 53,6 y 19,2%, respectivamente (fig. 3).
Morbimortalidad postoperatoria y seguimiento
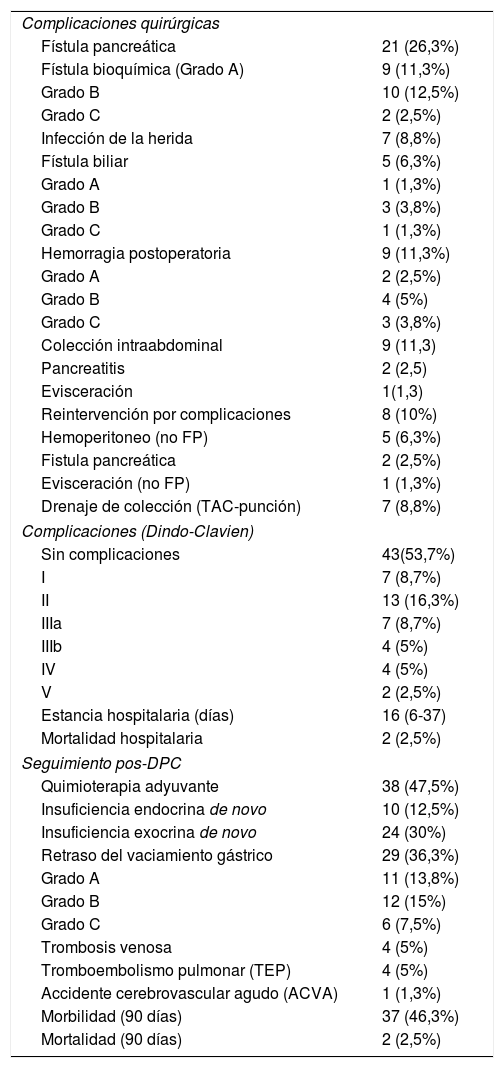
| Complicaciones quirúrgicas | |
| Fístula pancreática | 21 (26,3%) |
| Fístula bioquímica (Grado A) | 9 (11,3%) |
| Grado B | 10 (12,5%) |
| Grado C | 2 (2,5%) |
| Infección de la herida | 7 (8,8%) |
| Fístula biliar | 5 (6,3%) |
| Grado A | 1 (1,3%) |
| Grado B | 3 (3,8%) |
| Grado C | 1 (1,3%) |
| Hemorragia postoperatoria | 9 (11,3%) |
| Grado A | 2 (2,5%) |
| Grado B | 4 (5%) |
| Grado C | 3 (3,8%) |
| Colección intraabdominal | 9 (11,3) |
| Pancreatitis | 2 (2,5) |
| Evisceración | 1(1,3) |
| Reintervención por complicaciones | 8 (10%) |
| Hemoperitoneo (no FP) | 5 (6,3%) |
| Fistula pancreática | 2 (2,5%) |
| Evisceración (no FP) | 1 (1,3%) |
| Drenaje de colección (TAC-punción) | 7 (8,8%) |
| Complicaciones (Dindo-Clavien) | |
| Sin complicaciones | 43(53,7%) |
| I | 7 (8,7%) |
| II | 13 (16,3%) |
| IIIa | 7 (8,7%) |
| IIIb | 4 (5%) |
| IV | 4 (5%) |
| V | 2 (2,5%) |
| Estancia hospitalaria (días) | 16 (6-37) |
| Mortalidad hospitalaria | 2 (2,5%) |
| Seguimiento pos-DPC | |
| Quimioterapia adyuvante | 38 (47,5%) |
| Insuficiencia endocrina de novo | 10 (12,5%) |
| Insuficiencia exocrina de novo | 24 (30%) |
| Retraso del vaciamiento gástrico | 29 (36,3%) |
| Grado A | 11 (13,8%) |
| Grado B | 12 (15%) |
| Grado C | 6 (7,5%) |
| Trombosis venosa | 4 (5%) |
| Tromboembolismo pulmonar (TEP) | 4 (5%) |
| Accidente cerebrovascular agudo (ACVA) | 1 (1,3%) |
| Morbilidad (90 días) | 37 (46,3%) |
| Mortalidad (90 días) | 2 (2,5%) |
DPC: duodenopancreatectomía cefálica; FP: fístulas pancreáticas; TAC: tomografía axial computarizada.
La disparidad en la incidencia de FP post-DPC es tan llamativa que se han hallado diferencias significativas en estudios aleatorizados entre distintos hospitales y cirujanos5. La tasa de FP va a ser diferente según la definición adoptada, de modo que, según la serie de Winter el al.8, la incidencia de FP es del 9,4% si se siguen los criterios del Johns Hopkins, frente al 24,4% si se siguen los del ISGPF26. La primitiva definición de las FP, atendiendo al ISGPF26, ha sido criticada por varios autores12,27 en base a la nula repercusión clínica de las FP grado A y moderada de las grado B que rara vez van a precisar una reintervención. Recientemente, el ISGPS ha realizado una reclasificación de las FP, considerando las de grado A como FB, pero no FP propiamente dichas21. Según esta definición, nuestra incidencia de las verdaderamente consideradas FP (suma de B y C) es del 15% (12 pacientes), correspondiendo al 11,3% (nueve pacientes) las ahora llamadas FB (grado A). En una serie multicéntrica reciente, de 4.301 DPC, la tasa conjunta de FP grados B y C fue del 11,1% frente al 8,1% de FB y, al comparar la incidencia de FP grado C entre la utilización de tutor interno y externo, la incidencia ha sido significativamente superior con el interno28.
En base a los resultados publicados, en general, se defiende más el uso de tutores frente a no tutores debido a una menor tasa global de FP29-32, observando también una menor incidencia de FP graves (tipos B y C) y morbilidad postoperatoria30.
En series comparativas entre dos técnicas de las tres más utilizadas (no tutor, tutor interno o externo), la tasa de FP sin tutor se reporta entre 1,4 y 40,9%; entre 6,1 y 47,7% con tutor interno y entre 8 y 36,4% con tutor externo4,5,8-11,13,33.
En dos metaanálisis, comparando el tutor interno con el externo, la tasa de FP ha sido significativamente más baja en los pacientes con tutor externo34,35 al igual que la morbilidad global y la tasa de RVG35. En otro metaanálisis reciente se ha concluido también que la tutorización externa reduce significativamente la mortalidad relacionada con la FP36. Se ha referido que cuando se seleccionan los pacientes con alto riesgo de FP (puntuación 7-10), según criterios de Callery et al.37, los mejores resultados se obtienen en pacientes con tutorización externa del Wirsung, pancreático-yeyunostomía y drenaje intraabdominal pero no tratados con octreotida38.
Nuestra elección de la tutorización externa del Wirsung, desde hace 6,5 años, la basamos en las ventajas teóricas del tutor externo sobre el interno por la creación de una fístula pancreático-cutánea controlada mediante la derivación de gran cantidad de jugo pancreático fuera de la anastomosis, lo cual permite la cicatrización de la anastomosis y la permeabilidad del Wirsung. El tutor externo del Wirsung facilita la anastomosis ducto-mucosa y puede descomprimir el asa aferente y mejorar el control de las secreciones en caso de FP, posibilitando también el control radiológico de la anastomosis4,6,39-41. Por otro lado, la colocación de un tutor interno tiene el inconveniente de su fácil desprendimiento y emigración.
Las FP grado B se caracterizan por presentar colecciones intraabdominales que suelen drenarse por TAC-punción, como en siete (8,8%) de nuestros pacientes. La hemorragia intraabdominal no relacionada con la FP puede ser también motivo de reintervención, ocurrida en cinco (6,3%) de nuestros pacientes.
Las FP grado C post-DPC, de extremada gravedad, requieren reintervención o, en caso contrario, pueden desarrollar fallo multiorgánico y fallecer por dicha complicación21. En una serie multicéntrica francesa, de 680 pacientes con DPC, la incidencia de FP grado C ha sido del 5,3%, asociándose a una tasa de reintervención del 97% y de mortalidad del 25,7%41. En otra serie multicéntrica, donde se incluyen pacientes con tutor interno y externo, se refiere una incidencia significativamente mayor de FP grado C en el grupo de tutor interno y una mortalidad del 2% a 90 días, correspondiendo el 35% de la mortalidad a las FP grado C28. Los dos únicos pacientes fallecidos de nuestra serie (2,5%) lo hicieron por sepsis abdominal después de ser reintervenidos por FP grado C. En la reintervención por FP se drena el absceso y, en caso de dehiscencia o necrosis pancreática, se aconseja desmontar la anastomosis y cerrar el extremo yeyunal, finalizando con una pancreatectomía parcial dejando la cola pancreática o con una pancreatectomía total41,42, o simplemente colocando un drenaje del borde de sección del páncreas.
Dentro de los múltiples factores de riesgo de FP descritos, los más frecuentemente referidos son: conducto de Wirsung no dilatado (< 3 mm) y páncreas de textura blanda4-6,8-10,13,18,28,37,41, esteatosis pancreática43,44, transfusión importante18,41, DPC por tumores duodenales o ampulares18,37,41, edad mayor de 60 años45, IMC > 25, no utilización de tutor13 y tiempo prolongado de cirugía (7,3 vs. 6,6 horas)12.
La consistencia del páncreas es un parámetro subjetivo, difícil de estandarizar, habiéndose correlacionado la textura blanda con un diámetro del Wirsung < 3 mm12,13. La tasa de páncreas de consistencia dura es del 46,4 frente al 53,6% de consistencia blanda según una serie multicéntrica reciente28, tasas similares a las nuestras (páncreas duro, 51,2 vs. 48,8%, blando). En nuestro estudio solo hemos demostrado una incidencia significativamente mayor (p = 0,02) de FB en pacientes con páncreas blando frente a páncreas duro, pero la diferencia no ha sido significativa (p = 0,52) al comparar la tasa de FP tipos B + C entre los pacientes con páncreas de consistencia dura y blanda.
Se han mencionado una serie de estrategias para prevenir o disminuir la incidencia de FP, como ciertas modificaciones en la técnica16, profilaxis con octreotida46, refuerzo de la anastomosis con sellante de fibrina47, colocación de drenajes intraperitoneales48, y tutorización transanastomótica interna en todos los pacientes9,10,49 o en pacientes de alto riesgo50, aunque es la tutorización externa la estrategia más frecuentemente referida para prevenir las FP4,6,12,13,31,32,35,36,51,52, fundamentalmente en pacientes con elevado riesgo de FP16.
La colocación de drenajes abdominales post-DPC es un asunto controvertido. Así, en un estudio prospectivo aleatorizado (utilización o no de drenajes de Jackson-Pratt en DPC y pancreatectomías distales), se ha observado un aumento significativo de abscesos y colecciones intraabdominales y fístulas en el grupo con drenaje53. Otro estudio, prospectivo, multicéntrico y aleatorizado, demuestra que los pacientes con riesgo moderado o grave de FP post-DPC parecen beneficiarse del uso de drenajes abdominales, mientras que en un tercio con riesgo bajo de FP los drenajes pueden evitarse48. En una reciente publicación, donde se compara la utilización de drenajes aspirativos frente a pasivos, se concluye que las tasas de mortalidad a 30 días y las tasas globales de complicaciones son similares en ambos grupos, aunque se observa, con baja evidencia, que el uso de drenajes aspirativos frente a los pasivos puede reducir ligeramente la estancia hospitalaria, siendo mejor su retirada precoz en los pacientes con bajo riesgo de FP54. Nosotros nos hemos decantado por la utilización de drenajes de Penrose para evitar problemas de obstrucción o succión del drenaje aspirativo sobre la anastomosis que puede conllevar el desarrollo de una FP.
El RVG post-DPC es una complicación frecuente que se presenta entre el 6 y 57% de los casos4,6,10,24, siendo del 36,3% (29 casos) en nuestra experiencia. La patogenia no está clara, pudiendo aparecer tanto en la DPC con antrectomía como con preservación pilórica24. Se ha demostrado que la FP relevante (B o C) y las complicaciones intraabdominales son factores de riesgo para el desarrollo del RVG6,55.
Entre las limitaciones de este trabajo señalamos que se trata de una serie descriptiva de casos. No obstante, de todos los pacientes valorados con indicación de DPC, por parte de los cirujanos responsables, no se ha excluido ningún caso para realizar una tutorización externa.
Como conclusión, en esta serie preliminar de tutorización externa del conducto de Wirsung post-DPC, hemos observado una tasa de complicaciones concordante con la de otras series más amplias recientemente publicadas y una baja tasa de mortalidad. Con base en los resultados expuestos, nuestra técnica de elección es la tutorización del Wirsung en todos los casos después de DPC. Se precisa un análisis comparativo con otras técnicas para analizar los factores de riesgo de FP y mortalidad, y así poder confirmar con mayor seguridad la mejor técnica reconstructiva post-DPC.
Autoría/colaboracionesCarlos Jiménez-Romero: diseño del estudio; redacción del artículo; revisión crítica y aprobación de la revisión final.
Laura Alonso Murillo: adquisición y recogida de datos; análisis e interpretación de resultados.
Paula Rioja Conde: diseño del estudio y adquisición y recogida de datos.
Alberto Marcacuzco Quinto: diseño del estudio y adquisición y recogida de datos.
Oscar Caso Maestro: adquisición y recogida de datos; análisis e interpretación de resultados.
Anisa Nutu: adquisición y recogida de datos.
Isabel Pérez Moreiras: adquisición y recogida de datos.
Iago Justo Alonso: revisión crítica y aprobación de la revisión final; diseño del estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.