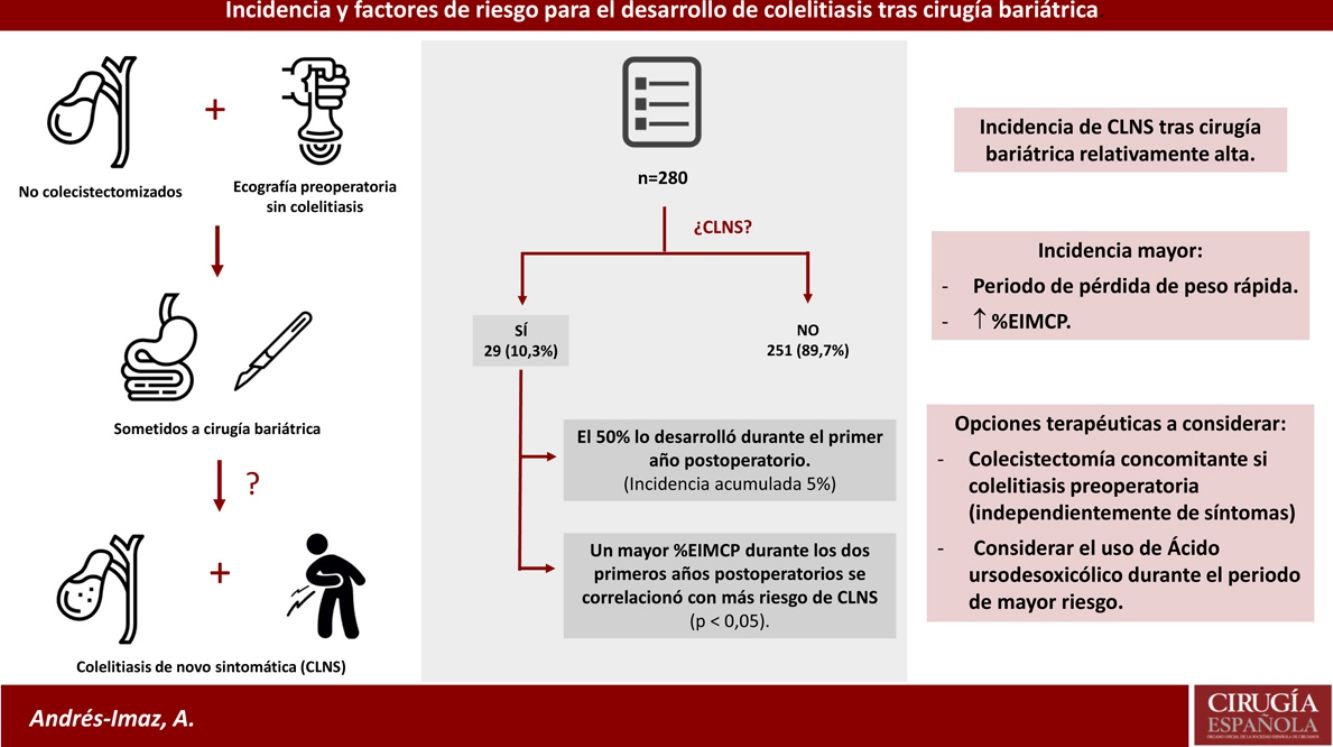
La obesidad y la rápida pérdida de peso tras la cirugía bariátrica (CB) son factores de riesgo para la formación de colelitiasis. El objetivo de este trabajo es conocer la incidencia de colelitiasis de novo sintomática (CLNS) tras CB y analizar los factores de riesgo para su desarrollo.
MétodosEstudio observacional retrospectivo unicéntrico de los pacientes sometidos a CB entre enero de 2010 y diciembre de 2017. Se ha estudiado la incidencia de CLNS y se han analizado el género, la edad, las comorbilidades, la técnica quirúrgica, el IMC inicial y el porcentaje de exceso de IMC perdido (%EIMCP) al 6.°, 12.° y 24.° mes postoperatorio.
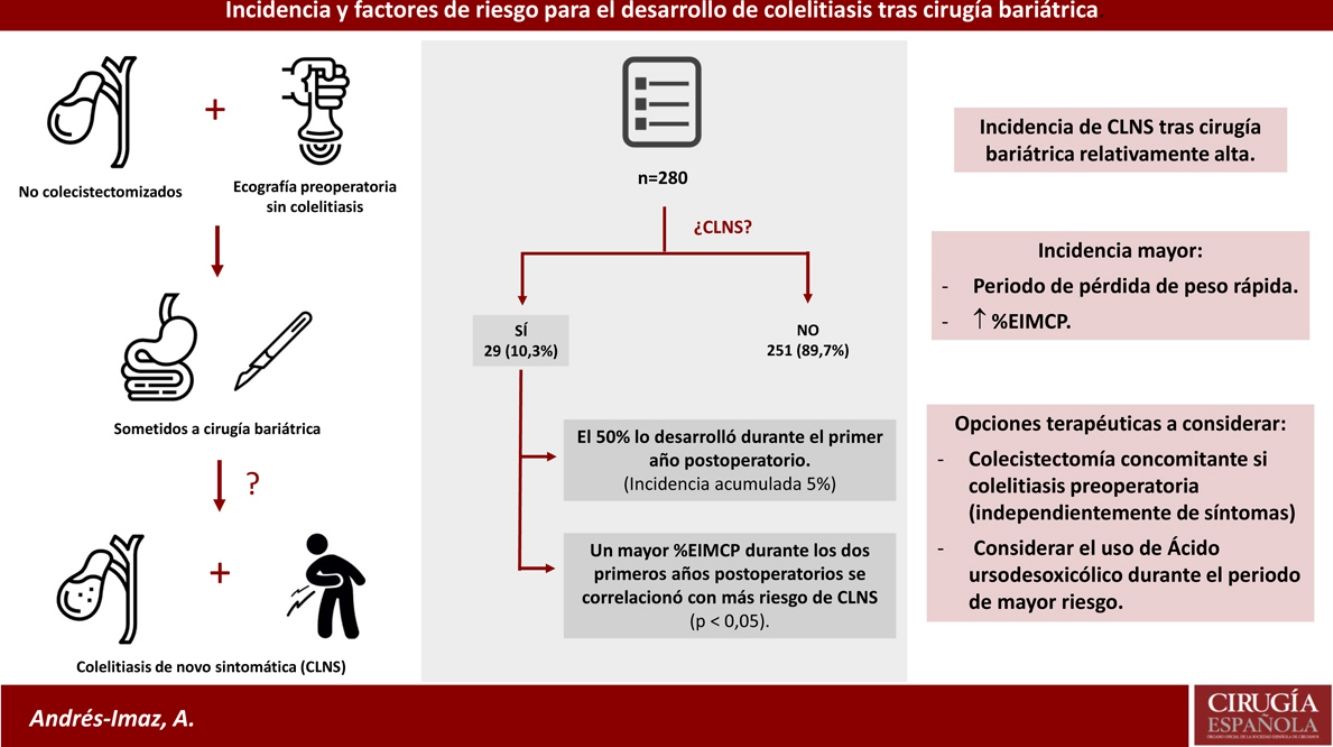
ResultadosDe los 415 pacientes intervenidos de CB, 280 han sido estudiados ya que no estaban colecistectomizados previamente y tenían una ecografía preoperatoria negativa para colelitiasis. Veintinueve desarrollaron CLNS (10,35%), con un aumento en la incidencia acumulada notablemente más alto durante el primer año postoperatorio (5%, IC 95% 2,4-7,6). Un mayor porcentaje de exceso de IMC perdido al 6.°, 12.° y 24.° mes postoperatorio se correlacionó de forma estadísticamente significativa con un mayor riesgo de CLNS.
ConclusionesLa incidencia de CLNS y colecistectomía tras CB es relativamente alta, principalmente durante el periodo de pérdida de peso rápida, y más cuanto mayor sea el porcentaje de exceso de IMC perdido. La colecistectomía concomitante en caso de colelitiasis preoperatoria, independientemente de la sintomatología y el uso de ácido ursodesoxicólico durante el periodo de mayor riesgo para el desarrollo de CLNS, son dos opciones terapéuticas a tener en cuenta.
Obesity and rapid weight loss after bariatric surgery (BS) are risk factors for the development of cholelitiasis. The aim of this study is to know the incidence of the de novo symptomatic cholelitiasis (DNSC) after BS and to analyze the risk factors for its development.
MethodsSingle-centre retrospective observational study of patients undergoing BS between January 2010 and December 2017. The incidence of DNSC has been studied and sex, age, comorbilities, surgical tecnique, initial BMI and percentage of excess BMI lost (%EIMCP) at 6th, 12th and 24th postoperative months have been analyzed.
ResultsAmong the 415 patients who underwent BS, 280 have been studied since they were not previously cholecystectomized and had a preoperative negative abdominal ultrasound. Twenty-nine developed DNSC (10.35%), with a remarkably higher increase in cumulative incidence during the first postoperative year (5%, 95% CI 2,4-7,6). A higher percentage of excess BMI lost at the 6, 12 and 24 postoperative months was statistically significantly correlated with an increased risk of DNSC.
ConclusionsIncidence of DNSC and cholecystectomy after BS are relatively high, mainly during rapid weight loss period and even more the higher the percentage of excess BMI lost is. Concomitant cholecystectomy during BS in case of preoperative cholelithiasis regardless of symptoms and the use of ursodeoxycholic acid during the period of greater risk for DNSC development are two therapeutic options to consider.
La obesidad es un factor de riesgo conocido para la formación de colelitiasis. El exceso de excreción de colesterol a la bilis y la disminución de la respuesta contráctil del músculo liso vesicular a la colecistoquinina producen una estasis biliar que favorece la precipitación de cristales y la consecuente formación de cálculos. Se estima que la población obesa mórbida (índice de masa corporal [IMC]>40kg/m2) tiene una incidencia anual de colelitiasis del 2%1,2.
Por otro lado, la pérdida de peso rápida, tras una cirugía bariátrica (CB) o por medios no quirúrgicos, predispone a la formación de colelitiasis de novo (CLN). El mecanismo por el cual se produce la CLN está todavía en discusión. Por un lado, la lipólisis produce una mayor excreción y movilización de colesterol generando una bilis litogénica, y por otro lado, la exclusión duodenal tras ciertos procedimientos quirúrgicos conlleva una menor secreción de colecistoquinina y, por tanto, una menor motilidad vesicular2.
Diversos estudios revelan que del 30 al 53% de la población sometida a CB desarrolla CLN y que del 7 al 14% presentará sintomatología secundaria a enfermedad biliar (CLN sintomática [CLNS]), principalmente en forma de cólico y colecistitis3–5. De hecho, la colecistectomía es la intervención más frecuentemente realizada tras la CB6. Por otro lado, se ha señalado7–10 que uno de los factores de riesgo para la formación de litiasis biliar es el porcentaje de exceso de peso perdido durante el primer año (%EIMCP), para luego disminuir cuando se alcanza un peso estable, y quizá en este sentido las técnicas quirúrgicas malabsortivas conlleven un riesgo mayor que las puramente restrictivas.
Por todo ello, la realización de una colecistectomía concomitante en la CB es un tema históricamente controvertido. Generalmente no existen dudas ante una colelitiasis sintomática en el momento de la cirugía, pero la indicación es discutida si la colelitiasis es asintomática o cuando no hay colelitiasis. En ausencia de ensayos clínicos aleatorizados, la actitud más consolidada y aceptada hoy en día es la colecistectomía selectiva, es decir, asociar colecistectomía solo en aquellos casos de litiasis sintomática, ya que la colecistectomía de rutina puede no ser técnicamente sencilla y no está exenta de complicaciones7–10.
El objetivo de este trabajo es conocer la incidencia de CLNS tras CB y analizar los factores de riesgo para su desarrollo.
MétodosEstudio observacional retrospectivo unicéntrico sobre una base de datos prospectiva de la Sección de Cirugía Esófago-Gástrica y Obesidad. El estudio fue aprobado por el comité de ética de nuestro centro (Código de Protocolo: AND-COL-2020-01).
Antes de la CB, todos los pacientes fueron valorados por un comité multidisciplinar formado por endocrinólogos, psicólogos, anestesiólogos, personal de enfermería y cirujanos. El estudio preoperatorio se completó mediante analítica, endoscopia digestiva alta con despistaje de infección por Helicobacter pylori, ecografía abdominal, pruebas de función respiratoria y valoración psicológica. Los pacientes que presentaban colelitiasis en la ecografía preoperatoria fueron sometidos a colecistectomía durante la CB, independientemente de si presentaban sintomatología o no. En las consultas de nutrición y psicología se realizó una valoración de la conducta y hábitos alimentarios, lo que se tuvo en consideración al realizar la indicación de la cirugía. Todos los pacientes fueron sometidos a una dieta líquida muy baja en calorías la semana previa a la intervención quirúrgica. Se realizaron dos tipos de técnicas bariátricas: se indicó la gastrectomía vertical (GV) para pacientes con IMC de 35-40 con comorbilidades asociadas a la obesidad, no picoteadores, y como primera fase en pacientes superobesos con IMC≥55, mientras que los pacientes con un IMC de 40-55, catalogados como picoteadores, eran sometidos a bypass gástrico en Y de Roux (BPGY).
Se incluyeron en el estudio aquellos pacientes sometidos a CB en nuestro centro entre enero de 2010 y diciembre de 2017. Se analizaron la frecuencia de CLNS tras CB y los factores de riesgo para el desarrollo de la misma. Se consideró CLNS todo cuadro abdominal secundario a enfermedad litiásica biliar (cólicos, colecistitis, pancreatitis, etc.) con prueba de imagen que confirmase la colelitiasis, teniendo todos ellos una ecografía negativa previa a la CB. Se definió como la fecha de diagnóstico el día que se realizó la prueba de imagen. Se realizó un seguimiento mínimo de 24 meses en régimen de consultas, teniendo en cuenta el seguimiento hasta febrero de 2020 (inclusive). Se excluyeron aquellos pacientes con otra técnica de CB previa o con un seguimiento menor de 24 meses. Se analizaron el género, la edad, las comorbilidades, la técnica quirúrgica, el IMC inicial y el %EIMCP al 6.°, 12.° y 24.° mes postoperatorio.
Los datos fueron recogidos utilizando Excel para Windows® y los análisis se realizaron mediante Excel para Windows® y Statistical Package for the Social Sciences® 21.0 (SPSS IBM®, Chicago, IL, EE. UU.). Se describieron las variables mediante el estadístico más apropiado para la naturaleza y escala de medición de cada una: media y desviación estándar para variables cuantitativas y frecuencias absolutas y relativas en porcentaje para variables cualitativas.
Se realizó un análisis univariante para evaluar la importancia de las variables de estudio en relación con el resultado de interés. Para estudiar las variables continuas se empleó el test de t de Student y para las variables nominales la prueba de Chi-cuadrado. Debido a que la aparición de los síntomas (CLNS) es dependiente del tiempo de seguimiento, su incidencia se estudió mediante curvas de Kaplan-Meier, analizando la significación estadística mediante la prueba de Log-rank. Para todas las pruebas de significación estadística, un valor de p<0,05 se consideró estadísticamente significativo.
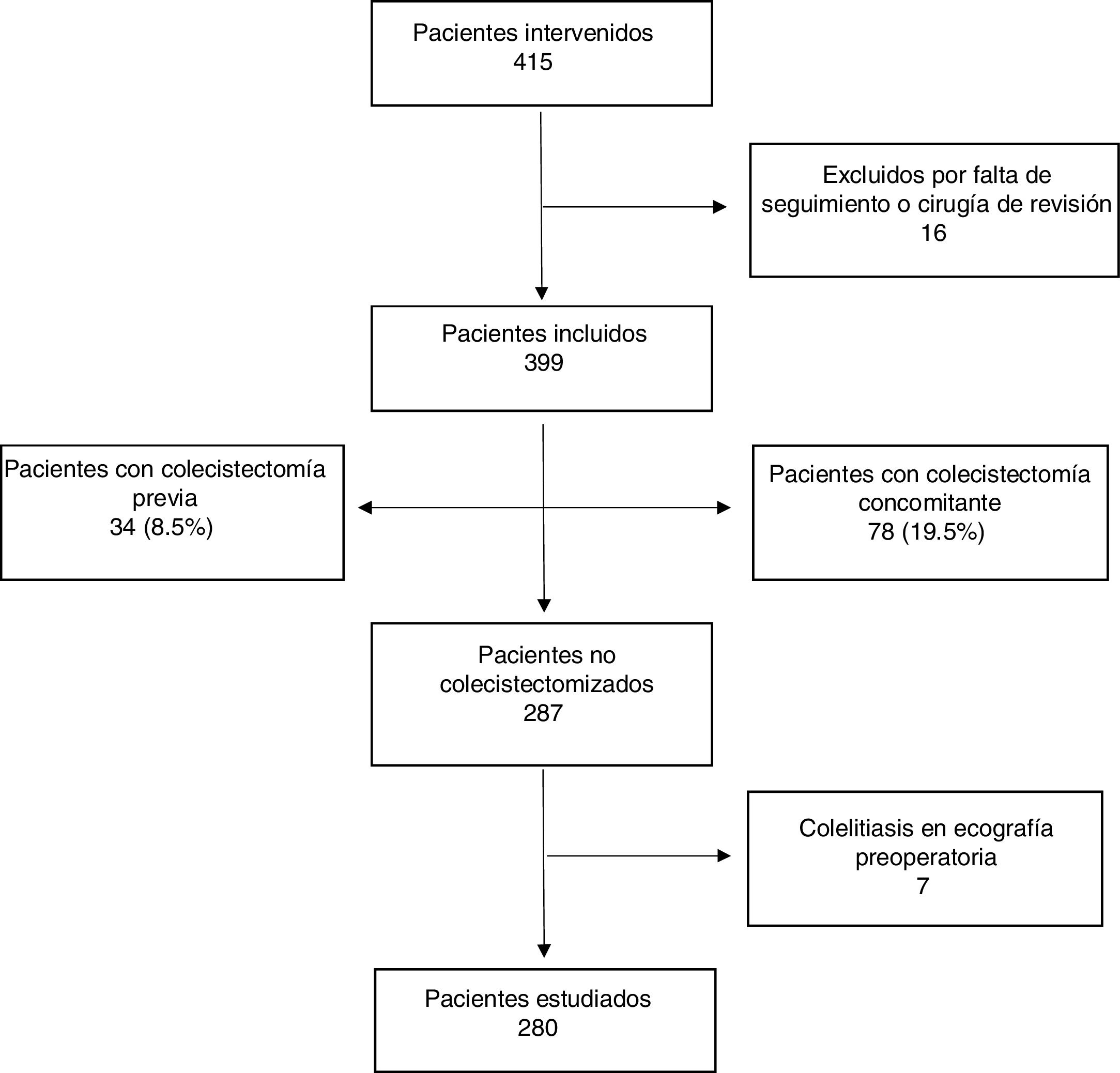
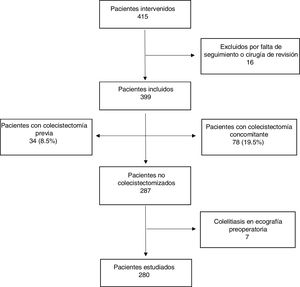
ResultadosDurante el periodo de estudio, un total de 415 pacientes fueron sometidos a CB (fig. 1). Dieciséis fueron excluidos por tener CB previa o un seguimiento postoperatorio menor de 24 meses.
De los 399 pacientes incluidos, 34 estaban previamente colecistectomizados (8,5%), en 78 se realizó colecistectomía concomitante (19,5%) y 7 (1,7%) tenían colelitiasis asintomática preoperatoria pero no fueron colecistectomizados por mala exposición del triángulo de Calot debido a la posición de los trocares.
La edad media fue de 44,92 años y el 71,9% eran mujeres. Doscientos cincuenta y cinco pacientes fueron sometidos a BPGY (63,91%) y 144 a GV (36,09%). La comorbilidad más frecuente fue la hipertensión arterial (HTA), presente en el 43,86%, seguida de la diabetes mellitus (DM), presente en el 28,57%. El IMC inicial fue de 46,03 y el %EIMCP al 6., 12.° y 24.° mes, de 57,49, 70,48 y 70,85, respectivamente.
El grupo de pacientes no colecistectomizados previamente y con ecografía preoperatoria negativa fueron 280. De estos, 29 desarrollaron CLNS (10,35%) (grupo A) y el resto permanecieron asintomáticos (grupo B). El tiempo de seguimiento medio para el conjunto de ambos grupos (n=280) fue de 77,6 meses (DE 24,97; rango 26,32-121,46).
En cuanto al grupo A, la mayoría comenzaron con cólicos biliares de repetición (15; 48,3%), pero también hubo casos de colecistitis aguda (7), pancreatitis aguda (4), colecistopancreatitis (uno), colangitis (uno), coledocolitiasis (uno) y epigastralgia (uno). La mayoría empezaron durante los primeros 24 meses postoperatorios (21; 75%). Veintisiete requirieron colecistectomía (93,1%), realizándose de forma electiva en la mayoría (78%) y de forma urgente en el resto (22%), estos últimos por presentar colecistitis aguda. El abordaje fue laparoscópico en el 89% de los casos. El abordaje abierto fue necesario en 3 ocasiones por dificultades técnicas en el contexto de colecistitis aguda con importantes cambios inflamatorios. Ninguno presentó complicaciones mayores en el postoperatorio. Dos pacientes con CLNS no fueron colecistectomizados, uno de ellos por un único episodio de cólico en el postoperatorio y el otro por presentar otras enfermedades de mayor relevancia.
Respecto a los 251 pacientes que permanecieron asintomáticos (grupo B), 88 tenían una prueba de imagen realizada tras la CB por otro motivo (litiasis renal, obstrucción intestinal, etc.). De estos, 14 presentaban CLN asintomática en dichas pruebas (15,6%).
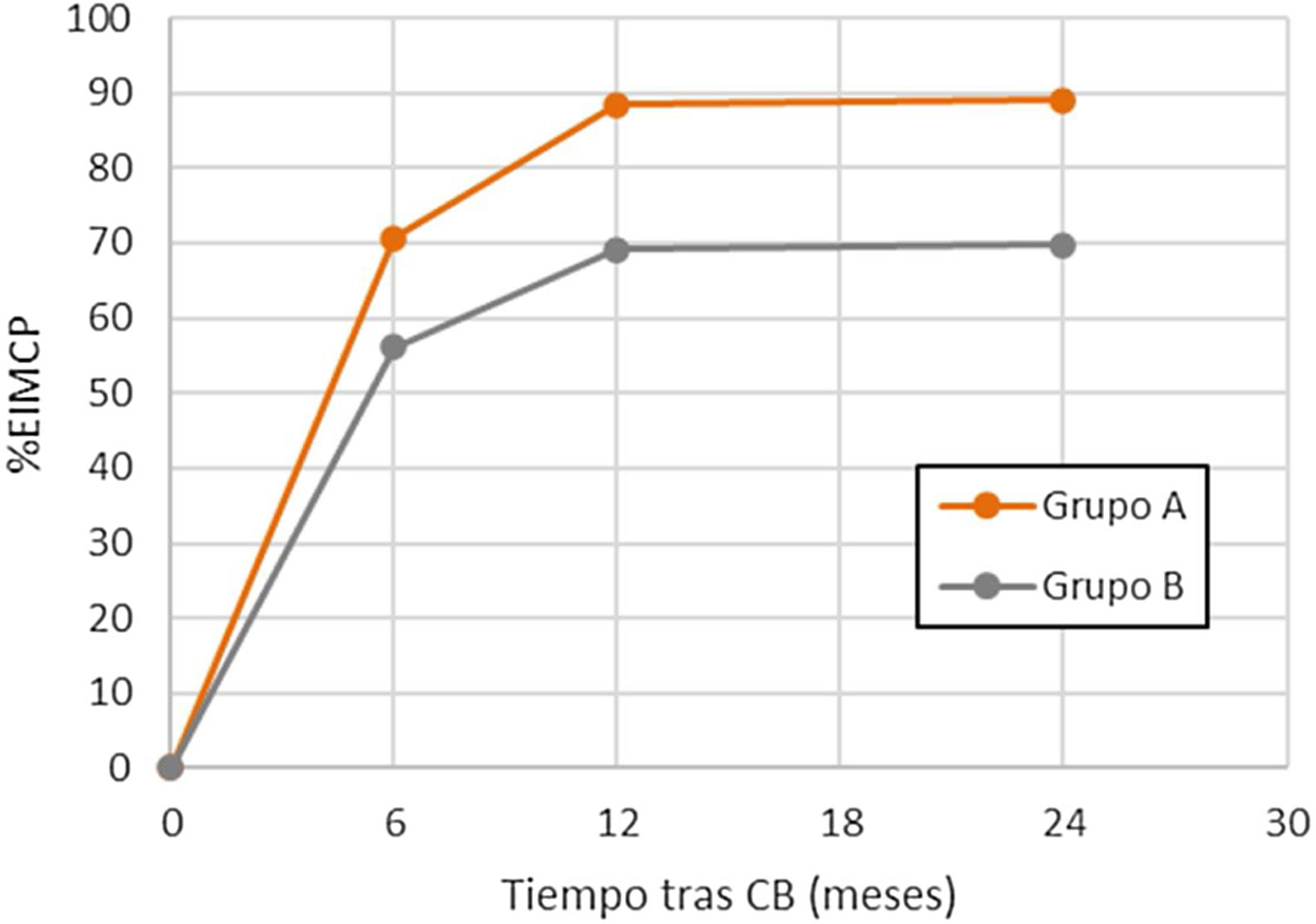
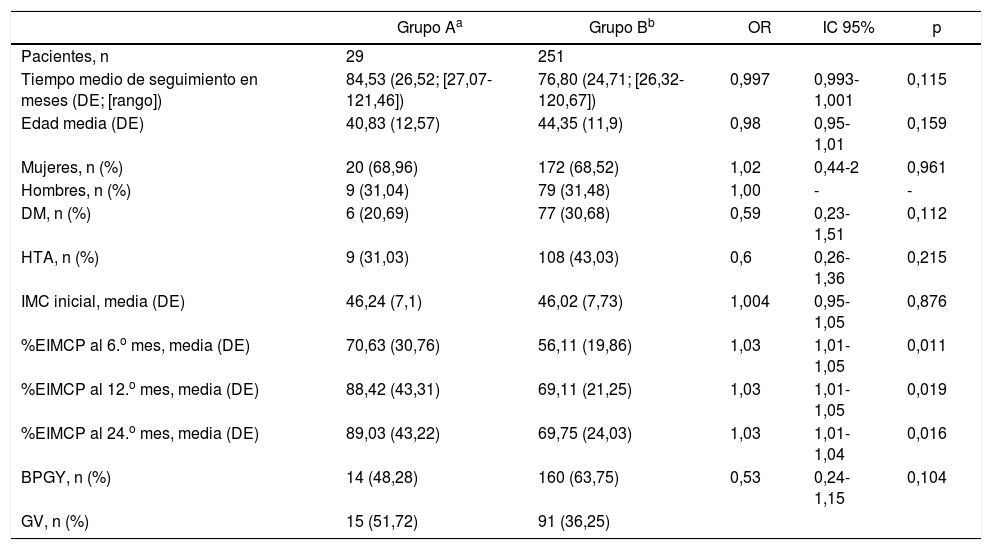
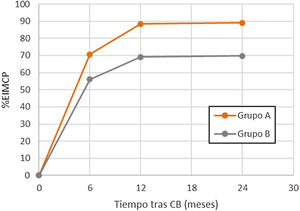
Comparando ambos grupos (tabla 1), el análisis univariante no demostró diferencias estadísticamente significativas en cuanto al tiempo de seguimiento, la edad, el género, las comorbilidades, el IMC inicial o la técnica quirúrgica, aunque sí cierta tendencia protectora de la HTA, la DM y el BPGY. Sin embargo, la mayor pérdida de peso (%EIMCP) al 6.°, 12.° y 24.° mes postoperatorio se correlacionó de forma estadísticamente significativa con un mayor riesgo de CLNS (p<0,05) (fig. 2).
Comparación de características clínicas entre ambos grupos
| Grupo Aa | Grupo Bb | OR | IC 95% | p | |
|---|---|---|---|---|---|
| Pacientes, n | 29 | 251 | |||
| Tiempo medio de seguimiento en meses (DE; [rango]) | 84,53 (26,52; [27,07-121,46]) | 76,80 (24,71; [26,32-120,67]) | 0,997 | 0,993-1,001 | 0,115 |
| Edad media (DE) | 40,83 (12,57) | 44,35 (11,9) | 0,98 | 0,95-1,01 | 0,159 |
| Mujeres, n (%) | 20 (68,96) | 172 (68,52) | 1,02 | 0,44-2 | 0,961 |
| Hombres, n (%) | 9 (31,04) | 79 (31,48) | 1,00 | - | - |
| DM, n (%) | 6 (20,69) | 77 (30,68) | 0,59 | 0,23-1,51 | 0,112 |
| HTA, n (%) | 9 (31,03) | 108 (43,03) | 0,6 | 0,26-1,36 | 0,215 |
| IMC inicial, media (DE) | 46,24 (7,1) | 46,02 (7,73) | 1,004 | 0,95-1,05 | 0,876 |
| %EIMCP al 6.o mes, media (DE) | 70,63 (30,76) | 56,11 (19,86) | 1,03 | 1,01-1,05 | 0,011 |
| %EIMCP al 12.o mes, media (DE) | 88,42 (43,31) | 69,11 (21,25) | 1,03 | 1,01-1,05 | 0,019 |
| %EIMCP al 24.o mes, media (DE) | 89,03 (43,22) | 69,75 (24,03) | 1,03 | 1,01-1,04 | 0,016 |
| BPGY, n (%) | 14 (48,28) | 160 (63,75) | 0,53 | 0,24-1,15 | 0,104 |
| GV, n (%) | 15 (51,72) | 91 (36,25) |
BPGY: bypass gástrico en Y de Roux; DE: desviación estándar; DM: diabetes mellitus; GV: gastrectomía vertical; HTA: hipertensión arterial; IC 95%: intervalo de confianza al 95%; IMC: índice de masa corporal; OR: odds ratio; %EIMCP: porcentaje de exceso de índice de masa corporal perdido.
Para calcular las odds ratio de ambas técnicas quirúrgicas, se ha tomado como valor de referencia la gastrectomía vertical.
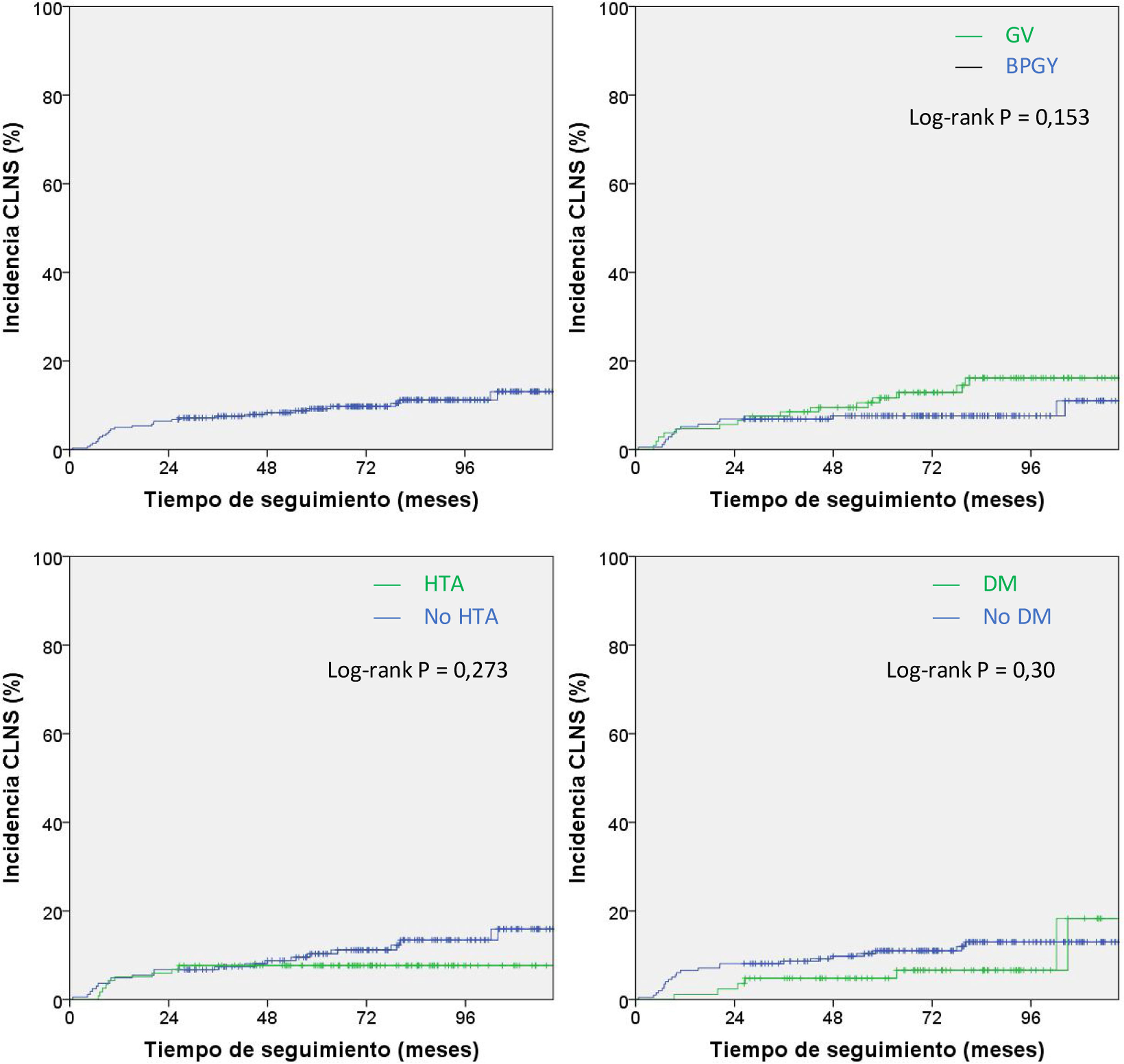
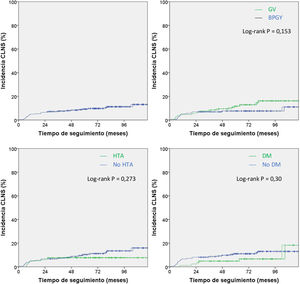
Por último, se analizó mediante curvas de Kaplan-Meier la probabilidad de incidencia de CLNS durante el periodo de seguimiento para el conjunto de pacientes estudiados (n=280), tanto en su totalidad como comparando según el tipo de intervención quirúrgica y prevalencia de HTA y DM (fig. 3).
Análisis de Kaplan-Meier de la probabilidad de colelitiasis de novo sintomática (CLNS) a lo largo del tiempo de seguimiento para el conjunto de pacientes estudiados y diferentes factores de riesgo. BPGY: bypass gástrico en Y de Roux; DM: diabetes mellitus; GV: gastrectomía vertical; HTA: hipertensión arterial.
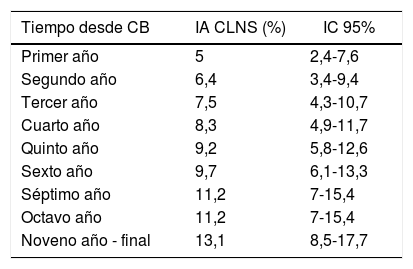
Como se muestra en la primera gráfica de la figura 3, el aumento en la incidencia acumulada fue notablemente más rápido durante el primer año. En este primer año la incidencia acumulada fue del 5% (IC 95% 2,4-7,6) (tabla 2). Posteriormente, la tasa de incremento disminuye, pero se mantuvo constante. La incidencia acumulada final tras 10 años de seguimiento fue del 13,1% (IC 95% 8,7-17,7). Este valor es compatible con la incidencia media calculada (10,35%) sin tener en cuenta el tiempo desde la CB hasta el diagnóstico de CLNS.
Detalle del análisis de Kaplan-Meier de la muestra estudiada (n=280), que expone la incidencia de colelitiasis de novo sintomática y sus intervalos de confianza a lo largo del tiempo
| Tiempo desde CB | IA CLNS (%) | IC 95% |
|---|---|---|
| Primer año | 5 | 2,4-7,6 |
| Segundo año | 6,4 | 3,4-9,4 |
| Tercer año | 7,5 | 4,3-10,7 |
| Cuarto año | 8,3 | 4,9-11,7 |
| Quinto año | 9,2 | 5,8-12,6 |
| Sexto año | 9,7 | 6,1-13,3 |
| Séptimo año | 11,2 | 7-15,4 |
| Octavo año | 11,2 | 7-15,4 |
| Noveno año - final | 13,1 | 8,5-17,7 |
CB: cirugía bariátrica; CLNS: colelitiasis de novo sintomática; IA: incidencia acumulada; IC 95%: intervalo de confianza al 95%.
Respecto a la HTA, la DM y el tipo de CB, ninguno de los valores p (Log-rank) alcanzó la significación estadística.
DiscusiónEn el presente estudio se constata que aproximadamente uno de cada 10 pacientes intervenidos de CB ha desarrollado una CLNS, la mayoría (75%) durante los primeros 24 meses postoperatorios, siendo necesaria la colecistectomía en casi todos ellos. El desarrollo de la misma ocurre principalmente durante el periodo de rápida pérdida de peso, y su incidencia es similar a la reportada en otros estudios retrospectivos3,4.
No obstante, a 83 pacientes sin sintomatología biliar (grupo B) se les realizó una prueba de imagen por otro motivo distinto, encontrándose en un 15,6% una CLN, lo que indica que la incidencia real de CLN es superior a la que nosotros reportamos.
En cuanto a los factores de riesgo para el desarrollo de CLNS tras CB, la evidencia actual es escasa. En el presente estudio, se ha realizado un análisis univariante para relacionar las variables independientes con la probabilidad de desarrollar CLNS. Un mayor %EIMCP aumentó de forma significativa el riesgo de CLNS, coincidiendo con lo reportado en los estudios de Coupaye et al.8 y Li et al.10.
En nuestro estudio, los pacientes sometidos a bypass gástrico presentaron una menor tendencia al desarrollo de CLNS, sin llegar a alcanzar la significación estadística. Estos resultados coinciden con lo publicado en el estudio de Coupaye et al.8, en el que la técnica quirúrgica no se relaciona directamente con la probabilidad de desarrollar CLNS. Por otra parte, no parece que exista diferencia en la pérdida ponderal entre el BPGY y la GV según 2 ensayos clínicos aleatorizados publicados al respecto11,12, por lo que cabría esperar un riesgo de CLNS similar tras ambas técnicas quirúrgicas.
También se objetivó una menor tendencia al desarrollo de CLNS en pacientes hipertensos y diabéticos, pudiendo interpretarse estos como posibles factores protectores, pero sin alcanzar en ningún caso la significación estadística. En cuanto al efecto protector de la HTA, este ya ha sido descrito previamente por Guzmán et al.13, pero como se describe en su estudio, esta asociación podría ser consecuencia del azar, ya que no hay mecanismos fisiológicos que lo justifiquen.
En el presente estudio se realizó colecistectomía concomitante a los pacientes con colelitiasis que se iban a someter a CB, ya que a pesar de la morbilidad añadida que esto podría suponer, la probabilidad de desarrollar CLN tras CB no es desdeñable13.
Por otro lado, en las guías para el manejo postoperatorio del paciente bariátrico publicadas por Vilallonga et al.3 se recomienda el uso profiláctico del ácido ursodesoxicólico (AUDC) durante el periodo de pérdida de peso rápida en pacientes intervenidos de CB y sin colelitiasis previa (nivel de evidencia 1a, recomendación A), ya que ha demostrado disminuir el desarrollo de CLN de forma significativa13–19. Sin embargo, su coste-efectividad está todavía por determinar3 y se asocia a un cumplimiento terapéutico bajo, principalmente debido a los efectos secundarios presentes hasta en un 25% de los casos en forma de náuseas, diarrea o alteraciones cutáneas, y a su posología (2-3 veces al día)20. Un reciente metaanálisis de Magouliotis et al.21 también recomienda su uso. Aun así, estos resultados deben interpretarse de forma cautelosa, teniendo en cuenta que son pocos los estudios incluidos y que la eficacia del AUDC puede variar dependiendo de la técnica quirúrgica que se haya realizado, debido a las diferencias que ello supone tanto en el microbioma como en el perfil de ácidos biliares.
Entre las limitaciones de nuestro estudio están su carácter retrospectivo y unicéntrico, con un número limitado de pacientes. Además, cabe destacar el hecho de no haber realizado una prueba de imagen postoperatoria de forma sistemática que hubiese permitido conocer la incidencia global real de CLN. Como aspectos positivos cabría mencionar que el seguimiento medio ha sido de 6,4 años y la pérdida de pacientes durante dicho periodo ha sido mínima. Esto, unido a que no se encontraron diferencias estadísticamente significativas en el tiempo de seguimiento entre ambos grupos (A y B) y a que los resultados son respaldados por las curvas de Kaplan-Meier, da consistencia al estudio realizado.
En conclusión, la incidencia de CLNS y colecistectomía tras CB es relativamente alta, principalmente durante el periodo de pérdida de peso rápida y más cuanto mayor sea el %EIMCP. La colecistectomía concomitante en caso de colelitiasis preoperatoria, independientemente de la sintomatología y el uso de AUDC durante el periodo de mayor riesgo para el desarrollo de CLNS, son dos opciones terapéuticas para el tratamiento de la colelitiasis en el paciente bariátrico. Sin embargo, se necesitarían estudios aleatorizados para aclarar el papel tanto de la colecistectomía concomitante como del uso del AUDC en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.