La neoplasia mucinosa papilar intraductal (NMPI) del páncreas puede progresar de displasia de bajo grado a displasia de alto grado y carcinoma invasivo asociado. El objetivo de este trabajo fue describir las características clínico-patológicas y los resultados de seguimiento a largo plazo de pacientes con pancreatectomía por NMPI.
MétodosEn este estudio retrospectivo de un solo centro, se analizan los resultados de los pacientes sometidos a resección pancreática, con diagnóstico anatomopatológico de NMPI, desde enero del 2009 a diciembre del 2019.
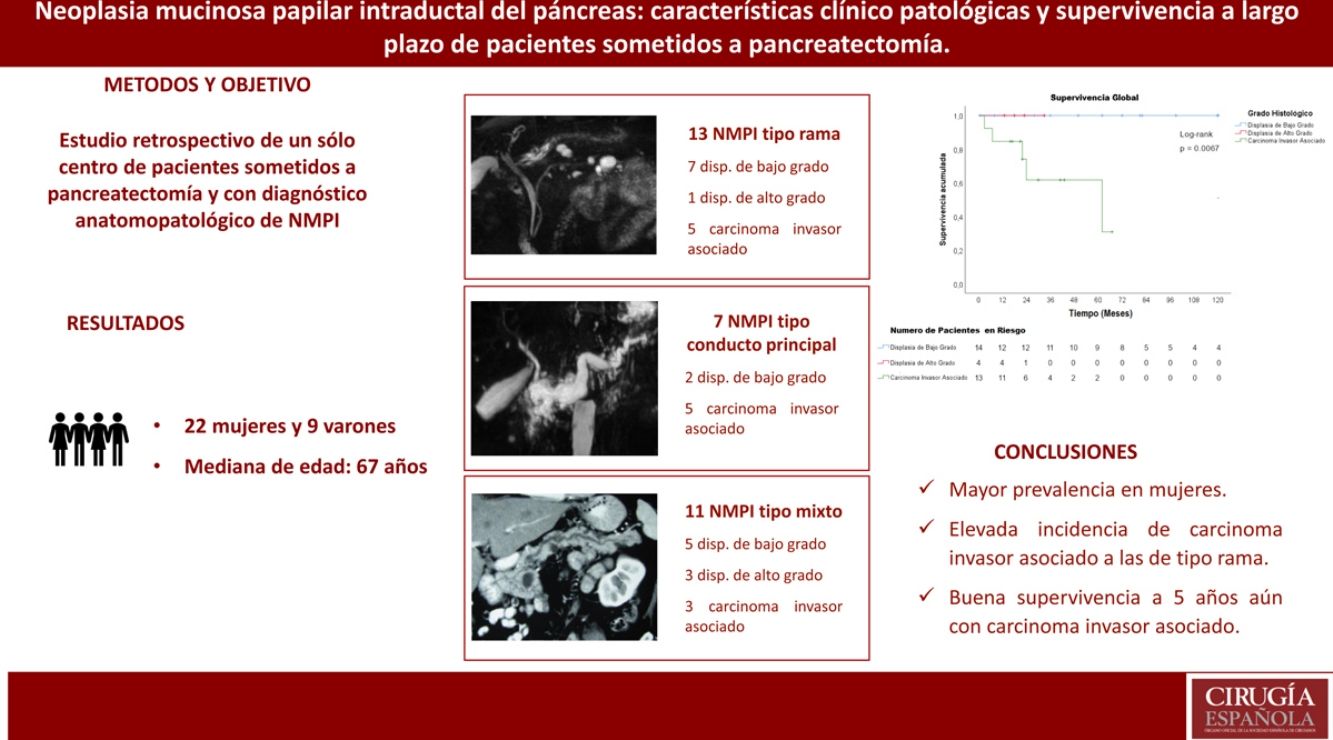
ResultadosUn total de 31 pacientes tuvieron diagnóstico de NMPI. Nueve pacientes fueron varones y 22 mujeres. La edad media fue de 67 años. Veintisiete pacientes (87%) presentaron síntomas. Los estigmas de alto riesgo se encontraron en 20 pacientes (64,5%) y las características preocupantes («worrisome features») en 10 pacientes (32,2%). Siete pacientes tuvieron NMPI tipo conducto principal, 13 NMPI tipo rama y 11 NMPI tipo mixto. El carcinoma invasivo asociado estuvo presente en 13 pacientes (41,9%), la displasia de alto grado en 4 pacientes (12,9%) y la displasia de bajo grado en 14 pacientes (45,2%). El tiempo de seguimiento fue de 2 a 12 años. La supervivencia media de los pacientes con NMPI y carcinoma invasivo asociado fue de 45,8 meses y la supervivencia libre de enfermedad de estos pacientes fue de 40,8 meses.
ConclusionesEn nuestros pacientes operados, la NMPI tuvo mayor prevalencia en mujeres, fue predominantemente sintomática y tuvo una elevada incidencia de carcinoma invasivo asociado a las de tipo rama. La supervivencia a 5 años fue buena aun con carcinoma invasivo asociado.
Intraductal papillary mucinous neoplasm (IPMN) of pancreas can progress from low grade dysplasia to high grade dysplasia and invasive carcinoma.
Methodsin this single center retrospective series we analyze the clinicopathological features and long-term follow up of patients who underwent pancreatic resection for IPMN, from January 2009 to December 2019.
Results31 patients were diagnosed with IPMN. Nine males and 22 females. The mean age was 67 years. Twenty-seven patients (87%) were symptomatic. Seven patients had main duct IPMN, 11 branch type IPMN and 13 mixed type IPMN. High-risk stigmata were found in 20 patients (64.5%) and worrisome features in 10 patients (32.2%). Thirteen patients (41.9%) had an associated invasive carcinoma, 4 (12.9%) high-grade dysplasia and 14 (45.2%) low-grade dysplasia. The follow-up was from 2 to 12 years. Median survival for patients with IPMN and associated invasive carcinoma was 45.8 months and disease-free survival was 40.8 months.
ConclusionsIPMN had higher prevalence in females, mostly symptomatic and high incidence of associated invasive carcinoma with branch type. The 5-year survival was good even with associated invasive carcinoma.
Actualmente se están realizando esfuerzos para dilucidar los mecanismos de carcinogénesis del cáncer de páncreas, a través del estudio de 5 lesiones precursoras que incluyen: la neoplasia intraepitelial pancreática (PanIN), la más frecuente1,2; la neoplasia mucinosa papilar intraductal, la neoplasia tubulopapilar intraductal, la neoplasia papilar oncocítica intraductal y la neoplasia mucinosa quística del páncreas1–3.
La neoplasia mucinosa papilar intraductal del páncreas (NMPI o IPMN por sus siglas en inglés: «Intraductal Papillary Mucinous Neoplasm») es una lesión quística que se origina en las células epiteliales que revisten el sistema ductal pancreático y se caracteriza por la proliferación celular formando proyecciones papilares y secreción de mucina4. Pueden surgir a partir del conducto pancreático principal (NMPI tipo conducto principal), sus ramas (NMPI tipo rama) o ambos (NMPI tipo mixto); y pueden ser lesiones únicas o múltiples (multifocal)3. Estas neoplasias pueden tener una progresión desde la displasia de bajo grado a displasia de alto grado y eventualmente carcinoma invasivo5–7. Se presume que esta vía de progresión representa el 20-30% de los cánceres de páncreas5. Las NMPI representan una oportunidad para identificar una población de alto riesgo que podría beneficiarse con una resección preventiva5.
Cuatro décadas después de su primera descripción, se sabe que el riesgo de progresión maligna es mayor cuando el conducto principal está involucrado7. Aproximadamente el 23% de todas las NMPI resecadas tienen un carcinoma invasivo asociado8, siendo el 43% para las NMPI tipo conducto principal, 45% para las NMPI tipo mixto y 18,5% para las NMPI tipo rama, respectivamente9,10. Basados en la histología y la expresión de mucinas (MUC), las NMPI pueden clasificarse en tres subtipos epiteliales: gástrica, intestinal y pancreatobiliar; cada una caracterizada por un riesgo distinto de progresión maligna3,9,10. Las NMPI tipo gástrico son usualmente lesiones con displasia de bajo grado, mientras que las intestinales y pancreatobiliares tienden a ser lesiones con displasia de alto grado y frecuentemente asociadas a carcinoma invasivo5,7. El carcinoma invasivo asociado a las NMPI puede ser ductal o coloide3,10 y la supervivencia a 5 años de estos pacientes varía del 34% al 62%, la cual es significativamente mayor comparada con el adenocarcinoma ductal común8. Se sabe también que el adenocarcinoma ductal puede aparecer en otras partes del páncreas en pacientes que albergan una NMPI, ya sea de forma sincrónica o metacrónica7. Finalmente, se han identificado mutaciones en los genes KRAS y GNAS en las NMPI aun antes de desarrollar carcinoma invasivo4.
El objetivo de este trabajo fue describir las características clínico-patológicas, así como los resultados de seguimiento a largo plazo de pacientes con pancreatectomía por NMPI.
MétodosEl presente estudio es una serie retrospectiva, descriptiva de NMPI resecadas en un servicio especializado de Cirugía de Páncreas. De la base de datos con información recolectada en forma prospectiva, se identificaron los pacientes con diagnóstico anatomopatológico de NMPI, desde enero del 2009 a diciembre del 2019.
Se recogió información demográfica, clínica, estudios radiológicos, procedimientos quirúrgicos, patología y evolución postoperatoria. Para el análisis de la recurrencia y supervivencia, se revisó retrospectivamente la historia clínica electrónica y los estudios radiológicos de seguimiento.
El diagnóstico de NMPI se realizó de acuerdo con los criterios de la Organización Mundial de la Salud (OMS): neoplasias epiteliales de células productoras de moco visibles macroscópicamente (típicamente >5mm), que surgen a partir del conducto pancreático principal (NMPI tipo conducto principal) y/o sus ramas (NMPI tipo rama o NMPI tipo mixta)3.
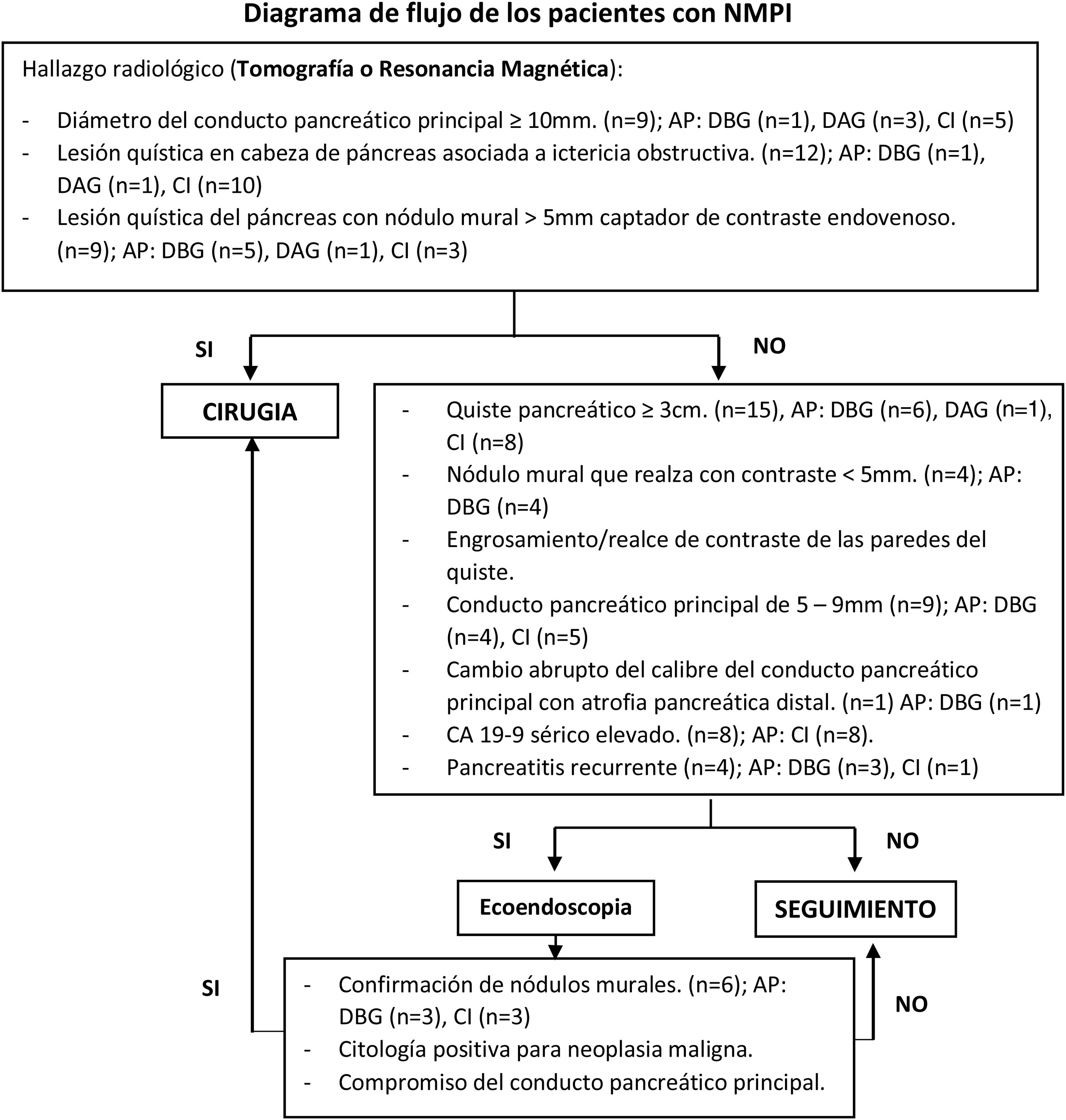
Para identificar a los pacientes con indicación quirúrgica y aquellos con necesidad de más estudios se utilizaron los criterios radiológicos propuestos por la International Association of Pancreatology (IAP)10, los cuales son:
- -
Estigmas de alto riesgo («high-risk stigmata»): ictericia obstructiva en paciente con una lesión quística en la cabeza del páncreas, nódulo mural ≥5mm que realza con contraste y conducto pancreático principal ≥10mm10.
- -
Características preocupantes («worrisome features»): quiste ≥3cm, nódulo mural que realza con contraste <5mm, engrosamiento/realce de contraste de las paredes del quiste, conducto pancreático principal de 5-9mm, cambio abrupto del calibre del conducto pancreático principal con atrofia pancreática distal, linfadenopatías, valores elevados del marcador CA 19-9 sérico y crecimiento rápido del quiste >5mm/2 años. Presencia de pancreatitis en la evolución clínica10.
Histológicamente las NMPI con displasia de bajo grado: se caracterizan por la presencia de atipia leve a moderada y podrían o no tener proyecciones papilares y mitosis3,11,12.
NMPI con displasia de alto grado (carcinoma in situ): se caracteriza por la presencia de atipia severa, papilas con ramificaciones irregulares, estratificación nuclear con pérdida de la polaridad, pleomorfismo, nucléolos prominentes y múltiples mitosis3,11,12.
NMPI con carcinoma invasivo asociado: que puede ser de dos tipos, el carcinoma coloide y el adenocarcinoma ductal3,10,12.
NMPI con carcinoma invasivo concomitante: genéticamente distinto al NMPI en otras partes de la glándula, a diferencia del carcinoma invasivo asociado. Debe existir una zona de transición sana de parénquima pancreático entre el NMPI y el carcinoma invasivo concomitante10,12.
Para la clasificación histopatológica del tipo de papila se utilizó la expresión de mucinas de membrana (MUC)3:
- -
NMPI tipo gástrico: MUC1 (−), MUC2 (−), MUC5AC (+), MUC6 (+)3.
- -
NMPI tipo intestinal: MUC1 (−), MUC2 (+), MUC5AC (+), MUC6 (−)3.
- -
NMPI tipo pancreatobiliar: MUC1 (+), MUC2 (−), MUC5AC (+), MUC6 (+)3.
Valores de CA 19-9 sérico menores o iguales a 37U/ml fueron considerados como normales13. Pacientes con hiperbilirrubinemia fueron excluidos.
Las indicaciones preoperatorias se detallan en la figura 1.
Todas las resecciones pancreáticas se realizaron con criterios oncológicos y con linfadenectomía estándar.
La morbilidad postoperatoria se definió como toda complicación posquirúrgica local o general (sistémica) dentro de los primeros 90 días del período postoperatorio. La fístula pancreática se definió como aquella clínicamente relevante grado B o C, de acuerdo con la clasificación del International Study Group on Pancreatic Fistula14. La hemorragia pospancreatectomía fue determinada como todo episodio de hemorragia posquirúrgico grado B o C de acuerdo con la clasificación del International Study Group of Pancreatic Surgery15. La infección de sitio operatorio se determinó de acuerdo con los criterios de Centers for Disease Control and Prevention (CDC)16. El absceso intraabdominal se estableció con la presencia de signos clínicos de sepsis (taquicardia, leucocitosis, fiebre), el hallazgo tomográfico de una colección y un cultivo positivo de la colección. Se utilizó la clasificación de Clavien-Dindo modificada para la gradación de las complicaciones17. Las complicaciones severas se consideraron como Clavien-Dindo grado III o más. La mortalidad postoperatoria fue definida como la ocurrida dentro de los 90 días posquirúrgicos o durante la hospitalización.
Análisis estadísticoEl análisis estadístico fue realizado utilizando el SPSS Statistics de IBM versión 25 para Windows. Las variables discretas se expresan como frecuencias y porcentajes, las variables continuas se expresan como medianas y rangos intercuartílicos (RIQ). Las variables categóricas fueron comparadas con la prueba de Chi-cuadrado. Se realizó análisis univariado para evaluar los factores asociados a displasia de alto grado y carcinoma invasivo. Las variables que tuvieron correlación estadística significativa en el análisis univariado fueron incluidas en el análisis multivariado. El valor de p<0,05 fue considerado como estadísticamente significativo. Para calcular la supervivencia se usó el método de Kapplan-Meier.
El trabajo se realizó de acuerdo con las normas STROBE (Strengthening the Reporting of Observational Studies in Epidemiology)18, cumple con la normativa vigente en investigación bioética y tuvo la autorización del Comité de Ética de la institución.
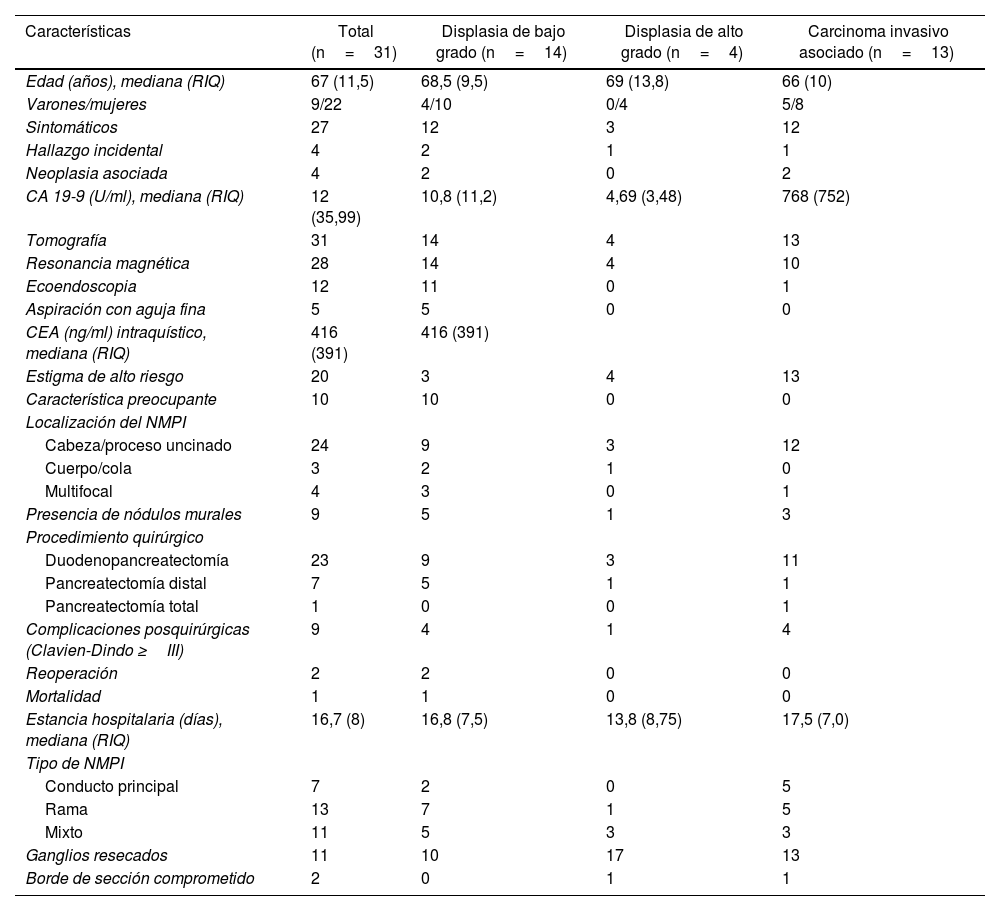
ResultadosDurante el período de estudio se realizaron 399 resecciones pancreáticas (320 duodenopancreatectomías y 79 pancreatectomías distales); de estas, 31 (7,7%) tuvieron diagnóstico anatomopatológico de NMPI. Nueve pacientes fueron varones y 22 fueron mujeres. La edad media de los varones fue 64,3 años y la de las mujeres 69 años. Veintisiete pacientes (87%) presentaron síntomas, siendo el más frecuente el dolor abdominal en 20 pacientes (64,5%), seguido de la pérdida de peso en 10 pacientes (32,3%). La ictericia estuvo presente en 12 pacientes (38,7%); de estos, 11 tuvieron carcinoma invasivo asociado y uno displasia de bajo grado. La pancreatitis estuvo presente en 4 pacientes (12,9%); de estos, uno tuvo carcinoma invasivo asociado y 3 displasia de bajo grado (tabla 1).
Características clínico-patológicas de las NMPI resecadas
| Características | Total (n=31) | Displasia de bajo grado (n=14) | Displasia de alto grado (n=4) | Carcinoma invasivo asociado (n=13) |
|---|---|---|---|---|
| Edad (años), mediana (RIQ) | 67 (11,5) | 68,5 (9,5) | 69 (13,8) | 66 (10) |
| Varones/mujeres | 9/22 | 4/10 | 0/4 | 5/8 |
| Sintomáticos | 27 | 12 | 3 | 12 |
| Hallazgo incidental | 4 | 2 | 1 | 1 |
| Neoplasia asociada | 4 | 2 | 0 | 2 |
| CA 19-9 (U/ml), mediana (RIQ) | 12 (35,99) | 10,8 (11,2) | 4,69 (3,48) | 768 (752) |
| Tomografía | 31 | 14 | 4 | 13 |
| Resonancia magnética | 28 | 14 | 4 | 10 |
| Ecoendoscopia | 12 | 11 | 0 | 1 |
| Aspiración con aguja fina | 5 | 5 | 0 | 0 |
| CEA (ng/ml) intraquístico, mediana (RIQ) | 416 (391) | 416 (391) | ||
| Estigma de alto riesgo | 20 | 3 | 4 | 13 |
| Característica preocupante | 10 | 10 | 0 | 0 |
| Localización del NMPI | ||||
| Cabeza/proceso uncinado | 24 | 9 | 3 | 12 |
| Cuerpo/cola | 3 | 2 | 1 | 0 |
| Multifocal | 4 | 3 | 0 | 1 |
| Presencia de nódulos murales | 9 | 5 | 1 | 3 |
| Procedimiento quirúrgico | ||||
| Duodenopancreatectomía | 23 | 9 | 3 | 11 |
| Pancreatectomía distal | 7 | 5 | 1 | 1 |
| Pancreatectomía total | 1 | 0 | 0 | 1 |
| Complicaciones posquirúrgicas (Clavien-Dindo ≥III) | 9 | 4 | 1 | 4 |
| Reoperación | 2 | 2 | 0 | 0 |
| Mortalidad | 1 | 1 | 0 | 0 |
| Estancia hospitalaria (días), mediana (RIQ) | 16,7 (8) | 16,8 (7,5) | 13,8 (8,75) | 17,5 (7,0) |
| Tipo de NMPI | ||||
| Conducto principal | 7 | 2 | 0 | 5 |
| Rama | 13 | 7 | 1 | 5 |
| Mixto | 11 | 5 | 3 | 3 |
| Ganglios resecados | 11 | 10 | 17 | 13 |
| Borde de sección comprometido | 2 | 0 | 1 | 1 |
CA 19-9: antígeno carbohidrato 19-9; CEA: antígeno carcinoembrionario; NMPI: neoplasia mucinosa papilar intraductal; RIQ: rango intercuartílico.
Todos los pacientes tuvieron tomografía como parte de los estudios preoperatorios y 28 pacientes resonancia magnética (fig. 1). La ecoendoscopia se realizó en 12 pacientes (38,7%) y la aspiración con aguja fina en 5 pacientes (16,1%). La mediana del valor del antígeno carcinoembrionario (CEA) del líquido intraquístico obtenido por aspiración con aguja fina fue de 416ng/ml (rango 121-731ng/ml). Sólo un paciente tuvo un valor menor de 192ng/ml (tabla 1).
Los estigmas de alto riesgo se encontraron en 20 pacientes (64,5%) y las características preocupantes en 10 pacientes (32,2%). La localización más frecuente de las NMPI fue en cabeza de páncreas en 24 pacientes (77,4%). Se realizaron 23 duodenopancreatectomías, 7 pancreatectomías distales con esplenectomía (3 por laparoscopia y 4 abiertas) y una pancreatectomía total.
La inmunohistoquímica con MUC se realizó en 4 pacientes (13%), de los cuales 2 tuvieron NMPI tipo intestinal (uno asociado a carcinoma invasivo de tipo coloide y el otro con displasia de alto grado) y 2 NMPI tipo pancreatobiliar (uno asociado a carcinoma invasivo de tipo ductal y el otro con displasia de alto grado).
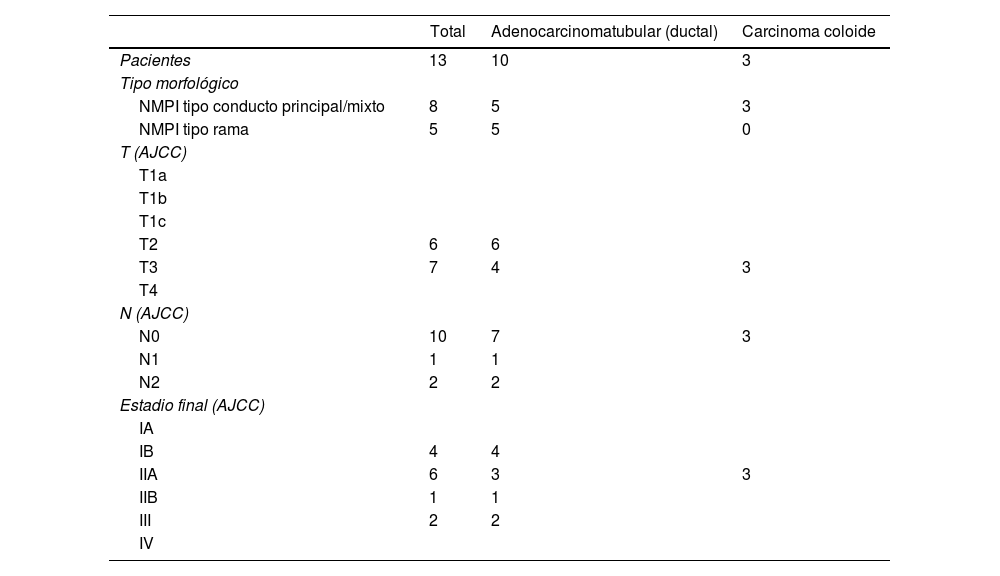
El carcinoma invasivo asociado estuvo presente en 13 pacientes (41,9%), la displasia de alto grado en 4 pacientes (12,9%) y la displasia de bajo grado en 14 pacientes (45,2%). De los 7 paciente con NMPI tipo conducto principal, 5 pacientes tuvieron carcinoma invasivo asociado (71,4%); de los 11 pacientes con NMPI de tipo mixto, 3 tuvieron carcinoma invasivo asociado (27%); y de los 13 pacientes con NMPI tipo rama, 5 pacientes tuvieron carcinoma invasivo asociado (38,5%) (tabla 2).
NMPI resecadas con carcinoma invasivo asociado
| Total | Adenocarcinomatubular (ductal) | Carcinoma coloide | |
|---|---|---|---|
| Pacientes | 13 | 10 | 3 |
| Tipo morfológico | |||
| NMPI tipo conducto principal/mixto | 8 | 5 | 3 |
| NMPI tipo rama | 5 | 5 | 0 |
| T (AJCC) | |||
| T1a | |||
| T1b | |||
| T1c | |||
| T2 | 6 | 6 | |
| T3 | 7 | 4 | 3 |
| T4 | |||
| N (AJCC) | |||
| N0 | 10 | 7 | 3 |
| N1 | 1 | 1 | |
| N2 | 2 | 2 | |
| Estadio final (AJCC) | |||
| IA | |||
| IB | 4 | 4 | |
| IIA | 6 | 3 | 3 |
| IIB | 1 | 1 | |
| III | 2 | 2 | |
| IV | |||
AJCC: American Joint Committee on Cancer; NMPI: neoplasia mucinosa papilar intraductal.
El carcinoma concomitante sincrónico estuvo presente sólo en una paciente (3,2%) con NMPI de tipo rama y fue un adenocarcinoma ductal.
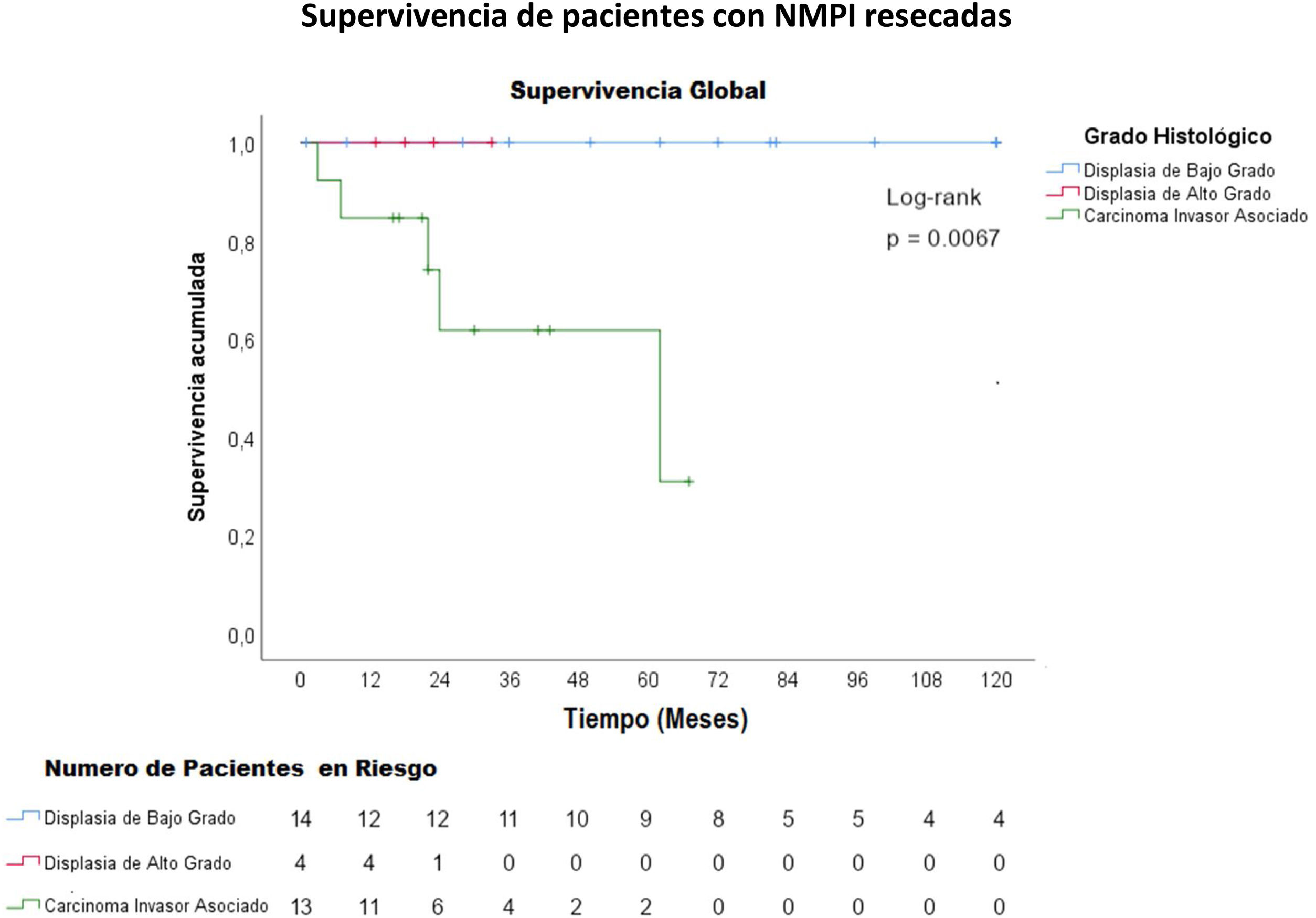
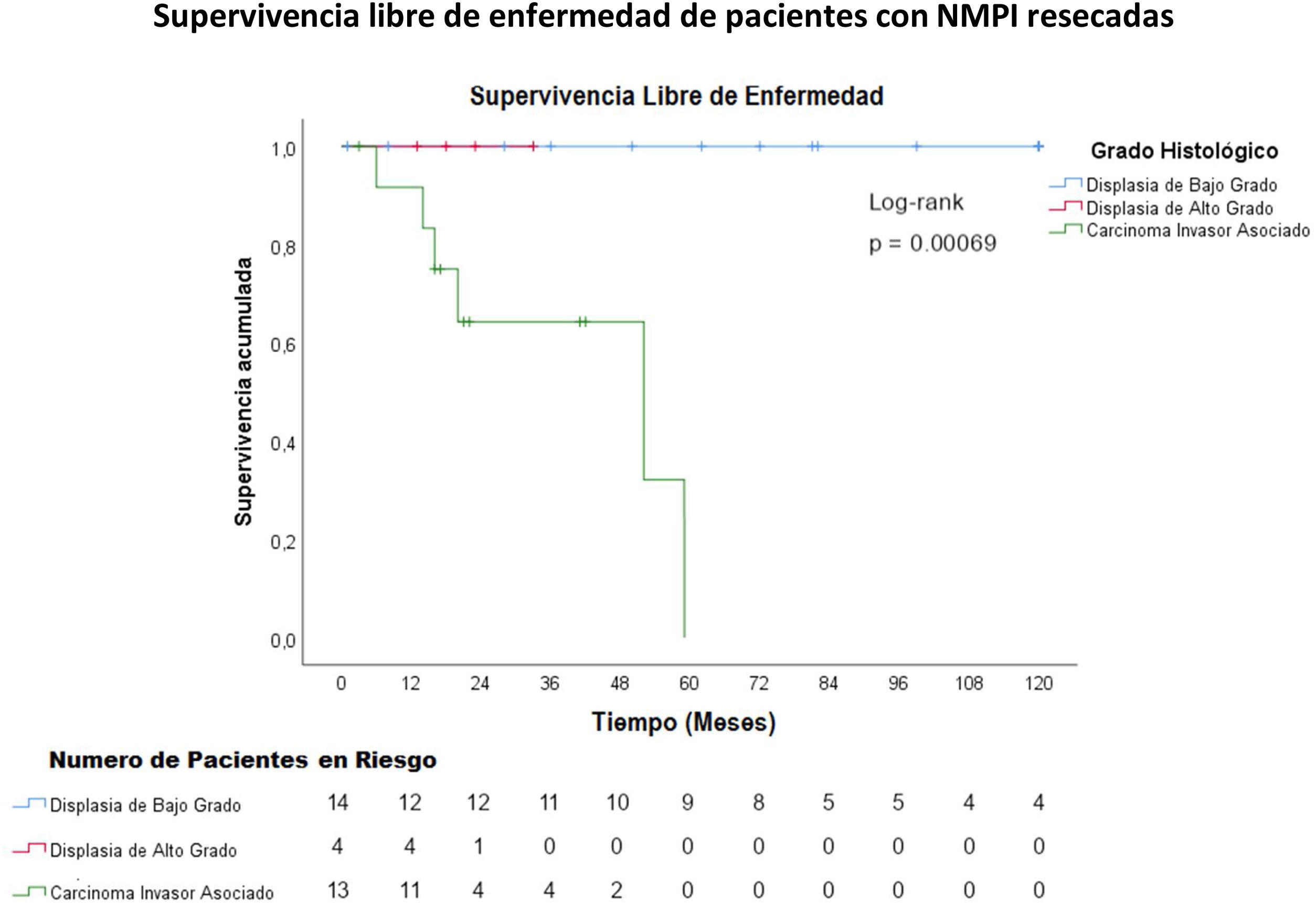
La mediana del seguimiento fue de 33 meses con un rango de 1 mes (paciente que falleció por complicaciones postoperatorias) a 144 meses (12 años). La supervivencia media de los pacientes con NMPI y carcinoma invasivo asociado fue de 45,8 meses y la supervivencia media libre de enfermedad de estos pacientes fue de 40,8 meses (figs. 2 y 3). La supervivencia de los pacientes con carcinoma invasivo tubular fue de 45 meses y de los pacientes con carcinoma coloide, de 52 meses (p=0,84).
En un estudio multicéntrico realizado en más de 100 hospitales de Estados Unidos se encontró que el 10% de las resecciones pancreáticas se realizaban por NMPI19. En nuestro servicio, el 7,7% de las resecciones pancreáticas realizadas durante el período de estudio correspondieron a NMPI.
En la presente serie, la edad promedio en el momento de la cirugía fue de 67 años, valor similar a otras series contemporáneas de NMPI resecadas en donde reportan una edad promedio de 69 años al momento de la cirugía20, con un rango de 40-75 años21. Así mismo, se encontró una mayor prevalencia en mujeres, distinto a lo reportado en la mayoría de las series, en donde se menciona una prevalencia ligeramente mayor en varones21,22.
La mayoría de los pacientes del presente trabajo presentaron síntomas, siendo el dolor el más frecuente. Este hallazgo es también contrario a lo encontrado en otras series, en las que el hallazgo incidental es más frecuente21,23. Cuando los pacientes presentan síntomas, el dolor abdominal es el más frecuente (35%), seguido de la pérdida de peso (29%), ictericia (11%)20, inicio de diabetes, o empeoramiento de esta, esteatorrea21 y pancreatitis aguda (13-32%)24. Se cree que la abundante mucina producida por las NMPI podría causar obstrucción ductal resultando en pancreatitis aguda25, en su mayoría leves, sin embargo, también se han descrito pancreatitis necrotizantes hasta en un 4%26. Actualmente la pancreatitis se considera como una característica preocupante y es una indicación de cirugía para evitar una eventual pancreatitis grave10,25. En esta serie 4 pacientes (13%) tuvieron pancreatitis aguda, todas de curso leve.
El diagnóstico de la NMPI se basa en estudios radiológicos (tomografía o la resonancia magnética contrastada con gadolinio y con pancreatocolangiografía) y ecoendoscopia. Estos estudios tienen diferentes objetivos: primero, diferenciar la NMPI de otras lesiones quísticas de páncreas; segundo, determinar el tipo de NMPI, y tercero, identificar las características asociadas a malignidad21. La resonancia magnética tiene mayor sensibilidad que la tomografía para identificar la comunicación entre el quiste y el sistema ductal pancreático, característica de las NMPI; también puede identificar múltiples quistes, nódulos, paredes engrosadas y el tamaño del conducto pancreático principal21. Más recientemente, se ha propuesto la restricción a la difusión en la resonancia como una característica radiológica de NMPI asociadas a carcinoma invasivo27.
La ecoendoscopia se considera como un estudio diagnóstico de «segundo nivel», después de la resonancia magnética y la tomografía10,21. Este procedimiento ayuda a diferenciar la NMPI de la neoplasia quística serosa macroquística y el seudoquiste pancreático mediante el análisis del líquido del quiste (CEA, amilasa/lipasa, glucosa y la citología)21. Se recomienda realizarla en aquellos pacientes con «características preocupantes» y en los que no se tenga un diagnóstico claro10 (fig. 1). Valores de CEA del líquido superiores a 192ng/ml diferencian las neoplasias mucinosas de las no mucinosas10,21, con una sensibilidad del 38-78% y una especificidad del 63-99%, pero no ayuda a diferenciar una neoplasia benigna de una maligna21. La citología de líquido quístico puede ayudar en el diagnóstico, aunque con una baja sensibilidad debido a la escasa celularidad10. El análisis molecular del líquido está aún en desarrollo, siendo las mutaciones de los genes KRAS y GNAS las que ayudan en el diagnóstico de los quistes mucinosos y a reconocer los quistes de comportamiento indolente que podrían observarse, respectivamente10. En la presente serie se realizó ecoendoscopia en 12 pacientes debido a duda diagnóstica y punción con aguja fina en 5 casos debido a que no se pudo demostrar claramente la comunicación de la lesión quística con el sistema ductal pancreático en la resonancia magnética, obteniéndose un valor de CEA>192ng/ml en el 75% de los casos. La ecoendoscopia también permite identificar los nódulos murales verdaderos y diferenciarlos de los tapones de moco, sobre todo cuando se usa el contraste armónico, con una sensibilidad del 60-100% y especificidad del 75-93%28. En los pacientes de este trabajo se identificaron nódulos murales por ecoendoscopia en 3 casos con displasia de bajo grado y en 3 casos con carcinoma invasivo asociado. Estos resultados probablemente sean debidos a que no contamos con el contraste armónico en nuestro medio.
Un valor de CA 19-9 sérico elevado también se encuentra en pacientes con una NMPI y carcinoma invasivo asociado hasta en un 63%28,29, con una sensibilidad del 34,2 al 52% y una especificidad del 89 al 92%30,31. En esta serie el 61% de pacientes con NMPI y carcinoma invasivo asociado tuvieron un valor elevado de este marcador.
Considerando que la cirugía está indicada en la NMPI con riesgo potencial de cáncer, el tratamiento quirúrgico debe consistir en una resección oncológica con linfadenectomía estándar32. Estas resecciones pancreáticas tienen una mayor morbilidad que otras cirugías gastrointestinales, además de complicaciones a largo plazo como insuficiencia pancreática endocrina y exocrina, así como el desarrollo de hígado graso33. Por estas razones no se recomienda la cirugía en todos los pacientes con NMPI. Idealmente la resección debería hacerse cuando la NMPI tenga displasia de alto grado21,29,33,34, sin embargo, es difícil hacer este diagnóstico en el preoperatorio33. En la presente serie, el 12,9% de pacientes tuvo displasia de alto grado en el momento de la resección y un 41,9% tuvo NMPI con carcinoma invasivo asociado. El 45,2% tuvo displasia de bajo grado, se operaron debido a la dilatación del Wirsung en 7 casos, presencia de nódulos murales en 5 casos y los otros 2 casos debido a que no se tenía un diagnóstico claro.
No hay duda de que toda NMPI de tipo conducto principal o mixta debe operarse9,10 debido al elevado porcentaje de carcinoma invasivo asociado, lo difícil es determinar cuándo resecar una NMPI de tipo rama, la cual tiene un riesgo de carcinoma invasivo asociado del 16,5 al 18,5%9,10,21. Además, debemos tener en cuenta que el porcentaje de malignidad de las NMPI tipo rama está sobreestimado, debido a que estos valores se basan en series de NMPI resecadas y actualmente la mayoría de estos pacientes se manejan con protocolos de observación y seguimiento. Como consecuencia, la incidencia de carcinoma invasivo asociado de todas las NMPI tipo rama probablemente sea inferior al 5%21. En un estudio de seguimiento de más de 20 años de pacientes con NMPI de tipo rama, encontraron que la incidencia a 5 años de carcinoma invasivo asociado fue del 3,3%, llegando al 12% a los 15 años35. En el presente trabajo encontramos una incidencia de carcinoma invasivo asociado a NMPI tipo rama del 38,5%, valor elevado si lo comparamos con las series contemporáneas; esto probablemente se deba al pequeño número de pacientes resecados o a un comportamiento distinto de esta patología en nuestra población. Aunque la resección de la NMPI tipo rama ciertamente merece consideración, debemos tener presente que estas lesiones ocurren en pacientes ancianos y el ritmo anual de progresión a displasia de alto grado o carcinoma invasivo es relativamente bajo (1,4-6-9%)10; esto nos permite hacer observación y seguimiento a los casos que no tengan predictores de carcinoma invasivo o displasia de alto grado.
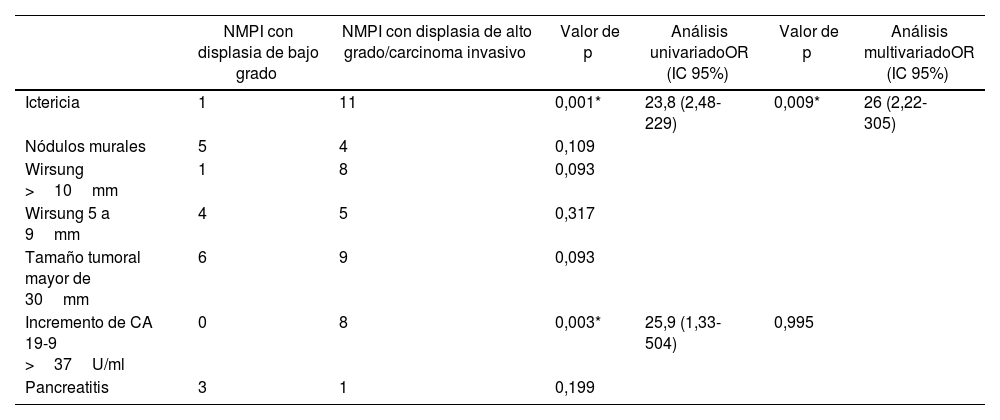
La ictericia, los nódulos murales captadores de contraste o el componente sólido y la dilatación del conducto pancreático principal ≥10mm tienen un valor predictivo para malignidad del 56-89%32. Un estudio actual de los estigmas de alto riesgo y características preocupantes propuestos por la IAP encontró que la presencia de ictericia, el tamaño del quiste mayor de 3cm, el componente sólido o nódulos murales, el dolor como síntoma y la pérdida de peso estuvieron asociados significativamente a NMPI con displasia de alto grado y carcinoma invasivo36. En la presente serie, el análisis univariado de los factores asociados a displasia de alto grado y carcinoma invasivo estadísticamente significativos fueron ictericia y valor de CA 19-9>37U/ml; sin embargo, al realizar el análisis multivariado, sólo la ictericia mostró significación estadística (tabla 3).
Análisis univariado y multivariado de los factores asociados a displasia de alto grado y carcinoma invasivo
| NMPI con displasia de bajo grado | NMPI con displasia de alto grado/carcinoma invasivo | Valor de p | Análisis univariadoOR (IC 95%) | Valor de p | Análisis multivariadoOR (IC 95%) | |
|---|---|---|---|---|---|---|
| Ictericia | 1 | 11 | 0,001* | 23,8 (2,48-229) | 0,009* | 26 (2,22-305) |
| Nódulos murales | 5 | 4 | 0,109 | |||
| Wirsung >10mm | 1 | 8 | 0,093 | |||
| Wirsung 5 a 9mm | 4 | 5 | 0,317 | |||
| Tamaño tumoral mayor de 30mm | 6 | 9 | 0,093 | |||
| Incremento de CA 19-9 >37U/ml | 0 | 8 | 0,003* | 25,9 (1,33-504) | 0,995 | |
| Pancreatitis | 3 | 1 | 0,199 |
CA 19-9: antígeno carbohidrato 19-9; IC: intervalo de confianza; NMPI: neoplasia mucinosa papilar intraductal; OR: odds ratio.
Los carcinomas asociados a una NMPI, así como el adenocarcinoma concomitante tienen un mejor pronóstico comparado con el adenocarcinoma de páncreas común4. La supervivencia media de una NMPI asociada a carcinoma invasivo es de 76,6 meses37 y la supervivencia media libre de enfermedad es de 60,3 meses38. Algunos estudios han demostrado una supervivencia a 5 años del 55% para el carcinoma tubular y 87% para los carcinomas coloides, con una media de 23-26 meses para el carcinoma tubular y 91-127 meses para el carcinoma coloide4,39. En el presente trabajo, la supervivencia media de los pacientes con NMPI y carcinoma invasivo asociado fue de 45,8 meses y la supervivencia media libre de enfermedad de estos pacientes fue de 40,8 meses (figs. 2 y 3). La supervivencia fue mayor en los pacientes con carcinoma coloide asociado comparados con el carcinoma tubular (52 meses versus 48 meses).
La recurrencia después de la resección de una NMPI con displasia de bajo y alto grado varía del 0 al 17% y puede llegar hasta un 43,3% después de la resección de un carcinoma invasivo asociado32,34, por lo que se recomienda la vigilancia de por vida del remanente pancreático.
Las limitaciones de este trabajo son: el diseño retrospectivo, el incluir sólo a pacientes con NMPI resecadas, la limitación de recursos como la ecoendoscopia con contraste armónico, así como el número relativamente pequeño de pacientes. Debemos tener en cuenta además que, si bien el trabajo se ha realizado en base a conceptos recientes, durante el período de estudio, esta patología ha tenido cambios en lo que respecta a la definición, clasificación e indicaciones para la resección y seguimiento.
Hasta que aparezcan herramientas más confiables para determinar cuándo resecar una NMPI, sobre todo la de tipo rama, el tratamiento de esta patología debe basarse en discusiones multidisciplinarias, individualizando a cada paciente y revisando las guías existentes.
En conclusión, la NMPI del páncreas es una enfermedad heterogénea y potencialmente maligna, con mayor prevalencia en mujeres, fue predominantemente sintomática y tuvo una elevada incidencia de carcinoma invasivo asociado a las de tipo rama en nuestros pacientes operados.
A pesar de las guías actuales de tratamiento, hacer un diagnóstico preoperatorio exacto es difícil y muchas veces se tiene que valorar los riesgos de una cirugía pancreática y el potencial maligno de esta enfermedad.
La supervivencia a 5 años de pacientes con NMPI resecadas aun con carcinoma invasivo asociado es buena.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.