Durante los últimos años, los cambios culturales de la sociedad actual y la mejora en la valoración del riesgo han incrementado la indicación de las mastectomías en mujeres con cáncer de mama. Diversos estudios han confirmado la seguridad oncológica de la mastectomías preservadoras y reconstrucción inmediata. El objetivo de este estudio es analizar la incidencia de recaídas locorregionales de este procedimiento y su impacto en la reconstrucción y la supervivencia global.
Pacientes y métodosEstudio prospectivo de pacientes con un carcinoma de mama que realizaron una mastectomía preservadora y reconstrucción inmediata. Se analizaron las recaídas locorregionales, el tratamiento de las mismas y la capacidad de preservar la reconstrucción, así como su impacto en la supervivencia.
ResultadosEl grupo a estudio lo constituyen 271 mujeres con carcinoma mamario tratadas mediante una mastectomía ahorradora de piel y reconstrucción inmediata. El seguimiento medio fue de 7,98 años y durante el mismo se diagnosticaron 18 recaídas locorregionales (6,6%): 72,2% en el colgajo de la mastectomía y 27,8% ganglionares. No se evidenciaron diferencias significativas en las características patológicas del tumor primario entre las pacientes con y sin una recaída locorregional, aunque el porcentaje de mujeres con tumores hormonosensibles fue superior en el grupo sin recaída. Las pacientes con recaída ganglionar presentaban tumores de mayor tamaño (el 80% T2-T3) y el 60% tenían metástasis axilares al diagnóstico vs. 7,7% de las mujeres con recaída en piel (p = 0,047). Todas las pacientes intervenidas de una recaída locorregional preservaron su reconstrucción. La incidencia de metástasis y muertes fue significativamente mayor en las pacientes con una recaída, causando una disminución no significativa de la supervivencia global.
ConclusiónLas recaídas locorregionales son un evento poco frecuente en las mujeres con una mastectomía preservadora y reconstrucción inmediata. La mayoría de las pacientes con recaída locorregional pueden preservar su reconstrucción inicial mediante la resección local del tumor y las terapias adyuvantes y/o neoadyuvantes.
In recent years, cultural changes in today's society and improved risk assessment have increased the indication for mastectomies in women with breast cancer. Various studies have confirmed the oncological safety of sparing mastectomies and immediate reconstruction. The objective of this study is to analyze the incidence of locoregional relapses of this procedure and its impact on reconstruction and overall survival.
Patients and methodsProspective study of patients with breast carcinoma who underwent a sparing mastectomy and immediate reconstruction. Locoregional relapses and their treatment and their impact on survival were analyzed.
ResultsThe study group is made up of 271 women with breast carcinoma treated with a skin-sparing mastectomy and immediate reconstruction. The mean follow-up was 7.98 years and during the same 18 locoregional relapses (6.6%) were diagnosed: 72.2% in the mastectomy flap and 27.8% lymph node. There were no significant differences in the pathological characteristics of the primary tumor between patients with and without locoregional relapse, although the percentage of women with hormone-sensitive tumors was higher in the group without relapse. Patients with lymph node relapse had larger tumors (80% T2–T3) and 60% had axillary metastases at diagnosis, compared to 7.7% of women with skin relapse (p = 0.047). All patients operated on for locoregional relapse preserved their reconstruction. The incidence of metastases and deaths was significantly higher in patients with a relapse, causing a non-significant decrease in overall survival.
ConclusionLocoregional relapses are a rare event in women with a sparing mastectomy and immediate reconstruction. Most patients with locoregional relapse can preserve their initial reconstruction through local resection of the tumor and adjuvant and/or neoadjuvant therapies.
La cirugía conservadora de mama asociada a radioterapia es el tratamiento estándar para el carcinoma mamario en estadio inicial1. Diversos estudios2–4 han demostrado que esta estrategia terapéutica proporciona una supervivencia global (SG) similar a la mastectomía radical modificada (MRM). No obstante, un 20-40% de las mujeres con un carcinoma mamario precisarán una mastectomía1. Durante los últimos años, tres hechos han condicionado un incremento en la indicación de mastectomías5–8. En primer lugar, la mejora en la valoración del riesgo para cáncer de mama ha condicionado un incremento en la indicación de la mastectomía con reconstrucción inmediata (RI)8. En segundo lugar, la mejora en el nivel cultural de la sociedad y la disponibilidad de información ha permitido a muchas mujeres valorar la mastectomía como su mejor opción frente al manejo conservador5. Finalmente, la evolución de los procedimientos de mastectomía y reconstrucción, especialmente la reconstrucción prepectoral, han permitido mejores resultados cosméticos, menor morbilidad, mayor satisfacción por parte de las pacientes y una seguridad oncológica similar a la MRM6,7,9–12.
En este contexto, las mastectomías preservadoras de piel (MPP) o de piel y pezón (MPPP) con RI se han convertido en el estándar actual. No obstante, algunas de estas pacientes presentarán una recaída locorregional (RLR) durante su seguimiento, lo cual plantea tres dificultades para el cirujano. La primera, valorar la preservación de la reconstrucción y su seguridad oncológica. La segunda, seleccionar un procedimiento quirúrgico adaptado a la mama reconstruida y a la enfermedad que, junto con las terapias adyuvantes (radioterapia, quimioterapia), garanticen el control locorregional del proceso. Finalmente, evaluar el impacto de la recaída en la supervivencia de la paciente a medio y largo plazo.
El objetivo de este estudio es analizar la incidencia de RLR tras una MPP con RI, la preservación de la reconstrucción inicial y el impacto de la recidiva en la SG a largo plazo.
Pacientes y métodosEstudio prospectivo de pacientes con un carcinoma de mama que realizaron una MPP/MPPP y RI intervenidas entre 2008 y 2020 en la Unida de Mama de nuestro centro. Se excluyeron pacientes con un carcinoma inflamatorio o progresión durante la terapia sistémica primaria (TSP). Se incluyeron todos los procedimientos de RI: implantes, colgajos musculares y mixta. Se realizó un análisis de las RLR y factores de riesgo para su aparición, así como su tratamiento y el impacto en la SG.
Definiciones. Se definió como RLR la aparición de tejido tumoral (confirmado histológicamente) en la pared torácica (piel, subcutáneo o músculo) o en regiones ganglionares ipsilaterales. Se excluyeron aquellas pacientes con metástasis a distancia de forma sincrónica o previo al diagnóstica de la RLR. Se definió como SG el tiempo transcurrido desde el diagnóstico de la enfermedad hasta el fallecimiento por cualquier causa. En caso de estar vivas fue el tiempo transcurrido hasta la fecha de la última revisión.
Tratamiento quirúrgico tras diagnóstico de cáncer de mama. Todas las pacientes fueron presentadas en el comité multidisciplinar para decidir el esquema terapéutico, basándose en las guías clínicas correspondientes a cada periodo1,13. La elección del tipo de mastectomía y reconstrucción fue decisión del cirujano, atendiendo a los criterios oncológicos y anatómicos de cada paciente. En todas las MPPP se realizó biopsia intraoperatoria del tejido retroareolar.
Tratamientos adyuvantes y neoadyuvantes tras el diagnóstico de cáncer de mama. Las pacientes con tumores con expresión de receptores hormonales recibieron terapia hormonal durante cinco o 10 años. En caso de precisar quimioterapia se utilizaron, principalmente, esquemas basados en antraciclinas y taxanos. En las pacientes con tumores con sobreexpresión de Her2 se indicó tratamiento con trastuzumab y, a partir de 2017, se asoció pertuzumab. Se indicó radioterapia en las pacientes con tumores mayores de 4 cm, afectación del margen de resección y/o metástasis axilares. En ningún caso se irradió la cadena mamaria interna. En casos seleccionados en el comité multidisciplinar se decidió radioterapia únicamente de pared torácica o de cadenas ganglionares.
Evaluación diagnóstica en las pacientes con RLR. A todas las pacientes con sospecha de una RLR se les realizó una biopsia con aguja gruesa guiada por ecografía. Tras la confirmación histológica se realizó una tomografía toraco-abdomino-pélvico para descartar enfermedad sistémica y una resonancia magnética de mama para la planificación quirúrgica.
Tratamiento quirúrgico tras RLR. Las pacientes con una recaída en el colgajo de mastectomía fueron intervenidas mediante una resección de la misma con márgenes libres de enfermedad (no tumor en la tinta). En las pacientes con reconstrucción con implantes se planificó una resección de la recaída mediante un acceso transcapsular, es decir, desde el interior de la cavidad del implante para evitar citarices visibles. Las pacientes con recaída ganglionar fueron sometidas a una linfadenectomía axilar.
Tratamientos adyuvantes y neoadyuvantes tras el diagnóstico de la RLR. Todas las pacientes recibieron terapia sistémica dirigida, según el subtipo tumoral. Aquellas mujeres con tumores con sobreexpresión de Her2 o triple negativo recibieron TSP. Todas las pacientes que no habían sido irradiadas, recibieron radioterapia tras la exéresis de la RLR.
Método estadístico. Las variables cuantitativas se expresarán con su media, desviación estándar (DE) y con su correspondiente intervalo de confianza al 95% (IC 95%). Las variables cualitativas se expresarán en proporciones y sus respectivos intervalos de confianza. Las diferencias entre las diversas variables cualitativas se hallarán mediante el test exacto de Fisher o test de χ2. Las diferencias entre variables cuantitativas se analizarán mediante la prueba t de Student para grupos independientes. Si las condiciones del t-test no se verifican, se utilizará la prueba U de Mann-Whitney. Para la incidencia de RLR y SG se utilizarán las curvas de Kaplan-Meier y su comparación mediante el test del logrank.
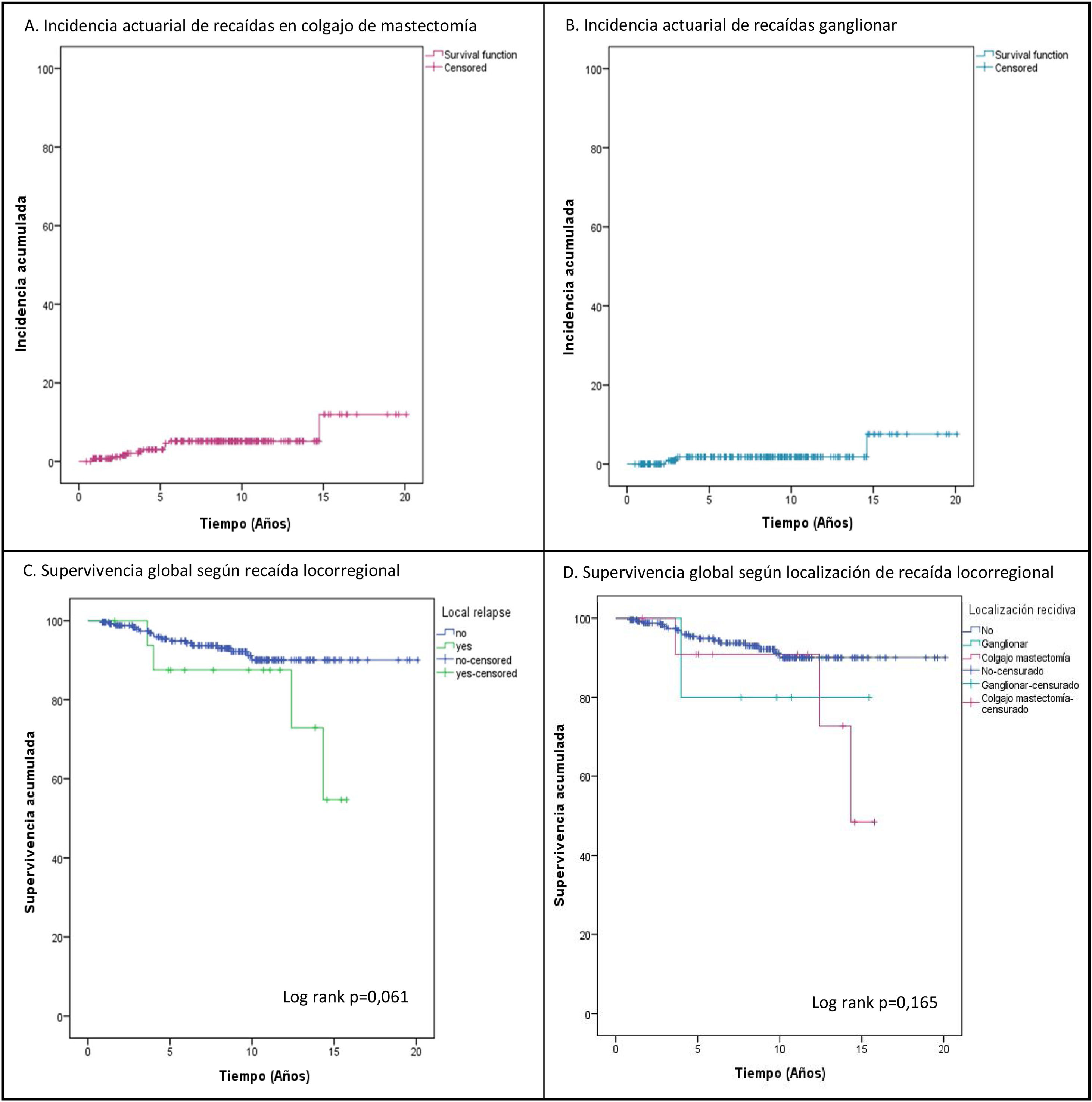
ResultadosEn el periodo a estudio se intervinieron 1.742 pacientes, de las cuales, 271 mujeres constituyen el grupo a estudio (87,5% con carcinoma infiltrante y 12,5% carcinoma ductal in situ). El seguimiento medio fue de 7,98 ± 4,3 años y durante el mismo se diagnosticaron 18 RLR (6,6%) en 17 pacientes. El 72,2% de estas recaídas se localizaron en el colgajo de la mastectomía (13 recaídas en 12 pacientes), con una incidencia actuarial a los cinco y 10 años de 3,6% (IC 95%: 2,4-4,8%) y 5,2% (IC 95%: 3,7-6,7%), respectivamente (fig. 1A). El 27,8% fueron recaídas ganglionares, con una incidencia actuarial a los cinco años de 1,8% (IC 95%: 0,9-2,7%) (fig. 1B).
Características del tumor primario. La tabla 1 compara las características clínico-patológicas entre las pacientes con y sin una RLR. El porcentaje de pacientes con una mutación genética fue superior en las mujeres con una RLR (16,7 vs. 9,1%), diferencia que no fue significativa. No se evidenciaron diferencias significativas en las características patológicas del tumor primario (grado histológico, invasión linfovascular, tamaño y subtipo tumoral), aunque el porcentaje de mujeres con tumores hormonosensibles fue superior en el grupo sin una RLR (73,2 vs. 52,9%).
Características clinicopatológicas y tratamientos complementarios
| Todosn 271 | Recaída locorregional | p | ||
|---|---|---|---|---|
| Sí (n 17) | No (n 254) | |||
| Características clínico patológicas | ||||
| Edad (años) | 46,1 ± 8,5 | 44,3 ± 9,8 | 46,2 ± 8,5 | 0,372 |
| IMC | 24,4 ± 4,1 | 23,5 ± 5,7 | 24,4 ± 4,0 | 0,250 |
| Mutación genética | 26 (9,6%) | 3 (17,6%) | 23 (9,1%) | 0,215 |
| MPPP | 72 (26,6%) | 5 (29,4%) | 67 (26,4%) | 1 |
| Tipo reconstrucción | ||||
| Autóloga | 38 (14,0%) | 6 (35,3%) | 32 (12,6%) | |
| Implantes | 224 (82,4%) | 11 (64,7%) | 213 (83,9%) | 0,003 |
| Autóloga + implantes | 10 (3,7%) | 0 (0,0%) | 10 (3,9%) | |
| Mastectomía bilateral | 95 (35,1%) | 8 (47,1%) | 87 (34,3%) | 0,301 |
| Tumores bilaterales | 15 (5,5%) | 0 (0,0%) | 15 (5,9%) | - |
| Tipo histológico | - | |||
| CDI | 197 (72,7%) | 13 (76,5%) | 184 (72,4%) | |
| CLI | 33 (12,2%) | 0 (0,0%) | 33 (13,0%) | |
| CDis | 34 (12,5%) | 4 (23,5%) | 30 (11,8%) | |
| Mucinoso | 4 (1,5%) | 0 (0,0%) | 4 (1,6%) | |
| Papilar | 2 (0,7%) | 0 (0,0%) | 2 (0,8%) | |
| Tubular | 1 (0,4%) | 0 (0,0%) | 1 (0,4%) | |
| Tamaño tumoral (cm) | 2,3 ± 2,0 | 2,6 ± 3,0 | 2,3 ± 1,9 | 0,728 |
| Tamaño tumoral | ||||
| T0 in situ | 34 (12,5%) | 4 (23,5%) | 30 (11,8%) | |
| T1mic | 3 (1,1%) | 0 (0%) | 3 (1,2%) | |
| T1a | 22 (8,1%) | 3 (17,6%) | 19 (7,5%) | |
| T1b | 34 (12,5%) | 1 (5,9%) | 33 (12,9%) | |
| T1c | 73 (26,8%) | 1 (5,9%) | 72 (28,3%) | 0,106 |
| T2 | 76 (27,9%) | 4 (23,5%) | 72 (28,3%) | |
| T3 | 17 (6,3%) | 2 (11,8%) | 15 (5,9%) | |
| T4 | 2 (0,7%) | 0 (0,0%) | 2 (0,8%) | |
| Tx | 10 (3,7%) | 2 (11,8%) | 8 (3,1%) | |
| Afectación axilar | ||||
| No | 153 (56,5%) | 9 (52,9%) | 144 (56,7%) | |
| Sí | 106 (39,1%) | 6 (35,3%) | 100 (39,4%) | 0,044 |
| No valorable | 12 (4,4%) | 2 (11,8%) | 10 (3,9%) | |
| Linfadenectomía axilar | 101 (37,3%) | 7 (41,1%) | 94 (37,0%) | 0,651 |
| Subtipo tumoral | ||||
| Luminal A | 75 (27,7%) | 2 (11,8%) | 73 (28,7%) | |
| Luminal B Her2- | 82 (30,3%) | 4 (23,5%) | 78 (30,7%) | |
| Luminal B Her2+ | 38 (14%) | 3 (17,6%) | 35 (13,8%) | 0,241 |
| Her2+ | 18 (6,6%) | 1 (5,9%) | 17 (6,7%) | |
| Triple negativo | 24 (8,9%) | 3 (17,6%) | 21 (8,3%) | |
| No válido | 34 (12,5%) | 4 (23,5%) | 30 (11,8%) | |
| Receptores progesterona - | 93 (34,3%) | 8 (47,1%) | 85 (33,5%) | 0,069 |
| Receptores hormonales + | 195 (71,9%) | 9 (52,9%) | 186 (73,2%) | 0,071 |
| Invasión linfo-vascular | 72 (26,6%) | 7 (41,2%) | 65 (25,6%) | 0,222 |
| Alto grado | 109 (40,2%) | 8 (47,1%) | 101 (39,8%) | 0,608 |
| Tratamientos complementarios | ||||
| Terapia sistémica primaria | 33 (12,2%) | 4 (22,5%) | 29 (11,4%) | 0,139 |
| Quimioterapia | 189 (69,7%) | 11 (64,7%) | 178 (70,1%) | 0,647 |
| Radioterapia pared torácica | 57 (21%) | 1 (5,9%) | 56 (22%) | 0,116 |
| Radioterapia c ganglionares | 61 (22,5%) | 2 (11,8%) | 59 (23,2%) | 0,275 |
| Anticuerpos | 56 (20,7%) | 4 (23,5%) | 52 (20,5%) | 0,767 |
| Hormonoterapia | 195 (71,9%) | 9 (52,9%) | 186 (73,2%) | 0,071 |
| Eventos durante el seguimiento | ||||
| Cáncer contralateral | 3 (1,1%) | 0 (0,0%) | 3 (1,2%) | - |
| Metástasis a distancia | 22 (8,1%) | 4 (23,5%) | 18 (7,1%) | 0,038 |
| Exitus | 21 (7,7%) | 4 (23,5%) | 17 (6,7%) | 0,033 |
| Otros tumores | 6 (2,2%) | 0 (0,0%) | 6 (2,4%) | - |
IMC: índice de masa corporal; MPPP: mastectomía preservadora de piel y pezón; CDI: carcinoma ductal infiltrante; CDis: carcinoma ductal in situ.
*No se operó por progresión durante quimioterapia neoadyuvante.
Cifras en negritas representan los datos con diferencias estadísticamente significativas.
No hubo diferencias estadísticamente significativas en los tratamientos complementarios administrados en ambos grupos (tabla 1). Un 21% de las pacientes recibieron radioterapia. La mayoría de las mujeres con una RLR (83,3%) no recibieron radioterapia de pared torácica y/o cadenas ganglionares. No obstante, la incidencia de RLR fue similar en las pacientes irradiadas (3,3%) que en las pacientes sin radioterapia (7,1%).
Características y tratamiento de las recaídas locorregionales. No se detectaron diferencias significativas en las características anatomopatológicas entre las pacientes con una recaída ganglionar y aquellas con una recaída en el colgajo de mastectomía (tabla 2). Sin embargo, las pacientes con recaída ganglionar presentaban tumores de mayor tamaño (el 80% T2-T3) y el 60% tenían metástasis axilares al diagnóstico vs. 7,7% de las mujeres con recaída en piel (p = 0,047). Tras 4,9 años de seguimiento medio desde la intervención de la RLR solo una paciente presentó otra recaída local (10 años después de la primera recaída).
Características clinicopatológicas del tumor inicial según localización de la recaída
| Recaída locorregionaln 18 | Recaída en piel y pared torácican 13 | Recaída en axilan 5 | p | |
|---|---|---|---|---|
| Edad al diagnóstico 1er tumor | 43,6 ± 9,5 | 44,5 ± 9,5 | 41,2 ± 10,7 | 0,520 |
| Tiempo medio de aparición recaída (años) | 4,9 ± 4,1 | 4,5 ± 3,8 | 5,1 ± 5,3 | 0,921 |
| Tiempo de aparición | ||||
| < 2 años | 2 (11,1%) | 2 (15,4%) | 0 (0%) | 0,390 |
| 2-5 años | 10 (55,6%) | 6 (46,2%) | 4 (80%) | |
| > 5 años | 6 (33,3%) | 5 (38,5%) | 1 (20%) | |
| Tratamiento neoadyuvante en la recaída | ||||
| Tipo de tumor inicial | 3 (16,7%) | 1 (7.6%) | 2 (40%) | |
| CDis | 4 (22,2%) | 3 (23,1%) | 1 (20%) | 1 |
| CDI | 14 (77,7%) | 10 (76,9%) | 4 (80%) | |
| Tamaño tumoral | ||||
| Tis | 4 (22,2%) | 3 (23,1%) | 1 (20%) | 0,104 |
| T1a | 3 (16,7%) | 3 (23,1%) | 0 (0%) | |
| T1b | 2 (11,1%) | 2 (15,4%) | 0 (0%) | |
| T1c | 2 (11,1%) | 2 (15,4%) | 0 (0%) | |
| T2 | 4 (22,2%) | 1 (7,7%) | 3 (60%) | |
| T3 | 1 (5,6%) | 0 (0%) | 1 (20%) | |
| Tx | 2 (11,1%) | 2 (15,4%) | 0 (0%) | |
| Subtipo tumoral | ||||
| Luminal A | 2 (11,1%) | 1 (7,7%) | 1 (20%) | |
| Luminal B Her2- | 5 (27,8%) | 4 (30,8%) | 1 (20%) | 0,543 |
| Luminal B Her2+ | 2 (11,1%) | 2 (15,4%) | 0 (0%) | |
| Her2+ | 1 (5,6%) | 0 (0,0%) | 1 (20%) | |
| Triple negativo | 4 (22,2%) | 3 (23,1%) | 1 (20%) | |
| No valorable | 4 (22,2%) | 3 (23,1%) | 1 (20%) | |
| Afectación ganglionar | 4 (22,2%) | 1 (7,7%) | 3 (60%) | 0,047 |
| Tratamiento tumor inicial | ||||
| Radioterapia pared | 1 (5,6%) | 0 (0%) | 1 (20%) | - |
| Radioterapia cadenas | 2 (11,1%) | 1 (7,7%) | 1 (20%) | 0,490 |
| Quimioterapia | 11 (61,1%) | 7 (53,8%) | 4 (80%) | 0,596 |
| Hormonoterapia | 9 (50%) | 7 (53,8%) | 2 (40%) | 0,618 |
| Anti-Her2 | 3 (16,7%) | 2 (15,4%) | 1 (20%) | 0,701 |
| Forma diagnóstico recaída | ||||
| Prueba de imagen | 6 (33,3%) | 4 (30,8%) | 2 (40%) | 1 |
| Palpación | 12 (66,7%) | 9 (69,2%) | 3 (60%) | |
CDI: carcinoma ductal infiltrante; CDis: carcinoma ductal in situ.
Recaída ganglionar. El 80% de las recaídas ganglionares se diagnosticaron en los primeros tres años (fig. 1B) y el 60% presentaron el mismo subtipo tumoral (tabla 3). Una paciente no fue intervenida de su recaída por progresión sistémica de la enfermedad durante la TSP, falleciendo 20 meses después del diagnóstico de la recaída. Las cuatro pacientes restantes fueron sometidas a una linfadenectomía axilar. Todas las pacientes recibieron quimioterapia (primaria o adyuvante) y aquellas que no habían sido irradiadas (80%) recibieron radioterapia de pared torácica y cadenas ganglionares.
Características de las pacientes con recaída ganglionar
| Paciente A | Paciente B | Paciente C | Paciente D* | Paciente E | |
|---|---|---|---|---|---|
| Tipo tumoral | |||||
| Primario | CDI | CDis | CDI | CDI | CDI |
| Recaída | CDI | CDI | CDI | CDI | CDI |
| Tiempo hasta recaída (años) | 14 | 3 | 2,4 | 2,3 | 3 |
| Tamaño tumoral (cm) | |||||
| Primario | 4 (ypT2N0) | 4 (pTisN0) | 3,5 (pT2N1) | 8 (ypT3N2) | 2,5 (pT2N1mi) |
| Cirugía axilar en tumor primario | Linfadenectomía | Biopsia de ganglio centinela | Linfadenectomía | Linfadenectomía | Biopsia de ganglio centinela |
| Localización | |||||
| Primario | CSI | CSE mama derecha | CSI mama derecha | CSE mama izquierda | CSI |
| Recaída | Ganglio DA | Axila | Rotter | Axila | Rotter |
| Subtipo tumoral | |||||
| Primario | Luminal A | - | Her2+ | Luminal B Her2- | Triple negativo |
| Recaída | Luminal B Her2- | Her2+ | Her2+ | Luminal B Her2- | Triple negativo |
| Tratamiento adyuvante | |||||
| Primario | nQT + HT | Ninguno | QT+Ac | nQT + RT +HT | QT |
| Recaída | QT + RT | QT + RT | QT+Ac+RT | nQT+HT | nQT + RT |
| Tiempo hasta metástasis (meses) | - | - | - | 7 | - |
| Tiempo hasta exitus (meses) | - | - | - | 20 | - |
Ac: anticuerpos; CDI: carcinoma ductal infiltrante; CDis: carcinoma ductal in situ; CIE: cuadrante infero externo; CII: cuadrante infero interno; CSE: cuadrante supero externo; CSI: cuadrante supero interno; DA: dorsal ancho; HT: hormonoterapia; nQT: quimioterapia neoadyuvante; QT: quimioterapia; RT: radioterapia.
Recaída colgajo mastectomía. No hubo ninguna recaída en el complejo aréola-pezón (CAP). El tiempo medio de aparición de la recaída fue de 4,9 años (± 3,8) (fig. 1A). La mayoría de las recaídas (83,3%) presentaron un subtipo tumoral diferente al tumor inicial (tabla 4). Una paciente no fue intervenida por progresión sistémica de la enfermedad durante la TSP. Todas las pacientes intervenidas preservaron su reconstrucción. Aquellas pacientes que no habían recibido radioterapia fueron irradiadas.
Características de las pacientes con recaída en el colgajo cutáneo
| Paciente F | Paciente G | Paciente H | Paciente I | Paciente J | Paciente K | Paciente L | Paciente M | Paciente N | Paciente O | Paciente P | Paciente Q | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tipo tumoral | ||||||||||||
| Primario | CDI | CDI | CDis | CDI | CDI | CDI | CDis | CDI | CDI | CDI | CDis | CDI |
| Recaída | CDI | CDis | CDI | CDI | Tubular | CDICDI | CDI | CDI | CDI | CDI | CDI | CDI |
| Tiempo hasta recaída (años) | 14,7 | 5,5 | 5,3 | 5,2 | 3,9 | 2,910 | 2,6 | 2,1 | 0,8 | 0,9 | 3,7 | 5,3 |
| Tamaño tumoral (cm) | ||||||||||||
| Primario | 3 (pT2N0) | 0,5 (pT1aN0) | 1,5 (pTisNx) | 0 (ypTxN0) | 1 (pT1bN1) | 0,2 (pT1aN0) | 2,5 (pTisN0) | 0,4 (pT1aNx) | 3,2 (pT2N0) | 0,2 (ypT1aNx) | 4 (pTisN0) | 0,9 (pT1bN0) |
| Recaída | 1 (pT1b) | 1 (pTis) | 1 (pT1a) | 0,5 (pT1a) | 0,5 (pT1a) | 1,1 (pT1c)0.5 (pT1a) | 0.5 (pT1a) | 1,4 (pT1c) | 1 (ypT1b) | 0,5 (ypT1aN2) | 0,9 (pT1b) | |
| Localización | ||||||||||||
| Primario | CSI | CIE | CIE | CIE | CII | CII | CSI | Retroareolar | CSI | CIE | CSE | CSE |
| Recaída | CSI | CSI | CSE | CSI | CII | CII/CIECII/CIE | CSI | CSE | CSI | CIE | CSE | CSE |
| Subtipo tumoral | ||||||||||||
| Primario | Luminal B Her2- | Luminal B Her2- | - | Luminal B Her2+ | Luminal B Her2- | Luminal B Her2+ | - | Triple Negativo | Luminal A | Triple Negativo | - | Luminal B Her2- |
| Recaída | Luminal B Her2- | - | Her2+ | Luminal B Her2- | Luminal A | Triple NegativoTriple Negativo | Luminal B Her2- | Luminal B Her2+ | Luminal B Her2- | Luminal B Her2- | Luminal B Her2- | Luminal B Her2- |
| Tratamiento adyuvante | ||||||||||||
| Primario | QT + HT | QT + HT | Ninguno* | nQT+Ac+HT+RT | HT | QT +Ac +HT | Ninguno | Ninguno | QT+HT | nQT | - | Ninguno*** |
| Recaída | QT + HT +RT | RT | QT + Ac | QT+RT+HT | RT + HT | QT + RTQT | RT + HT | QT+Ac** | QT+HT + RT | nQT + RT | nQT + RT +HT | Qt + RT +HT |
| Tiempo hasta metástasis (meses) | - | - | - | 56 | - | - | - | 23 | 27 | - | - | - |
| Tiempo hasta exitus (meses) | Viva | Viva | Viva | 30 | Viva | Viva | Viva | 114 | 33 | Viva | Viva | Viva |
Ac: anticuerpos; CDI: carcinoma ductal infiltrante; CDis: carcinoma ductal in situ; CIE: cuadrante infero externo; CII: cuadrante infero interno; CSE: cuadrante supero externo; CSI: cuadrante supero interno; Cx: cirugía; HT: hormonoterapia; nQT: quimioterapia neoadyuvante; QT: quimioterapia; RT: radioterapia.
Eventos y supervivencia. Durante el seguimiento, 22 pacientes (8,1%) presentaron metástasis a distancia, incidencia superior a las recaídas locorregionales (6,6%). Veintiún mujeres (7,7%) fallecieron durante el seguimiento (tabla 1), 17 de ellas (6,3%) por su carcinoma mamario, tres (1,1%) por otro tumor y una paciente (0,4%) con metástasis óseas falleció por causa médica. Tres pacientes con metástasis estaban vivas cuando finalizó el seguimiento. La SG y libre de enfermedad a los 10 años fue de 88,9% (IC 95%: 86,3-91,5%) y 80,4% (IC 95%: 77,1-83,7%), respectivamente. La incidencia de metástasis (23,5 vs. 7,1%; p = 0,038) y muertes (23,5 vs. 6,7%; p = 0,033) fue significativamente mayor en las pacientes con una RLR (tabla 1), causando una disminución no significativa de la SG a 10 años (87,5% [IC 95%: 79,2-95,8%] vs. 90% [IC 95%: 87,5-92,5%]; p = 0,061 [fig. 1C]). Todas las pacientes con una RLR y metástasis a distancia fallecieron durante el seguimiento. No hubo diferencias significativas en SG según tipo de RLR (fig. 1D).
DiscusiónEn los últimos años se ha incrementado el uso de las mastectomías preservadoras con RI para el tratamiento del cáncer de mama. Diversos autores han analizado la seguridad oncológica de estas técnicas5–12. Así, Valero et al.6 estudiaron 449 mujeres con una MPPP y tras un seguimiento medio de 39 meses evidenciaron tres RLR (0,7%), ninguna de ellas en el CAP. Margenthaler et al.7 analizaron de forma retrospectiva 588 MPPP y evidenciaron un 1,9% de RLR, ninguna de ellas en el CAP. Wu et al.11 analizaron 199 MPPP por carcinoma ductal in situ y durante el seguimiento identificaron 5% de RLR, una de ellas en el CAP. En los metanálisis de De la Cruz et al.10 y Lanitis et al.9 no se evidenciaron diferencias en la incidencia de RLR, ni en SG ni libre de enfermedad entre la MRM y la MPPP. Finalmente, el metanálisis de Blanckaert et al.12 describe una incidencia de RLR entre el 0 y el 8,3%, con una incidencia de recaída en el CAP entre el 0 y el 4,1%. Aunque la mayoría de los estudios incluidos en estos metanálisis son retrospectivos o con escaso seguimiento, todos describen una incidencia RLR por debajo del 10%12, y es por ello que la guía clínica de la National Comprehensive Cancer Network (NCCN)13 ha aceptado la MPPP con RI como una opción válida en mujeres con cáncer de mama en unidades con experiencia y equipos multidisciplinares. En nuestro estudio evidenciamos una incidencia de RLR del 6,6% y ninguna recaída en el CAP, datos similares a los referenciados en la literatura. De hecho, la incidencia de RLR fue inferior a la incidencia de metástasis a distancia (6,6 vs 8,1%), datos similares a los presentados por otros autores como Van Maaren et al.14. La baja incidencia de recaídas en nuestro estudio impidió identificar factores de riesgo para una RLR. Sin embargo, observamos que los tumores hormonosensibles son menos frecuentes en las mujeres con una RLR. Datos similares describen Wu et al.11 en su estudio, cuyo análisis determinó que la ausencia de receptores de progesterona es un factor de riesgo independiente para una RLR.
Algunos autores sugieren que la radioterapia podría ser un método de prevención de una RLR en las mujeres con una MPP15,16. Por el contrario, las guías clínicas de NCCN13 recomiendan utilizar los mismos criterios de radioterapia para las MPP que para la MRM. Park et al.17 analizaron el impacto de la radioterapia en mujeres con una mastectomía y afectación ganglionar N1. Los autores exponen que el riesgo de RLR ha disminuido desde la incorporación de las terapias sistémicas dirigidas, por tanto, el beneficio absoluto de la radioterapia tras una mastectomía, incluso en pacientes con afectación axilar N1, es bajo en comparación con la reportada en los estudios más antiguos17. Concluyen que la indicación de radioterapia tras una MPP/MPPP debe ser individualizada. La mayoría de las pacientes con RLR de nuestro estudio no fueron tratadas con radioterapia durante su diagnóstico inicial, no obstante, nuestros datos no muestran diferencias significativas en la incidencia de RLR entre las mujeres con y sin radioterapia de pared tras una MPP/MPPP.
Diversos autores han descrito que la RLR en el cáncer de mama es una enfermedad heterogénea. Sin embargo, existen pocos estudios sobre el pronóstico de estas recaídas en las mastectomías preservadoras. Langstein et al.18 determinaron que las recaídas en pared torácica tienen peor supervivencia que las recaídas en tejido subcutáneo. De igual forma, el estudio de Wu et al.19 determinó que las recaídas en el CAP tienen menor impacto en supervivencia que las recaídas en tejido subcutáneo, y a su vez, estas tienen mejor supervivencia que las recaídas ganglionares. Nuestro estudio muestra que el comportamiento de la recaída en el colgajo de la mastectomía difiere de la recaída ganglionar. Las recaídas en el subcutáneo suelen ser tardías y con un subtipo tumoral diferente, sugiriendo que estas podrían ser un nuevo primario en tejido residual glandular. Por el contrario, las recaídas ganglionares acontecen en mujeres con tumores localmente avanzados, son precoces y suelen ser el mismo subtipo tumoral, sugiriendo que este proceso es una progresión de la enfermedad. Sekine et al.20 proponen una teoría similar, sugiriendo que la causa de la recaída ganglionar es la incapacidad de la terapia sistémica para eliminar células circulantes, y por tanto, una progresión de la enfermedad. Así, la recaída/progresión de la enfermedad depende de la biología tumoral, siendo los tumores Her2+ y triple negativo los de mayor riesgo de recaídas locales y metástasis21–24. Estos datos apoyan la teoría que la recaída ganglionar es una manifestación más de la progresión sistémica, y por tanto, impactan negativamente en la SG25–27. En nuestro estudio, la RLR disminuyó la SG, aunque esto no fue estadísticamente significativo (p = 0,061). Probablemente, las recaídas ganglionares son las que modifiquen la SG, pero la baja incidencia de las mismas en nuestro estudio no permite corroborar la teoría.
El tratamiento idóneo de una RLR en una mastectomía con reconstrucción es controvertido. Las guías clínicas de la NCCN13 y Buchholz et al.28 proponen que el tratamiento debe ser multidisciplinar, abogando por la resección local con márgenes libres con la menor morbilidad permisible, radioterapia de pared y/o cadenas ganglionares, si no la habían recibido previamente, y la terapia sistémica dirigida que precise según el subtipo tumoral. No obstante, existe escasa literatura sobre la posibilidad de preservar la reconstrucción. Mirzabeigi et al.29 analizaron 41 mujeres con una RLR tras una mastectomía y reconstrucción, de las cuales, un 49% perdió la reconstrucción. Newman et al.30 analizaron 372 pacientes con MPP, evidenciando un 6,2% de recaídas locales, perdiendo la reconstrucción un 13% de estas mujeres. Datos similares publicaron Wu et al.19 que analizaron 128 recaídas tras mastectomía con reconstrucción, perdiendo la reconstrucción un 16% de los casos. Este estudio determinó que una edad mayor de 50 años, un tamaño de la recaída mayor de 2 cm y la multifocalidad son factores de riesgo independientes para la pérdida de la reconstrucción. También evidenciaron que la supervivencia fue similar en las pacientes con resección local de la recaída frente a aquellas con resección amplia y perdida de la reconstrucción. En nuestro estudio, la mayoría (88,2%) de las mujeres con una recaída fueron intervenidas y todas ellas preservaron su reconstrucción. Probablemente estos buenos resultados son gracias a la detección precoz de la recaída (tumores menores de 2 cm) y a la unifocalidad del proceso. Durante el seguimiento solo se detectó otra recaída local tras 10 años de la primera recaída. Por tanto, al igual que plantea Wu et al.19, la resección local preservando la reconstrucción parece oncológicamente segura en casos seleccionados. No obstante, más estudios prospectivos serán necesarios para confirmar esta teoría.
Nuestro estudio presenta algunas limitaciones. En primer lugar, la baja incidencia de RLR impidió detectar factores de riesgo para estas recaídas y su impacto real en SG. En segundo lugar, la ausencia de un grupo control con MRM sin reconstrucción impide comparar la seguridad de la técnica quirúrgica. Finalmente, la heterogeneidad de la muestra, condicionada por los cambios evolutivos en el tratamiento quirúrgico en cada periodo y la participación de más de un cirujano, puede dificultar la interpretación de algunos resultados.
En conclusión, las RLR son un evento poco frecuente en las mujeres con una MPP/MPPP y RI. Las recaídas en el colgajo de mastectomía son un evento diferente a la recaída ganglionar atendiendo a su intervalo de aparición y concordancia histológica con el tumor primario. La mayoría de las pacientes con RLR pueden preservar su reconstrucción inicial mediante la resección local del tumor y las terapias adyuvantes y/o neoadyuvantes. Nuestro estudio muestra que el diagnóstico de una RLR tras mastectomía y RI no empeora significativamente la supervivencia a largo plazo.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.