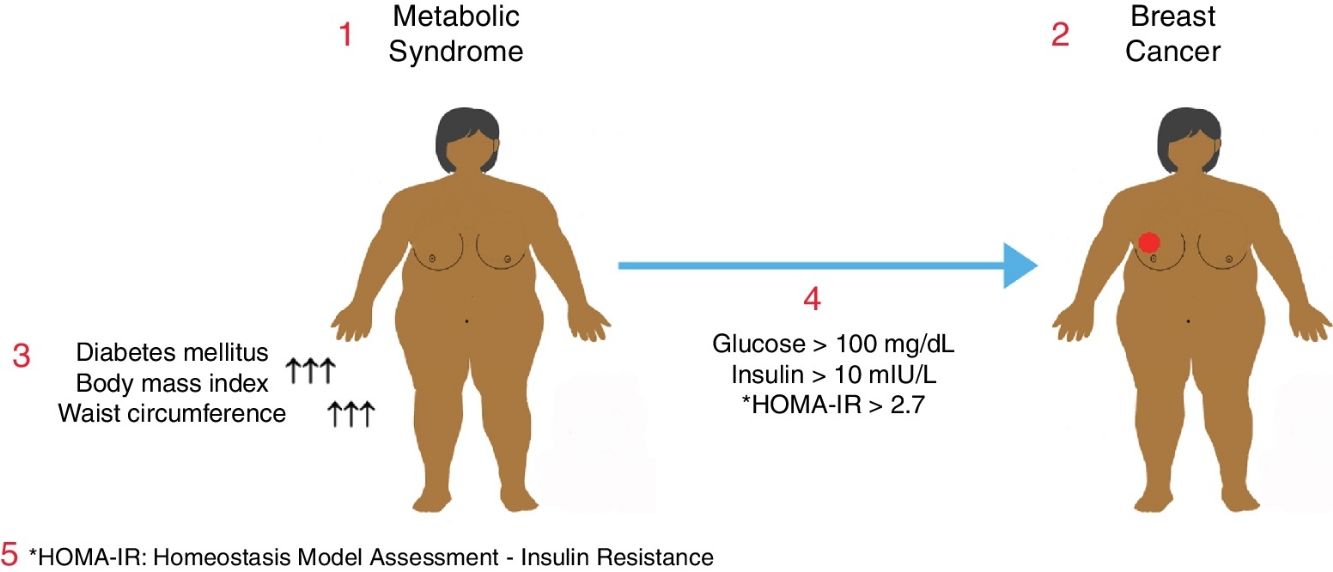
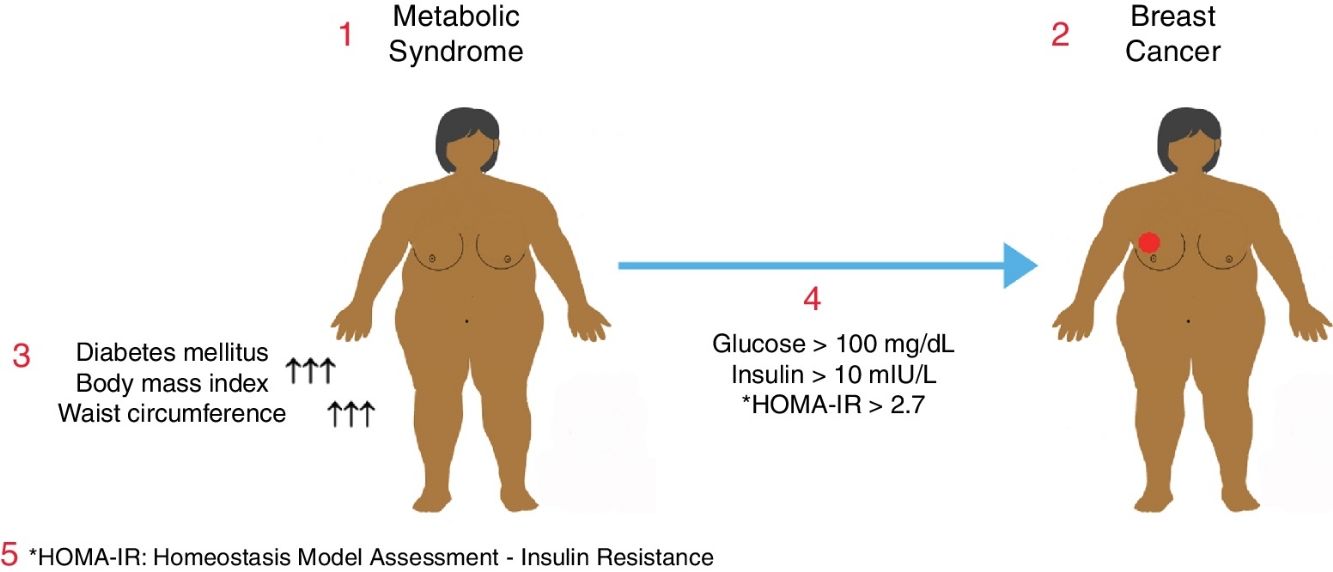
El síndrome metabólico (SM) se asocia con un aumento del riesgo de diabetes mellitus (DM) y cardiopatía coronaria. El SM también puede estar asociado con un aumento del riesgo de algunos cánceres frecuentes. El objetivo de este estudio fue determinar la relación entre el SM y el cáncer de mama en mujeres posmenopáusicas.
MétodosEstudio de cohortes prospectivo de mujeres posmenopáusicas. Dicha cohorte se dividió en dos grupos: el «grupo con un diagnóstico benigno», formado por mujeres a las cuales se les realizó un seguimiento por cribado del cáncer de mama, y el «grupo con un tumor maligno», formado por pacientes con cáncer de mama diagnosticado por biopsia. Se analizaron como variables a estudio la edad, peso, altura, índice de masa corporal (IMC), perímetro abdominal, glucosa sérica, LDL, HDL y niveles de insulina. Se utilizó la fórmula del modelo homeostático HOMA-IR para evaluar la resistencia a la insulina. Las diferencias se consideraron estadísticamente significativas cuando p<0,05.
ResultadosDoscientas mujeres con una media de edad de 61,5±9,6años (rango: 37-93) se inscribieron en el estudio que consta de 150 (75%) pacientes en el grupo con un diagnóstico benigno y 50 (25%) pacientes en el grupo con un tumor maligno. El IMC y el perímetro abdominal fueron mayores en el grupo con un tumor maligno (p<0,05). La incidencia de DM y SM fue mayor en el grupo con un tumor maligno (p<0,005). En el grupo con un tumor maligno se detectaron incidencias mucho más altas en relación con los niveles glucémicos en ayunas>100mg/dl, los niveles de insulina>10mUI/l y puntuaciones en el HOMA-IR>2,7 (p<0,05).
ConclusionesExiste relación entre el SM y el cáncer de mama posmenopáusico. Son necesarios más estudios para establecer métodos de protección para la prevención del cáncer de mama en mujeres con SM.
Metabolic syndrome is associated with an increased risk of diabetes mellitus (DM) and coronary heart disease. It may also be associated with a higher risk of some common cancers. The objective of this study was to determine the relationship between metabolic syndrome and breast cancer in postmenopausal women.
MethodsWe present a prospective cohort study of postmenopausal women. This cohort was divided into two groups: the «benign diagnosis group», including women who were studied after breast cancer screening; and the «malignant tumor group», including patients with breast cancer that had been diagnosed by biopsy. Age, weight, height, body mass index (BMI), abdominal perimeter, serum glucose, LDL, HDL and insulin levels were analyzed as variables under study. The HOMA-IR homeostatic model formula was used to assess insulin resistance. The differences were considered statistically significant when P<.05.
ResultsTwo hundred women with a mean age of 61.5±9.6 (range: 37-93) were enrolled in the study, consisting of 150 (75%) patients with a benign diagnosis and 50 (25%) patients with a malignant tumor. BMI and abdominal perimeter were higher in the group with a malignant tumor (P<.05). The incidence of DM and metabolic syndrome was higher in the malignant tumor group (P<.005). In the malignant tumor group, much higher incidences correlated with fasting glycemic levels >100mg/dL, insulin levels >10mIU/L and HOMA-IR scores >2.7 (P<.05).
ConclusionsThere is a relationship between metabolic syndrome and postmenopausal breast cancer. More studies are needed to establish methods for the prevention of breast cancer in women with metabolic syndrome.
El síndrome metabólico (SM) está constituido por un grupo de enfermedades causadas por etiologías genéticas y ambientales, y con más de un factor de riesgo cardiovascular. Hiperglucemia, hipertensión (HT), dislipidemia, obesidad visceral e hipercoagulabilidad son los componentes del SM. El principal mecanismo fisiopatológico del SM es la resistencia de los tejidos diana al uso de glucosa inducida por insulina. El SM se ha convertido en una epidemia en los países desarrollados y en vías de desarrollo, donde se han producido cambios en el estilo de vida1. Según otra definición del SM, se trata de una endocrinopatía mortal en que se combinan entre sí la obesidad abdominal causada por la resistencia a la insulina, la intolerancia a la glucosa, la dislipidemia, la HT y la cardiopatía coronaria (CPC)2.
La prevalencia del SM varía en función del país y según las características étnicas de la sociedad, la nutrición y el estilo de vida, y los criterios diagnósticos utilizados para el cribado de esta enfermedad3,4. En los últimos años, se ha observado un aumento importante del número de pacientes con SM en todo el mundo, directamente proporcional al aumento de la prevalencia de la obesidad y la diabetes mellitus (DM)5. Se ha establecido que el SM desempeña un papel en el desarrollo de varios tipos de cáncer, entre los cuales se encuentra el cáncer de mama, que es el tipo de cáncer más frecuente en las mujeres, aunque el mecanismo aún no está claro6. Además, en las mujeres, el cáncer de mama es el cáncer potencialmente mortal más frecuente de todos7,8. La incidencia general del cáncer de mama continúa aumentando en todo el mundo y, desde 1970 hasta la actualidad, esta tasa ha pasado de 1/18 a 1/8 mujeres9. Cuando se analiza la distribución por edad del cáncer de mama, más de la mitad de los casos ocurren en pacientes de más de 50años y el 55% son posmenopáusicos10. En la mayoría de los casos se desconoce la etiología, si bien se han definido varios factores de riesgo para el cáncer de mama, entre los cuales los más importantes son el sexo femenino y la edad avanzada11. En estudios recientes se ha demostrado que la obesidad y las afecciones relacionadas con esta desempeñan un papel importante en la historia natural de dicho cáncer. Además, se ha demostrado que la obesidad y la resistencia a la insulina están relacionadas con un mal pronóstico en el cáncer de mama avanzado12,13.
El objetivo de este estudio es establecer la relación entre el cáncer de mama y el SM en mujeres posmenopáusicas.
MétodosEste estudio de cohortes prospectivo se llevó a cabo en el Departamento de Cirugía General junto con el Departamento de Medicina Familiar del mismo centro durante el período de un año. Todos los procedimientos realizados se ajustaban a la Declaración de Helsinki de 1964 y sus enmiendas posteriores, o a normas éticas comparables. Se obtuvo la aprobación ética del Comité de Ética de Investigación Clínica del centro y se obtuvo el consentimiento informado de cada participante en el estudio.
A cada paciente se le realizó la detección, se le diagnosticó y se le trató en la misma unidad, y se las dividió en 2 grupos: el «grupo con un diagnóstico benigno» y el «grupo con un tumor maligno». El «grupo con un diagnóstico benigno» estaba formado por mujeres posmenopáusicas voluntarias seleccionadas al azar, a las cuales se les realizó un seguimiento por cribado de cáncer de mama en el Departamento de Medicina Familiar, con visitas periódicas de consulta externa sin ninguna evidencia del desarrollo del cáncer de mama. El «grupo con un tumor maligno» estaba formado por pacientes que recibieron tratamiento quirúrgico por cáncer de mama diagnosticado por biopsia en el Departamento de Cirugía General, cuyas muestras postoperatorias, según se confirmó histopatológicamente, eran compatibles con tumor maligno de mama. Estos 2 grupos se formaron por separado ya que ninguna de las pacientes del «grupo con un diagnóstico benigno» pasó al «grupo con un tumor maligno» a causa de algún tumor maligno recientemente desarrollado.
El SM en una paciente se definió como la existencia de, al menos, DM, intolerancia a la glucosa o resistencia a la insulina, acompañado, en cada caso, de 2 de las enfermedades responsables de este síndrome, como HT, dislipidemia y obesidad abdominal.
Se excluyó a las mujeres premenopáusicas, mujeres a quienes se les había inducido la menopausia quirúrgicamente, a las menores de 18años, hombres y mujeres con antecedentes de cirugía de cáncer de mama o terapia neoadyuvante/adyuvante.
Además de los datos demográficos, se analizaron: edad, peso, altura, índice de masa corporal (IMC), perímetro abdominal, glucosa sérica, lipoproteínas de baja densidad (LDL), lipoproteínas de alta densidad (HDL) y niveles de insulina. Se utilizó la fórmula del modelo homeostático HOMA-IR para evaluar la resistencia a la insulina, calculada mediante la ecuación [HOMA-IR=insulina sérica en ayunas×glucemia en ayunas/405], para determinar la resistencia a la insulina. Se considera que el valor normal de HOMA-IR es <2,7 y que las personas con un nivel de HOMA-IR≥2,7 presentan varios niveles de resistencia a la insulina14.
Se utilizó el programa estadístico Number Cruncher Statistical System 2007 (Kaysville, Utah, EE.UU.) para el análisis estadístico. Además de los métodos estadísticos descriptivos (media, mediana, frecuencia, razón de posibilidades, mínimo y máximo), se utilizaron la prueba de la χ2 de Pearson, la prueba exacta de Fisher, la prueba de Fisher-Freeman-Halton y la corrección de continuidad de Yates para la comparación de datos cualitativos. Un valor de p<0,05 se consideró estadísticamente significativo.
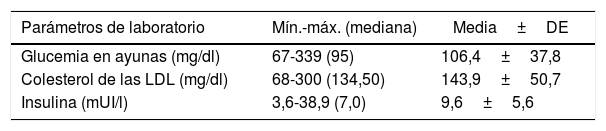
ResultadosUna cohorte de 200 mujeres posmenopáusicas con una media de edad de 61,5±9,6 (intervalo: 37-93) años se inscribieron en el estudio, formado por 150 pacientes (75%) en el grupo con un diagnóstico benigno y 50 (25%) pacientes en el grupo con un tumor maligno. Los datos demográficos y los resultados de laboratorio se resumen en las tablas 1 y 2.
Parámetros de laboratorio
| Parámetros de laboratorio | Mín.-máx. (mediana) | Media±DE |
|---|---|---|
| Glucemia en ayunas (mg/dl) | 67-339 (95) | 106,4±37,8 |
| Colesterol de las LDL (mg/dl) | 68-300 (134,50) | 143,9±50,7 |
| Insulina (mUI/l) | 3,6-38,9 (7,0) | 9,6±5,6 |
DE: desviación estándar; LDL: lipoproteínas de baja densidad; máx.: máximo; mín.: mínimo.
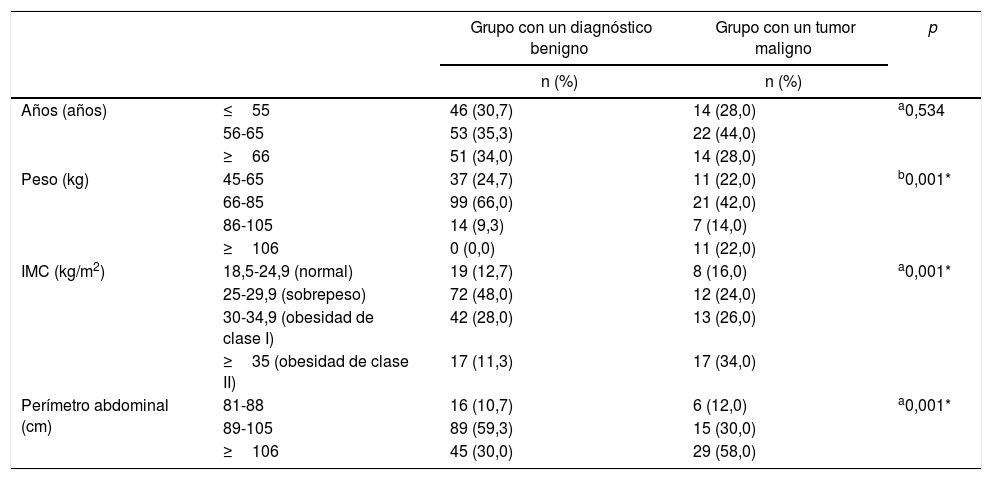
Cuando se analizó el peso de las participantes, se observó que 99 (66%) pacientes del grupo con un diagnóstico benigno pesaban entre 66 y 85kg, y estas cifras eran más altas que en el grupo con un tumor maligno (p=0,005). En cambio, el número de pacientes que pesaban más de 106kg era mayor en el grupo con un tumor maligno (p=0,001). De acuerdo con los valores de IMC de las participantes, se encontró que 72 (48%) pacientes del grupo con un diagnóstico benigno tenían valores de IMC entre 25 y 29,9kg/m2 y este valor fue más alto que en el grupo con un tumor maligno (p=0,005), mientras que 17 (34%) pacientes del grupo con un tumor maligno mostraban valores de IMC superiores a 35kg/m2, que aumentó considerablemente en comparación con el grupo con un diagnóstico benigno (p=0,001). El número de pacientes con un perímetro abdominal entre 89 y 105cm fue mucho mayor en el grupo con un diagnóstico benigno (p=0,001), mientras que se halló un perímetro abdominal por encima de 106cm en 29 (58%) pacientes del grupo con un tumor maligno, lo que ponía de manifiesto un valor considerablemente mayor que en el grupo con un diagnóstico benigno (p=0,001) (tabla 3).
Comparaciones de edad y parámetros de obesidad entre los grupos del estudio
| Grupo con un diagnóstico benigno | Grupo con un tumor maligno | p | ||
|---|---|---|---|---|
| n (%) | n (%) | |||
| Años (años) | ≤55 | 46 (30,7) | 14 (28,0) | a0,534 |
| 56-65 | 53 (35,3) | 22 (44,0) | ||
| ≥66 | 51 (34,0) | 14 (28,0) | ||
| Peso (kg) | 45-65 | 37 (24,7) | 11 (22,0) | b0,001* |
| 66-85 | 99 (66,0) | 21 (42,0) | ||
| 86-105 | 14 (9,3) | 7 (14,0) | ||
| ≥106 | 0 (0,0) | 11 (22,0) | ||
| IMC (kg/m2) | 18,5-24,9 (normal) | 19 (12,7) | 8 (16,0) | a0,001* |
| 25-29,9 (sobrepeso) | 72 (48,0) | 12 (24,0) | ||
| 30-34,9 (obesidad de clase I) | 42 (28,0) | 13 (26,0) | ||
| ≥35 (obesidad de clase II) | 17 (11,3) | 17 (34,0) | ||
| Perímetro abdominal (cm) | 81-88 | 16 (10,7) | 6 (12,0) | a0,001* |
| 89-105 | 89 (59,3) | 15 (30,0) | ||
| ≥106 | 45 (30,0) | 29 (58,0) |
IMC: índice de masa corporal; n: número de pacientes.
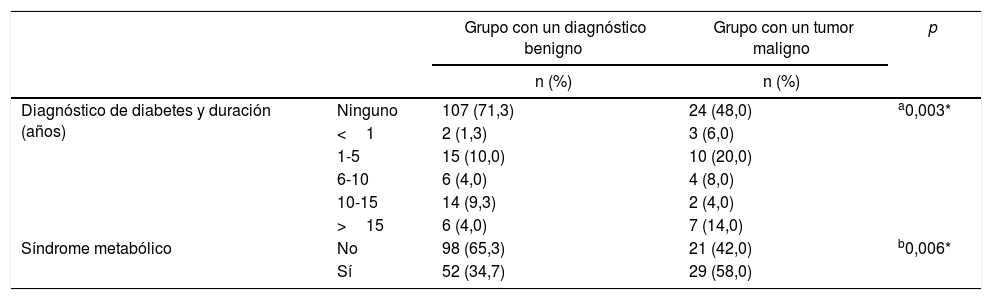
La incidencia de DM en el grupo con un diagnóstico benigno fue muy inferior que en el grupo con un tumor maligno (p=0,005). En este último grupo, el número de pacientes con un diagnóstico de DM durante un período de más de 15años fue considerablemente mayor que en el grupo con un diagnóstico benigno (p=0,02). Cuando se analizó a las pacientes que cumplían los criterios de SM, se encontró que a 29 (58%) pacientes se les había diagnosticado SM en el grupo con un tumor maligno, mientras que 52 (35%) recibieron este diagnóstico en el grupo con un diagnóstico benigno, lo que revelaba que la incidencia del SM era mucho mayor entre las pacientes con cáncer de mama (p=0,006). Del mismo modo, el número de pacientes sin SM en el grupo con un diagnóstico benigno fue mucho mayor que en el grupo con un tumor maligno (p=0,006) (tabla 4).
Comparaciones de los parámetros de diabetes y síndrome metabólico entre los grupos del estudio
| Grupo con un diagnóstico benigno | Grupo con un tumor maligno | p | ||
|---|---|---|---|---|
| n (%) | n (%) | |||
| Diagnóstico de diabetes y duración (años) | Ninguno | 107 (71,3) | 24 (48,0) | a0,003* |
| <1 | 2 (1,3) | 3 (6,0) | ||
| 1-5 | 15 (10,0) | 10 (20,0) | ||
| 6-10 | 6 (4,0) | 4 (8,0) | ||
| 10-15 | 14 (9,3) | 2 (4,0) | ||
| >15 | 6 (4,0) | 7 (14,0) | ||
| Síndrome metabólico | No | 98 (65,3) | 21 (42,0) | b0,006* |
| Sí | 52 (34,7) | 29 (58,0) |
n: número de pacientes.
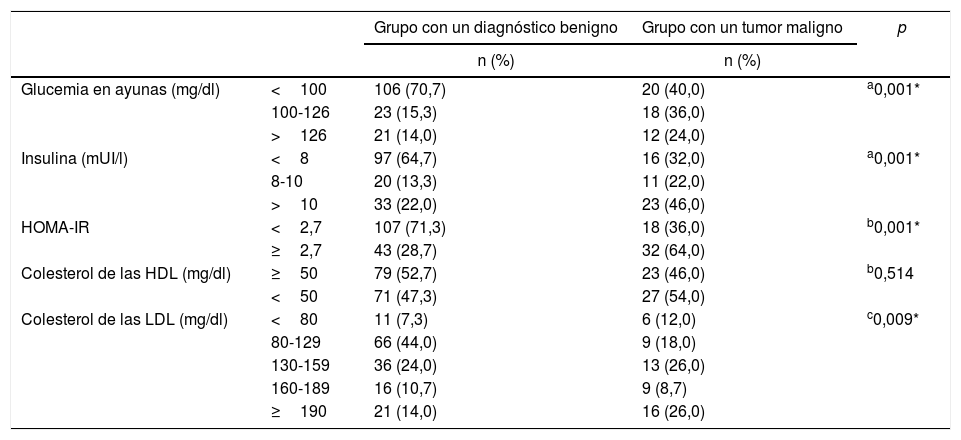
Respecto a los niveles glucémicos en ayunas, los valores <100mg/dl fueron más frecuentes en el grupo con un diagnóstico benigno (p=0,001). En cambio, en el grupo con un tumor maligno se detectó que la mayoría de las pacientes tenían niveles de glucosa >100mg/dl (p=0,003). El número de pacientes con niveles basales de insulina sérica <8mUI/l fue mucho mayor en el grupo con un diagnóstico benigno, mientras que el número de pacientes con niveles de insulina >10mUI/l aumentó sobremanera en el grupo con un tumor maligno (p=0,001 y p=0,002, respectivamente). También se analizaron los niveles de HOMA-IR, lo que mostró que el HOMA-IR>2,7 era mucho más frecuente en el grupo con un tumor maligno (p=0,001). No hubo diferencias respecto a los niveles de colesterol HDL entre los grupos de estudio (p>0,05). Cuando se examinaron los niveles de colesterol LDL de ambos grupos, se detectó que 16 (26%) pacientes del grupo con un tumor maligno tenían LDL≥190mg/dl, lo que revelaba un valor más alto que en el grupo con un diagnóstico benigno (p=0,009). La mayoría del grupo con un diagnóstico benigno tenía niveles de LDL entre 80 y 129mg/dl (p=0,023) (tabla 5).
Distribución de los resultados de laboratorio entre los grupos de estudio
| Grupo con un diagnóstico benigno | Grupo con un tumor maligno | p | ||
|---|---|---|---|---|
| n (%) | n (%) | |||
| Glucemia en ayunas (mg/dl) | <100 | 106 (70,7) | 20 (40,0) | a0,001* |
| 100-126 | 23 (15,3) | 18 (36,0) | ||
| >126 | 21 (14,0) | 12 (24,0) | ||
| Insulina (mUI/l) | <8 | 97 (64,7) | 16 (32,0) | a0,001* |
| 8-10 | 20 (13,3) | 11 (22,0) | ||
| >10 | 33 (22,0) | 23 (46,0) | ||
| HOMA-IR | <2,7 | 107 (71,3) | 18 (36,0) | b0,001* |
| ≥2,7 | 43 (28,7) | 32 (64,0) | ||
| Colesterol de las HDL (mg/dl) | ≥50 | 79 (52,7) | 23 (46,0) | b0,514 |
| <50 | 71 (47,3) | 27 (54,0) | ||
| Colesterol de las LDL (mg/dl) | <80 | 11 (7,3) | 6 (12,0) | c0,009* |
| 80-129 | 66 (44,0) | 9 (18,0) | ||
| 130-159 | 36 (24,0) | 13 (26,0) | ||
| 160-189 | 16 (10,7) | 9 (8,7) | ||
| ≥190 | 21 (14,0) | 16 (26,0) |
HDL: lipoproteínas de alta densidade; LDL: lipoproteínas de baja densidade; n: número de pacientes.
El SM es un grupo de factores de riesgo de DM y enfermedad cardiovascular que se ha convertido en un problema importante en todo el mundo15. Entre estos factores de riesgo se encuentran obesidad, intolerancia a la glucosa, HT, niveles elevados de triglicéridos y niveles bajos de colesterol de las HDL16. El SM también se asocia con mayor riesgo de algunos tipos de cáncer17. Así, en este estudio se objetiva que existe mayor riesgo de desarrollar cáncer de mama si se presentaba SM subyacente en mujeres posmenopáusicas. Además, las investigaciones de los componentes del SM revelaron diferencias importantes entre los 2 grupos de nuestro estudio.
La obesidad puede provocar la alteración de los niveles de hormonas circulantes y factores de crecimiento, lo que puede producir mayor carcinogénesis18. En un estudio de cohortes que comparaba el cáncer de mama posmenopáusico con la obesidad a lo largo de un seguimiento de 5años, hubo una relación proporcional entre cáncer de mama y valores elevados de IMC desde los 18años19. También hay estudios que revelan mayor riesgo de cáncer de mama en mujeres posmenopáusicas, además de peores resultados clínicos en todas las edades asociados con valores elevados de IMC18. En este estudio, según los valores del IMC, el número de pacientes del grupo con un tumor maligno con un IMC≥35 fue mucho más elevado que en el grupo con un diagnóstico benigno.
Algunos estudios en mujeres posmenopáusicas indican que existe mayor riesgo de cáncer de mama con unos valores de perímetro abdominal más altos, lo que demuestra el hecho de que, como marcador de las consecuencias metabólicas de la obesidad, parece que la obesidad abdominal influye en el riesgo de cáncer de mama20. Aunque existe alguna controversia, varios estudios de cohortes y de casos y controles respaldan estos hallazgos21,22. En la mayoría de esos estudios, el límite superior del perímetro abdominal se estableció en 88cm23. En este estudio, el número de pacientes con un perímetro abdominal entre 89 y 105cm fue mucho mayor en el grupo con un diagnóstico benigno, mientras que en el grupo con un tumor maligno, el número de pacientes con un perímetro abdominal ≥106cm fue considerablemente mayor.
La hiperglucemia crónica en pacientes con DM se desarrolla como resultado de la resistencia a la insulina que reduce la absorción de glucosa por el tejido muscular y reduce el almacenamiento de glucosa en el hígado, lo que produce niveles glucémicos elevados20. En biología del cáncer, dado que las células neoplásicas utilizan glucosa para su proliferación, se puede considerar que unos niveles más elevados de glucosa circulante pueden estimular la carcinogénesis20. Junto con el aumento de los niveles de estrógenos o el factor de crecimiento similar a la insulina I, el desarrollo de resistencia a la insulina puede representar un factor de riesgo del cáncer de mama24. Se ha encontrado que la resistencia a la insulina está asociada con obesidad, HT, dislipidemia e intolerancia a la glucosa, y en algunos estudios se ha demostrado una relación entre los niveles glucémicos en ayunas y el cáncer de mama24. También se encontró una relación similar en nuestro estudio ya que en el grupo con un tumor maligno, el número de pacientes diabéticas fue considerablemente mayor que en el grupo con un diagnóstico benigno. Aunque la DM es una de las enfermedades más comunes en la edad posmenopáusica entre la población normal, se encontraron valores elevados en el grupo con cáncer de mama, no solo en nuestro estudio sino también en muchos otros parecidos25. Por tanto, el tratamiento de la DM ha demostrado ser fundamental, una vez más.
Además de los efectos metabólicos de la insulina, también induce actividad mitógena que puede producir la proliferación de las células epiteliales mamarias normales, y el aumento de la proliferación por la hiperinsulinemia puede provocar el desarrollo de cáncer de mama26. Hay estudios que indican la asociación entre la hiperinsulinemia y el aumento del riesgo de cáncer de mama20. Coherentemente, en este estudio, el número de pacientes con niveles basales de insulina sérica <8mUI/l fue considerablemente mayor en el grupo con un diagnóstico benigno, mientras que el número de pacientes con niveles de insulina >10mUI/l fue mucho mayor en el grupo con un tumor maligno.
El valor normal de la fórmula HOMA-IR es <2,7 y se considera que las personas con un nivel de HOMA-IR≥2,7 presentan varios niveles de resistencia a la insulina14. Los valores más elevados de HOMA-IR se han asociado con mayor riesgo de cáncer de mama en mujeres posmenopáusicas. Sin embargo, en el cáncer de mama diagnosticado antes de los 55años, no se observó ninguna relación importante27. En nuestro estudio, un valor de HOMA-IR>2,7 fue mucho más frecuente en el grupo con un tumor maligno. Los resultados de este estudio fueron parecidos a otros en los que el valor de corte de la puntuación HOMA-IR se estableció en 2,5, aunque decidimos que 2,7 es el valor de corte basado en las últimas guías14,16,27. Dado que los valores de glucemia e insulina en ayunas se utilizan para el cálculo de la fórmula HOMA-IR, se estableció una correlación positiva con las puntuaciones HOMA-IR y el cáncer de mama.
Los cambios en el perfil de lípidos séricos con una reducción de los niveles de colesterol de las HDL y un aumento de los niveles de colesterol total, colesterol de las LDL y triglicéridos se conocen como dislipidemia. Dado que el colesterol es un precursor de las hormonas esteroides, se considera que el riesgo de cáncer de mama aumenta en las mujeres dislipidémicas, especialmente con niveles elevados de colesterol de las LDL20. En cambio, se ha detectado que las mujeres con niveles elevados de colesterol de las HDL presentan menor riesgo de cáncer de mama20. Después de investigar la relación entre los niveles de colesterol sérico y el riesgo de cáncer de mama, varios estudios revelaron que con el aumento del colesterol total y el colesterol de las LDL y la reducción de los niveles de colesterol de las HDL se presentaba mayor riesgo de cáncer de mama; además, se comunicó que estos valores estaban más relacionados en mujeres posmenopáusicas18,20,28. En este estudio se encontró que los niveles de colesterol de las LDL eran mucho más altos en el grupo con un tumor maligno, aunque el colesterol de las LDL únicamente no es un criterio de diagnóstico del SM. Nuestra interpretación es que los niveles elevados de LDL podrían deberse a otros factores ambientales, como cambios en los hábitos alimentarios y menor nivel de actividad física.
En su estudio prospectivo con 4.888 mujeres, Kabat et al. comunicaron que 165 pacientes desarrollaron cáncer de mama después de un período de seguimiento de 8años y concluyeron que no había relación entre un SM subyacente y el cáncer de mama29. En cambio, en un estudio de casos y controles realizado por Rosato et al. se evaluó a 3.869 pacientes con cáncer de mama posmenopáusico y a un grupo de control de 4.082 mujeres posmenopáusicas. Se diagnosticó SM cuando se cumplían, al menos, 3 de los criterios, es decir, DM, HT, hiperlipidemia y obesidad. El número de pacientes que cumplieron, al menos, 3 de estos criterios fue mucho mayor en el grupo de cáncer de mama28. En un estudio de casos y controles realizado por Wang et al. con 43 pacientes con cáncer de mama posmenopáusico y 86 pacientes en el grupo de control, las mujeres que cumplieron con 4 de los criterios de SM mostraron mayor riesgo de cáncer de mama posmenopáusico18. En nuestro estudio, se encontró que la incidencia de SM en el grupo con un tumor maligno fue considerablemente mayor que en el grupo con un diagnóstico benigno.
Entre los inconvenientes de nuestro estudio pueden citarse el hecho de que este se haya realizado en un único centro, el tamaño de la muestra relativamente pequeño, el hecho de no tener en cuenta las características étnicas que pueden afectar a los diferentes criterios diagnósticos y definitivos del SM, y no investigar las características del estilo de vida de las pacientes.
En conclusión, se objetiva asociación entre el SM y el desarrollo de cáncer de mama posmenopáusico. Por ello, debe realizarse un diagnóstico precoz y tratamiento precoz del SM en las mujeres posmenopáusicas. Son necesarios más estudios para establecer métodos de protección para prevenir el desarrollo del cáncer de mama en mujeres con SM.
FinanciaciónTodos los autores declaran que no existe ninguna fuente de financiación y que no hay ningún incentivo económico comercial directo o indirecto asociado con la publicación de este artículo.
AutoríaDiseño del estudio: Ozgur Ekinci, Tunc Eren, Melike Kurtoglu Yakici, Zuhal Aydan Saglam, Orhan Alimoglu.
Búsqueda bibliográfica: Ozgur Ekinci, Tunc Eren, Melike Kurtoglu Yakici.
Recopilación de datos: Ozgur Ekinci, Melike Kurtoglu Yakici, Aman Gapbarov, Muhammet Ali Aydemir.
Análisis de datos: Ozgur Ekinci, Melike Kurtoglu Yakici, Aman Gapbarov, Muhammet Ali Aydemir, Zuhal Aydan Saglam, Orhan Alimoglu.
Redacción del original: Ozgur Ekinci, Tunc Eren, Melike Kurtoglu Yakici, Aman Gapbarov.
Revisión crítica: Ozgur Ekinci, Tunc Eren, Zuhal Aydan Saglam, Orhan Alimoglu.
Conflicto de interesesEl autor para correspondencia y todos los coautores declaran que no existe ningún conflicto de intereses.