El trasplante simultáneo de páncreas-riñón (SPK, por simultaneous pancreas kidney) es una opción terapéutica válida en pacientes afectos de diabetes mellitus tipo 1 con enfermedad renal crónica terminal que son candidatos a trasplante renal. Se presentan los resultados desde el inicio del programa de trasplante SPK en la Comunidad Valenciana.
MétodosEstudio descriptivo, retrospectivo y unicéntrico de los trasplantes de páncreas realizados en el Hospital Universitari i Politècnic La Fe, desde septiembre de 2002 a diciembre de 2015. Se recogieron variables clínicas de los donantes y receptores, variables peri-operatorias y supervivencia del paciente y del injerto pancreático.
ResultadosOchenta y un pacientes con diabetes mellitus tipo 1 (48 hombres y 33 mujeres, de 37,4±5,7 años, IMC de 24,1±3,4kg/m2, con una duración de su diabetes de 25,5±6,5 años) recibieron un trasplante SPK. La supervivencia global del paciente a uno, 3 y 5 años fue del 91,3, el 91,3 y el 89,5%, respectivamente. Sin embargo, la supervivencia del paciente en los periodos 2002-2008 y 2009-2015 fue del 88,2 y el 93,6% al año, del 88,2 y el 93,7% a los 3 años, y del 85,3 y el 93,7% a los 5 años, respectivamente (p=1). La supervivencia global del injerto pancreático a uno, 3 y 5 años fue del 75,2, el 69,1 y el 63,2%, respectivamente. Por otra parte, la supervivencia del injerto pancreático en los periodos 2002-2008 y 2009-2015 fue del 67,5 y el 80,6% al año, del 64,7 y el 71,8% a los 3 años, y del 58,8 y el 65,3% a los 5 años, respectivamente (p=0,0109). Las complicaciones postrasplante fueron: rechazo del injerto en un 8,6%, trombosis venosa del injerto en un 7,4% y pancreatitis del injerto en un 4,9%.
ConclusionesEn 13 años de experiencia en trasplante SPK, la supervivencia del paciente y del injerto pancreático y la tasa de complicaciones tras el trasplante de páncreas son similares a las de otras series de mayor tamaño. La experiencia del equipo médico-quirúrgico mejora la supervivencia del injerto pancreático, sin influir en la supervivencia del paciente.
Simultaneous pancreas-kidney (SPK) transplant is a proven option of treatment for patients with type 1 diabetes mellitus and related end-stage renal disease, who are candidates for kidney transplantation. The results from the beginning of SPK transplant program in Comunidad Valenciana are presented.
MethodsDescriptive, retrospective, and single-center study of the pancreas transplant performed at the Hospital Universitari i Politècnic La Fe, from September 2002 to December 2015. Clinical variables from donors and recipients, peri-operative variables, patient survival, and pancreatic graft survival were collected.
ResultsEighty-one patients with type 1 diabetes mellitus (48 males and 33 females, mean age 37.4±5.7 years, mean BMI 24.1±3.4kg/m2, mean duration of diabetes 25.5±6.5 years) received SPK transplantation. The overall patient survival at one, 3, and 5 years were 91,3, 91,3 and 89,5%, respectively. However, patient survival in the periods 2002-2008 and 2009-2015 were 88.2 and 93.6% at one year, 88.2 and 93.7% at 3 years, and 85.3 and 93.7% at 5 years, respectively (P=1). The overall pancreatic graft survival at one, 3, and 5 years were 75.2, 69.1 and 63.2%, respectively. On the other hand, pancreatic graft survival in the periods 2002-2008 and 2009-2015 were 67.5 and 80.6% at one year, 64.7 and 71.8% at 3 years, and 58.8% and 65.3% at 5 years, respectively (P=.0109). Postransplant complications were: graft rejection 8.6%, venous graft thrombosis 7.4%, graft pancreatitis 4.9%.
ConclusionsIn 13-year's experience of SPK transplantation, patient and pancreatic graft survival and the rate of complications after pancreas transplantation were similar to those of other larger series. The medical-surgical team experience improves pancreatic graft survival without influencing patient survival.
El trasplante simultáneo de páncreas-riñón (SPK, por su acrónimo en inglés simultaneous pancreas kidney) es una alternativa terapéutica en pacientes con diabetes mellitus tipo 1 (DM-1) y enfermedad renal crónica terminal que son candidatos a trasplante renal. El trasplante SPK con buena evolución consigue la insulinoindependencia y logra una normoglucemia a largo plazo que permite evaluar el efecto de la normalización prolongada del metabolismo de la glucosa en el curso de las complicaciones diabéticas, como la retinopatía y la neuropatía1. También se ha comprobado que reduce los factores de riesgo cardiovascular, como la dislipidemia y la hipertensión arterial, mejora la función cardiaca y reduce la mortalidad, aumentando la calidad de vida de estos pacientes2.
Los primeros trasplantes SPK se realizaron en la Universidad de Minnesota (EE. UU.) en la década de los 603. Sin embargo, la morbimortalidad relacionada entonces con estos trasplantes era elevada4,5. Hasta la década de los 80 no llegaron a Europa6 y en 1983 se realizó el primer trasplante SPK en España, en el Hospital Clínic de Barcelona6,7. Desde entonces y hasta 2015 se han realizado en España un total de 1.632 trasplantes de páncreas, siendo el SPK el más frecuentemente realizado8.
Por otro lado, se ha demostrado que diferentes variables, como la selección del donante, la necesidad de diálisis previa o la experiencia del equipo médico-quirúrgico encargado de la realización y manejo de los trasplantes SPK, son esenciales en los buenos resultados del trasplante, minimizando las complicaciones9.
El objetivo de este estudio es describir los resultados del trasplante SPK en la Comunidad Valenciana, medidos en supervivencia del paciente y de los injertos pancreático y renal, de forma global y en los periodos de tiempo comprendidos entre 2002 y 2008 y entre 2009 y 2015, así como describir las complicaciones relacionadas con su realización.
MétodosEstudio retrospectivo, descriptivo y unicéntrico de todos los pacientes sometidos a trasplante de páncreas de forma consecutiva desde septiembre de 2002 hasta diciembre de 2015 en la Comunidad Valenciana.
Los criterios de selección de donantes fueron los vigentes en 20158: edad comprendida entre los 10 y los 45 años, peso superior a 30kg, con grupo sanguíneo compatible, hemodinámicamente estables y con ausencia de historia personal o familiar de diabetes mellitus, traumatismo pancreático previo, antecedente de pancreatitis aguda o crónica, cirugía pancreática o esplenectomía previa, antecedente de etilismo crónico, enfermedad maligna, enfermedad infecciosa o transmisible y serología negativa para el virus de la inmunodeficiencia humana (VIH) y los virus de la hepatitis B y C.
Los criterios de selección de receptores para el trasplante SPK fueron los vigentes en 2015: diagnóstico de DM-1, edad menor de 50 años (valorando individualmente pacientes por encima de dicha edad), ausencia de reserva pancreática confirmada con valores de péptido C<0,5ng/ml, ausencia de trastornos psiquiátricos o psicológicos severos y capacidad para entender lo que supone un trasplante de páncreas en relación con la colaboración en el postoperatorio (complicaciones que pueden surgir y en el seguimiento del tratamiento). Los criterios de exclusión de receptores fueron: infección por VIH positiva o infección activa, alteraciones de la coagulación no controlables, prueba cruzada positiva para células T con suero actual, drogadicción o alcoholismo activos, enfermedad psiquiátrica que incapacite para el trasplante, historia personal de neoplasia (últimos 5 años), infarto de miocardio reciente (últimos 6 meses), coronariografía con lesiones no corregibles, fracción de eyección cardiaca menor del 50%, índice de masa corporal (IMC) mayor de 30kg/m2, incumplimiento de tratamientos previos o hemorragia retiniana reciente.
Se recogieron datos clínicos del donante y del receptor de forma sistemática y retrospectiva mediante consulta de la historia clínica. Tanto en los donantes como en los receptores se recogieron datos clínicos y analíticos basales y, además, en el caso de los receptores, también datos evolutivos postrasplante hasta la fecha de finalización del estudio.
El protocolo empleado en el trasplante de páncreas ya ha sido previamente descrito9,10. Se empleó la misma técnica quirúrgica y el mismo esquema de inmunosupresión y de profilaxis antitrombótica y antiinfecciosa en todos los pacientes.
Todos los implantes de páncreas y riñón, así como todas las trasplantectomías de los injertos, fueron realizados por el mismo equipo quirúrgico, realizándose la misma técnica quirúrgica estandarizada en todos los casos9,10. Los injertos pancreáticos y renales procedieron de donante cadáver en su totalidad.
La extracción del injerto duodenopancreático se realizó en bloque junto con el injerto hepático, realizándose la separación del duodeno y el páncreas posteriormente. Para la preservación del injerto se emplearon, en los primeros trasplantes, la solución de Wisconsin hasta 2009 y, posteriormente, la de Celsior. El tiempo de isquemia fría máximo aceptado fue de hasta 12h.
En la cirugía de banco, la reconstrucción vascular arterial del páncreas se preparó mediante injerto en «Y» a partir de la ilíaca común del donante, anastomosando la arteria ilíaca externa a la arteria mesentérica superior y la arteria ilíaca interna a la arteria esplénica del injerto. El drenaje venoso sistémico se realizó con una anastomosis termino-lateral entre la vena porta del injerto y la vena cava inferior. La colocación del injerto pancreático fue intraperitoneal en la fosa ilíaca derecha, y el injerto renal se colocó en la fosa ilíaca izquierda extraperitonealmente, ambos a través de una misma incisión en la línea media. Para la derivación de la secreción exocrina pancreática se realizó un drenaje entérico mediante anastomosis intestinal latero-lateral entre el duodeno del injerto y el íleon del receptor, con doble sutura continua en la capa submucosa y serosa intestinal. No se realizó ninguna derivación de la secreción exocrina a vejiga.
Como terapia de inducción de la inmunosupresión10 se empleó la globulina antitimocítica o el basiliximab. Como terapia de mantenimiento de la inmunosupresión, la pauta más frecuente consistía en una combinación de tacrolimus, micofenolato de mofetilo o sirolimus y prednisona.
El protocolo de profilaxis infecciosa fue: antibacteriana, con amoxicilina-clavulánico 1g/8h iv (si alergia: ciprofloxacino 200mg/12h iv) durante los 3 primeros días del postoperatorio; antifúngica, con fluconazol a dosis de 4mg/kg/día iv u oral durante 2 meses; frente a Pneumocystis jirovecii, con trimetoprim/sulfametoxazol a dosis de 80/400mg un comprimido al día desde que el paciente inicie tolerancia oral, durante 6 meses; y la antiviral frente a citomegalovirus con ganciclovir 5mg/kg/12h iv durante 7 días (en los casos: donante y receptor positivos, donante positivo con receptor negativo, y donante negativo con receptor positivo). No se administró en caso de donante y receptor negativos. A partir del séptimo día se pautaba valganciclovir oral, con dosis ajustada a función renal, durante un mínimo de 3 meses.
La profilaxis de trombosis vascular se realizó con heparina de bajo peso molecular (enoxaparina 4.000UI/día), iniciándose a las 24h de la intervención, y con ácido acetilsalicílico a una dosis de 100mg cada 24h a partir del día 5-6 postrasplante.
Se definieron los objetivos de control glucémico, lipídico y de presión arterial de acuerdo con las recomendaciones de la American Diabetes Association11. Se definió el mantenimiento de la función del injerto pancreático12 cuando la HbA1c era<7,0%, sin insulina o con una dosis diaria de insulina<50% de las necesidades basales previas al trasplante y<0,5UI/kg/día, junto con unos niveles de péptido C mayores que el nivel basal y sin presentar hipoglucemias graves. Se consideró pérdida del injerto pancreático cuando, tras el trasplante, el injerto presentaba una función parcial que requería el empleo de insulina exógena a una dosis>50% de las necesidades basales12, cuando presentaba un rechazo, una recidiva de la DM-110 o se realizaba pancreatectomía por complicaciones quirúrgicas. Se definió el mantenimiento de la funcióndel injerto renal como el logro de la independencia completa de la diálisis, y se consideró pérdida del injerto renal la necesidad de diálisis tras el trasplante. Se sospechó el rechazo agudo del injerto pancreático cuando se producía un aumento en los niveles de amilasa y/o lipasa sérica y/o los niveles de glucosa en suero junto con una caída marcada en los niveles séricos de péptido C y/o dolor abdominal. Sin embargo, dado que las mediciones de la amilasa y la lipasa en suero tienden a ser relativamente inespecíficas, si se sospechaba un rechazo agudo del páncreas, el diagnóstico se confirmaba con una biopsia percutánea y ecoguiada del injerto pancreático. La cola pancreática fue el área elegida para realizar la biopsia, ya que generalmente proporciona un mejor soporte histológico, puesto que tiene la mayor densidad de células beta. Si bien, dado que en la mayoría de los casos suele coexistir rechazo de los injertos renal y pancreático de forma simultánea, solo se realizaba biopsia del injerto renal para la confirmación. En caso de que el resultado de la biopsia fuera no concluyente, se realizaba exclusivamente biopsia del injerto pancreático. Se siguieron los criterios de Banff para la clasificación del rechazo del injerto pancreático13.
Este estudio fue aprobado por el Comité Ético de Investigación Clínica del Instituto de Investigación de Salud La Fe, Valencia (España). Se obtuvo el consentimiento informado por escrito de todos los pacientes antes de su inclusión en el estudio.
Análisis estadísticoLas variables continuas se describen como mediana y rango intercuartílico, tanto basales como durante el seguimiento. Las variables categóricas se describen como proporciones. Con respecto al análisis estadístico, para las variables continuas se empleó el test Chi cuadrado para comprobar la normalidad de los datos, el test t de Student para datos pareados y el test de Wilcoxon para datos no pareados. En las variables categóricas se empleó el test de Pearson, y para comparaciones con una N menor de 10 (GL=9) se empleó el test exacto de Fisher en lugar del de Pearson. Las comparaciones se realizan entre el periodo basal y el año de seguimiento, y también en función del periodo de la intervención: 2002-2008 y 2009-2015. Se estableció dicha división al ser periodos de tiempo que engloban 7 años cada uno, tratándose de una división temporal equitativa de los años de evolución del programa de trasplante de la Comunidad Valenciana.
La supervivencia del paciente, del injerto pancreático y del injerto renal se describen empleando el método Kaplan-Meier para estimar la función de supervivencia. Se describen funciones totales y para cada periodo. La comparación estadística entre periodos se realizó empleando la función no paramétrica de Mann-Whitney y sobre periodos de seguimiento equivalentes (5 años). En todos los test se consideró significación estadística un valor de p<0,05.
El análisis estadístico se realizó con SPSS® Statistics (versión 20) y con Matlab R2019a.
ResultadosSe valoraron un total de 104 pacientes como posibles candidatos a trasplante de páncreas; de ellos, 22 (21,2%) fueron excluidos por no cumplir los criterios de inclusión.
Los otros 82 pacientes (78,8%) fueron sometidos a trasplante pancreático, 81 a trasplante SPK y uno fue un trasplante de páncreas aislado, en una paciente que previamente había recibido un trasplante renal (PAK, por su acrónimo en inglés pancreas after kidney). Ningún trasplante aislado de páncreas (PTA, por su acrónimo en inglés pancreas transplantation alone) se ha realizado en nuestro centro.
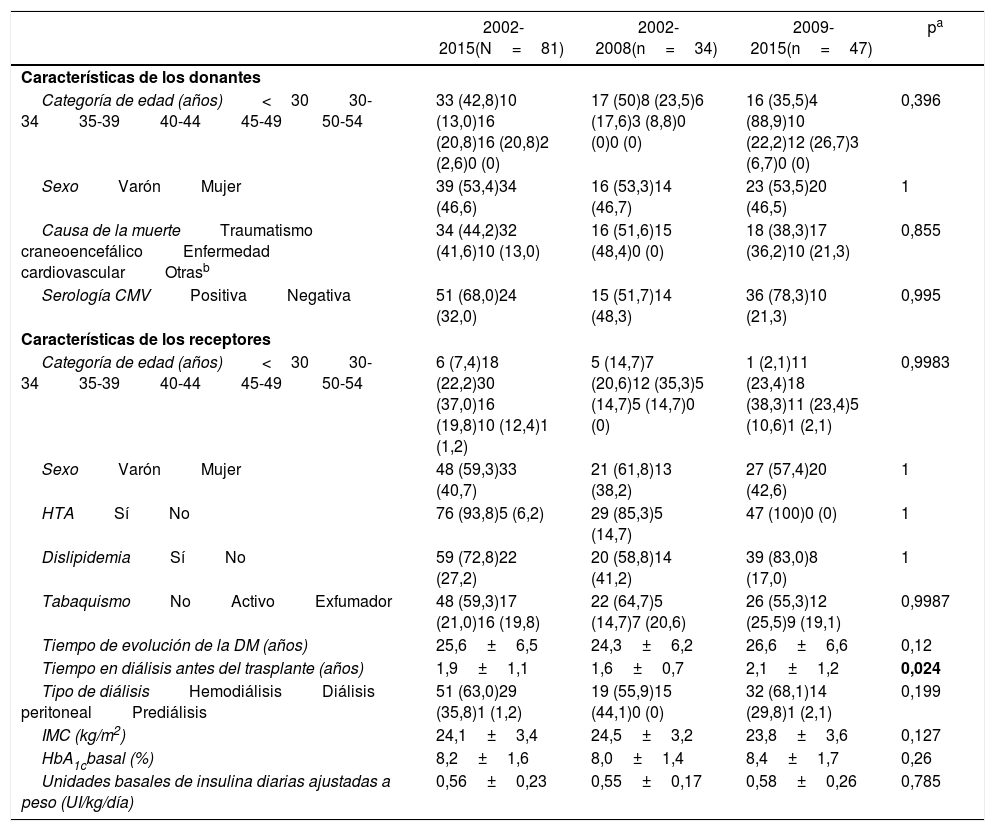
Para el presente estudio se consideraron los pacientes sometidos a trasplante SPK. Las características de los 81 donantes y las características basales de los 81 pacientes receptores se recogen en la tabla 1. Se empleó la solución de preservación de Wisconsin en 18 injertos y la de Celsior en los 63 restantes.
Características de los donantes y receptores de los 81 trasplantes simultáneos de páncreas-riñón y comparativa entre ambos periodos (2002-2008 y 2009-2015)
| 2002-2015(N=81) | 2002-2008(n=34) | 2009-2015(n=47) | pa | |
|---|---|---|---|---|
| Características de los donantes | ||||
| Categoría de edad (años)<3030-3435-3940-4445-4950-54 | 33 (42,8)10 (13,0)16 (20,8)16 (20,8)2 (2,6)0 (0) | 17 (50)8 (23,5)6 (17,6)3 (8,8)0 (0)0 (0) | 16 (35,5)4 (88,9)10 (22,2)12 (26,7)3 (6,7)0 (0) | 0,396 |
| SexoVarónMujer | 39 (53,4)34 (46,6) | 16 (53,3)14 (46,7) | 23 (53,5)20 (46,5) | 1 |
| Causa de la muerteTraumatismo craneoencefálicoEnfermedad cardiovascularOtrasb | 34 (44,2)32 (41,6)10 (13,0) | 16 (51,6)15 (48,4)0 (0) | 18 (38,3)17 (36,2)10 (21,3) | 0,855 |
| Serología CMVPositivaNegativa | 51 (68,0)24 (32,0) | 15 (51,7)14 (48,3) | 36 (78,3)10 (21,3) | 0,995 |
| Características de los receptores | ||||
| Categoría de edad (años)<3030-3435-3940-4445-4950-54 | 6 (7,4)18 (22,2)30 (37,0)16 (19,8)10 (12,4)1 (1,2) | 5 (14,7)7 (20,6)12 (35,3)5 (14,7)5 (14,7)0 (0) | 1 (2,1)11 (23,4)18 (38,3)11 (23,4)5 (10,6)1 (2,1) | 0,9983 |
| SexoVarónMujer | 48 (59,3)33 (40,7) | 21 (61,8)13 (38,2) | 27 (57,4)20 (42,6) | 1 |
| HTASíNo | 76 (93,8)5 (6,2) | 29 (85,3)5 (14,7) | 47 (100)0 (0) | 1 |
| DislipidemiaSíNo | 59 (72,8)22 (27,2) | 20 (58,8)14 (41,2) | 39 (83,0)8 (17,0) | 1 |
| TabaquismoNoActivoExfumador | 48 (59,3)17 (21,0)16 (19,8) | 22 (64,7)5 (14,7)7 (20,6) | 26 (55,3)12 (25,5)9 (19,1) | 0,9987 |
| Tiempo de evolución de la DM (años) | 25,6±6,5 | 24,3±6,2 | 26,6±6,6 | 0,12 |
| Tiempo en diálisis antes del trasplante (años) | 1,9±1,1 | 1,6±0,7 | 2,1±1,2 | 0,024 |
| Tipo de diálisisHemodiálisisDiálisis peritonealPrediálisis | 51 (63,0)29 (35,8)1 (1,2) | 19 (55,9)15 (44,1)0 (0) | 32 (68,1)14 (29,8)1 (2,1) | 0,199 |
| IMC (kg/m2) | 24,1±3,4 | 24,5±3,2 | 23,8±3,6 | 0,127 |
| HbA1cbasal (%) | 8,2±1,6 | 8,0±1,4 | 8,4±1,7 | 0,26 |
| Unidades basales de insulina diarias ajustadas a peso (UI/kg/día) | 0,56±0,23 | 0,55±0,17 | 0,58±0,26 | 0,785 |
CMV: citomegalovirus; DM: diabetes mellitus; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal.
Los resultados se han calculado con base en los datos disponibles y se expresan como número (porcentaje) o como media±desviación estándar.
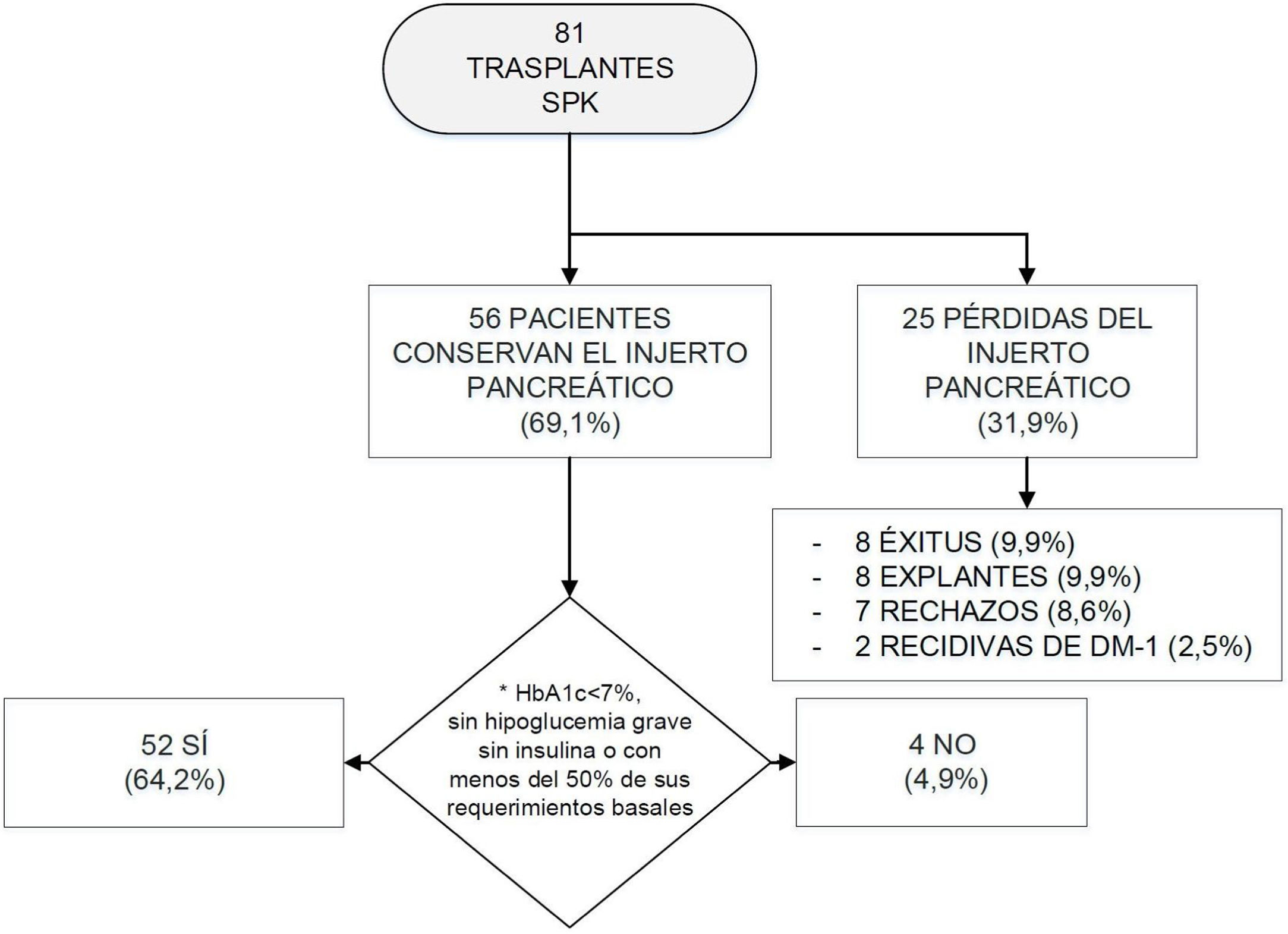
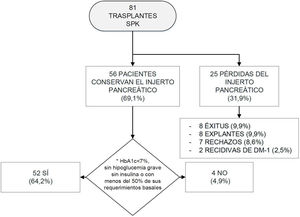
Tras el trasplante de páncreas, de los 81 pacientes iniciales, 8 fueron exitus entre 2002 y 2015 (fig. 1), obteniéndose una tasa de mortalidad global del 9,9%. De ellos, 6 fallecieron en los 3 primeros meses postrasplante, con una mediana y rango intercuartílico de 1,5 [0,00-6,75] meses tras el trasplante. Las causas de mortalidad fueron:
- -
Infecciosas, en 4 casos (50% del total de fallecidos): 2 infecciones abdominales quirúrgicas, una neumonía hospitalaria y una infección urinaria que desembocaron en shock séptico.
- -
Trombosis venosa del injerto pancreático, en 2 casos (25%). En uno de ellos coexistió con trombosis del injerto renal.
- -
Fístula iliacomesentérica en un solo caso (12,5%).
- -
Hemorragia posquirúrgica en un solo caso (12,5%).
Evolución de los trasplantes SPK.
DM-1: diabetes mellitus tipo 1; HbA1c: hemoglobina glucosilada; SPK: simultaneous pancreas kidney transplantation («trasplante simultáneo de páncreas-riñón»).
*Se estableció el mantenimiento de la funcionalidad del injerto pancreático según los criterios Igls12.
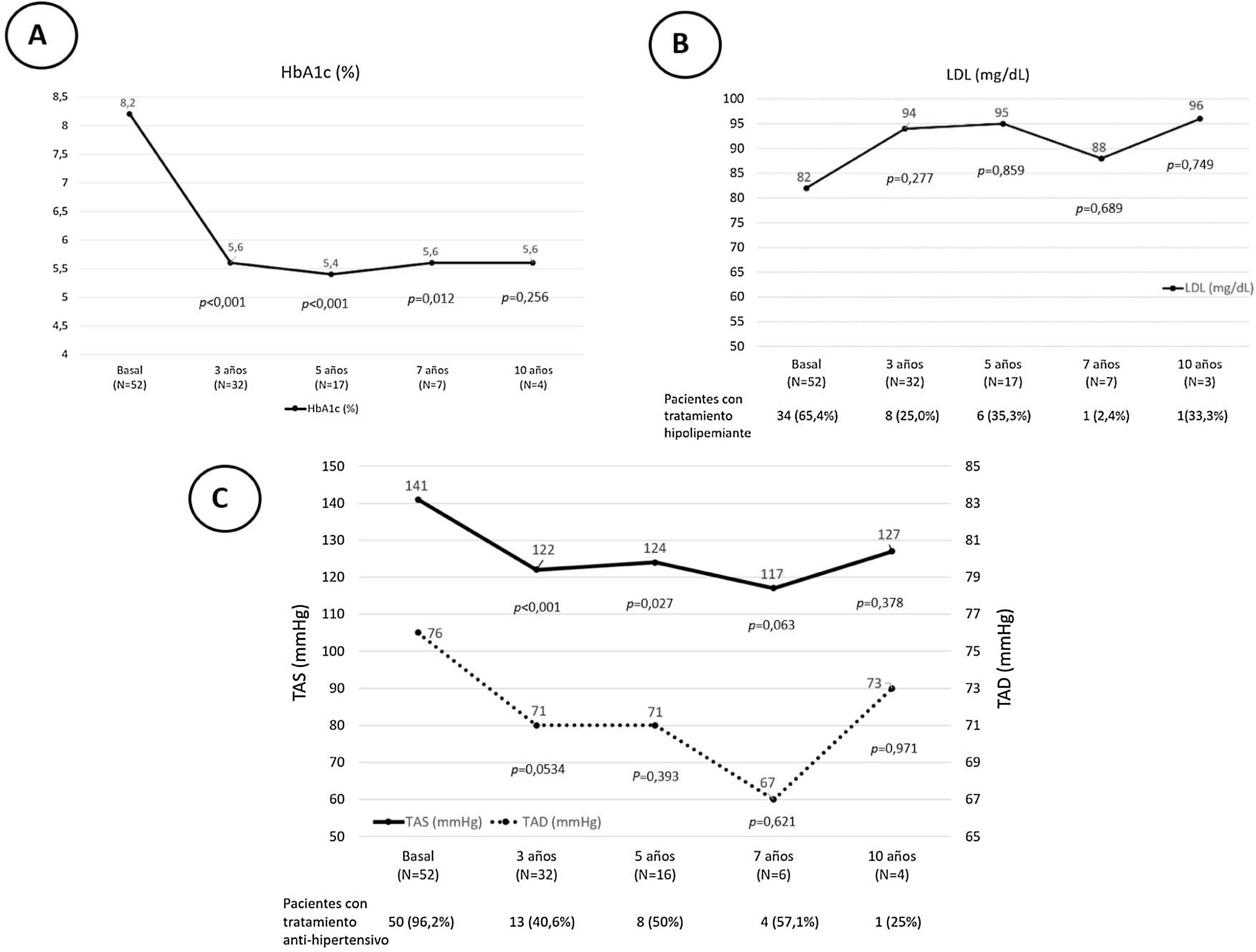
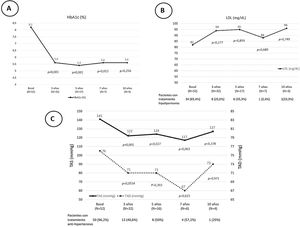
Tras el trasplante SPK, 52 pacientes presentaban una función del injerto pancreático óptima o buena según criterios Igls12, sin precisar insulina 41 pacientes o con bajos requerimientos los 11 restantes, a razón de 0,20[0,16-0,24]UI/kg/día a los 6 meses del trasplante (fig. 1). Se recogieron datos demográficos, clínicos y bioquímicos en estos 52 pacientes durante su evolución tras el trasplante SPK. Estos 52 pacientes con injerto pancreático normofuncionante alcanzaron buen control de la tensión arterial y del perfil lipídico durante el seguimiento postrasplante, con o sin tratamiento antihipertensivo o hipolipidemiante, respectivamente (fig. 2).
Valores basales y evolutivos de la HbA1c (A), el LDL y los pacientes en tratamiento hipolipidemiante (B) y las cifras de TAS y TAD y los pacientes con tratamiento antihipertensivo (C) en el postrasplante SPK de los pacientes con injerto pancreático y renal normofuncionantes. Los resultados se expresan como mediana y porcentaje.
HbA1c: hemoglobina glucosilada; LDL: low density lipoproteins cholesterol («colesterol unido a lipoproteínas de baja densidad»); SPK: simultaneous pancreas kidney transplantation («trasplante simultáneo de páncreas-riñón»); TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
De los 29 pacientes restantes, 8 fallecieron, 17 perdieron el injerto pancreático por rechazo pancreático, recidiva de la DM-1 o explante quirúrgico del injerto, y los 4 restantes presentaron un fallo de funcionalidad del injerto pancreático con niveles de HbA1c>7% o con requerimientos de insulina mayores que los basales (fig. 1).
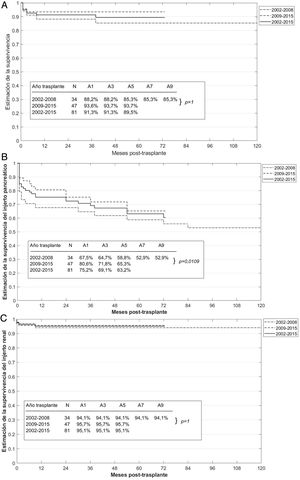
La supervivencia global del paciente a uno, 3 y 5 años del trasplante SPK fue del 91,3, el 91,3 y el 89,5%, respectivamente. Sin embargo, la supervivencia del paciente en los periodos 2002-2008 y 2009-2015 fue del 88,2 y el 93,6% al año, del 88,2 y el 93,7% a los 3 años, y del 85,3 y el 93,7% a los 5 años, respectivamente, aunque no se alcanzaron diferencias estadísticamente significativas entre ambos periodos (p=1) (fig. 3A).
La supervivencia global del injerto pancreático a uno, 3 y 5 años del trasplante fue del 75,2, el 69,1 y el 63,2%, respectivamente, y la del injerto renal fue del 95,1% en los 3 casos (fig. 3B y C). Sin embargo, la supervivencia del injerto pancreático en los periodos 2002-2008 y 2009-2015 fue del 67,5 y el 80,6% al año, del 64,7 y el 71,8% a los 3 años, y del 58,8 y el 65,3% a los 5 años, respectivamente, obteniéndose significación estadística (p=0,0109) entre los 2 periodos evaluados.
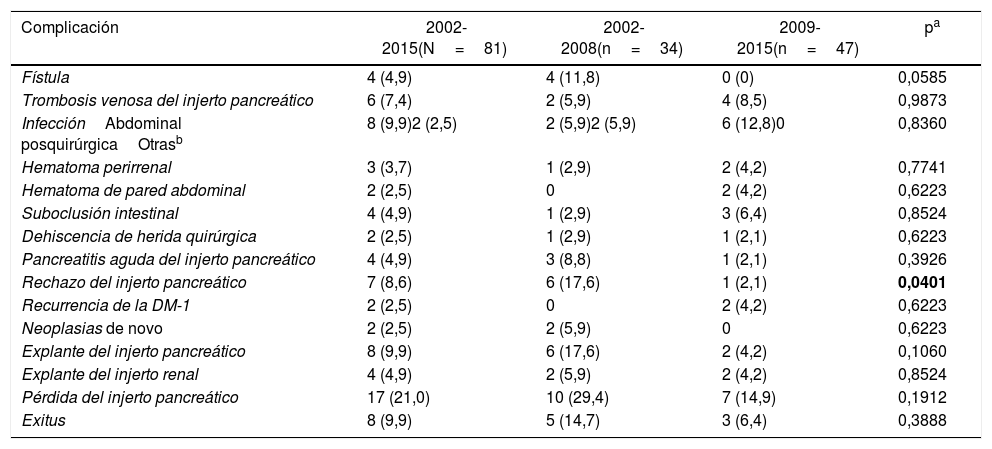
Las complicaciones que aparecieron tras los trasplantes SPK se recogen en la tabla 2.
Complicaciones quirúrgicas tras el trasplante simultáneo de páncreas-riñón: globales y por periodos de tiempo
| Complicación | 2002-2015(N=81) | 2002-2008(n=34) | 2009-2015(n=47) | pa |
|---|---|---|---|---|
| Fístula | 4 (4,9) | 4 (11,8) | 0 (0) | 0,0585 |
| Trombosis venosa del injerto pancreático | 6 (7,4) | 2 (5,9) | 4 (8,5) | 0,9873 |
| InfecciónAbdominal posquirúrgicaOtrasb | 8 (9,9)2 (2,5) | 2 (5,9)2 (5,9) | 6 (12,8)0 | 0,8360 |
| Hematoma perirrenal | 3 (3,7) | 1 (2,9) | 2 (4,2) | 0,7741 |
| Hematoma de pared abdominal | 2 (2,5) | 0 | 2 (4,2) | 0,6223 |
| Suboclusión intestinal | 4 (4,9) | 1 (2,9) | 3 (6,4) | 0,8524 |
| Dehiscencia de herida quirúrgica | 2 (2,5) | 1 (2,9) | 1 (2,1) | 0,6223 |
| Pancreatitis aguda del injerto pancreático | 4 (4,9) | 3 (8,8) | 1 (2,1) | 0,3926 |
| Rechazo del injerto pancreático | 7 (8,6) | 6 (17,6) | 1 (2,1) | 0,0401 |
| Recurrencia de la DM-1 | 2 (2,5) | 0 | 2 (4,2) | 0,6223 |
| Neoplasias de novo | 2 (2,5) | 2 (5,9) | 0 | 0,6223 |
| Explante del injerto pancreático | 8 (9,9) | 6 (17,6) | 2 (4,2) | 0,1060 |
| Explante del injerto renal | 4 (4,9) | 2 (5,9) | 2 (4,2) | 0,8524 |
| Pérdida del injerto pancreático | 17 (21,0) | 10 (29,4) | 7 (14,9) | 0,1912 |
| Exitus | 8 (9,9) | 5 (14,7) | 3 (6,4) | 0,3888 |
DM-1: diabetes mellitus tipo 1.
Los resultados se expresan como número (porcentaje).
En los trasplantes SPK se produjeron 8 explantes del injerto pancreático (9,9%), todos ellos debidos a complicaciones quirúrgicas: 3 trombosis venosas del injerto pancreático, 2 pancreatitis agudas del injerto pancreático secundarias al acto quirúrgico, una dehiscencia de sutura anastomótica duodeno-ileal, una fístula y en otro caso coexistieron la aparición de una fístula con una trombosis venosa. Además, estas complicaciones quirúrgicas justificaron la pérdida de funcionalidad del injerto pancreático en el 47% de los casos.
En cuanto al injerto renal, de los 81 pacientes trasplantados SPK, 4 (4,9%) precisaron realizar trasplantectomía renal, con la consiguiente pérdida del injerto renal. Tres (75%) de los explantes fueron en el postrasplante inmediato y se debieron a complicaciones quirúrgicas: en 2 por trombosis del injerto renal y el tercero por formación de hematoma posquirúrgico. En el cuarto paciente (25%), el explante se realizó a los 9 meses postrasplante debido a un rechazo crónico del injerto renal.
De los 81 trasplantados SPK, 7 (8,6%) presentaron rechazo del injerto pancreático: 2 rechazos agudos y 5 crónicos. En todos ellos se constataron niveles elevados de amilasa y lipasa. Se realizó biopsia del injerto pancreático, confirmándose el rechazo en 5 pacientes. En los otros 2, coexistió rechazo del injerto renal y pancreático y solo se realizó biopsia del injerto renal.
Uno de los casos fue diagnosticado de rechazo agudo celular moderado (Banff II) y el tratamiento médico con bolos iv de glucocorticoides permitió mantener la función del injerto pancreático. En los otros 6 casos con rechazo del injerto pancreático, se produjo una pérdida de funcionalidad del mismo y uno de ellos, posteriormente, fue sometido a trasplante PAK, desarrollando de nuevo un rechazo crónico del injerto con la consecuente pérdida del nuevo injerto pancreático. El rechazo del injerto pancreático fue el responsable del 41,2% del total de los casos con pérdida de funcionalidad del injerto pancreático.
La recidiva de DM-1 se produjo en 2 pacientes sometidos a trasplante SPK, motivando la pérdida de funcionalidad de ambos injertos10. La recidiva de la DM-1 justificó el 11,8% de las pérdidas del injerto pancreático.
DiscusiónSegún los datos de la International Diabetes Federation, la incidencia de DM-1 se encuentra entre 5 y 8 nuevos casos por cada 100.000 habitantes y año14. En la Comunidad Valenciana, la DM-1 tiene una prevalencia aproximada del 0,3% y una incidencia de 11-15 casos por cada 100.000 habitantes15.
La diabetes mellitus mal controlada de forma crónica conlleva la aparición de complicaciones macro y microvasculares, siendo la principal causa de ceguera adquirida, insuficiencia renal y amputación no traumática de los miembros inferiores. Además, la diabetes mellitus es la responsable del 8,5% de todas las muertes que se producen en Europa antes de los 80 años14,16, es la sexta causa de mortalidad en la Comunidad Valenciana y contribuye a las causas vasculares y a ciertos tipos de neoplasias malignas15.
En pacientes con DM-1 se ha demostrado que la insulinoterapia intensiva mantenida a largo plazo logra una normoglucemia que evita la aparición de complicaciones crónicas. Sin embargo, la insulinoterapia intensiva no está exenta de riesgos, puesto que aumenta entre 2-3 veces el número de hipoglucemias con respecto a la pauta convencional de insulinización17. A su vez, las hipoglucemias, especialmente las graves, se relacionan con una mayor mortalidad18,19. Es por ello que el trasplante SPK es una opción terapéutica válida en pacientes que son candidatos a trasplante renal por nefropatía diabética terminal, puesto que restablece el estado de euglucemia sin riesgo de hipoglucemia.
Según el International Pancreas Transplant Registry20, desde el año 2001 se han realizado más de 2.000 trasplantes de páncreas anuales a nivel mundial, y de ellos, el trasplante SPK es el más frecuente, con más de 1.500 trasplantes al año. El número de trasplantes SPK en nuestro país ha ido aumentando de forma progresiva, especialmente a partir del año 20008, alcanzando su cifra máxima en 2011, con 106 trasplantes. Posteriormente ha descendido el número de trasplantes realizados, pero manteniéndose por encima de los 70 trasplantes de páncreas anuales8. Del mismo modo, desde que se realizó el primer trasplante SPK en la Comunidad Valenciana en el año 2002, ha habido un aumento progresivo en la realización de este tipo de trasplantes, siendo 2008 y 2010 los años con mayor número de trasplantes SPK: 108. En nuestra serie nos hemos centrado en los resultados de SPK, puesto que el tamaño muestral de los trasplantes PAK era muy reducido y no se ha realizado ningún trasplante PTA.
En la serie de EE. UU.21, la mayor descrita hasta la fecha, la supervivencia del paciente al primer y tercer año del trasplante SPK entre 2001-2005 fue del 95,2 y el 91%, respectivamente. Estas cifras aumentan de forma progresiva conforme avanzan los años de realización del trasplante, siendo del 96,1 y el 92,8%, respectivamente, para los trasplantes SPK realizados entre 2006-2010, y del 97,6 y el 94,6% para los trasplantes SPK realizados entre 2011-201621.
Del mismo modo, en Europa y en España, otras series de trasplante de páncreas arrojan cifras de supervivencia del paciente al año del trasplante similares22–26. Evaluando la supervivencia del paciente a más largo plazo, también se han obtenido óptimos resultados, con unas supervivencias al quinto y décimo año postrasplante superiores al 85%24–27.
En nuestra serie, los resultados obtenidos son similares a los reflejados en estas series, con una supervivencia global del paciente al primer y quinto año del trasplante SPK del 91,3 y el 89,5%, respectivamente. Además, parece haber una tendencia a una mayor supervivencia del paciente en los trasplantes realizados más recientemente, en el periodo 2009-2015 frente al relativo a 2002-2008, tal y como ocurría en las series previas, si bien las diferencias entre ambos periodos no fueron estadísticamente significativas.
Por otro lado, la supervivencia global del injerto pancreático al año del trasplante SPK (75,2%) es algo inferior a la de otras series publicadas que presentan cifras de supervivencia superiores al 80%22–26. Sin embargo, si tenemos en cuenta la supervivencia del injerto pancreático por periodos de tiempo, observamos que la supervivencia en el periodo de tiempo más reciente (2009-2015) es superior al 80% frente a la del 67,5% del primer periodo, siendo esta diferencia estadísticamente significativa (p=0,0109). Por tanto, la supervivencia del injerto pancreático aumenta de forma progresiva con los años de realización del trasplante, siendo cifras comparables a las de series más amplias21–24,26.
La mejoría de la supervivencia del injerto pancreático en el segundo periodo de tiempo con respecto al primero probablemente se deba a una mayor experiencia del equipo médico-quirúrgico en el trasplante SPK, entre otras causas. Por un lado, la pauta de inmunosupresión y la técnica quirúrgica fueron las mismas en todos los pacientes, independientemente del momento de realización del trasplante, por lo que estas variables no influirían en el resultado. Por otro lado, no se encontraron diferencias estadísticamente significativas en cuanto a las características de los donantes entre un periodo u otro, y en lo que respecta a los pacientes receptores, tan solo hubo diferencias estadísticamente significativas en el tiempo de permanencia en diálisis antes del trasplante SPK, que fue superior en los pacientes del segundo periodo de tiempo. Todo ello justificaría que la experiencia del equipo es esencial para lograr mejores resultados, sin que ello influya en la supervivencia del paciente.
En lo que respecta a la supervivencia del injerto renal, esta suele ser, en general, mayor que la del injerto pancreático, y nuestros resultados son similares a los de las series descritas previamente21–27, sin que exista ninguna diferencia estadísticamente significativa entre los 2 periodos de tiempo analizados.
Por otro lado, la mortalidad en los pacientes con diabetes mellitus se atribuye en el 56% de los casos a enfermedad renal, y en el 44% a enfermedad cardiovascular28. Se ha demostrado que el trasplante de páncreas, en cualquiera de sus modalidades (SPK, PAK y PTA), conlleva un aumento notable en la supervivencia del paciente, de alrededor de 10 años, en comparación con aquellos que permanecen en lista de espera29.
En nuestro centro, en los pacientes sometidos a trasplante SPK con buena función de los injertos pancreático y renal se consiguió un buen control de las cifras de presión arterial30, que se mantuvo durante el seguimiento a 10 años postrasplante, tal y como se muestra en la figura 2. En ella se aprecia como se redujo de forma progresiva el número de pacientes que precisaban de tratamiento antihipertensivo e hipolipidemiante tras el trasplante.
De esta forma, tras el trasplante SPK, la mejoría en el control glucémico, la normalización de la función renal y el control de factores de riesgo cardiovascular como la presión arterial y la dislipidemia contribuirían al aumento de la supervivencia de los pacientes con diabetes trasplantados frente a los no trasplantados.
Sin embargo, el trasplante de páncreas no está exento de complicaciones. Históricamente, las complicaciones quirúrgicas o «fallos técnicos» han sido la principal causa de mortalidad y de pérdida del injerto pancreático tras el trasplante SPK. Se describió inicialmente una tasa de complicaciones quirúrgicas del 15,3% tras el trasplante SPK, siendo la causa más común de pérdida del injerto pancreático (39,3%). No obstante, estas cifras han ido reduciéndose de forma progresiva con la mejoría de las técnicas quirúrgicas9,31,32, hasta alcanzar unas cifras actuales del 7 y el 5,6% en los trasplantes SPK realizados en los periodos de 2006-2009 y 2011-2016, respectivamente22. A pesar de ello, siguen siendo la principal causa de comorbilidad en todos los tipos de trasplante de páncreas22.
Las complicaciones médicas y quirúrgicas que aparecieron en el inicio del programa de trasplante de páncreas en nuestro hospital ya se describieron con anterioridad9. Actualmente, en nuestra serie, las complicaciones quirúrgicas siguen siendo las principales responsables de la pérdida del injerto pancreático.
La trombosis del injerto es la complicación más frecuente y más grave33,34, siendo la principal causa de reintervención y de explante del injerto pancreático32,35. En nuestra serie, la incidencia de trombosis del injerto pancreático fue del 7,4% (6 casos). Esta incidencia es similar a la reflejada por el Grupo Español de Trasplante de Páncreas36, pero es algo menor que la descrita en otras series internacionales y que se sitúa entre el 8 y el 13%33,37,38. Su etiología es multifactorial, viéndose implicados múltiples factores tales como el estado de hipercoagulabilidad39, problemas en la anastomosis, estasis a nivel de los vasos esplénicos, factores relacionados con el donante (mayor si edad>50 años, muerte cardiovascular, etc.)37,38,40, con la extracción (aporte excesivo de la solución de preservación, drenaje inadecuado de la sangre) y con el receptor (diálisis peritoneal previa, drenaje venoso portal, pancreatitis del injerto, síndromes de trombofilia)36–38. A este respecto, el empleo de una solución de preservación u otra, Wisconsin o Celsior, se ha descrito que no influye en los resultados de trombosis venosa25,41. En nuestra serie se empleó más la solución de Celsior frente a la de Wisconsin, que únicamente fue empleada hasta 2009, tal y como se ha descrito con anterioridad9. Una vez se produce la trombosis del injerto, el tratamiento generalmente es la realización del explante del mismo (trasplantectomía). Por tanto, su prevención es fundamental. Algunas mejoras encaminadas a reducir la incidencia de trombosis del injerto son la profilaxis antitrombótica, el control postoperatorio mediante ecografía Doppler, la mejoría en la selección del donante y del receptor y una mejoría en la técnica quirúrgica evitando el drenaje venoso portal31,42.
Por su parte, la pancreatitis del injerto tras el acto quirúrgico se produce como consecuencia de la lesión por isquemia-reperfusión o por reflujo en las derivaciones exocrinas vesicales. Además, la pancreatitis suele asociarse a la aparición de complicaciones graves como fístulas, trombosis, colecciones infecciosas o necrosis31. En nuestra serie tuvo una incidencia del 4,9%, cifra algo inferior al 6% obtenido por el Grupo Español de Trasplante de Páncreas 36, probablemente debido a que no se realizó ninguna derivación exocrina vesical, minimizándose así el riesgo de pancreatitis.
La recidiva de la DM-1 ocurrió en 2 pacientes (2,5%) trasplantados SPK de nuestra serie, prevalencia también algo menor que la descrita por otras series (entre 7-9%), probablemente debido a que nuestra cohorte de pacientes es más reciente y, en consecuencia, el esquema de inmunosupresión fue mejorado con respecto a series previas10.
Esta implementación del esquema de inmunosupresión, con el tacrolimus y el micofenolato de mofetilo, de mayor potencia inmunosupresora que la azatioprina43, también ha permitido una reducción en las pérdidas del injerto pancreático mediadas por rechazo. Así, la incidencia de rechazo inmunológico del injerto pancreático también fue menor en nuestra serie, 8,6%, con respecto a la descrita en la literatura, situada en torno al 9-37,2%24,25,44, con una pérdida del injerto pancreático al año del trasplante del 20%. También se ha demostrado que la incidencia de rechazo aumenta cuando el donante es mayor de 30 años y el receptor es de raza negra o menor de 30 años. Por el contrario, esta incidencia es menor en los trasplantes SPK frente a los PAK o PTA y mejora con el paso del tiempo, siendo menor en los trasplantes realizados más recientemente22, tal y como ha sucedido en nuestra cohorte, alcanzándose diferencias estadísticamente significativas entre ambos periodos de tiempo.
Como consecuencia de la inmunosupresión intensificada, las infecciones se han convertido en la principal causa de mortalidad durante el primer año postrasplante45-48, especialmente las infecciones abdominales posquirúrgicas25,49. En nuestro caso son las responsables de la mitad de las muertes, a pesar de la aplicación de profilaxis antibacteriana, antifúngica y anticitomegalovirus. Dentro de ellas se recogen las fugas anastomóticas, los abscesos o colecciones quirúrgicas, la infección de la herida quirúrgica, etc. Algunos factores que pueden favorecerlas son: edad avanzada del donante y el receptor, mayor tiempo de isquemia fría, el empleo de diálisis peritoneal frente a hemodiálisis y la mayor permanencia en lista de espera para trasplante34,37,38,50.
Por su parte, las fístulas son complicaciones poco frecuentes35, con una incidencia en torno al 5-8% en derivaciones duodeno-entéricas51, siendo algo mayor en derivaciones duodeno-vesicales. En nuestra serie aparecieron en el 4,9% de los trasplantes SPK.
Comparando de forma global las complicaciones que surgieron en ambos periodos de tiempo, 2002-2008 y 2009-2015, en el primer periodo se aprecian más fístulas, mayor número de rechazos del injerto pancreático, de necesidad de trasplantectomía (explante del injerto pancreático) y de exitus con respecto al periodo posterior. En el segundo periodo el número total de trombosis venosas y de infecciones intraabdominales posquirúrgicas fue mayor, pero menos graves, puesto que hay un menor número de explantes pancreáticos y de exitus. Sin embargo, en lo que respecta a la aparición de complicaciones entre ambos periodos de tiempo, solo se alcanzaron diferencias estadísticamente significativas en los rechazos del injerto pancreático, que podría estar en relación con la mejoría de la pauta inmunosupresora. En el resto de las complicaciones no se alcanzaron diferencias estadísticamente significativas, probablemente debido al pequeño tamaño muestral.
Este estudio tiene varias limitaciones. La primera es el menor tamaño muestral, especialmente si se compara con otras series publicadas a nivel internacional, pero queda justificado al ser una serie regional con una población de 5 millones de habitantes y una prevalencia de DM-1 del 0,3%15. La segunda es que se trata de un estudio retrospectivo, por lo que algunos datos están incompletos o no disponibles.
En conclusión, en 13 años de experiencia en trasplante SPK, la supervivencia del paciente y del injerto pancreático y la tasa de complicaciones tras el trasplante de páncreas logradas en el segundo periodo de tiempo son similares a las de otras series de mayor tamaño. La experiencia del equipo médico-quirúrgico mejora la supervivencia del injerto pancreático, sin influir en la supervivencia del paciente.
NotaLos datos utilizados para respaldar los hallazgos de este estudio están disponibles bajo petición al autor.
FinanciaciónNo se necesitaron recursos de financiación ya que esta investigación se realizó dentro de la práctica clínica diaria de los autores en la Consellería de Sanitat de la Comunidad Valenciana (España).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.