Recientemente se ha demostrado una relación inversa entre la concentración en sangre de la lipoproteína(a) (Lp[a]) y los triglicéridos (TG). A mayor tamaño de lipoproteínas de muy baja densidad (VLDL), mayor presencia de VLDL ricas en apoliproteína E (apo E) y en sujetos con genotipo apo E2/E2, Lp(a) más baja. El mecanismo de esta asociación contrapuesta es desconocido. El objetivo de nuestro análisis fue evaluar la correspondencia Lp(a)-TG en los pacientes atendidos en las Unidades de Lípidos incluidos en el registro de la Sociedad Española de Arteriosclerosis (SEA) comparando las diferentes dislipidemias.
Pacientes y métodosSe incluyeron 5.275 usuarios de ≥ 18 años registrados antes del 31 de marzo de 2023, con datos de concentración de Lp(a) e información completa del perfil lipídico sin tratamiento.
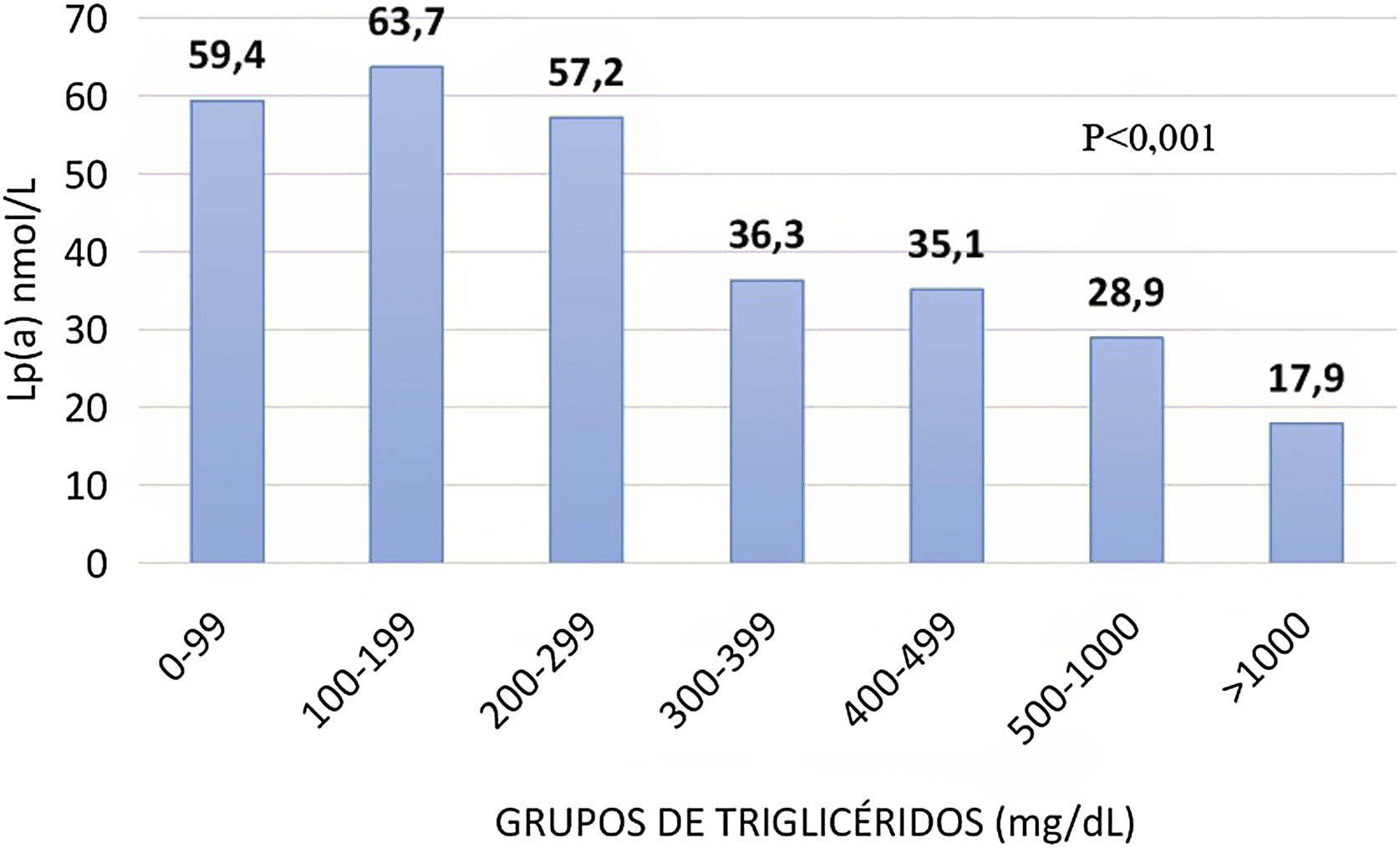
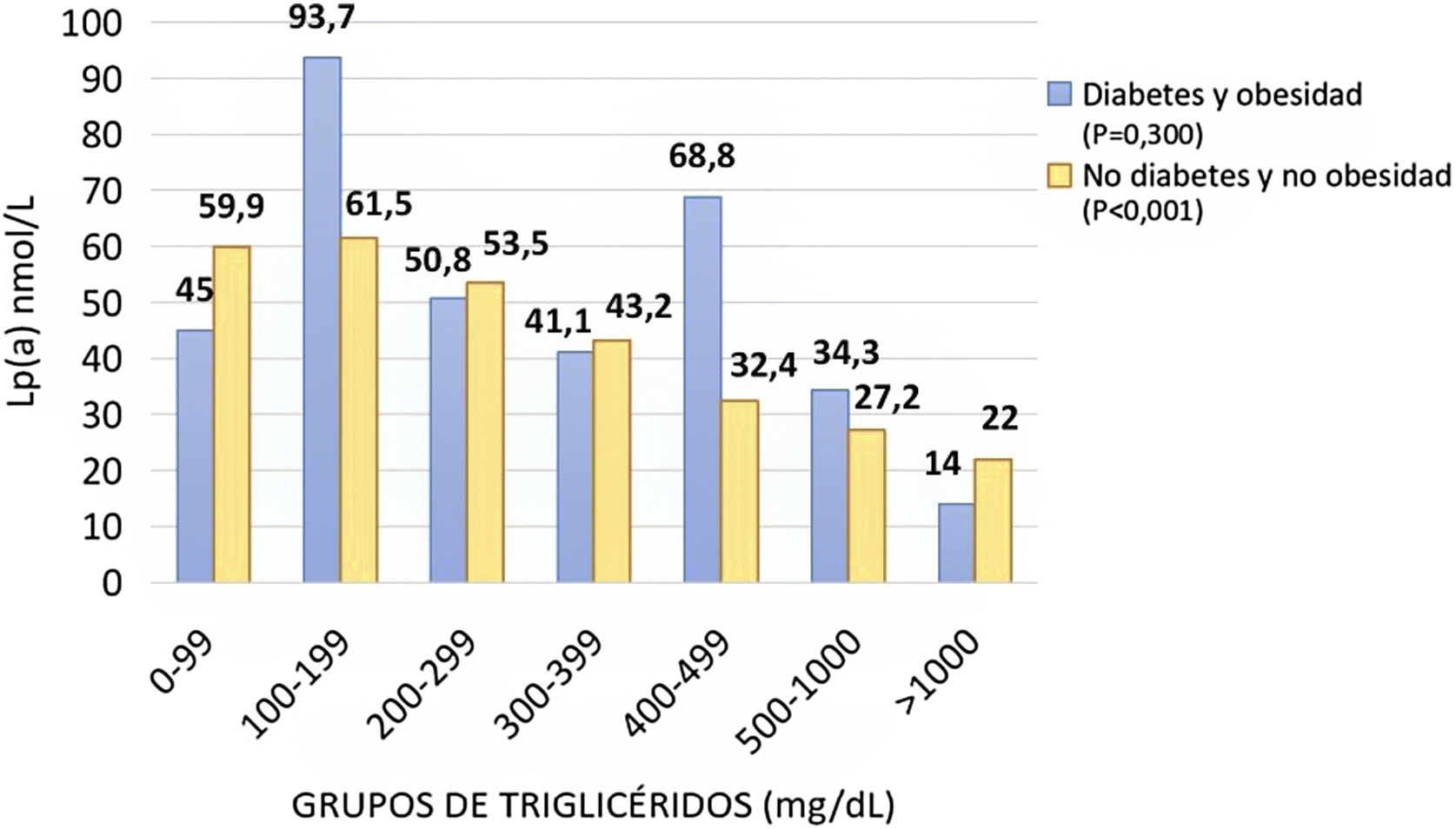
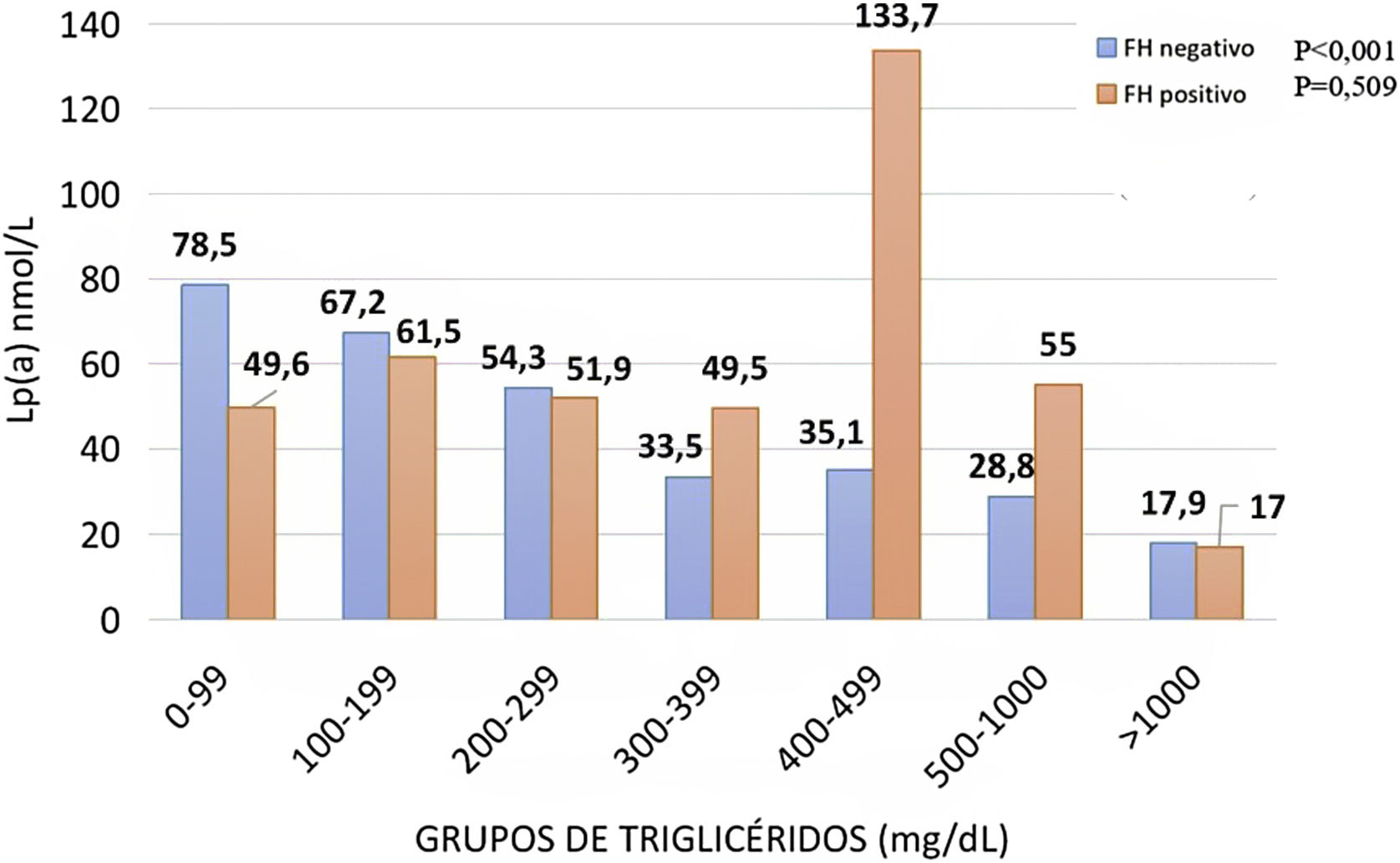
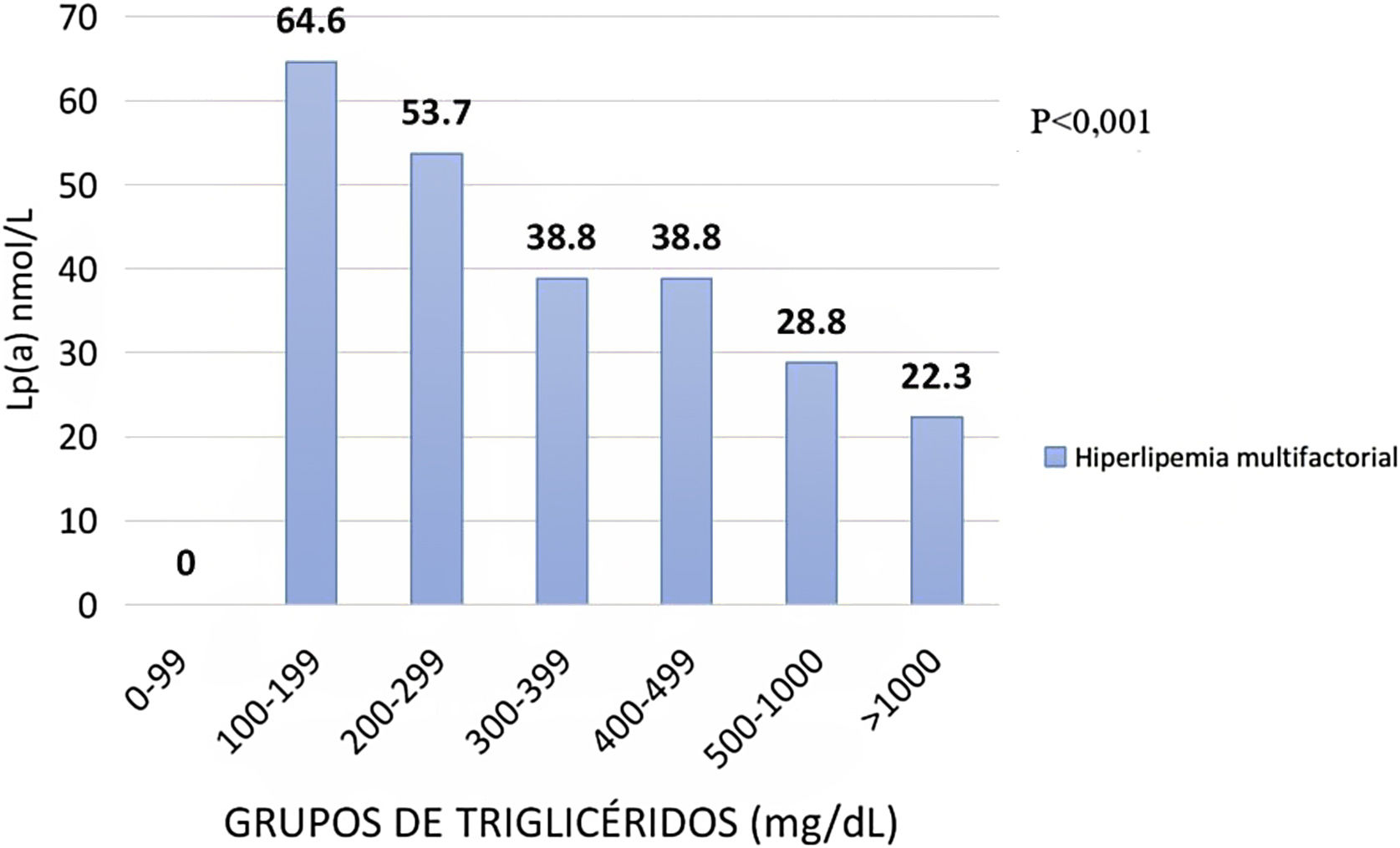
ResultadosLa media de edad fue de 53,0 ± 14,0 años, con 48% de mujeres. Un total de 9,5% (n = 502) tenían diabetes mellitus (DM) y 1.184 sujetos (22,4%) presentaban obesidad. La mediana de TG fue de 130 mg/dL (rango intercuartílico [IQR] 88,0-210) y de Lp(a) 55,0 nmol/L (IQR 17,9 -156). La concentración de Lp(a) mostró una asociación negativa con la de TG cuando los valores de estos superaban los 300 mg/dL. Los pacientes con TG > 1.000 mg/dL mostraron el menor nivel de Lp(a) 17,9 nmol/L y los usuarios con TG < 300 mg/dL, presentaron una media de Lp(a) de 60,1 nmol/L. En pacientes sin DM ni obesidad, la relación inversa de Lp(a)-TG fue especialmente importante (p < 0,001). La mediana de Lp(a) fue de 58,3 nmol/L en aquellos con TG < 300 mg/dL y 22,0 nmol/L si TG > 1.000 mg/dL. No se encontró asociación entre TG y Lp(a) en sujetos con DM y obesidad, ni en los que contaban con hipercolesterolemia familiar (HF). En los que padecen hiperlipemia combinada multifactorial con TG < 300 mg/dL la Lp(a) fue 64,6 nmol/L, en el rango de 300-399 mg/dL de TG la Lp(a) desciende hasta 38,8 nmol/L y hasta 22,3 nmol/L si TG > 1.000 mg/dL.
ConclusionesNuestros resultados muestran una relación inversa de Lp(a)-TG en concentraciones de TG > 300 mg/dL en sujetos sin DM, ni obesidad o HF. Del mismo modo, sugieren que en aquellas hipertrigliceridemias por sobreproducción hepática de VLDL, se reducen la formación de Lp(a), a diferencia de aquellas en las que el catabolismo periférico de las lipoproteínas ricas en TG está reducido.
Recently, an inverse relationship between the blood concentration of lipoprotein(a) (Lp(a)) and triglycerides (TG) has been demonstrated. The larger the VLDL particle size, the greater the presence of VLDL rich in apoliprotein E and in subjects with the apoE2/E2 genotype, the lower Lp(a) concentration. The mechanism of this inverse association is unknown. The objective of this analysis was to evaluate the Lp(a)–TG association in patients treated at the lipid units included in the registry of the Spanish Society of Atherosclerosis (SEA) by comparing the different dyslipidemias.
Patients and methodsFive thousand two hundred and seventy-five subjects ≥18 years of age registered in the registry before March 31, 2023, with Lp(a) concentration data and complete lipid profile information without treatment were included.
ResultsThe mean age was 53.0 ± 14.0 years, with 48% women. The 9.5% of subjects (n = 502) had diabetes and the 22.4% (n = 1184) were obese. The median TG level was 130 mg/dL (IQR 88.0–210) and Lp(a) 55.0 nmol/L (IQR 17.9–156). Lp(a) concentration showed a negative association with TG concentration when TG values exceeded 300 mg/dL. Subjects with TG > 1000 mg/dL showed the lowest level of Lp(a), 17.9 nmol/L, and subjects with TG < 300 mg/dL had a mean Lp(a) concentration of 60.1 nmol/L. In subjects without diabetes or obesity, the inverse association of Lp(a)–TG was especially important (p < 0.001). The median Lp(a) was 58.3 nmol/L in those with TG < 300 mg/dL and 22.0 nmol/L if TG > 1000 mg/dL. No association was found between TG and Lp(a) in subjects with diabetes and obesity, nor in subjects with familial hypercholesterolemia. In subjects with multifactorial combined hyperlipemia with TG < 300 mg/dL, Lp(a) was 64.6 nmol/L; in the range of 300–399 mg/dL of TG, Lp(a) decreased to 38. 8 nmol/L, and up to 22.3 nmol/L when TG > 1000 mg/dL.
ConclusionsOur results show an inverse Lp(a)–TG relationship in TG concentrations > 300 mg/dL in subjects without diabetes, obesity and without familial hypercholesterolemia. Our results suggest that, in those hypertriglyceridemias due to hepatic overproduction of VLDL, the formation of Lp(a) is reduced, unlike those in which the peripheral catabolism of TG-rich lipoproteins is reduced.
La lipoproteína(a) (Lp[a]) se sintetiza en el hígado y consiste en una partícula similar a la lipoproteína de baja densidad (LDL), en la que la apolipoproteína B-100 (apo B) establece una unión covalente por un enlace de disulfuro con una proteína específica de la Lp(a), la apo A1.
La apo A ha evolucionado del gen del plasminógeno mediante duplicación y remodelación. Está compuesta por un número repetido de secuencias de aminoácidos denominados «kringles» y por un dominio proteasa inactivo2,3. A pesar de su similitud con la partícula LDL, el catabolismo de la Lp(a) es desconocido, aunque se ha visto que es independiente del metabolismo de las LDL4,5. La concentración de Lp(a) es muy variable entre sujetos (en parte debido a la raza y el sexo). Esta depende principalmente de factores genéticos y se conoce que alrededor de 25% de la población presenta niveles aumentados de Lp(a) (> 50 mg/dL)6. Se ha observado que en la hipercolesterolemia familiar (HF) heterocigota, los usuarios presentan valores más elevados de Lp(a) que la población general, sin saber la causa que justificaría este incremento7–9. Además, los pacientes con HF homocigota que portan dos alelos nulos en el gen del receptor de las LDL (LDLR), tienen el doble de concentración de Lp(a) que sus familiares no HF10.
Las altas concentraciones en el plasma de esta partícula se asocian con la enfermedad cardiovascular (CV) ateromatosa y la estenosis aórtica, posiblemente por las propiedades proinflamatorias y proaterogénicas de Lp(a)11,12. Por otro lado, los niveles elevados de triglicéridos (TG) están relacionados de forma independiente con mayor morbimortalidad CV, en concreto cuando se corresponden con partículas LDL pequeñas y densas, y el colesterol transportado en las lipoproteínas de alta densidad (cHDL) está disminuido13,14.
La síntesis de TG es importante en la de Lp(a) en las células del hepatocito15, y se ha descrito que existe asociación entre las concentraciones sanguíneas de Lp(a) y TG16. Además, la de Lp(a) varía según el genotipo de APOE17 y la de apo E en las partículas de muy baja densidad (VLDL) está directamente relacionada con la de Lp(a)18. Recientemente se ha demostrado una correspondencia inversa de Lp(a)-TG. Los sujetos con un mayor tamaño de partículas VLDL tienen una Lp(a) más baja, y los pacientes con VLDL ricas en apo E y aquellos con genotipo apo E2/E2 presentaron valores más bajos de Lp(a). De esta manera, las VLDL más grandes y las VLDL enriquecidas en apo E estarían inversamente involucradas en la concentración plasmática de Lp(a)19. Si la relación contrapuesta entre TG y Lp(a) es dependiente de la causa de la hipertrigliceridemia es información desconocida en la actualidad.
El objetivo de este análisis es evaluar las diferencias en la asociación Lp(a)-TG en los sujetos atendidos en las Unidades de Lípidos del registro de la Sociedad Española de arteriosclerosis (SEA) comparando las diferentes dislipemias.
Pacientes y métodosVariables de estudioEl registro incluye, entre otros datos, antecedentes personales de salud, examen físico (tensión arterial, peso, talla, índice de masa corporal [IMC]), parámetros bioquímicos y presencia de enfermedad CV.
Los datos incluidos en la historia personal de salud se definieron como hipertensión arterial: presión arterial sistólica ≥ 140 mmHg o arterial diastólica ≥ 90 mmHg o consumo de medicación antihipertensiva; y diabetes mellitus (DM) definida como valores de glucosa plasmática en ayunas ≥ 126 mg/dL. La obesidad se consideró con IMC ≥ 30 kg/m2. Los sujetos diagnosticados de hiperlipemia combinada multifactorial se definieron como aquellos que presentaban colesterol no HDL (c-no-HDL) ≥ 160 mg/dL y TG ≥ 150 mg/dL sin mutación de HF. Estos pacientes fueron dicotomizados según cuatro variables: DM, obesidad, HF e hiperlipemia combinada multifactorial.
Para el estudio de la asociación Lp(a)-TG se seleccionaron únicamente aquellos sujetos que disponían de información de Lp(a) y TG, excluyendo el resto.
Los datos bioquímicos se recogieron en ayunas y sin tratamiento hipolipemiante o bien, ajustados por esta terapia mencionada con la que estaban tratados. Se recopiló información basal de lípidos: colesterol total (CT), colesterol transportado en las lipoproteínas de baja densidad (cLDL), cHDL, TG, apo B y Lp(a). La presencia de enfermedad CV se valoró a su inclusión en el registro. El cLDL se calculó por la fórmula de Friedewald cuando los TG eran inferiores a 400 mg/dL. La concentración de Lp(a) se registró en md/dL y nmol/L en función de la técnica utilizada en cada centro y posteriormente se realizó la conversión a nmol/L para homogeneizar los resultados. Se empleó la fórmula Lp(a), nmol/L = 2,18 × Lp(a), mg/dL – 3,8320.
Llevamos a cabo este estudio de acuerdo con la Declaración de Helsinki para la protección de los derechos y el bienestar de las personas que participan en la investigación biomédica.
Análisis estadísticoLas variables se expresaron como media (desviación estándar [DE]) para las de distribución normal, mediana (rango intercuartílico [IQR]) para las que no tenían dicha repartición, o porcentaje para las cualitativas. El análisis de la concentración de Lp(a) se colocó por grupos de TG (0-99; 100-199; 200-299; 300-399; 400-499; 500-999 y ≥ 1.000 mg/dL, respectivamente). Para el estudio de las diferencias entre grupos se empleó la prueba de análisis de la varianza (ANOVA). Todos los análisis de datos fueron realizados con el programa Statistical Package for the Social Sciences (SPSS) versión 21 (IBM Armonk [Nueva York], EE. UU.).
ResultadosCaracterísticas clínicasUn total de 5.275 sujetos del Registro de Dislipemias de la SEA fueron incluidos en el estudio. Las principales características clínicas de la población, así como la concentración de los parámetros lipídicos, se presentan en la tabla 1.
Características clínicas y concentraciones de lípidos de la población total Registro de Dislipemias
| Media (DE)/porcentaje (n) | Población total Registro de Dislipemias | |
|---|---|---|
| n | Media (DE) / % | |
| Sexo, mujeres, n (%) | 5.275 | 48 (100) |
| Edad (años) | 5.275 | 53,0 ± 14,0 |
| Peso (kg) | 5.275 | 74,7 ± 25,7 |
| IMC (kg/m2) | 5.275 | 27,4 ± 21,8 |
| Hipertensión, n (%) | 5.275 | 1.293 (24,5) |
| DM2, n (%) | 5.275 | 502 (9,5) |
| Historia de tabaquismo (fumador), n (%) | 5.275 | 1.224 (23,2) |
| Historia de enfermedad CV, n (%) | 5.275 | 1.293 (24,5) |
| CT sin tratamiento (mg/dL) | 5.275 | 301,0 (262,0-350,0) |
| TG sin tratamiento (mg/dL) | 5.275 | 130,0 (88,0-210,0) |
| cHDL sin tratamiento (mg/dL) | 5.275 | 53,00 (43,00-64,00) |
| cLDL sin tratamiento (mg/dL) | 5.275 | 206,4 (165,2-256,9) |
| c-no-HDL sin tratamiento (mg/dL) | 5.275 | 245,0 (207,0-294,0) |
| Lp(a) (nmol/L) | 5.275 | 55,0 (17,9 -155,7) |
c-no-HDL: colesterol no HDL; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; CV: cardiovascular; DE: desviación estándar; DM: diabetes mellitus tipo 2; IMC: índice de masa corporal; Lp(a): lipoproteína (a); TG: triglicéridos.
Datos continuos expresados como media (DE); los categóricos se expresan como porcentajes (número); los cuantitativos con intervalos (mediana-IQR).
La media de edad en el momento de inclusión en el registro fue de 53,0 ± 14,0 años, 48% eran mujeres y la media de IMC fue de 27,4 ± 21,8 kg/my. Un total de 9,5% (n = 502) padecían DM y 1.184 (22,4%) presentaban obesidad. La concentración media de TG fue de 130,0 mg/dL (IQR 88,0-210,0) y la de Lp(a) 55,0 nmol/L (IQR 17,9-155,7).
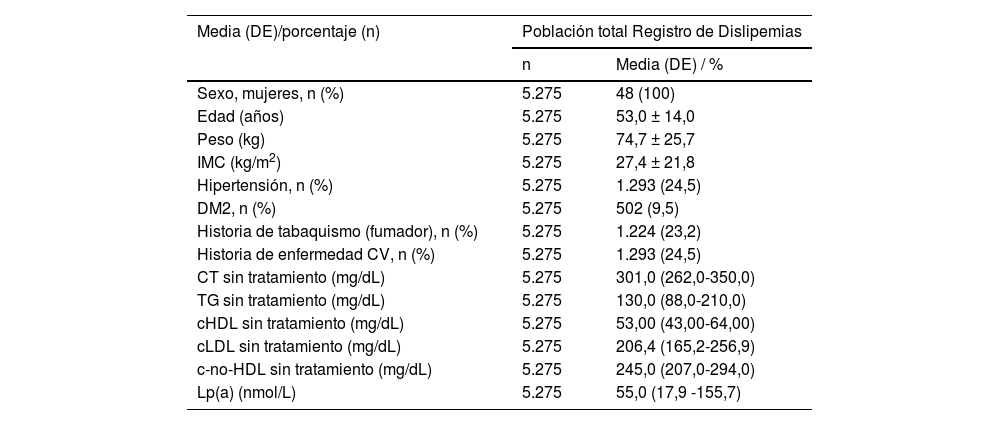
Asociación entre triglicéridos y lipoproteína(a)Para estudiar la asociación entre la concentración de TG y Lp(a), los pacientes fueron clasificados en rangos de 100 mg/dL de TG y se representó gráficamente la de Lp(a) (fig. 1). Esta última mostró una relación negativa con la de TG. Aquellos sujetos que presentaban mayor concentración de TG (> 1.000 mg/dL) mostraron la menor de Lp(a) (17,9 nmol/L) y a la inversa, en aquellos con cifras inferiores a 300 mg/dL de TG, la cantidad media de Lp(a) fue de 60,1 nmol/L. Entre los rangos 0-99, 100-199 y 200-299 mg/dL los niveles de Lp(a) fueron de 59,4, 63,7 y 57,2 nmol/L, respectivamente. Se observa un decrecimiento progresivo de la cantidad de Lp(a) a medida que aumenta la dada por grupos de TG, acentuándose a partir de unas superiores de 300 mg/dL.
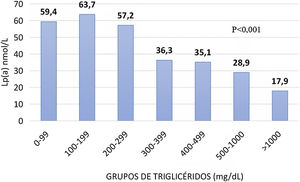
Efecto del mecanismo de la hipertrigliceridemia en la asociación entre triglicéridos y lipoproteína(a)Para estudiar el efecto de la hipertrigliceridemia en la concentración de Lp(a), los pacientes del registro se dividieron en cuatro grupos, dependiendo de los siguientes criterios: con y sin DM, con o sin obesidad, con y sin mutación HF y con hiperlipemia combinada multifactorial. Los usuarios sin DM y sin obesidad mostraron la asociación inversa de Lp(a)-TG que fue especialmente importante (fig. 2). A mayor concentración de TG menor era la de Lp(a), siendo la media de 58,3 nmol/L en aquellos con TG inferior a 300 mg/dL en sujetos sin obesidad ni DM. Como ocurría en la totalidad de la población, la asociación se intensifica a partir de niveles de TG > 300 mg/dL, con cifras de 43,2, 32,4, 27,2 y 22,0 nmol/L, a medida que aumentan los de TG en el grupo de los pacientes no diabéticos ni obesos. En cambio, los usuarios con DM y obesidad no mostraron dicha asociación (fig. 2).
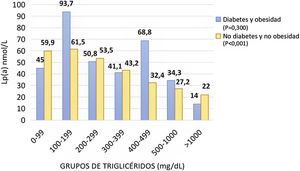
Cuando se compararon los sujetos portadores de una mutación relacionada con la HF y los no portadores, se apreció una asociación lineal y decreciente entre aquellos con mutación negativa a diferencia de los pacientes con mutación que no mostraron correspondencia entre Lp(a)-TG (fig. 3).
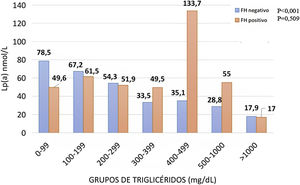
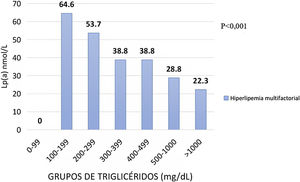
El efecto de los TG en la Lp(a) en los sujetos definidos con hiperlipemia multifactorial se describe en la figura 4. En este caso los valores medios para el grupo de TG de 0-99 mg/dL muestran una cifra media de Lp(a) de 64,6 nmol/L, mientras que en el rango de 300-399 mg/dL se encuentran cantidades medias de 38,8 nmol/L hasta disminuir en 22,3 nmol/L en superiores de TG.
DiscusiónLa concentración de Lp(a) es un factor de riesgo CV bien establecido, que se modifica poco a lo largo de la vida y en la que los factores genéticos juegan un papel fundamental. Sin embargo, diferentes situaciones clínicas que incluyen la enfermedad renal crónica21, el síndrome nefrótico22, el embarazo23 o la colestasis24 también la alteran, lo que ha ayudado a conocer los mecanismos de control de la Lp(a) en la sangre. Nuestro estudio añade otra entidad, la hipertrigliceridemia, que modifica sustancialmente los niveles de Lp(a) confirmando un estudio reciente19 y señala, por primera vez, que el mecanismo de la hipertrigliceridemia juega un papel a la hora de explicar la relación inversa entre Lp(a) y TG. En nuestro análisis, la asociación contraria de Lp(a)-TG es diferente entre las comorbilidades estudiadas.
En primer lugar, el presente estudio confirma que en la población del Registro de Dislipemias, tomada en su conjunto, se demuestra la asociación negativa Lp(a)-TG descrita recientemente19 y que había sido sugerida anteriormente por la investigación de Bartens et al.25, donde se mostraba que las concentraciones elevadas de TG, se correspondían negativamente con los niveles de Lp(a), pero no se analizaron los potenciales mecanismos de dicha relación, aunque se identificó que un aumento de partículas remanentes de TG ricas en apo E pudiera influir en la síntesis de Lp(a)19.
De nuestra investigación se desprende que la correspondencia inversa entre Lp(a) y TG no es lineal y que solo con concentraciones de TG por encima de 300 mg/dL, el efecto es significativo llegando a ser muy importante en aquellos sujetos en donde estas son de TG > 1.000 mg/dL que tienen 75% menos de Lp(a) en sangre que los usuarios con TG < 300 mg/dL.
Para estudiar el mecanismo de esta relación hemos elegido cuatro entidades que pueden asociar hipertrigliceridemia: DM26, obesidad27, HF con mutaciones en genes candidatos28 y otras hipercolesterolemias de base poligénica y carácter multifactorial como la hiperlipemia combinada multifactorial, anteriormente denominada hiperlipemia familiar combinada29. De modo que podemos comprobar el efecto de la correspondencia en situaciones con disminución del catabolismo periférico de las partículas ricas en TG, como la obesidad y la DM, donde la resistencia periférica a la insulina reduce la actividad lipoproteín lipasa26; un decrecicmiento del catabolismo de lipoproteínas a nivel hepático, como la HF, y aumento de la síntesis de lipoproteínas ricas en TG, como la hiperlipemia combinada multifactorial30.
Al estudiar a los sujetos con y sin DM, así como con y sin obesidad se demuestra que la relación inversa Lp(a)-TG es no significativa en presencia de cualquiera de ambas situaciones y se magnifica en ausencia de ellas. Como la mayor parte de hipertrigliceridemias sin obesidad y DM son consecuencia predominantemente de un aumento de la síntesis hepática de TG, podemos especular que aquellas situaciones con sobreproducción de partículas VLDL inhiben de alguna forma la síntesis de Lp(a). En consonancia con esta hipótesis, en los sujetos con HF y variante patogénica demostrada, la asociación inversa deja de observarse. Por el contrario, en usuarios con el diagnóstico de hiperlipemia combinada multifactorial, entidad donde existe el mayor incremento de la síntesis de VLDL dentro de las hiperlipemias más comunes, es donde la asociación negativa es más importante y significativa.
Esta relación inversa entre Lp(a)-TG no es constitutiva e irreversible, ya que en aquellos que consiguen reducir la concentración de TG bien por dieta o fármacos, la de Lp(a) incrementa19. Las estatinas elevan discretamente la de Lp(a) por algún mecanismo desconocido31. De acuerdo con nuestros resultados, el efecto de las estatinas sobre los TG sería responsable, al menos en parte del aumento de Lp(a). Este aspecto no ha sido estudiado hasta la actualidad y sería interesante poder realizarlo en el futuro.
Nuestros datos sugieren que las hipertrigliceridemias a consecuencia de una hipersíntesis de TG como se demuestra en sujetos sin DM, sin obesidad o sin mutación patogénica de HF, donde existe un enriquecimiento de partículas VLDL, probablemente reduce la formación de Lp(a). Este fenómeno coincidiría con el ya demostrado y descrito en el caso de los inhibidores de la proteína transferidora de ésteres de colesterol (CETP)32. Por el contrario, aquellas hipertrigliceridemias consecuencia de un trastorno de catabolismo, donde hay disminución de catabolismo de TG como en la DM y la obesidad, parece no mostrarse esta relación inversa de Lp(a)-TG.
En resumen, la asociación inversa de Lp(a)-TG parece depender de la etiología de la hiperlipemia, donde predomina el aumento de la síntesis a nivel hepático y se corresponde con más intensidad dicho fenómeno.
Contribución de los autoresConceptualización, VM-B y FC; Curación de Datos VM-B, AC, PC, AMB, AV, CM-A, JP, JM-G, AF-A, MS-T y FC. Análisis: VM-B y FC; Adquisición de Financiamiento, FC; Investigación, VM-B, AC, ML, FC; Metodología, VM-B y FC; Administración de Proyectos, FC; Recursos, FC; Software VM-B y FC; Redacción - Elaboración del borrador original: VM-B y FC; Revisión: todos los autores. Todos los autores han leído y aprobado el manuscrito final.
FinanciaciónEste estudio ha sido financiado con ayudas del Ministerio de Economía y Competitividad de España PI 18/01777 PI 19/00694 y CIBERCV; y Gobierno de Aragón B-14. Estos proyectos están cofinanciados por el Instituto de Salud Carlos III y el Fondo Europeo de Desarrollo Regional (FEDER) de la Unión Europea «Una forma de hacer Europa».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosEsta comunicación fue presentada en el XXXIII Congreso Nacional de la SEA – Virtual del 7 al 10 de junio de 2021 y galardonada con el premio a la mejor comunicación del área/ tópico: unidades de lípidos, prevención secundaria y tratamientos.