La biopsia selectiva de ganglio centinela (BSGC) en el cáncer de endometrio se encuentra aún en periodo de estudio para validar su implantación protocolizada y evitar así la linfadenectomía pélvica y aortocava.
ObjetivoMostrar nuestros resultados durante el proceso de validación de la técnica y así colaborar para su implantación en otros centros.
MétodoEstudio observacional descriptivo prospectivo de pacientes intervenidas de cáncer endometrial en las que se realizó BSGC vía laparoscópica desde julio de 2016 a diciembre de 2019.
ResultadosLos ganglios centinela (GC) en todas las pacientes fueron negativos para metástasis. Hubo una concordancia del 100% entre los resultados anatomopatológicos de los GC y de las posteriores linfadenectomías de validación. En ningún caso se objetivaron complicaciones operatorias durante la realización de la BSGC.
ConclusiónLa BSGC en pacientes en estadios iniciales de carcinoma endometrial es una técnica en fase de validación pero cuyos resultados son prometedores, pudiéndose llevar a cabo una cirugía menos invasiva de forma segura, evitando la comorbilidad asociada a la linfadenectomía.
Sentinel lymph node biopsy (SLNB) in endometrial cancer is still being assessed in order to validate its standardised protocol to avoid pelvic and aortocaval lymphadenectomy.
ObjectiveTo present the results of the technique during the validation process, and work towards its implementation in other centres.
MethodA prospective descriptive observational study of endometrial cancer patients who underwent laparoscopic SLNB from July 2016 to December 2019.
ResultsSentinel lymph nodes (SLN) in all patients were negative for metastasis. There was a 100% agreement between the histopathology results of the SLN and the subsequent validation of lymphadenectomies. No surgical complications were observed in any of the cases during the performing of the SLNB.
ConclusionSLNB in patients in early stages of endometrial carcinoma is a technique in the validation phase, but the results of which are promising. This means that less invasive surgery can be carried out safely, avoiding comorbidity associated with lymphadenectomy.
El cáncer de endometrio es la neoplasia ginecológica más frecuente en nuestro medio1. Encontramos dos tipos diferentes, tanto histológicamente como en su oncobiología, pronóstico y tratamiento: el endometrioide y el no endometrioide (clasificación de Bokhman, 1986)2,3.
La indicación de linfadenectomía en el cáncer de endometrio es un tema controvertido3. El análisis ganglionar nos informa sobre el estadio de la enfermedad y, por tanto, sobre el pronóstico y la indicación de adyuvancia3-5. Solo se aconseja realizar la linfadenectomía en pacientes con factores de riesgo de afectación linfática: tipo no endometrioide, alto grado histológico, tumores mayores de 2cm, invasión profunda miometrial/cervical, etc.3,4,6. En casos de riesgo intermedio (solo invasión profunda miometrial o alto grado histológico) la linfadenectomía únicamente tiene como objetivo la estadificación, ya que no supone un aumento de la supervivencia4.
El ganglio centinela (GC) se define como la primera estación de drenaje linfático de una lesión primitiva, por lo que es el tejido que mayor probabilidad tiene de albergar una metástasis de una neoplasia. En caso de ausencia de afectación del GC se asume el mismo resultado en el resto del territorio ganglionar, por lo que nos puede aportar información sobre el estadio de la enfermedad sin necesidad de realizar un análisis de todos los ganglios. De esta forma se comienza a llevar a cabo una técnica quirúrgica en extensión, la biopsia selectiva del ganglio centinela (BSGC). Se trata del estudio del GC en pacientes con neoplasia en fase precoz, conociendo así la extensión de la enfermedad y el manejo terapéutico que precisará. Es una técnica que ya está validada en diversas neoplasias, como en la mama, melanoma, pene o vulva5,7. Con ella se consigue evitar realizar intervenciones con una alta morbilidad y riesgo quirúrgico como es la linfadenectomía completa.
Según numerosos estudios, la vía de abordaje óptima para la cirugía del cáncer de endometrio es la endoscópica3,4, ya que presenta las ventajas del abordaje mínimamente invasivo, siendo el riesgo de recurrencias y la supervivencia libre de enfermedad similares a las del abordaje laparotómico. La vía vaginal puede ser aconsejable en pacientes con alto riesgo quirúrgico, prolapso uterino y/o tumor confinado al útero3.
En el Hospital Universitario Virgen Macarena de Sevilla se ha iniciado un protocolo de implementación y validación de la BSGC en el cáncer de endometrio. El objetivo de este trabajo es exponer nuestra experiencia durante el proceso, analizando los datos de las pacientes intervenidas hasta el momento. De esta forma, pretendemos que se trate de un procedimiento reproducible en otros centros y que suponga un avance en el manejo y el tratamiento de esta neoplasia tan frecuente.
MétodoRealizamos un estudio observacional descriptivo prospectivo de las pacientes diagnosticadas de cáncer de endometrio que han sido intervenidas quirúrgicamente realizándose BSGC vía laparoscópica en el Hospital Universitario Virgen Macarena desde julio de 2016 a diciembre de 2019. El estudio se planteó cumpliendo las normas de la Declaración de Helsinki y de ética en investigación.
Criterios de inclusión- •
Pacientes diagnosticadas de cáncer de endometrio tipo I.
- ∘
Estadios IA (grado histológico FIGO G2-G3).
- ∘
IB (FIGO G1-G3).
- •
Pacientes con cáncer de endometrio endometroide estadio II (FIGO G1-G2).
- •
Sospecha de enfermedad extrauterina o ganglionar por pruebas de imagen prequirúrgicas.
- •
Pacientes con algo riesgo anestésico en las que se contraindica la realización de procedimientos de larga duración.
- •
Contraindicaciones relativas: edad avanzada y obesidad mórbida, individualizando según el estado general de la paciente.
Todas las pacientes incluidas en el estudio tenían diagnóstico de cáncer de endometrio estadioI (A o B) prequirúrgico, encontrando un solo caso que en el diagnóstico posquirúrgico resultó ser finalmente estadioII. Solo encontramos una paciente incluida en el estudio que presentaba una contraindicación relativa para ello: la edad avanzada (86años). Sin embargo, individualizando el caso, ya que se trataba de una paciente con buena calidad de vida, ausencia de comorbilidad y bajo riesgo anestésico, se consideró apta para realizar la técnica de BSGC.
Las pruebas de imagen realizadas preoperatoriamente fueron: ecografía transvaginal exclusivamente en 6 pacientes, RNM en 2 y ambas pruebas en 11 casos. La tomografía computarizada de emisión de positrones (SPECT-TC) el día previo a la cirugía se realizó en todos los casos excepto en 3, en los que, por falta de disponibilidad del equipo o bien por intolerancia de la paciente a la prueba, no pudo llevarse a cabo.
Procedimiento protocolizado de BSGC en el Hospital Universitario Virgen Macarena de SevillaDebemos informar a la paciente adecuadamente, firmando tras ello el consentimiento informado por escrito. La citamos en la consulta de Ginecología Oncológica el día previo a la intervención para la inyección del radiofármaco: 111-148MBq de nanocoloides de albúmina (Nanocoll®) en 4 inyecciones de 1ml. Se realizará una inyección superficial (1-3mm) y profunda (1-2cm) por cada alícuota, con aguja espinal de 22-25G. Las zonas de punción son los cuadrantes laterales periorificiales del cérvix (3 y 9 horarias). En caso de conización previa se inyectará el trazador pericicatricial.
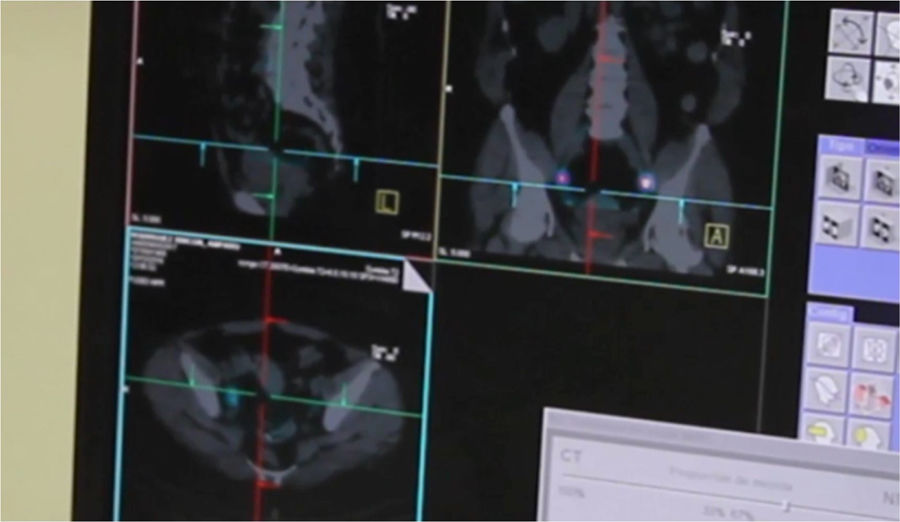
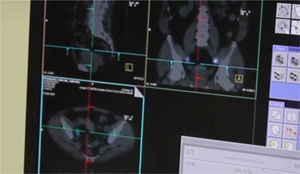
Tras 2h de la inyección del radiofármaco se realiza un estudio mediante SPECT-TC para identificar las regiones que reciben drenaje linfático directo del tumor primario y localizar los GC en cavidad abdominal (fig. 1).
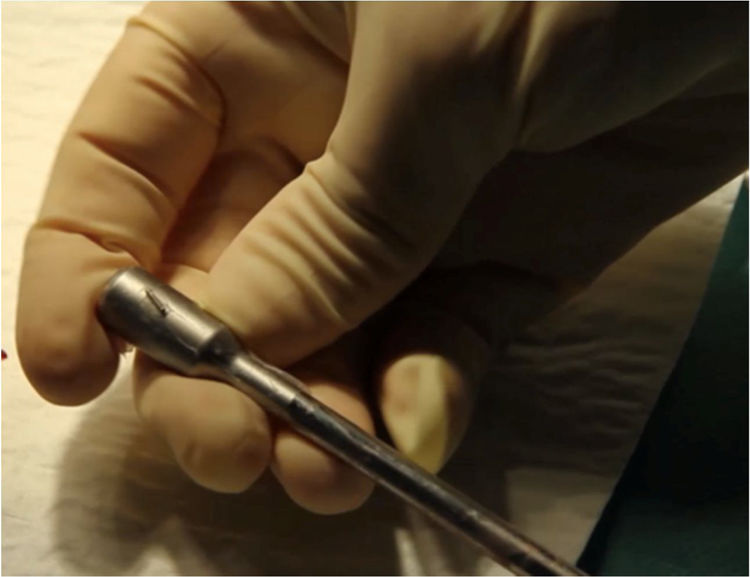
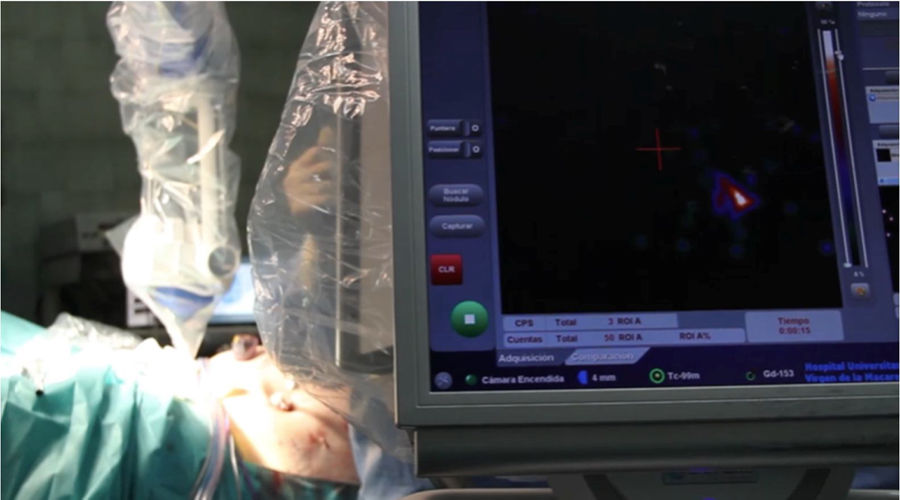
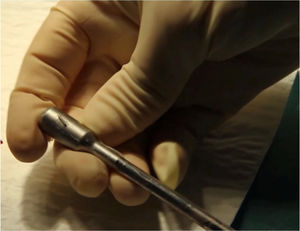
Ya intraoperatoriamente, utilizamos conjuntamente una sonda detectora gamma endoscópica lineal (fig. 2) y una minigammacámara portátil Sentinella 102 (Oncovision) (fig. 3) para la detección de los GC. Una vez anestesiada la paciente, se inyecta el colorante siguiendo las mismas pautas que con el radiofármaco. El colorante utilizado puede ser azul de metileno (2-4ml) o verde de indocianina. En nuestro estudio se ha utilizado mayoritariamente el azul de metileno, ya que para el uso del verde de indocianina es necesaria la disponibilidad del equipo laparoscópico específico, con el que contamos desde hace dos años, pero dado que su uso es compartido con otras especialidades del centro hospitalario, en ocasiones no ha estado disponible.
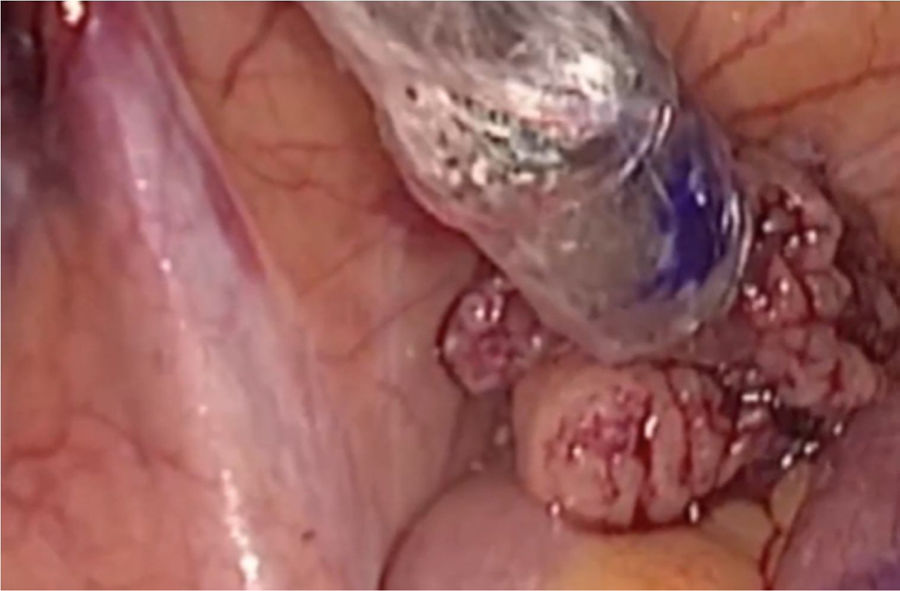
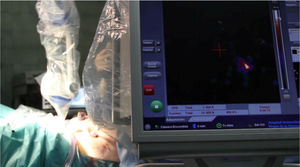
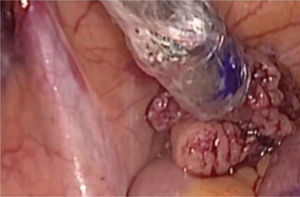
La cirugía se realizará siempre que sea posible vía endoscópica, y en nuestro centro se lleva a cabo por especialistas en ginecología y obstetricia pertenecientes a la sección de ginecología oncológica, expertos en cirugía laparoscópica oncológica. Iniciamos el mapeo bilateral del lecho quirúrgico con la sonda laparoscópica (fig. 4). Simultáneamente se va monitorizando el proceso con la minigammacámara portátil, en busca de los puntos de máxima actividad sobre los territorios ganglionares señalados en las imágenes de fusión SPECT-TC. Si no localizamos dichos puntos, se continúa el mapeo por los territorios habituales de drenaje del tumor (cadenas ilíacas externas, primitivas y obturatrices), territorios de drenaje secundarios (cadenas aortocavas) y región paramedial. De esta forma se lleva a cabo la detección de todos los GC para su extirpación. En caso de visualizar un ganglio teñido o uno superior a 1cm (aunque no haya sido marcado), se realiza la exéresis.
Mapeo del lecho quirúrgico con sonda lineal gammaendoscópica. Se realiza un rastreo del territorio ganglionar bilateralmente para detectar los ganglios con actividad tras inyección del radiofármaco. En la mayoría de las ocasiones se encuentran además teñidos por el colorante inyectado en cérvix previamente a la cirugía.
Una vez resecados todos los GC, se extraen en bolsa estanca y se realiza una medición ex vivo con la sonda y la minigammacámara portátil. Además, comprobamos que no queda actividad sospechosa en el lecho quirúrgico utilizando igualmente ambos equipos.
Todos los ganglios extirpados se envían en un bote en fresco, correctamente identificados, a la unidad de anatomía patológica. Para su análisis anatomopatológico (microestadificación) cada ganglio es seriado e incluido en su totalidad. El material obtenido tras el tallado es fijado en formaldehído al 4% e incluido en parafina, Posteriormente realizamos cortes a tres niveles (a intervalos de 200micras) y obtenemos dos cortes de cada nivel para tinción con hematoxilina-eosina y para estudio inmunohistoquímico. Se realizó mediante el sistema automatizado CoverStainer (Dako, Santa Clara, CA, Estados Unidos). El anticuerpo prediluido utilizado fue una citoqueratina de amplio espectro (CKA1-AE) (Ventana Benchmark Ultra automated inmunohistochemistry slide processing platform, Tucson, Estados Unidos).
Finalmente se completa la cirugía realizando una histerectomía total y doble anexectomía, linfadenectomía pélvica bilateral y aortocava, ya que la técnica se encuentra aún en proceso de validación. Así podemos comparar el resultado anatomopatológico del GC con el del resto de ganglios extirpados, y en caso de que exista concordancia, implementar un cambio en nuestro protocolo quirúrgico, evitando la realización de linfadenectomías innecesarias y, por tanto, de su morbilidad operatoria asociada.
Por tanto, cuando existan suficientes casos para considerar validada la técnica de BSGC, procederemos de la siguiente forma:
- •
En caso de GC negativo se realizará únicamente histerectomía y doble anexectomía.
- •
Si el GC es positivo para metástasis, debería realizarse una linfadenectomía pélvica bilateral y aortocava completa (si procede).
- •
Si nos encontramos con una ausencia de migración del trazador a una de las hemipelvis, será preceptiva la linfadenectomía de esa hemipelvis concreta.
En cuanto a las medidas de radioprotección, se llevan a cabo las recomendaciones internacionales, aislando todo el material que haya estado en contacto con las piezas contaminadas bajo la supervisión de un técnico de la unidad de radiofísica.
Por último, registramos los datos relevantes sobre antecedentes de la paciente, características de la neoplasia, técnica quirúrgica y resultados obtenidos en el análisis de los ganglios linfáticos, así como complicaciones durante o tras la intervención. El análisis de los datos fue realizado con el programa de SPSS versión 25 para Windows. Se realizó un análisis estadístico de frecuencias, en el caso de variables categóricas o nominales, y descriptivo en las cuantitativas continuas. De esta forma calculamos el rango, con el valor máximo y mínimo, la media, la mediana, la moda y la desviación estándar de cada variable estudiada.
ResultadosSe incluyeron 19 pacientes, ya que, aunque la muestra inicial era de 21, en dos de ellas se decidió no realizar linfadenectomía, como explicamos más adelante. La edad media fue de 62años, con un rango de 36años (de 48 a 84años) y desviación estándar de 8,6. El IMC medio es de 30,09kg/m2, con un rango de 12,3 (desde 23,7 a 36kg/m2) y desviación estándar de 3,98.
El 68,4% de las pacientes presentaban algún factor de riesgo de desarrollar cáncer de endometrio, siendo los más frecuentes la obesidad (10 casos, 52,63%) y la HTA (8 casos, 42,1%). En todas las pacientes el motivo de consulta inicial fue la metrorragia. El porcentaje de nulíparas fue del 31,57%, siendo 18 pacientes menopáusicas (94,73%).
Los tipos histológicos fueron todos adenocarcinomas endometrioides, excepto un caso de diagnóstico posquirúrgico de carcinoma seroso papilar/sarcoma del estroma endometrial. En cuanto al estadio prequirúrgico de la enfermedad, nos encontramos con 3casos de estadioIA (15,78%) y 16IB (84,21%). En 8 casos (42,1%) el diagnóstico posquirúrgico fue distinto al inicial, siendo en el 62,5% de estos una estadificación menor (5casos de estadio prequirúrgicoIB que resultóIA) y en el 37,5% mayor (un caso de estadio prequirúrgicoIB y posquirúrgicoII y dos casos de estadioIA que tras la cirugía resultó serIB). Por tanto, podríamos concluir que la discordancia de estadios se ha dado principalmente en casosIB que finalmente fueronIA (5casos, 26,31%).
Respecto a los grados de diferenciación, hubo una gran heterogeneidad de resultados en el momento del diagnóstico de la enfermedad. Sin embargo, en el análisis posquirúrgico de las piezas el más frecuente fue el grado2 o moderadamente diferenciado (68,4%). En 7 casos (36,84%) los receptores de estrógenos y progesterona fueron positivos y en 12 casos (63,15%) fueron negativos a receptores estrogénicos. Solo en 5 pacientes (26,31%) el tamaño tumoral posquirúrgico analizado en la pieza de histerectomía fue mayor que el observado preoperatoriamente en pruebas de imagen. En la mayoría de casos se usó el doble método con azul de metileno y radiotrazador Tc-99m metaestable para la detección del GC, excepto en 5 pacientes (26,31%) en las que se utilizó el verde de indocianina como colorante, ya que contábamos con disponibilidad del equipo laparoscópico de inmunofluorescencia (en uno de estos sin Tc-99m asociado).
Respecto a los aspectos quirúrgicos, solo dos pacientes presentaban antecedentes de laparotomía previa (10,52%). En todas se realizó un abordaje laparoscópico, utilizando para las maniobras de acceso la entrada directa con trócar umbilical sin neumoperitoneo previo (en el 89,47%), excepto en dos pacientes (10,52%), en las que se realizó una laparoscopia abierta con trócar de Hasson. Los protocolos quirúrgicos fueron completos, realizándose histerectomía total más doble anexectomía y linfadenectomía pélvica bilateral y aortocava (hasta vena renal izquierda). Contamos con dos excepciones que hemos excluido de la muestra: una paciente a la que no se le practicó linfadenectomía por el tipo histológico y la morbilidad anestésica asociada, y otra a la que solo se le realizó una histerectomía total y doble anexectomía con BSGC, ya que se trataba de una neoplasia de muy bajo riesgo. En cuanto a las vías de abordaje a la hora de realizar las linfadenectomías aortocavas, en 12 casos (63,15%) se realizaron vía extraperitoneal y en 7 transperitoneal (36,84%). Se registraron complicaciones en 3 pacientes (14,28%): una lesión del nervio obturador que se suturó intraoperatoriamente, una lesión térmica ureteral que se reparó también durante la propia cirugía y una perforación intestinal, diagnosticada en el postoperatorio durante la estancia hospitalaria. Es importante destacar que ninguna de estas complicaciones se produjo durante el procedimiento de BSGC. Se registró una sola reconversión a laparotomía (5,26%) por intolerancia de la paciente al neumoperitoneo. La duración media del procedimiento de BSGC fue de 52min.
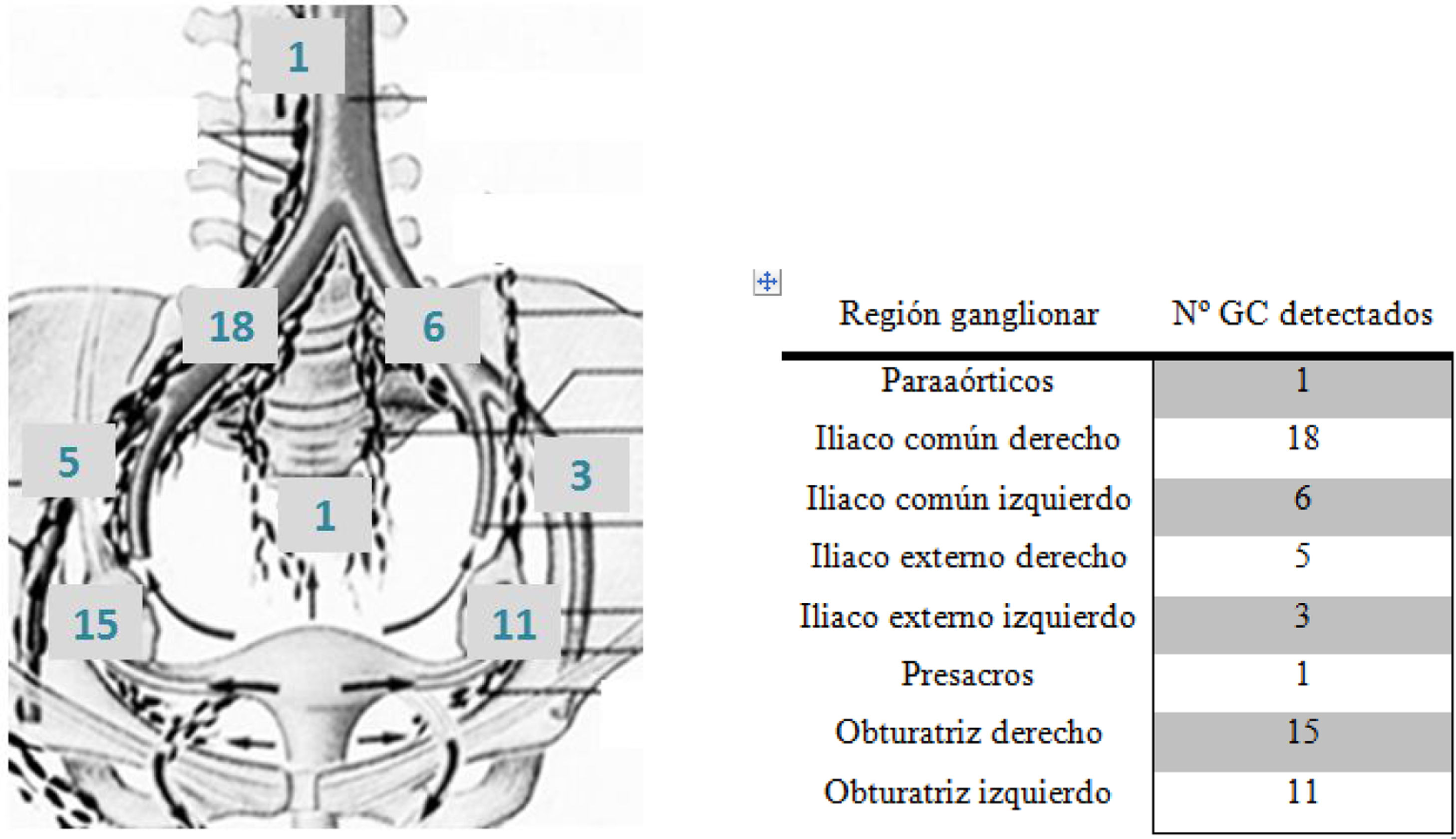
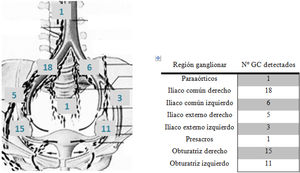
En todas las pacientes se detectaron GC, en la mayoría de ellas de forma bilateral (14 pacientes, 73,68%). En los casos en que se detectaron GC unilateralmente fueron en el territorio linfático derecho: 5 pacientes, en una se detectó un solo ganglio (obturatriz derecho) y en las 4 restantes dos ganglios. De estas últimas, un ganglio se encontró en territorio de la iliaca común derecha y el otro, en 2 de ellas, en obturatriz derecha, y en las otras 2 pacientes, en iliaca externa derecha. Solo se objetivó un caso de detección de un GC en territorio aortocavo (5,26%). En conclusión, se detectaron GC en el 100% de las pacientes, en el 73,68% bilateralmente, en el 26,32% restante unilateralmente (lado derecho) y en un solo caso en territorio aortocavo (fig. 5). No se detectaron GC en localizaciones inusuales que no se hubieran detectado con la linfadenectomía pélvica y paraaórtica indicada comúnmente.
En 4 pacientes (21,05%) se obtuvieron menos GC durante la cirugía que los observados en las imágenes del SPECT, mientras que en 2 casos (10,52%) se obtuvieron más. En el resto de cirugías hubo coincidencia entre el número de ganglios observados en las imágenes previas y los extirpados. En cuanto a los GC detectados por actividad del radiofármaco, además el 83,4% se encontraban también teñidos por el colorante inyectado.
La media de GC extirpados fue de 3,15, con una desviación estándar de 1,34. El valor mínimo fue un ganglio y el máximo 6, con un rango de 5. Hasta en 6 casos (31,6%) se consiguieron extirpar 3GC, siendo el número más frecuente dentro de la muestra.
La media de ganglios obtenidos durante la linfadenectomía pélvica fue de 10, con un rango de 20 entre el valor mínimo (2) y el máximo (22). La desviación estándar fue de 5,73. En el caso de los ganglios paraaórticos, paracava e interaortocava nos encontramos con que el mínimo extirpado fue de 3 y el máximo de 31 (rango de 28). La media en este caso de ganglios es de 10,61 y la desviación estándar, de 6,8.
Todos los GC fueron negativos en el estudio histológico intraoperatorio, con una concordancia del 100% respecto al análisis postintervención diferido de los ganglios extirpados en la linfadenectomía de validación (que fueron también en su totalidad negativos para malignidad).
DiscusiónEl mapeo linfático con identificación del GC en el cáncer de endometrio se realizó por primera vez en 1996, existiendo desde entonces controversia sobre cómo realizar la estadificación quirúrgica8. La diseminación linfática suele ser el primer lugar de extensión neoplásica extrauterina9, por lo que es importante realizar una correcta estadificación para evitar infra o sobretratar a estas pacientes10. La linfadenectomía solo debe realizarse en casos de riesgo intermedio y alto de afectación ganglionar según el ensayo SEPAL11. La Federación Internacional de Ginecología y obstetricia (FIGO) considera riesgo intermedio: invasión profunda del miometrio (>50%) y alto grado histológico (G3) con afectación <50% del miometrio o invasión linfovascular4,11. Aunque no existe consenso en cuanto a la definición de «alto riesgo», suelen incluirse en esta el carcinoma no endometrioide y los endometrioides de alto grado, que invaden miometrio >50% o de gran tamaño (>2cm)3.**
La BSGC está indicada en fases precoces del cáncer de endometrio9,10. Existen múltiples investigaciones sobre la localización óptima de inyección del radiotrazador y el colorante, sin obtenerse aún ningún consenso9. Dichos estudios se centran en comparar la inyección en el cérvix y en el cuerpo uterino. Algunos concluyen que existe una mayor identificación de GC aortocavos con la inyección corporal3. Esta última puede realizarse peritumoral guiada por histeroscopia, considerada la más fisiológica, aunque con una alta dificultad técnica, por lo que no suele realizarse en la práctica clínica9. En 2017 se publicó un estudio prospectivo en el que se estudiaba la inyección miometrial de radiotrazador guiada por ecografía transvaginal (TUMIR)12. Se analiza la seguridad y el rendimiento de esta novedosa técnica, concluyendo que se trata de un método factible y que aporta información representativa del drenaje linfático en pacientes con cáncer de endometrio. Un ensayo prospectivo multicéntrico aleatorizado (SNEC)13 compara también la inyección cervical con la histeroscópica, usando como colorante verde de indocianina. Concluyen que aunque la inyección histeroscópica aporta una identificación linfática más precisa, la cervical cuenta con la gran ventaja de ser una técnica más simple y reproducible que conlleva un menor tiempo quirúrgico13,14. Es, por tanto, la técnica que se lleva a cabo en la mayoría de los centros hospitalarios. En nuestra unidad realizamos dos punciones superficiales (1-3mm) y dos profundas (1-2cm) en ambos cuadrantes laterales de cérvix3, como recomienda la Guía de práctica clínica de oncología (National Comprehensive Cancer Network [NCCN])15, consiguiendo una alta tasa de detección de GC. De hecho, en la mayoría de los casos se consiguió identificar con el trazador/colorante el mismo número de ganglios que los objetivados en el SPECT-TC, previo a la cirugía. Por tanto, según nuestra experiencia la inyección cervical es una técnica sencilla con alta tasa de detección.
En cuanto al trazador y colorantes utilizados, se han usado múltiples opciones. En la mayoría de los centros, incluyendo el nuestro, es de elección el nanocoloide tecnecio 99 (Tc-99m)3,5,9. Existen dos opciones principales de colorantes: azul de metileno y verde de indocianina (indocyanine green [ICG], solo o combinado con Tc-99m)3,5,9. En nuestra muestra se utilizó en la gran mayoría de pacientes (14, 73,68%) azul de metileno, ya que la implementación de ICG en nuestro centro es más reciente y contamos con menos disponibilidad del equipo de laparoscopia (se usó en 5 casos, 26,31%). Se recomienda una técnica combinada de colorante y Tc-99m para obtener mayor sensibilidad diagnóstica, sobre todo si usamos azul de metileno3. En nuestra muestra se realizó de esta forma siempre, excepto en un caso en el que se utilizó el ICG exclusivamente. Se han publicado múltiples investigaciones que comparan las tasas de detección de ambos colorantes. Un metaanálisis de Bodurtha Smith et al.16 analiza la detección de GC usando Tc-99m y azul de metileno en 51 estudios (4.915 pacientes), siendo de un 81%, con una sensibilidad del 96%. Lin et al.17 publicaron un metaanálisis que incluía 44 estudios (2.236 pacientes) en las que se había utilizado ICG como colorante, con una tasa de detección de GC del 93% y una sensibilidad del 91%. Diversos estudios demuestran que el IMC elevado afecta negativamente al mapeo ganglionar18, algo que no parece ocurrir cuando se usa ICG9. Este sería un aspecto a tener en cuenta para fomentar el uso de ICG en nuestro centro, ya que prácticamente la mitad de las pacientes de la muestra presentaban obesidad. En general, diversos estudios concluyen que el ICG es un marcador seguro4, con una mayor tasa de detección general y bilateral que otros métodos, pero que supone un alto coste por precisar un sistema óptico específico9. Por tanto, en la práctica clínica continúan utilizándose frecuentemente tintes azules, ya que constituye una alternativa adecuada y con un menor coste9.
Existen múltiples estudios que defienden que la tasa de detección de diseminación linfática mediante BSGC en el cáncer de endometrio es muy alta: 90%, con un VPN del 99%19. Estos datos son similares en múltiples ensayos realizados20,21, por lo que se considera una técnica prometedora. Dado que se encuentra aún en fase de validación, se debe realizar una linfadenectomía completa posterior, cumpliendo de esta forma el protocolo terapéutico recomendado por las sociedades científicas19. Así se ha llevado a cabo tanto en nuestro centro como en las investigaciones consultadas. En 2016 un estudio retrospectivo de la técnica usando ICG publica una tasa de falsos negativos del 8,3%22, similar al de otras publicaciones. En 2017 se publicó un ensayo prospectivo multicéntrico con la muestra más grande hasta el momento de BSGC en cáncer de endometrio (ensayo FIRES, Rossi et al.23), 340 pacientes. Se usó ICG y se completó la cirugía con linfadenectomía. Se detectaron GC positivos en el 97% de las pacientes que presentaban metástasis linfáticas. En general, la mayoría de publicaciones consideran la BSGC como una técnica exitosa, con tasas de detección del 85-100%10. El estudio de nuestro centro corrobora dicha cifra, con una concordancia de resultado de GC respecto al resto de ganglios extirpados del 100%, por lo que no contamos con falsos negativos. Aun así, siempre debemos tener en cuenta la gran limitación de nuestro estudio: el número de casos con que contamos. Para tener resultados más sólidos debemos continuar la investigación incluyendo un mayor número de pacientes, y a ser posible contando con la disponibilidad de uso de ICG, dadas las ventajas con las que cuenta según la literatura revisada.
Es importante realizar un mapeo adecuado bilateral para considerar la evaluación de GC completa5. La guía oncológica NCCN recomienda que si no se detectan GC en un lado, se debe realizar linfadenectomía completa de dicha hemipelvis, al igual que si existen ganglios sospechosos aumentados de tamaño, pese a no estar marcados15. Sin embargo, la última revisión de UpToDate recomienda individualizar realizando linfadenectomía del lado no marcado solo si existe riesgo intermedio o alto de diseminación linfática3. Tras la recomendación en la Conferencia de consenso de 2014 de las sociedades científicas European Society for Medical Oncology (ESMO), European Society of Gynaecological Oncology (ESGO) y European Society for Radiotherapy and Oncology (ESTRO)10, en la mayoría de los centros5,9, incluido el nuestro, se lleva a cabo el algoritmo de actuación de Barlin et al.24, que se ajusta a la guía NCCN y determina que si existe dificultad de detección de GC se realizará linfadenectomía de ese lado5. Diversos estudios (estudio retrospectivo multicéntrico de Papadia et al.25, ensayo aleatorizado prospectivo de Frumovitz et al.26 y dos metaanálisis16,27) defienden que podríamos evitar la linfadenectomía de una hemipelvis usando ICG como colorante, ya que cuenta con una mayor tasa de detección bilateral.
En definitiva, podemos concluir que la BSGC en el cáncer de endometrio es una técnica en investigación con resultados prometedores que puede dar lugar a una disminución en las complicaciones intra y postoperatorias asociadas a la linfadenectomía9,14. En nuestro estudio en concreto se ha visto que las complicaciones quirúrgicas no se produjeron durante la BSGC. Un estudio publicado por Geppert et al.28 en 2018 determina que igualmente no hubo ninguna complicación intraoperatoria durante la BSGC y se asocia con una menor incidencia de linfedema de miembros inferiores (1,3% versus 18,1% de la linfadenectomía completa, con diferencias estadísticamente significativas: p=0,0003)28.
La Clínica Mayo y el Memorial Sloan Kettering Cancer Center han publicado múltiples estudios sobre BSGC en cáncer de endometrio, y uno de ellos incluía neoplasias de alto riesgo como adenocarcinoma endometrioide con >50% de invasión miometrial y algunos no endometrioides (células claras y serosos). En definitiva, existe controversia sobre la BSGC en casos de alto riesgo14, y se necesitan estudios a largo plazo para determinar el impacto en la supervivencia9. Según algunas publicaciones, la BSGC en tumores no endometrioides podría ser factible3, con una detección de metástasis ganglionares del 20%.
Para finalizar, un aspecto relevante a destacar es el análisis del coste-efectividad de la técnica. En 2018 Suidan et al.29 publican un estudio en el que comparan tres estrategias en casos de cáncer de endometrio de bajo riesgo: realizar linfadenectomía de rutina en todos los casos, selectiva basada en criterios de inclusión (pacientes de alto riesgo) o BSGC. Se analizaron los costes en cuanto a hospitalización, disponibilidad de quirófano, duración de la cirugía, personal médico y necesidad de tratamiento por complicaciones. Los resultados obtenidos en cuanto a coste económico y años de vida ajustados por calidad (AVAC) son respectivamente: 18.041$ y 2,79años en el caso de la linfadenectomía de rutina, 17.036$ y 2,81años en la linfadenectomía selectiva y, por último, 16.401$ y 2,87años en la BSGC. Por tanto, se concluye que la linfadenectomía de rutina es la técnica que supone un mayor coste y un menor beneficio en la calidad de vida y supervivencia de la paciente, siendo la BSGC la que presenta un coste más bajo. Por ello, se considera la estrategia más rentable de las tres presentadas.
ConclusiónLa BSGC es un método seguro y reproducible para el estudio de la extensión metastásica linfática en el tratamiento quirúrgico del cáncer de endometrio. Con esta técnica se pretende conseguir una correcta estadificación modificando los procedimientos quirúrgicos protocolizados y evitar así la morbilidad asociada a la linfadenectomía. En nuestro centro el 100% de los GC negativos se correlacionaron con linfadenectomías pélvicas y aortocavas negativas. Actualmente el procedimiento está en fase de validación, por lo que nuestro objetivo es obtener una muestra mayor que arroje conclusiones más sólidas para poder evitar, así, la realización de linfadenectomías innecesarias.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.