El útero es un órgano fundamental para la concepción y el desarrollo de un embarazo a término. En el estudio de la paciente con problemas reproductivos siempre debemos realizar una correcta valoración del factor uterino y tenerlo presente, ya que las anomalías de este órgano pueden estar implicadas hasta en la mitad de los casos de esterilidad. En este trabajo se realiza una revisión bibliográfica en la base de datos Medline, seleccionando los artículos con mayor evidencia científica sobre las principales anomalías uterinas que pueden causar problemas reproductivos y obstétricos: congénitas (como malformaciones müllerianas) o adquiridas. Se expone la presentación clínica, repercusiones reproductivas y obstétricas (esterilidad, abortos de repetición, complicaciones obstétricas como parto prematuro), métodos diagnósticos y principales opciones terapéuticas de cada entidad.
The uterus is a fundamental organ for the conception and development of a full-term pregnancy. In the study of the patient with reproductive problems, we should always make a correct assessment of the uterine factor and keep it in mind since uterine abnormalities may be involved in up to half of the cases of sterility. In this work, we carried out a literature review in the Medline database selecting the articles with a higher level of evidence on the main uterine anomalies that can cause reproductive and obstetric problems: congenital (such as Müllerian malformations) or acquired. The clinical presentation, reproductive and obstetric repercussions (sterility, repeated miscarriage, obstetric complications such as premature birth), diagnostic methods and main therapeutic options of each entity are exposed.
El útero es el órgano del aparato reproductor femenino que tiene un papel fundamental en la concepción, proporcionando un endometrio apto para la implantación embrionaria. El factor uterino puede tener un papel en la esterilidad hasta en un 50% de los casos. Sin embargo, su incidencia como factor único es mucho menor: entre un 5 y un 12%1.
Existen muchas causas de esterilidad por factor uterino (UFI), pudiendo clasificarlas en congénitas o adquiridas2. Pueden provocar infertilidad por fallo de implantación, o abortos recurrentes3, por lo que se considera crucial su inclusión en el estudio básico de esterilidad e infertilidad.
En esta revisión, hacemos un análisis de las publicaciones más recientes y de los estudios más notorios en relación con la UFI.
Material y métodoSe realizó una revisión de fuentes primarias de investigación cuantitativas y cualitativas encontradas en la base de datos Medline en los últimos años hasta diciembre del 2020. Se seleccionaron artículos originales publicados en los últimos 20 años, en idioma inglés y español, a través de los siguientes descriptores en inglés y sus respectivas traducciones al español: Female infertility; Müllerian Anomalies; Uterine Anomalies; Leiomyoma; Uterine synechiae.
Los criterios de inclusión contemplaron metaanálisis, ensayos clínicos aleatorizados, estudios de cohortes, de casos y controles. Igualmente, se incluyen revisiones sistemáticas y guías de asistencia práctica publicadas recientemente por las principales sociedades científicas nacionales e internacionales. Todas estas investigaciones tratan sobre las diferentes causas de esterilidad de origen uterino, explicando sus orígenes, clínica, métodos diagnósticos y opciones terapéuticas.
Los criterios de exclusión fueron artículos con poca validez, de texto incompleto, artículos de opinión, casos únicos y revisiones bibliográficas de escasa relevancia.
ResultadosTras realizar la búsqueda descrita en Medline, se encontraron 210 resultados, seleccionando de estos un total de 57 para la presente revisión narrativa, por su validez y resultados relevantes sobre el tema.
Se incluyeron artículos notorios sobre esterilidad de origen uterino y Guías de Asistencia Práctica como la publicada en 2018 por la sección de Esterilidad e Infertilidad de la Sociedad Española de Ginecología y Obstetricia. Igualmente, se incluyeron las guías internacionales más recientes publicadas por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) y la Sociedad Americana de Medicina Reproductiva (ASRM). Entre los artículos de revista incluidos, son destacables diversos metaanaálisis publicados tras la revisión de múltiples estudios sobre el tema, los cuales se discutirán de manera particular.
Los apartados de malformaciones y leiomiomas uterinos son los más extensos ya que ambas patologías son las más estudiadas en cuanto a su repercusión reproductiva. Encontramos numerosas publicaciones, de las que seleccionamos 20 artículos de malformaciones uterinas y 18 sobre leiomiomas, en las que se incluyen revisiones sistemáticas, estudios originales y retrospectivos con resultados consistentes y artículos sobre las opciones terapéuticas. La información sobre la malformación uterina más frecuente, el útero septo, se obtiene en gran parte de la guía de consenso de la ESHRE. La clasificación de los leiomiomas según su localización se toma de la guía publicada por la Federación Internacional de Ginecología y Obstetricia (FIGO). Se seleccionan cuatro publicaciones sobre los pólipos endometriales, incluyendo metaanálisis y estudios prospectivos randomizados sobre sus repercusiones en fecundación in vitro. Para terminar, se exponen tres referencias de hiperplasia endometrial y cinco tanto de adenomiosis como de adherencias endometriales, incluyendo metaanálisis y revisiones sistemáticas.
DiscusiónCausa Congénita:Anomalías MüllerianasDefinición y datos epidemiológicosLas malformaciones uterinas o anomalías müllerianas fueron descritas por primera vez en el siglo XIX por Cruveilhier y Von Rokitansky1,2. Consisten en la reabsorción incompleta de los conductos de Müller durante la embriogénesis, dando lugar a múltiples anomalías siendo el útero septo la más común, ya que representa entre un 80 a 90% de todos los casos4–6.
No se conoce exactamente la frecuencia de estas malformaciones, ya que existe un infradiagnóstico por tratarse de entidades, en muchos casos, asintomáticas1,2. Algunos estudios han descrito una incidencia de un 4,3% en la población general, pudiendo llegar hasta un 5 a 25% en pacientes con antecedentes de abortos de repetición7. En la revisión de Chan et al. se concluye que la prevalencia va a variar según la población estudiada, encontrando una tasa de malformaciones müllerianas en la población general del 5,5%, que es mayor en caso de pacientes con problemas reproductivos: el 8% de mujeres estériles, el 12,3% de las que tenían antecedentes de aborto espontáneo, y si unimos ambos factores (esterilidad y aborto espontáneo) encontramos una tasa mucho mayor de malformaciones, de hasta un 24,5%8. Sin embargo, hay otros estudios que defienden que la prevalencia de malformaciones congénitas uterinas es similar en mujeres con o sin problemas reproductivos9. En conclusión, no existe un consenso sobre si las malformaciones uterinas son más frecuentes en mujeres con infertilidad o también en las que padecen problemas para concebir respecto a la población general.
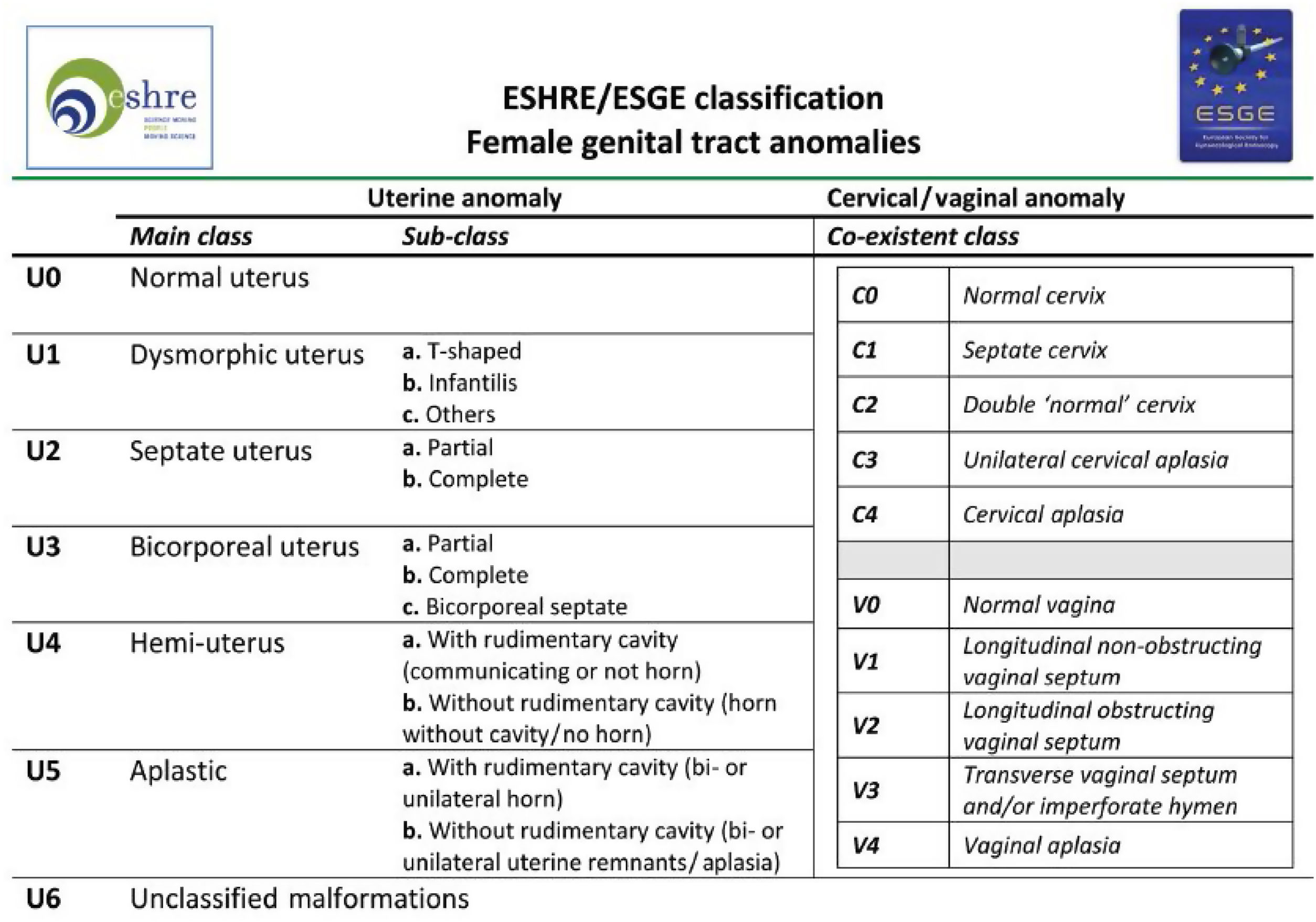
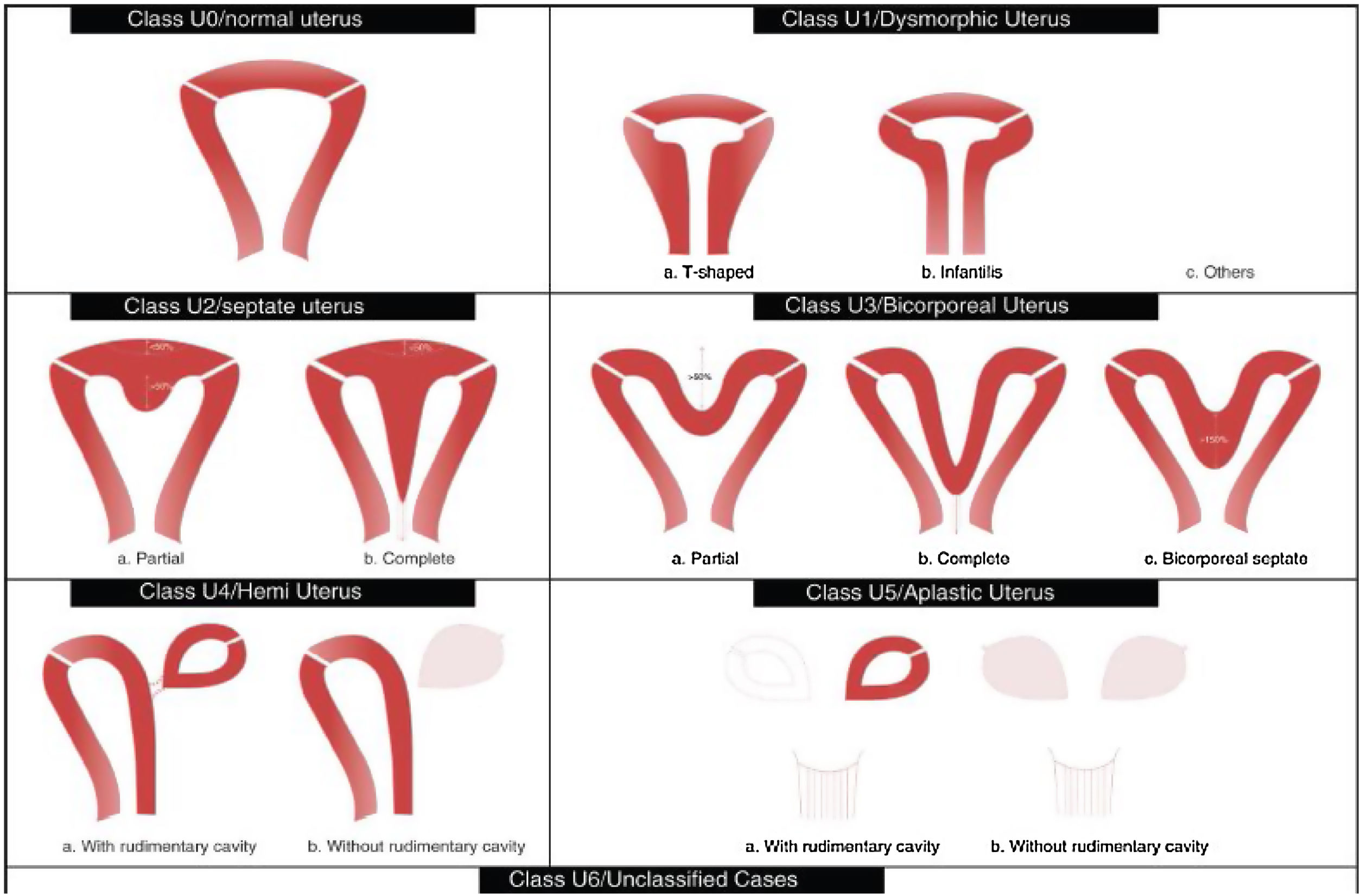
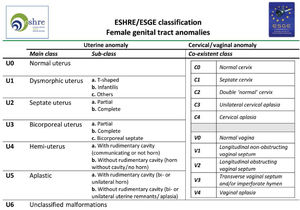
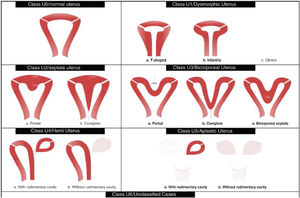
Tipos e impacto reproductivoAunque aún no existe una clasificación aceptada universalmente10, una de las más utilizada clásicamente es la publicada en 1988 por la American Fertility Society (AFS, actualmente American Society for Reproductive Medicine o ASRM) basándose en la anatomía genital y centrándose en la uterina1,2. Sin embargo, recientemente, se ha publicado una más actualizada llamada clasificación Congenital Uterine Anomalies (CONUTA), fruto del trabajo conjunto de la ESHRE y la Sociedad Europea de Endoscopia Ginecológica (ESGE)11. En esta se agrupan las malformaciones según el elemento anatómico afectado y establece medidas de referencia, y aunque es algo controvertida por su complejidad, constituye una clasificación ampliamente aceptada por la comunidad científica.
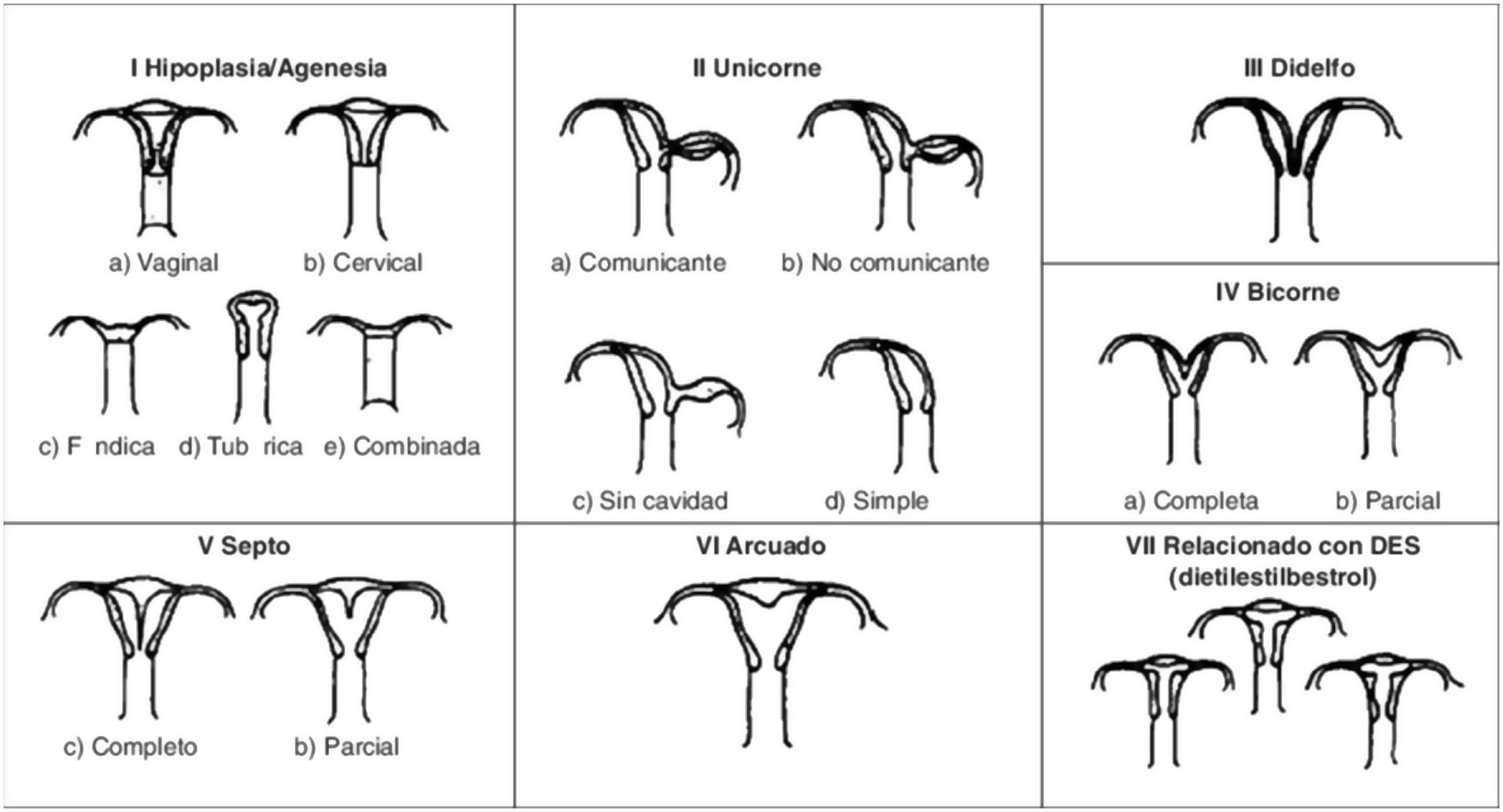
La anomalía uterina congénita más frecuente es el útero septo (35%), seguido del bicorne (26%) y arcuato (18%)9. El útero septo se considera la malformación con peores resultados obstétricos. Algunos de los estudios revisados describen que existe una hipovascularización del septo y problemas mecánicos por el aumento de la proporción de tejido muscular, disminución del tamaño de la cavidad uterina y mecanismos de incompetencia cervical12, lo que daría lugar a dificultad en la implantación y el desarrollo adecuado de la placenta5, con un mayor riesgo de aborto espontáneo, aborto tardío, parto prematuro, abruptio placentae y una tasa de nacidos vivos entre el 50 y 72%2,6,9,13.
El útero bicorne puede tener asociada una incompetencia cervical y existen revisiones que describen un incremento en la tasa de abortos espontáneos, que alcanzan el 36% y de parto prematuro, hasta el 23% de los casos13. Por el contrario, el útero arcuato se considera hoy día una variante de la normalidad, sin presentar sintomatología ni consecuencias reproductivas14.
Menos frecuentemente encontramos el útero unicorne (10%), didelfo (8%), la agenesia uterina (3%)3,9 o el útero en T. Este último se caracteriza por una morfología de la cavidad endometrial en forma de «T» por un aumento de la contractilidad miometrial a nivel de los segmentos medio e inferior uterinos. Suele ser asintomática, pero en muchos casos, debido a que la cavidad es irregular e hipoplásica, existe una disminución en las posibilidades de gestación espontánea con recién nacido vivo14. Además, puede asociarse con esterilidad, aborto recurrente, gestación ectópica o incompetencia cervical y prematuridad1. Recientemente, se han publicado varios estudios, como el de 2019 de Uyar et al.15 que demuestran que la resección en cuña vía histeroscópica como tratamiento del útero en «T» puede ser efectiva para mejorar los resultados de tratamientos reproductivos como la fecundación in vitro15,16. Aun así, se requieren más datos de estudios aleatorizados de mayor validez, ya que los publicados hasta el momento son de carácter retrospectivo y cuentan con grandes limitaciones como su tamaño muestral15.
DiagnósticoLa AFS no establece cuál es el método diagnóstico más adecuado2. Se debe realizar siempre una adecuada exploración física para detectar malformaciones vaginales y cervicales (septos vaginales, doble cérvix, etc.)1. La ecografía 3 D y la resonancia nuclear magnética (RNM) son las pruebas de imagen más apropiadas, ya que podemos valorar la anatomía externa e interna, cérvix y patología pélvica asociada2,3,10,17. Todo ello se puede efectuar de una forma precisa, diagnosticando zonas obstruidas y obteniendo medidas exactas, siempre que sea realizado por personal especializado17. Además, cuentan con la gran ventaja de ser pruebas no invasivas que no irradian a la paciente. En cuanto a sus limitaciones encontramos que no siempre tenemos disponibilidad del equipo necesario y, en concreto en el caso de la RNM, no es posible realizarla en pacientes con claustrofobia18.
Las técnicas endoscópicas siempre se han considerado de gran utilidad para el diagnóstico de las malformaciones uterinas12. Clásicamente, el «gold standard» estaba constituido por la laparoscopia, aunque no es la técnica más usada en la práctica clínica, por su riesgo quirúrgico y el coste que conlleva. Los avances de las pruebas de imagen, fundamentalmente RNM y ecografía 3 D, han supuesto que se consideren de gran utilidad para el diagnóstico de malformaciones uterinas, incluso al mismo nivel que la laparoscopia, que quedaría relegada a casos complejos de valoración anatómica dificultosa por técnicas de imagen18.
La histeroscopia se considera un procedimiento muy útil ya que, aunque cuenta con la limitación de que solo visualizamos la parte interna de la cavidad, en muchos casos permite el diagnóstico, e incluso el tratamiento, fundamentalmente en casos de útero septo5.
TratamientoEstablecer un consenso sobre el manejo adecuado de las pacientes con malformaciones müllerianas y problemas reproductivos es un tema controvertido9. Tradicionalmente, el tratamiento de estas malformaciones se limitaba a pacientes con antecedente de dos o más pérdidas gestacionales2. Sin embargo, hoy día contamos con técnicas quirúrgicas mínimamente invasivas con escasos riesgos, como la septoplastia histeroscópica2,9. Actualmente, se recomienda realizarla si diagnosticamos un útero septo de forma casual en un estudio de esterilidad2,3, especialmente en pacientes con abortos de repetición, esterilidad primaria, parto prematuro en gestaciones anteriores y previo a técnicas de reproducción asistida12. Aun así, no existe ningún ensayo clínico controlado aleatorizado que haya identificado los beneficios y riesgos de realizar la septoplastia sistemática en las pacientes con problemas reproductivos19,20. Hay publicados estudios observacionales recientes que sugieren que la resección del tabique disminuye el riesgo de aborto espontáneo y mejora los resultados obstétricos2,10. Además, cuenta con la gran ventaja de ser una técnica que no contraindica, de entrada, la posibilidad de un parto vaginal posterior21.
En los estudios revisados encontramos que todos describen una tasa de embarazo posterior a la septoplastia similar, observándose una reducción significativa (de hasta cinco veces) de la tasa de aborto espontáneo y de parto prematuro5,12. Además, un metaanálisis de Nouri et al. publicado en 2010, determina una tasa de embarazo tras septoplastia del 60,1%, con una tasa de nacidos vivos de 45%22.
Existen limitaciones en los estudios realizados sobre el tiempo ideal que debe transcurrir entre la cirugía resectiva del septo uterino y la búsqueda gestacional, sin existir a día de hoy aún un consenso2. Algunas guías, como la más reciente de la Sociedad Española de Ginecología y Obstetricia, indican que, dado que la recuperación tras esta intervención es inmediata, podría iniciarse la búsqueda gestacional en el siguiente ciclo menstrual normal1. Otras guías como la de la ASRM indican que se podrían requerir hasta dos meses para la reparación completa del endometrio, aunque no existe suficiente evidencia para realizar recomendaciones sólidas al respecto20.
Causas adquiridasLeiomioma uterinoDefinición y datos epidemiológicosLos leiomiomas uterinos constituyen la tumoración benigna más frecuente del tracto genital femenino, afectando del 20 al 50% de las mujeres en edad reproductiva1,3. Su prevalencia aumenta a partir de los 40 años y en mujeres que tienen su primer embarazo a edad más avanzada. Además, están presentes en hasta el 27% de mujeres que buscan asistencia reproductiva2.
Tipos e impacto reproductivoActualmente, la clasificación más aceptada es la publicada por la FIGO en la que se diferencian nueve tipos de miomas según su localización23,24. De hecho, este aspecto es muy relevante ya que los estudios publicados sobre la repercusión de los leiomiomas en la fertilidad encuentran variaciones según el tipo de mioma, principalmente si afectan a la cavidad endometrial. La mayoría de investigaciones indican que los miomas submucosos e intramurales que tienen impronta endometrial (tipo 0, 1 y 2) afectan negativamente la fertilidad, ya sea en casos de gestación espontánea como de técnicas de reproducción asistida3,25,26. Se establece que los miomas submucosos pueden ser la causa de los problemas reproductivos hasta en un 5 a 18% de los casos, con incluso tres veces más riesgo de aborto espontáneo y una disminución de la tasa de embarazo y recién nacido vivo2,27,28. Un metaanálisis publicado por Pritts et al. en 2009, en el que se incluyen 23 estudios (uno de ellos ensayo clínico aleatorizado) que comparan mujeres estériles con y sin leiomiomas, concluye que las pacientes con miomas submucosos o intramurales que deforman la cavidad tenían menor tasa de gestación y más riesgos de aborto espontáneo28. En el caso de los intramurales que no generan impronta en la cavidad endometrial (tipos 3 a 5) existe controversia27–29. Según este mismo metaanálisis, parece que también existe una menor tasa de implantación y embarazo en curso, con un aumento de la tasa de aborto respecto a pacientes que no presentan miomas2,28. La tasa de embarazo tras fecundación in vitro parece ser menor en pacientes con miomas submucosos e intramurales, puede estar justificada su resección previamente, especialmente cuando son de gran tamaño (>3 cm)25. Por el contrario, otras revisiones publicadas más recientemente, como la de Munro en 2019, indican que no está clara la repercusión de los miomas cuando no afectan al endometrio, siendo necesarios más estudios aleatorizados al respecto29. Por último, en el caso de los miomas tipo 5,6 y 7 de la FIGO no hay un consenso claro sobre su impacto reproductivo. El metaanálisis publicado en 2009 por Pritts et al. concluye que en el caso de miomas subserosos no existe una repercusión sobre la receptividad endometrial28,29.
A la hora de la planificación preconcepcional en pacientes diagnosticadas de leiomiomas se recomienda que, si es posible, no pospongan el embarazo, ya que a partir de los 35 años existe una notable disminución de la fertilidad femenina, por lo que pueden afectarse aún más los resultados gestacionales29,30.
TratamientoEl manejo terapéutico de las pacientes con problemas reproductivos diagnosticadas de miomas va a depender en gran medida de sus características, principalmente tamaño y localización (figs. 1 y 2).
Imagen esquemática de la Clasificación clásica de malformaciones uterinas congénitas publicada en 1988 por la AFS, actualmente ASRM2.
Tabla de la Clasificación de malformaciones uterinas congénitas CONUTA publicada conjuntamente por ESHRE y ESGE1,11.
La mayoría de terapias médicas se consideraban contraindicadas en pacientes con deseo gestacional, por los posibles efectos adversos que podían tener a largo plazo. Sin embargo, en 2011 la ASRM, tras revisar las publicaciones al respecto desde 2005, concluyó que existían algunos moduladores de receptores de progesterona que podrían utilizarse en el tratamiento de pacientes con miomas y problemas reproductivos31. El acetato de ulipristal era el más utilizado, hasta que se publicó una alerta sanitaria en marzo del 2020 que ordenaba su retirada de la comercialización hasta revisar el balance riesgo-beneficio, por varios casos de fallo hepático grave tras su uso. En ese mismo año, se publicó un estudio sobre los resultados de la fecundación in vitro en pacientes con miomas submucosos tratadas previamente con acetato de ulipristal32. Aunque se obtuvieron resultados favorables, cuenta con limitaciones importantes como el tamaño muestral y sesgos por tratarse de pacientes jóvenes y excluyéndose casos con obesidad. En conclusión, aunque parecen existir estudios prometedores sobre el tratamiento médico, es necesario continuar realizando más investigaciones para establecer unas recomendaciones claras31.
En cuanto a la embolización de arteria uterina, no existen estudios con muestra suficiente sobre la seguridad de un embarazo posterior a su realización. Algunos describen un mayor riesgo de aborto espontáneo tras embolización, hasta de un 64%2. Asimismo, se vio que aumentaba el riesgo de parto prematuro (en mayor medida que tras miomectomía) y de hemorragia postparto por alteraciones en la placentación (acretismo y placenta previa)33–35. En definitiva, la mayoría de los expertos contraindican la embolización de las arterias uterinas en pacientes con deseo genésico siendo preferible la cirugía36.
En cuanto al tratamiento quirúrgico, actualmente es preferible el uso de técnicas mínimamente invasivas, considerando de elección la miomectomía laparoscópica e histeroscópica37. Un estudio publicado en 2016 por Wang et al. ha comparado ambas en el tratamiento de miomas submucosos, considerando de elección la resección histeroscópica por su gran seguridad y eficacia3,24.
Aunque se ha encontrado que el riesgo de rotura uterina tras una miomectomía abdominal es muy bajo (0,002%), cuando se produce una entrada en cavidad se recomienda un tiempo de seguridad mínimo de seis meses antes de iniciar la búsqueda gestacional38,39.
En conclusión, según una guía de la ASMR publicada en 2017, el tratamiento de los miomas debe realizarse en caso de que sean sintomáticos o bien submucosos o intramurales que deformen la cavidad endometrial40. De esta forma, se observa una mejora en la tasa de embarazo, aunque no hay suficientes datos para afirmar que conlleve una disminución de la tasa de aborto o mejora en la tasa de recién nacido vivo. Si, por el contrario, la paciente está asintomática y el mioma no afecta al endometrio, no se recomienda la miomectomía para mejorar los resultados reproductivos, ya que no existen suficientes estudios al respecto. Igualmente, tampoco se conoce si hay diferencias reproductivas según el tamaño o número de los miomas cuando estos no afectan a la cavidad40.
Pólipo endometrialDefinición y datos epidemiológicosLos pólipos endometriales son formaciones hiperplásicas conformadas por estroma, glándulas, vasos y, en caso de los adenomatoides, fibras musculares1. Su prevalencia va aumentando con la edad, siendo poco frecuente encontrarlos en mujeres menores de 30 años2. Además, se ha visto una mayor prevalencia en mujeres estériles, estimándose de un 6 a 8%1,2. Un ensayo prospectivo publicado en 2004 por Hinckley et al. sobre los hallazgos histeroscópicos previos a la realización de una fecundación in vitro encontró una prevalencia de 325 de las 1.000 mujeres incluidas en el estudio, lo que supone un porcentaje significativo del 32,5%41.
Impacto reproductivo y resultados del tratamientoSu repercusión reproductiva sigue siendo un tema controvertido. Existen pocos datos que los relacione con la esterilidad en general y el fallo de implantación en concreto29. Se han publicado diversos estudios sobre la tasa de éxito tanto de inseminación artificial como fecundación in vitro tras la polipectomía histeroscópica. Algunos defienden que tras este tratamiento aumenta la tasa de éxito de la inseminación artificial, como el estudio prospectivo randomizado publicado en 2005 por Pérez et al., en el que concluyen un aumento de más del doble de las posibilidades de embarazo42.
En cuanto a estudios del éxito de la fecundación in vitro tras la polipectomía, hay algunos como el de Lass et al. publicado en 1999 que puntualiza el caso concreto de pólipos de pequeño tamaño (< 2 cm), los cuales no parecen repercutir negativamente en la tasa de embarazo tras la transferencia embrionaria43. Aun así, sí se describe un aumento en la tasa de aborto espontáneo en estas pacientes (27,3 vs. 10,7%, p = 0,08)35. En definitiva, aunque la evidencia actual es insuficiente, requieriendo más estudios al respecto, la Asociación Americana y la Española de Ginecología, recomiendan la polipectomía previa a tratamientos de reproducción asistida para lograr una mayor tasa de éxito1,29,44.
Hiperplasia endometrialDefinición y diagnósticoLa hiperplasia endometrial consiste en una hiperproliferación causada por la elevación de las concentraciones de estrógenos sin correcta aposición de la progesterona, por lo que es más frecuente en casos de obesidad o anovulación1. Estos factores a su vez suponen causas de problemas reproductivos en muchas ocasiones45. En caso de sospecha, es importante confirmar el diagnóstico mediante biopsia endometrial y realizar un estudio anatomopatológico ya que, dependiendo de si existen atipias celulares, va a variar el plan de actuación (fig. 3).
Imagen esquemática de la Clasificación de malformaciones uterinas congénitas CONUTA publicada conjuntamente por ESHRE y ESGE1,11.
En casos de pacientes con problemas de fertilidad e hiperplasia sin atipias se puede realizar tratamiento con gestágenos en la segunda fase del ciclo1. Si por el contrario, presenta atipias y tiene deseo genésico, se podría realizar un tratamiento con progestágenos a dosis altas (por ejemplo, acetato de megestrol 40 a 80 mg/día) y un control exhaustivo posterior para confirmar que la hiperplasia haya remitido mediante biopsia endometrial antes de que la paciente inicie la búsqueda gestacional1.
Según un metaanálisis publicado en 2014 por Koskas et al., el acetato de megestrol ha sido hasta ahora el tratamiento con mayor tasa de regresión de la hiperplasia (hasta del 80% a los 12 meses de su inicio), aunque no existen datos consensuados sobre la dosis indicada46. Este trabajo concluye que se puede plantear en estas pacientes realizar tratamiento de reproducción asistida de cara a conseguir gestación más precozmente y evitar la progresión de la enfermedad46. Además, según los resultados publicados en el metaanálisis de Gallos et al. de 2013, en pacientes con hiperplasia endometrial se obtiene una tasa de nacidos vivos significativamente mayor tras técnica de reproducción asistida (39,4%) que mediante embarazo espontáneo (14,9%)47.
AdenomiosisDefinición e impacto reproductivoLa adenomiosis es una entidad de etiología desconocida que consiste en la presencia de glándulas endometriales en el espesor miometrial29. Su repercusión reproductiva es un tema controvertido, aunque los estudios señalan que puede causar esterilidad, abortos espontáneos, así como peores resultados tras tratamiento de reproducción1,48–50. Igualmente, diversos estudios describen que las pacientes con adenomiosis tienen un mayor riesgo de complicaciones obstétricas tardías, fundamentalmente causadas por insuficiencia placentaria49. Los estudios indican que esto puede deberse a una escasa receptividad endometrial por alteración de la decidualización y a un aumento de la contractilidad miometrial, ya que la arquitectura y función normal del miometrio se encuentran alteradas en estas pacientes1,29.
Opciones terapéuticas y resultadosEl plan de actuación va a variar según las características de la paciente, la sintomatología que presente y sus deseos genésicos. Hay poca evidencia publicada sobre terapias que puedan suponer una mejoría en los resultados reproductivos de las mujeres con esta enfermedad29.
Aunque existe controversia sobre la eficacia del uso de análogos de hormona liberadora de gonadotropinas (GnRH) previamente a técnicas de reproducción asistida, algunos estudios no aleatorizados indican que dicho tratamiento durante los tres meses antes de iniciar técnica puede suponer un beneficio1,2,29. Según el estudio publicado este último año por Hou et al., tras la pauta prolongada no se han visto beneficios en los resultados de fecundación in vitro, tras ajustar los resultados teniendo en cuenta variables que pueden influir como la edad, obesidad, etc. Sin embargo, sí que se observó una mejoría de los resultados de fecundación in vitro tras la pauta ultralarga de agonistas de GnRH51. Ambas consisten en la inyección intramuscular de agonista de GnRH (triptorelina), de acción corta en la pauta larga y acción prolongada en la ultralarga. La dosis administrada también es diferente, en la pauta larga de 0,1 mg/día durante 10 días y posteriormente se reduce la dosis a la mitad (0,05 mg/día) hasta la inyección de gonadotropina coriónica humana (HCG) para inducir la ovulación. Sin embargo, en la pauta ultralarga se administran 3,27 mg cada 28 días durante al menos tres meses antes de comenzar la estimulación ovárica51.
Los estudios sobre la eficacia de ultrasonidos de alta intensidad parecen indicar que pueda suponer un beneficio, pero son insuficientes ya que son escasos y de poca validez estadística. En cuanto al tratamiento quirúrgico con la resección de focos de adenomiosis no existe suficiente evidencia al respecto52.
Adherencias uterinasDefinición e impacto reproductivoOtra causa de problemas reproductivos de origen uterino es la presencia de sinequias intrauterinas, con una prevalencia de aproximadamente el 1,5% en mujeres estériles53 y hasta un 21,5% en pacientes con historia de legrado puerperal54. Un metaanálisis publicado por Hooker et al. en 2014 en el que se evaluaron más de 900 mujeres que habían padecido un aborto espontáneo, el 86% tratadas mediante legrado uterino, encontró una prevalencia de adherencias del 19,1%55. Múltiples publicaciones establecen las adherencias uterinas como una importante causa de infertilidad1,3,56. Según este mismo metaanalisis, del 3 al 38% (con una prevalencia agrupada del 19%) de las pacientes diagnosticadas de adherencias van a presentar problemas reproductivos55. Se concluye que, además, la mayoría de pacientes que presentaban sinequias tras el legrado tenían alguna anormalidad uterina previa, como malformaciones, pólipos o leiomiomas. Asimismo, en estas mujeres se pueden producir complicaciones obstétricas: aborto espontáneo, embarazo ectópico, parto prematuro y alteraciones en la placentación1.
Diagnóstico y tratamientoAunque por los antecedentes personales y pruebas de imagen podemos establecer una sospecha, la confirmación diagnóstica se realiza mediante histeroscopia, donde visualizaremos sinequias endometriales1,2,57. Además, se puede llevar a cabo en el mismo acto el tratamiento quirúrgico mediante adhesiolisis histeroscópica3. Esta debe realizarse con control ecográfico para disminuir el riesgo de perforación uterina y si es posible con tijera sin electricidad para así no dañar el endometrio sano cercano1. Tras el tratamiento quirúrgico la mejoría sintomática y el resultado reproductivo posterior va a depender de la gravedad inicial del cuadro56,57. Algunos estudios publicados concluyen que del 70 al 90% pueden tener menstruaciones cíclicas normales tras la adhesiolisis2. Sin embargo, se ha informado una tasa de recurrencias tras el tratamiento del 3 al 23%, pudiendo llegar a un 20 a 62% en caso de adherencias más severas56.
Es importante destacar que la prevención del cuadro adherencial se considera incluso más importante que su tratamiento, por lo que se debe evitar realizar legrados, principalmente en úteros grávidos y puerperales, fomentando el uso del tratamiento médico en caso de aborto y evitar las infecciones administrando una correcta profilaxis antibiótica en casos indicados1.
ConclusionesEl útero septo es la malformación uterina congénita más frecuente y la que cuenta con peores resultados reproductivos, aconsejándose la cirugía mediante septoplastia resectoscópica con una mejoría de la tasa de embarazo espontánea o tras tratamiento de reproducción asistida, así como menores complicaciones obstétricas. Los leiomiomas uterinos son una patología muy frecuente, cuya repercusión reproductiva va a depender de su localización: los submucosos o intramurales que afectan al endometrio van a interferir en la concepción y desarrollo de la gestación. Se aconseja su extirpación mediante técnicas no invasivas, principalmente la histeroscopia. De la misma forma, está recomendada la polipectomía histeroscópica previa a técnicas de reproducción asistida, aunque aún no está totalmente clara su repercusión reproductiva. La prevención del síndrome adherencial, evitando realizar intervenciones que produzcan daño en el endometrio es la mejor opción para evadir problemas reproductivos por esta causa.
En conclusión, el factor uterino es una causa muy frecuente de esterilidad por lo que debe tenerse siempre en cuenta y continuar en el futuro la investigación en este ámbito, con estudios de mayor calidad, con mayores muestras y aleatorizados, que nos puedan dar datos para establecer recomendaciones más sólidas en el manejo de estas pacientes y que mejoren su pronóstico reproductivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.