El tumor trofoblástico del lecho placentario es una afección muy infrecuente que forma parte del grupo de las neoplasias trofoblásticas gestacionales. Se origina generalmente tras un aborto o gestación normal a partir de la proliferación patológica del trofoblasto intermedio extravelloso, que puede ocurrir en meses o años tras la gestación. Su presentación clínica habitual es el sangrado uterino anómalo, la amenorrea y unos niveles de β-hCG bajos, en contra de lo que ocurre con el coriocarcinoma o la mola invasiva. El tratamiento de elección es la histerectomía junto con linfadenectomía pélvica. Es particularmente resistente a la quimioterapia, y un 30% de las pacientes presentan metástasis al diagnóstico. Se presenta un caso clínico de un tumor trofoblástico del lecho placentario diagnosticado en nuestro centro en julio de 2018, en una paciente con infertilidad que tras 3 abortos espontáneos comenzó con unos niveles de β-hCG bajos, pero en meseta y con tendencia al alza. Se aborda el enfoque diagnóstico y terapéutico que recibió, así como la evolución hasta la actualidad.
Placental site trophoblastic tumour (PSTT) is a very rare pathology that is part of the group of gestational trophoblastic neoplasia (GTN). It generally develops after a nonmolar abortion or term pregnancy from the pathological proliferation of extravillous intermediate trophoblast that can occur months or years after gestation. Its usual clinical presentation is abnormal uterine bleeding, amenorrhoea, and low levels of β-hCG, in contrast to choriocarcinoma or invasive mole. The treatment of choice is hysterectomy along with pelvic lymphadenectomy. It is particularly resistant to chemotherapy and 30% of patients present metastatic disease on diagnosis. A clinical case of PSTT diagnosed at our centre in July 2018 in a patient with infertility who, after 3 spontaneous abortions, debuted with low levels of β-hCG but on a plateau and with an upward trend. The diagnostic and therapeutic approach she received is addressed, as well as the evolution to date.
El tumor trofoblástico del lecho placentario (TTLP) forma parte del grupo de neoplasias trofoblásticas gestacionales (NTG) junto con el coriocarcinoma, la mola invasiva y el tumor trofoblástico epitelioide (que comparte características similares al TTLP). Es una enfermedad muy infrecuente, con una incidencia de 1/50.000-100.000 gestaciones, representando menos del 3% de todas las NTG1.
El TTLP se origina generalmente tras un aborto o gestación normal, y es menos frecuente tras una gestación molar, lo que lo diferencia del coriocarcinoma o la mola invasiva2.
El TTLP se desarrolla a partir de una proliferación patológica del trofoblasto intermedio extravelloso, que puede ocurrir tras varios meses o incluso años después del embarazo. Esto dificulta su diagnóstico e influye en el pronóstico, pues hasta el 30% de las pacientes presenta metástasis en el estudio inicial de extensión3.
A continuación se describe el proceso diagnóstico de un caso clínico de TTLP diagnosticado en nuestro centro y su seguimiento hasta la actualidad.
Presentación del casoSe trata de una paciente de 41 años con esterilidad primaria (3 abortos previos, el último de ellos en agosto de 2017) que, previamente a iniciar un nuevo ciclo de fecundación in vitro, se descubre una β-hCG positiva. La ecografía transvaginal mostraba un útero en anteversión de tamaño normal, con endometrio fino y homogéneo y ambos anexos normales, sin evidenciarse gestación extrauterina. Las determinaciones seriadas de β-hCG durante 4 semanas mostraron unos niveles bajos en meseta, pero con discreta tendencia al alza (123,5-190,1mU/ml), lo que descartaba una gestación normoevolutiva (junio-julio de 2018).
Se solicitó una determinación de β-hCG en orina (165mU/ml) para descartar un falso positivo en sangre por anticuerpos heterófilos. También se revisó el estudio histológico de los restos extraídos el año previo mediante legrado por el último aborto de la paciente, el cual estaba informado como tejido deciduocorial, sin signos de enfermedad trofoblástica gestacional. Ante ello, se decidió tratamiento con metotrexato por la sospecha de que la paciente padeciera una gestación ectópica. Sin embargo, tras 2 dosis de metotrexato 75mg intramuscular los niveles de β-hCG continuaban aumentando entre un 12-20%.
A continuación se realizó una histeroscopia diagnóstica (julio de 2018), en la que se observaba un endometrio atrófico, sin aumento de vascularización ni restos deciduocoriales. Se tomó una biopsia endometrial que determinó la presencia de escasas células de trofoblasto intermedio dispersas en el estroma, junto con cambios estromales compatibles con nódulo o placa del lecho placentario.
Ante la sospecha de una enfermedad trofoblástica gestacional se derivó a la paciente a oncología médica. Se solicitó un estudio de extensión consistente en tomografía axial computarizada (TAC) cerebral y TAC torácica (agosto de 2018) que fueron informados como negativos para imágenes metastásicas. No obstante, ante la persistencia del aumento de los niveles de β-hCG se decidió administrar actinomicina-D (septiembre de 2018). Tras 4 ciclos la cifra de β-hCG era superior a 500mU/ml (922mU/ml), por lo que se inicia poli-quimioterapia (noviembre de 2018) según el esquema EMA-CO (etopósido, metotrexato, dactinomicina, ciclofosfamida y vincristina).
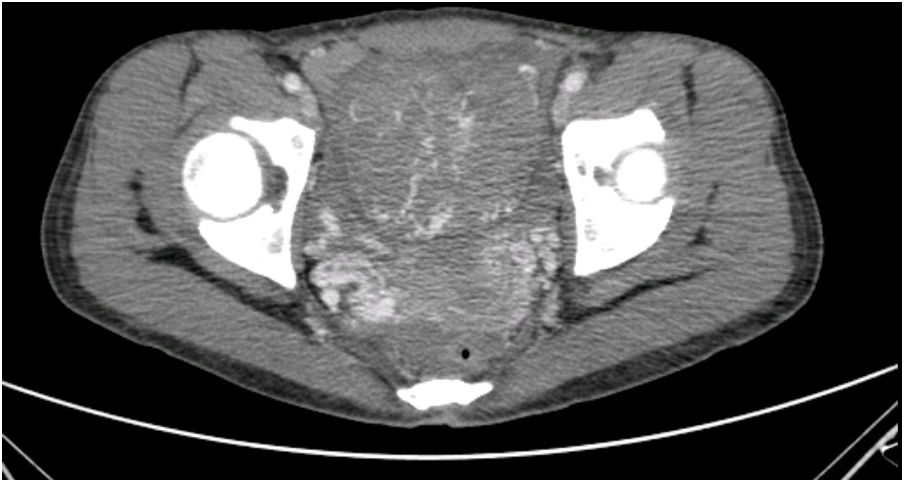
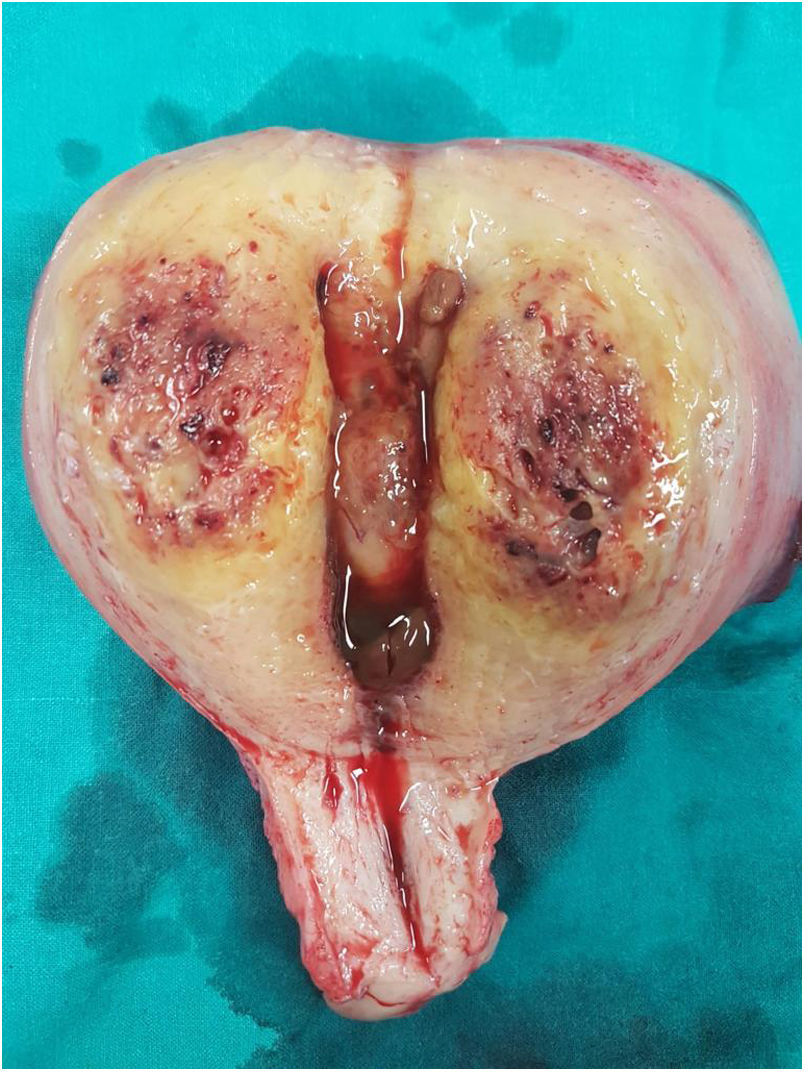
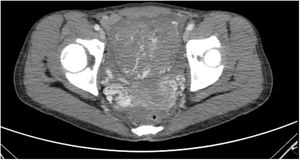
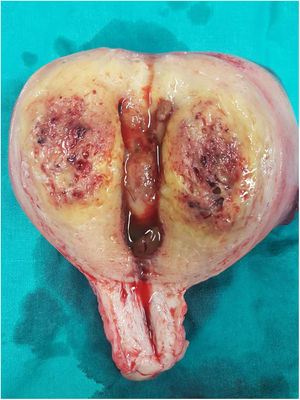
La paciente es ingresada en enero de 2019 por una descompensación hidrópica y se descubre en una TAC un útero aumentado de tamaño y con aumento de la vascularización (fig. 1). Ante la ausencia de respuesta a la quimioterapia y la imagen uterina se decide realizar una histerectomía (fig. 2).
En el estudio anatomopatológico, macroscópicamente se evidenció un útero muy aumentado de peso (464g) y tamaño (14×12×8cm), con marcado engrosamiento de todo el espesor miometrial, sin que se reconociera una lesión nodular definida. El espesor en la pared anterior y posterior fue de 3,5 y 4cm, y destacaba la consistencia blanda. La cavidad endometrial presentaba escaso contenido fibrinohemorrágico y estaba tapizada por un endometrio de entre 1 y 2mm de espesor, sin lesiones.
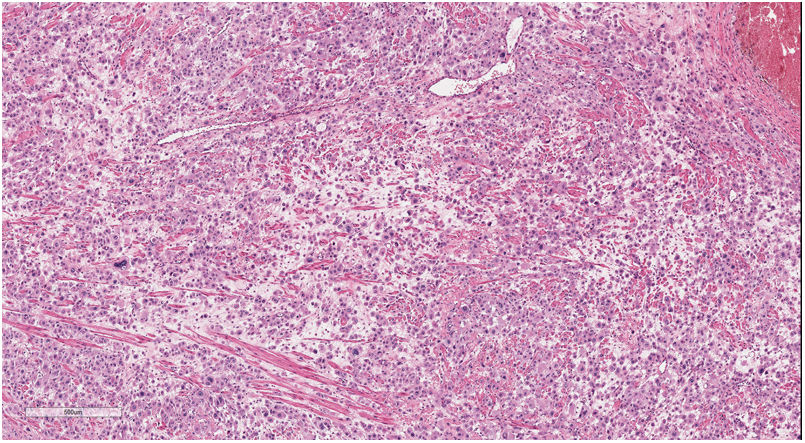
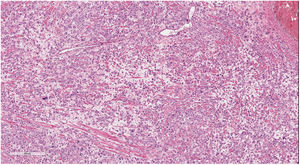
El estudio microscópico mostró la presencia de una infiltración extensa de todo el espesor del miometrio por células epitelioides con marcado pleomorfismo, que se disponían en un patrón difuso en sábana y focalmente formando nidos y cordones, con predominio de células mononucleadas junto con menor proporción de células bi y multinucleadas, con marcado edema entre ellas (fig. 3). Presentaban citoplasma eosinófilo o anfófilo, con núcleos redondeados u ovales, con cromatina grosera y tamaño muy variable, algunos muy grandes y de contornos convolutos. Se identificaron mitosis aisladas, con un recuento de menos de una mitosis en 10 campos de gran aumento. Al nivel del endometrio se identificaron células escasas y aisladas, epitelioides pequeñas y medianas, con escasa atipia, dispersas en el estroma, predominantemente en la zona basal.
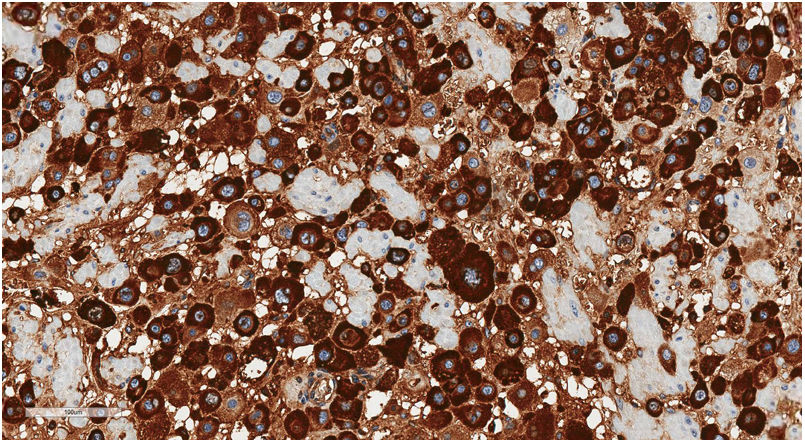
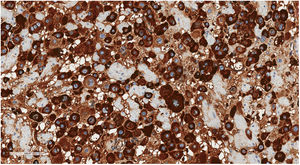
Con estudio inmunohistoquímico las células neoplásicas presentaban expresión de lactógeno placentario humano o hPL (fig. 4), CKAE1/3 y MUC4, siendo negativas para β-hCG, p63, p16 y CD10. El índice proliferativo con ki67 fue bajo, del 3-5%.
El diámetro máximo de la lesión fue de 10cm, que correspondía al diámetro máximo del cuerpo uterino, al estar todo el espesor del miometrio ocupado por la proliferación neoplásica. No se identificó infiltración de las trompas de Falopio.
Con estos hallazgos el diagnóstico fue de tumor trofoblástico del lecho placentario, estadio patológico FIGO IA.
Durante el seguimiento de la paciente posterior a la cirugía, los niveles de β-hCG se negativizan y en los estudios de imagen se diagnostican unos nódulos pulmonares que, en primer lugar, son descritos como probablemente metastásicos, pero los estudios de PET-TAC posteriores lo descartan. La paciente se encuentra libre de enfermedad en el momento actual.
DiscusiónEn el caso clínico expuesto se pueden observar las principales características que definen al TTLP, como son el lento crecimiento meses después de la gestación que lo acontece, los niveles bajos de β-hCG, el retraso en el diagnóstico y la resistencia a la quimioterapia.
Se trata de una paciente asintomática en la que la determinación de una β-hCG positiva previa a un ciclo de fecundación in vitro fue lo que propició la batería de pruebas diagnósticas ante la sospecha de una enfermedad trofoblástica gestacional.
Se han descrito factores de riesgo relacionados con el desarrollo del TTLP, como la gestación molar previa, la edad materna avanzada (>40 años, como es el caso de nuestra paciente) o el origen asiático4, así como factores de mal pronóstico: estadio avanzado de la enfermedad (según FIGO), intervalo largo desde la gestación previa (>2 años), desarrollo tras gestación a término, niveles altos de β-hCG, alto índice mitótico (>5/10) o necrosis tumoral2,5.
Las principales manifestaciones clínicas de TTLP son el sangrado uterino anómalo y la amenorrea6. En contra de lo que ocurre con el coriocarcinoma o la mola invasiva, el TTLP secreta niveles bajos de β-hCG (<1.000UI/ml)2, pero elevan el lactógeno placentario (hPL) y la fosfatasa alcalina placentaria7,8. Es por ello que la elevación del hPL es una de las características diferenciales de estos tumores8. El diagnóstico, como se expone en el caso clínico, puede ser tórpido, pero es muy sugestiva la aparición de una masa uterina meses después de una gestación, junto con niveles bajos de β-hCG con tendencia al alza9.
Aunque el TTLP puede permanecer mucho tiempo confinado en el útero, cuando metastatiza lo hace principalmente al pulmón (80%), al sistema nervioso central (10%) y a la vagina (30%). El estudio de extensión de nuestra paciente fue negativo, lo que indica que se trataba de un estadio inicial de la enfermedad. Los últimos estudios también demuestran que puede metastatizar precozmente a los ganglios linfáticos regionales, por lo que se recomienda linfadenectomía asociada a la histerectomía, si existen factores de riesgo adversos10. En nuestro caso, dado que la paciente no presenta factores de riesgo de mal pronóstico, pues se trataba de un estadio inicial según FIGO, la gestación previa hacía menos de 2 años que había ocurrido y los niveles de β-hCG eran bajos, se desestimó la linfadenectomía.
El tratamiento de elección es quirúrgico, porque el TTLP es particularmente resistente a la quimioterapia y es necesaria la combinación de varios fármacos en las pacientes de alto riesgo11,12. En nuestro caso la paciente no respondió o tuvo una respuesta muy escasa, a pesar de la combinación de varios fármacos quimioterápicos, pues los niveles de β-hCG seguían al alza.
En conclusión, el TTLP es un tipo de NTG de baja incidencia que en la mayoría de los casos presenta un comportamiento de características benignas por su lento crecimiento, lo que hace la que enfermedad se diagnostique confinada al útero en la mayoría de los casos. No obstante, no goza de buena respuesta a la quimioterapia, lo que convierte a la histerectomía en el tratamiento de elección. La aparición de enfermedad metastásica será el mayor determinante para el pronóstico de estas pacientes.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo ha existido fuente de financiación alguna.
Conflicto de interesesLos autores declaran la no existencia de conflicto de interés alguno.