Los tumores neuroendocrinos hipofisarios (TNEH) constituyen un grupo heterogéneo de tumores cuya incidencia ha experimentado un aumento progresivo a la que han contribuido técnicas de imagen más sensibles y mayor experiencia en neurorradiología en este ámbito. Aunque la mayoría de los TNEH son indolentes, algunos presentan un comportamiento agresivo y puede aparecer recurrencia tras la extirpación quirúrgica. Los cambios introducidos por la clasificación de la Organización Mundial de la Salud en 2017 y las controversias terminológicas con relación a los tumores neuroendocrinos hacen necesario actualizar las recomendaciones para el diagnóstico, el manejo pre y postoperatorio, y el seguimiento de respuesta al tratamiento de los TNEH. Este documento multidisciplinar, iniciativa del área de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición (SEEN), se centra en los estudios neurorradiológicos de imagen médica para el diagnóstico, pronóstico y seguimiento de los TNEH. Se describen los requisitos básicos y aspectos que deben cubrir los estudios con resonancia magnética nuclear y se propone un informe mínimo de radiología que ayude al clínico en sus decisiones terapéuticas. Este trabajo complementa así el consenso entre el Área de Neuroendocrinología de la SEEN y de la Sociedad Española de Anatomía Patológica para el estudio anatomopatológico de los TNEH.
Pituitary neuroendocrine tumours (PitNETs) constitute a heterogeneous group of tumours with a gradually increasing incidence, partly accounted for by more sensitive imaging techniques and more extensive experience in neuroradiology in this regard. Although most PitNETs are indolent, some exhibit aggressive behaviour, and recurrence may be seen after surgical removal. The changes introduced in the WHO classification in 2017 and terminological debates in relation to neuroendocrine tumours warrant an update of the guidelines for the diagnosis, preoperative and postoperative management, and follow-up of response to treatment of PitNETs. This multidisciplinary document, an initiative of the Neuroendocrinology area of the Sociedad Española de Endocrinología y Nutrición [Spanish Society of Endocrinology and Nutrition] (SEEN), focuses on neuroimaging studies for the diagnosis, prognosis and follow-up of PitNETs. The basic requirements and elements that should be covered by magnetic resonance imaging are described, and a minimum radiology report to aid clinicians in treatment decision-making is proposed. This work supplements the consensus between the Neuroendocrinology area of the SEEN and the Sociedad Española de Anatomía Patológica [Spanish Society of Pathology] for the pathological study of PitNETs.
Los tumores neuroendocrinos hipofisarios (TNEH) constituyen un grupo heterogéneo de tumores en términos radiológicos, histológicos y clínicos1. En los últimos años, se ha registrado un aumento progresivo de su incidencia, justificada por un aumento de mayor experiencia en el reconocimiento neurorradiológico experto y por el desarrollo de técnicas de imagen más sensibles2,3. Los TNEH constituyen un 15-25 % de las neoplasias intracraneales1,4-7 y los más frecuentes son los adenohipofisarios (85-90% de los casos). No obstante, en la región selar también es posible encontrar otro tipo de lesiones, como las metástasis de múltiples orígenes, las neoplasias mesenquimales, meníngeas o de origen neural y también quistes y procesos inflamatorios4-7. Se estima que el 15% de la población presentaría un tumor hallado por neuroimagen o anatomía patológica. Los TNEH con repercusión clínica representan 1 de cada 1.0008-10.
Aunque la mayoría de los TNEH son indolentes, con un crecimiento lento y una respuesta óptima al tratamiento, algunos presentan un comportamiento agresivo (entre un 5 y un 15% según las series11), caracterizado por la invasión local, la resistencia al tratamiento y, muy raramente, la aparición de metástasis12. Además, en algunos pacientes, a pesar de su extirpación quirúrgica, se produce recurrencia13. Por todo ello, la terminología para definir este grupo de tumores ha sido objeto de debate; desde 2016, el término TNEH ha sustituido al tradicional concepto de adenoma hipofisario1. En cuanto a su clasificación, la más reciente, llevada a cabo por la OMS 2017, agrupa a los TNEH de acuerdo con el perfil de hormonas hipofisarias y de factores de transcripción que expresan6. Esta clasificación ha facilitado una aproximación diferente a su diagnóstico patológico14,15 y ha permitido establecer una clasificación más precisa de los tumores, reduciendo drásticamente el porcentaje de aquellos que son nulos16-18.
Los recientes cambios introducidos por la clasificación de la OMS en 20176 y las controversias terminológicas con relación a los tumores neuroendocrinos hacen necesario revisar las pautas para el diagnóstico, manejo pre y postoperatorio y seguimiento de respuesta al tratamiento de los TNEH. Recientemente, se ha elaborado un consenso entre el Área de conocimiento de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición (SEEN) y de la Sociedad Española de Anatomía Patológica (SEAP) para el estudio anatomopatológico de los TNEH15. De forma complementaria, este documento multidisciplinar, iniciativa del área de Neuroendocrinología de la SEEN, se centra en los estudios neurorradiológicos de imagen médica para el diagnóstico, pronóstico y seguimiento de los TNEH.
La resonancia magnética (RM) como prueba de imagen de elección en el estudio y seguimiento de los TNEHEn la actualidad, la RM se considera la prueba de referencia en el diagnóstico por imagen de las enfermedades de la región hipotalámica-hipofisaria8,19-21. Con su mayor resolución de contraste y la posibilidad de obtener imágenes multiplanares, permite identificar las estructuras normales, diagnosticar lesiones, planificar el tratamiento quirúrgico, realizar el seguimiento de la enfermedad hipofisaria y evaluar la respuesta al tratamiento8.
Indicaciones de la RM en el diagnóstico de los TNEHSon indicaciones de RM para el diagnóstico diversas entidades en las que se sospeche una alteración anatómica o funcional de la hipófisis. Entre estas, estarían la hiper o hipofunción de la adenohipófisis, disfunción de la neurohipófisis, sospecha de compresión de estructuras adyacentes en la región selar, aparición de defectos del campo visual temporal o parálisis asociada a los pares craneales III, IV y VI.
Indicaciones de otras técnicas de imagen médicaTomografía axial computarizada (TC)La TC fue la técnica empleada para el estudio de la región hipofisaria antes del desarrollo de la RM, pero esta última la ha desplazado por su mayor capacidad de resolución de contraste, evitando la presencia de artefactos de endurecimiento de haz en la región de la silla turca y la exposición a radiación ionizante de la TC19. Por lo tanto, hoy en día, la TC se utiliza para el diagnóstico primario solo cuando la RM está contraindicada (p. ej., algunos pacientes con marcapasos, cuerpos extraños metálicos oculares, implantes cocleares u obesidad que impida técnicamente utilizar la RM), y de forma complementaria a la RM para el diagnóstico diferencial de los meningiomas, craneofaringiomas y germinomas, pues permite identificar calcificaciones u osificaciones características de estos tumores. También se utiliza la TC para valorar la integridad ósea de la base del cráneo y para la planificación quirúrgica.
Tomografía por emisión de positrones (PET) con 11C-metioninaLa PET/TC 11C-metionina (MET) es una técnica sensible y complementaria a la RM para la detección de adenomas hipofisarios o tejido residual tras cirugía hipofisaria. La principal ventaja de la MET frente a la 18F-fluorodesoxiglucosa (FDG) radica en su mejor ratio de captación hipófisis/cerebro22.
Esta modalidad tiene una mayor sensibilidad, sobre todo en microadenomas recurrentes22. Puede aportar información cuando la RM o la FDG son negativas, especialmente en los microadenomas23,24. Su tasa de detección es mayor que la de la RM en determinados TNEH25 y también es útil para valorar la respuesta al tratamiento con análogos de la somatostatina en estos tumores23.
Cateterismo de senos petrososEl cateterismo de senos petrosos se emplea en el diagnóstico de la enfermedad de Cushing, cuando la imagen en la RM no es concluyente o en adenomas de diámetro inferior a 6 mm26,27. Aunque alcanza sensibilidades superiores al 90% para establecer el origen hipofisario de la enfermedad, es una técnica invasiva y no es tan específica en demostrar la lateralización del tumor en una mitad u otra de la adenohipófisis28.
Requisitos de la RM para el diagnóstico y seguimiento de los TNEHConsideraciones sobre la potencia de los equipos de RMLa hipófisis no suele medir más de 8mm de longitud y los microadenomas pueden ser muy pequeños, llegando a no superar el milímetro de diámetro. Por ello, es imprescindible que las imágenes sean de una buena resolución espacial, y óptima resolución de contraste, es decir, que tengan adecuadas relaciones señal-ruido y contraste-señal, respectivamente.
La primera consideración a la hora de realizar un estudio de RM de hipófisis en un equipo de 1,5 T o en uno de 3 T es la disponibilidad de cada centro. Aunque en los últimos años ha aumentado el número de equipos de 3 T, estos siguen siendo minoritarios, por lo que sus indicaciones deben ser cuidadosamente delimitadas. Usar un equipo con campo mayor puede ser útil si hay sospecha de microadenoma y la exploración con 1,5 T no excluye esta posibilidad29. También es útil para evaluar con mayor precisión diferencias sutiles entre el tejido normal y anormal, así como la predicción de la invasión de las estructuras adyacentes y la evaluación del tallo hipofisario29,30. No obstante, los equipos de alto campo plantean dificultades técnicas, al ser más sensibles a artefactos, especialmente de susceptibilidad, por lo que deben de estar adecuadamente ajustados, y plantean mayores limitaciones en algunos pacientes.
Uso de contraste en la RMSe utiliza contraste de gadolinio para la RM tanto en el diagnóstico como en el seguimiento de las lesiones hipofisarias. No obstante, en los últimos años ha surgido preocupación por el depósito de contraste, en especial de compuestos lineales, en el parénquima encefálico. Por este motivo, se han emitido informes oficiales sobre su uso y restricciones31.
Las guías de práctica clínica para TNEH recomiendan un seguimiento neurorradiológico en rangos entre los 3 y los 12 meses para los tumores agresivos8 y no se han posicionado con respecto a los no agresivos. Es necesario que los clínicos sean conscientes de la necesidad de minimizar la exposición de los pacientes al contraste de gadolinio32, adecuando el intervalo de los estudios a cada situación clínica, evitando el uso de contraste cuando no sea necesario20,33.
Protocolo básico de RM para la exploración de la neurohipófisis y el estudio de TNEHSe puede dividir el protocolo de RM de hipófisis en 3partes21,34, que se describen en la tabla 1.
Protocolo básico de resonancia magnética para la exploración de neurohipófisis y estudio de TNEH
| Estudio | Adquisición | Metodología | Objetivo |
|---|---|---|---|
| Estudio morfológico | De rutina, se realizan secuencias en plano sagital y coronal, y muy ocasionalmente axial, potenciadas en T1, sin y con contraste, y en T2 | Secuencia de cortes finos con alta resolución espacial y un buen ratio señal/ruidoEl corte debe ser fino, con un grosor entre 2 y 3mm. Puede reducirse a 1mm o 1,5mm en equipos de 3 TCampo de visión pequeño, de entre 140 y 160 mm | Identificar las estructuras normales o patológicas, su relación con estructuras vecinas, y conocer si son sólidas, quísticas, con componente graso, hemorrágico o proteicoDistinguir las zonas con gran contenido de agua libre por ser hiperintensas (ventrículos, cisternas basales o las lesiones quísticas).Delimitar los vasos intracraneales (carótidas o el polígono de Willis), hipointensos por el flujo rápido de la sangreIdentificación de contenido hemorrágico (p. ej., señal hipointensa en T2 en la hipófisis)Muy útil si el uso de contraste de gadolinio está contraindicado |
| Estudio dinámico | Serie de imágenes coronales potenciadas en T1 durante la fase arterial de administración de gadolinio | Se realiza un escaneo rápido repetitivo (baja resolución) con secuencias cíclicas de 10min en coronalDurante la primera secuencia se administra un bolo de 10ml a 2,5 ml/s+bolo de 20 ml de suero fisiológicoLas sucesivas permiten comprobar como aumenta la intensidad de señal de la glándula en el tiempo | Identificar un microadenoma por un realce más lento que el resto del tejido hipofisario. La hipófisis y el tallo hipofisario carecen de barrera hematoencefálica, lo que hace que tengan un realce rápido y progresivo que comienza en la parte superior de la glándula y se extiende al resto |
| Estudio poscontraste | Cortes sagitales y coronales spin echo potenciados en T1 | Observar el realce homogéneo normal que debe aparecer en la fase tardía tras administrar gadolinio |
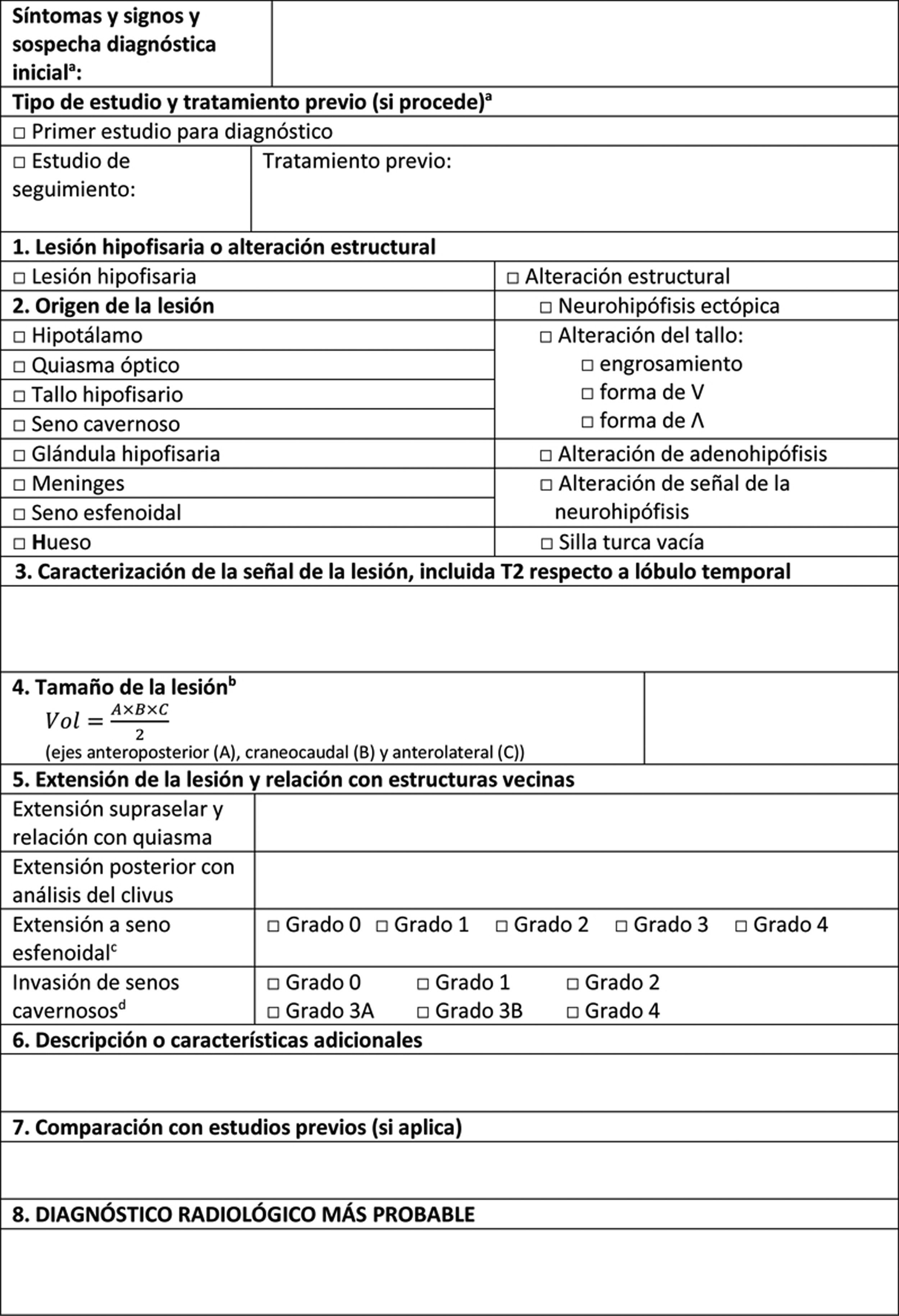
Un informe de estudio inicial de RM por sospecha de TNEH debe de incluir toda la información relevante para definir la lesión. En la tabla 2 se presenta una propuesta de informe básico basado en los siguientes puntos.
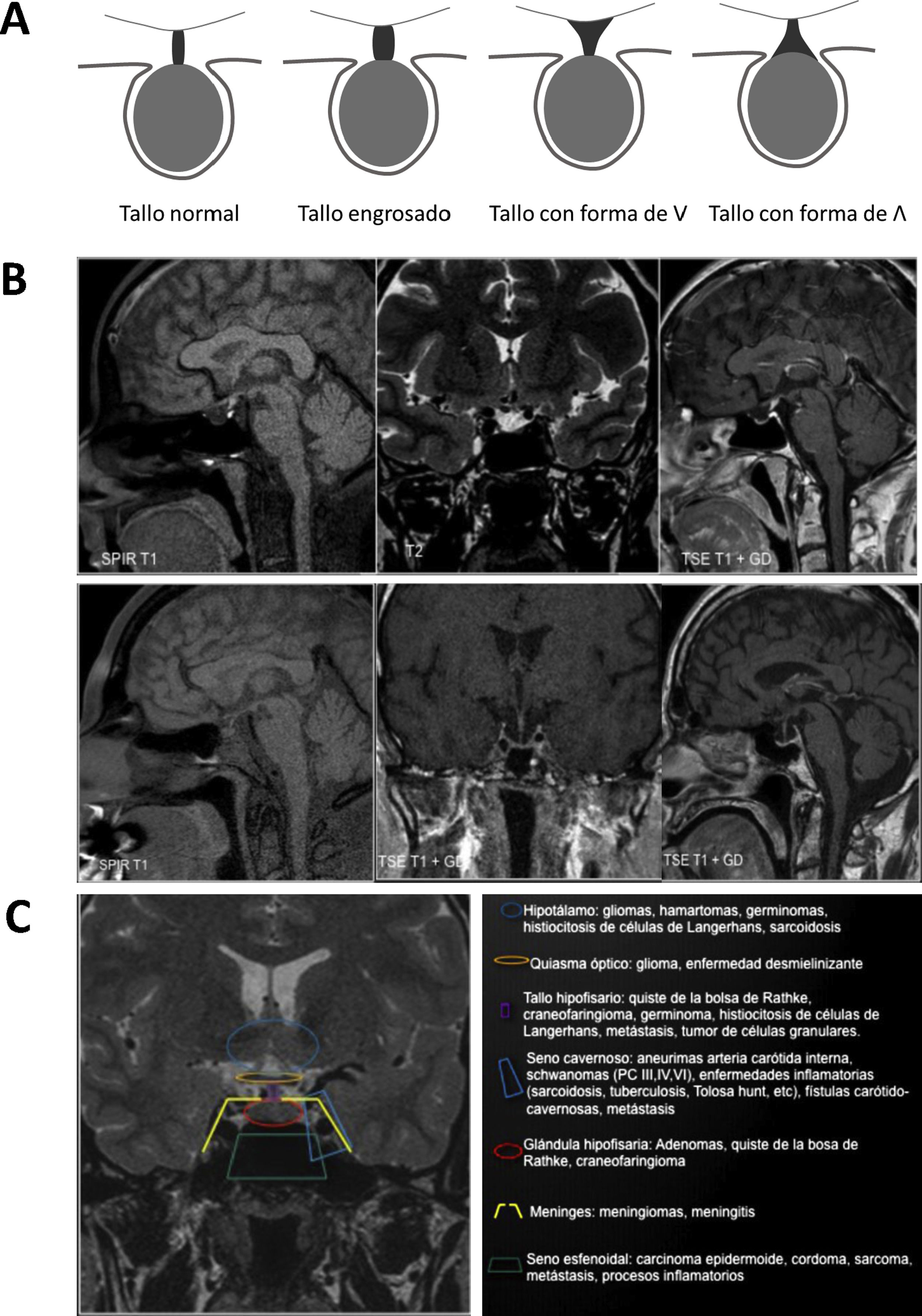
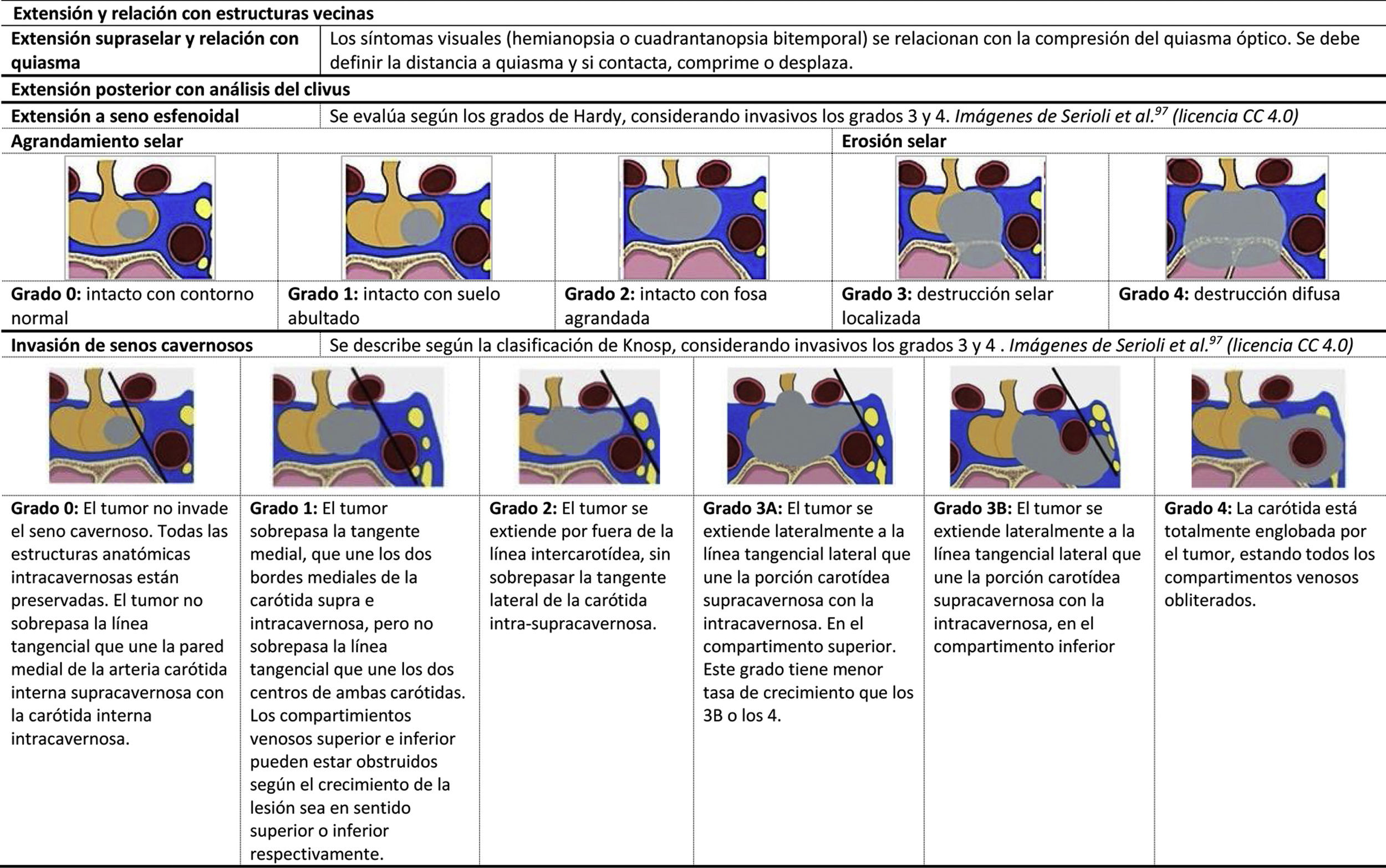
El primer objetivo es determinar si existe o no una alteración en la anatomía normal de la hipófisis. De esta manera se debe tener en cuenta: el volumen y morfología de la silla, el tamaño, señal y forma de la glándula, el contenido supraselar (tallo [fig. 1A], quiasma y suelo del tercer ventrículo) y los senos cavernosos.
Alteraciones morfológicas. A) Morfologías del tallo. B) Paneles superiores: neurohipófisis ectópica e hipoplasia del tallo y de la adenohipófisis; panel inferior izquierdo: diabetes insípida (ausencia de hiperseñal normal en T1 de la neurohipófisis). Paneles inferiores central y derecho: silla turca vacía (corte coronal y sagital). C) Clasificación de lesiones selares y paraselares según su origen.
Hay que recordar que el tamaño hipofisario es mayor en neonatos y en mujeres, especialmente en período puberal, o durante la gestación y el posparto, donde la forma de la hipófisis con borde superior convexo no debe confundirse con un adenoma hipofisario. En algunos casos, las deficiencias glandulares primarias también pueden asociarse a crecimiento fisiológico de la glándula hipofisaria, por ejemplo, en el caso del hipotiroidismo primario35. Por tanto, ante una alteración anatómica debe evaluarse si se trata de una variante de la normalidad o una lesión36 (fig. 1B).
Origen de la lesión hipofisariaPara el diagnóstico diferencial es necesario determinar el origen de la lesión hipofisaria, para lo que se pueden seguir las pautas mostradas en la figura 1C.
Caracterización de la lesiónPara caracterizar las lesiones se requiere de al menos las secuencias morfológicas potenciadas en T1 y en T2 en las que se describirán las características de señal en las diferentes potenciaciones de la lesión hipofisaria en comparación con la glándula sana, o con el lóbulo temporal adyacente. Estas características permiten una cierta aproximación a la caracterización histológica/tisular de las lesiones para diferenciar las lesiones sólidas, de las quísticas y de las mixtas, intentado además conocer el contenido de las lesiones quísticas (proteínico, hemorrágico, colesterol, etc.). En este sentido, para la caracterización también se utiliza la captación de contraste.
La imagen de dinámica T1, o Dynamic Contrast Enhanced MR (DCE) por su sigla en inglés, se emplea para valorar la vascularización y grado de permeabilidad de los tejidos. En la enfermedad hipofisaria se ha empleado para diferenciar el tejido hipofisario normal de los adenomas hipofisarios. Como el tejido hipofisario está más vascularizado que los adenomas, las curvas de captación en el tiempo del tejido hipofisario normal muestran un pico de realce mayor y más rápido con una pendiente más pronunciada, comparativamente con los adenomas37 (tabla 1).
Incluir secuencias coronales en T2 puede ayudar a identificar microprolactinomas (hiperintensos en T2) evitando el uso de contraste. También, los adenomas corticotropos silentes pueden tener patrón microquístico en T2 y es importante su identificación porque son más agresivos. Finalmente, en acromegalia, ofrece información para predecir la respuesta a análogos33.
Tamaño de la lesiónEl tamaño se debe definir midiendo los 3ejes del espacio (anteroposterior [A], craneocaudal [B] y transversal [C], y estos datos son los mínimos a incluir en el informe. Para el cálculo del volumen se puede emplear la fórmula geométrica Vol=A×B×C2, con la limitación que asumimos la esfericidad de la lesión38. También se puede llevar a cabo un análisis volumétrico 3D con un software específico y, aunque es una opción más laboriosa, permite definir mejor adenomas irregulares o lobulados. Sin embargo, aunque esta última aproximación es más exacta y sería de especial interés en el seguimiento posquirúrgico, todavía no se aplica de rutina en la práctica clínica y se utiliza más en estudios de investigación. Ambos métodos se han comparado38 y se ven limitados por la variabilidad intra e interobservador en la delimitación de las lesiones, especialmente cuando la diferencia de intensidad de los adenomas con respecto al parénquima normal es escasa.
Además, es importante utilizar siempre el mismo método de cálculo de volumen para poder estimar correctamente los cambios evolutivos.
Extensión y relación con estructuras vecinasEn el informe se debe de describir la extensión de la lesión y su relación con las estructuras vecinas, considerando las clasificaciones establecidas que se resumen en la tabla 3.
Comparación con estudios previos de RMSi no se trata del primer estudio de diagnóstico, el estudio se debe de obtener utilizando el mismo protocolo y configuración que el original o los previos19. Idealmente se realizará en el mismo equipo de RM, disponiendo de las imágenes almacenadas en el sistema PACS (Picture Archiving and Communication System) del centro. En el informe se deberá comparar con estudios previos y poner en contexto el estudio actual19,21,39:
- –
Contexto clínico del caso: diagnóstico inicial y tratamiento realizado.
- –
Comparación con los estudios radiológicos previos, tanto con el estudio del diagnóstico como con el de seguimiento.
- –
Si se ha llevado a cabo cirugía, considerar los cambios propios de la intervención, tanto en el postoperatorio inmediato como en controles posteriores.
- –
Identificar posibles restos tumorales o recidiva (tejido que se comporte como la lesión inicial del estudio diagnóstico).
- –
Describir posibles complicaciones: fístulas de líquido cefalorraquídeo, hemorragias, etc.
Si se sospecha que un TNEH es agresivo, se debe de realizar una correcta estadificación de la enfermedad. Es necesario investigar la posible presencia de metástasis ante datos como el crecimiento acelerado, tumor invasivo, crecimiento a pesar de tratamientos adecuados y falta de coherencia entre los síntomas, los datos bioquímicos y los hallazgos radiológicos40. Las principales localizaciones de metástasis son la médula espinal, las cadenas ganglionares cervicales y, menos frecuentemente, el hígado, el hueso y el pulmón. Para este estudio, las opciones de imagen son la PET y la TC de cuerpo completo. La FDG-PET tiene mayor sensibilidad en la estadificación de diversos procesos oncológicos frente a la TC de cuerpo completo. El TNEH agresivo presenta alta avidez por la FDG, por lo que debería considerarse como técnica de imagen para el cribado de enfermedad a distancia. En el caso de metástasis confirmadas, la PET con 68Ga-DOTATATE puede ser útil para valorar la expresividad de los receptores de la somatostatina41 y evaluar el tratamiento alternativo con análogos marcados con 177Lu42.
Pruebas de imagen en la planificación quirúrgica de los TNEHEvaluación prequirúrgicaLos propósitos del estudio neurorradiológico de los adenomas hipofisarios en este contexto son los ya descritos: identificar la lesión y definir las relaciones espaciales del tumor con las estructuras circundantes. Entre ellas, destacan el efecto sobre los nervios ópticos/quiasma, la extensión en senos cavernosos y su relación con la arteria carótida interna adyacente, la extensión paraselar y la invasión de base de cráneo/foramina ovales, apófisis clinoides, planum esfenoidal, clivus y senos esfenoidales. Además del estudio básico de RM antes descrito (tabla 2), es útil contar con secuencias complementarias como la angiografía por RM43,44, especialmente ante la sospecha de una posible naturaleza vascular de la lesión selar o de estenosis de la arteria carótida interna adyacente.
Datos de RM para planificación quirúrgica para microadenomasLos microadenomas hipofisarios son las neoplasias intraselares más comunes y su diagnóstico se basa en la presencia de hallazgos indirectos y directos. Los hallazgos indirectos son: a) el desplazamiento lateral del tallo hipofisario; b) la alteración morfológica del contorno superior (diafragma selar), y c) la irregularidad o convexidad focal del suelo selar. Los hallazgos directos son la identificación de lesiones redondeadas u ovaladas, de señal diferente del resto del parénquima glandular en secuencias basales o de menor captación de contraste, comparativamente con el resto de la adenohipófisis. Los microadenomas pueden mostrar hiperintensidad en las imágenes ponderadas en T1, debido a su mayor contenido proteínico o a la hemorragia de una parte o de toda la lesión.
En el caso de los microadenomas, es relevante determinar la lateralización, es decir, la localización precisa en una de las 2mitades del lóbulo anterior, si se pretende conservar la mitad sana hipofisaria para mantener la funcionalidad.
Datos de RM para la planificación quirúrgica de macroadenomasLos macroadenomas hipofisarios generalmente se extienden fuera de la silla turca. Para la planificación es necesario aclarar la conformación de la lesión, su consistencia (firme, quística, necrótica o hemorrágica) y sus relaciones con las estructuras anatómicas circundantes. El tumor generalmente se extiende en sentido craneal, tendiendo a comprimir el quiasma óptico; puede permanecer subdiafragmático o romper el diafragma selar. Se debe describir la posición del adenoma cuando se extiende en la región supraselar. El adenoma también puede extenderse hacia abajo, hacia el seno esfenoidal, o lateralmente hacia el seno cavernoso45. Es de máxima importancia valorar si el seno cavernoso está comprimido o invadido (tabla 3) o si hay invasión del tercer ventrículo, y planificar el abordaje (sea transfenoidal o transcraneal). Igualmente, resulta fundamental para el neurocirujano poder saber a priori si existe invasión de la adventicia de la arteria carótida interna adyacente, pues en este caso, si la resección es agresiva, puede desgarrar la carótida y producirse un sangrado arterial masivo.
Una de las vías frecuentes para abordarlo quirúrgicamente es la endoscopia nasal. Por ello, es conveniente describir la posición según 4regiones establecidas por 2planos virtuales: uno pasa a través de la superficie inferior del quiasma y los cuerpos mamilares y el otro a través del margen posterior del quiasma y el dorsum sellae. Las regiones resultantes son la supraquiasmática, la subquiasmática, la retroselar y la ventricular.
Utilidad de la TC en la planificación quirúrgicaEn casos seleccionados se usará la TC para proporcionar más detalles sobre la presencia de componentes calcificados de la lesión y lograr una definición precisa de los límites óseos. Si el abordaje quirúrgico elegido es el transesfenoidal, la TC ofrecerá información relevante sobre el grado de neumatización del seno esfenoidal; si es transcraneal (p. ej., supraorbitario) obtendremos información sobre el grado de neumatización del seno frontal. Asimismo, la TC permite una visión general detallada del mapa óseo de las fosas nasales, senos paranasales y base del cráneo. Permite el estudio de las marcas anatómicas referenciadas en la cirugía endoscópica nasosinusal (cornetes nasales, apófisis unciformes, etc.) y del grado de neumatización e integridad y posicionamiento de las paredes óseas de los senos esfenoidal y frontal.
Predicción de la remisión posquirúrgicaEl factor clave para la predecir la remisión posquirúrgica es el grado de invasión del seno cavernoso46,47. Se ha descrito recientemente la importancia de la diferenciación dentro del grado 3 de Knosp entre los grados 3A y 3B (tabla 3) para predecir el éxito de la cirugía, siendo significativamente menor en el grado 3B47-49. Con este objetivo de poder predecir la remisión posquirúrgica y la recurrencia, podrían ser de utilidad las secuencias de difusión (DWI) y el coeficiente de difusión aparente (ADC)50.
Evaluación intraoperatoria mediante RMLa RM intraoperatoria (RMi) está descrita desde 199451. Sin embargo, su implementación en la práctica clínica es todavía muy baja y la literatura al respecto es controvertida. En una revisión reciente52 sobre las modalidades de RMi (bajo campo, alto campo y neuronavegación) se citan ventajas como la mejor visualización del seno cavernoso, la información en tiempo real para el cirujano y por ello la posibilidad de aumentar la tasa de resección tumoral completa y preservación de glándula sana, entre otras cuestiones. Por otro lado, la duración de la cirugía y el coste aumentan.
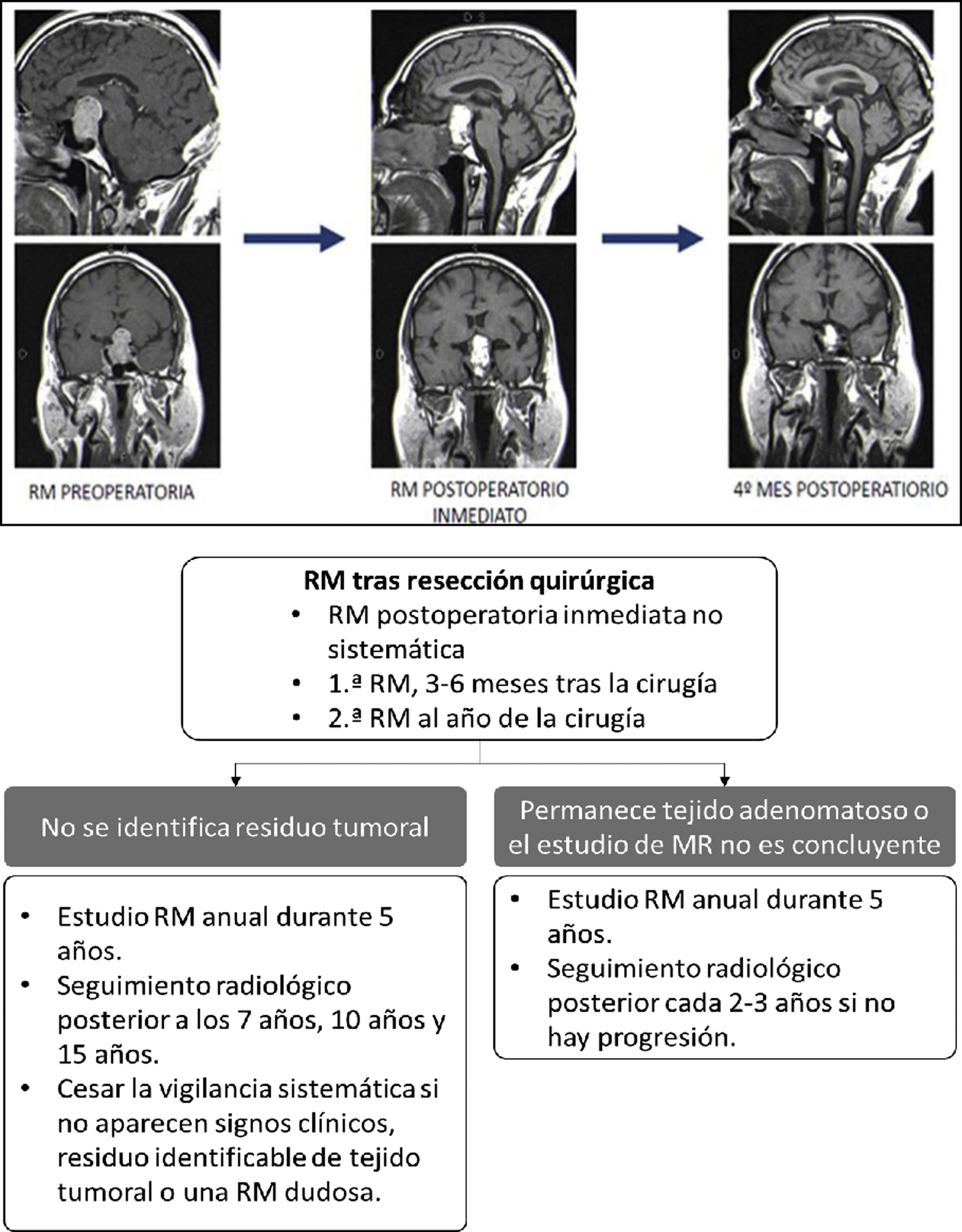
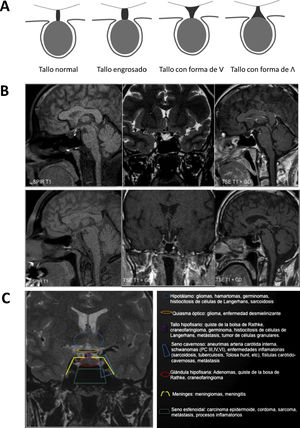
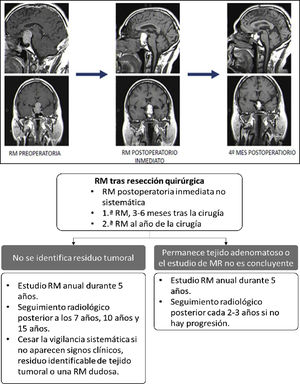
Evaluación posquirúrgica mediante RMNo existe un consenso claro con respecto al momento óptimo para realizar el estudio de RM posquirúrgica53,54. La RM posquirúrgica inmediata (dentro de la primera semana tras cirugía) sirve para detectar restos tumorales durante el seguimiento evolutivo, sirviendo de base para los controles de RM posteriores55-57. Es útil para diagnosticar posibles complicaciones y para valorar la glándula normal, y el grado de resección de la lesión21,58 (fig. 2, panel superior). Se pueden tener en cuenta estas referencias:
- –
Si la intensidad de señal y la captación de contraste son similares a los de la lesión en el estudio prequirúrgico, dicho tejido es sospechoso de resto tumoral.
- –
Cuando la captación de contraste es lineal y periférica, es más probable que corresponda a cambios posquirúrgicos59. El conocimiento de las características radiológicas de los materiales implantados en la región selar es también muy importante, ya que algunos materiales, como la grasa, pueden identificarse hasta años después de la cirugía y, en cambio otros, como los materiales hemostáticos, solo durante unas semanas después de la cirugía. Por otro lado, es importante tener en cuenta que la disposición y las características de la grasa que se usa para tapar el defecto quirúrgico de la cirugía transesfenoidal, varía entre el estudio inmediatamente posquirúrgico y los controles posteriores.
- –
En el estudio dinámico, la identificación en la sospecha de resto tumoral de un grosor de captación>3,9mm se relaciona con restos tumorales con una sensibilidad del 89% y especificidad del 97%60.
Superior: evolución adenoma hipofisario al 4.° mes de la cirugía. Inferior: seguimiento radiológico con RM para TNEH no funcionantes.
Traducido y adaptado de Cortet-Rudelli et al.55, 2015.
En el control postoperatorio tardío, y sobre todo en los TNEH no funcionantes, la RM se suele realizar entre el tercero y sexto mes tras la intervención21,55. Aunque en el control posquirúrgico inmediato es posible orientar sobre si se ha logrado resección parcial o completa, no es hasta 4-6 meses después de la cirugía que se reabsorben los materiales del lecho quirúrgico y que se puede valorar claramente el grado de resección tumoral. En los TNEH funcionantes no es necesario el control radiológico de rutina si se confirma remisión hormonal y no se sospecha complicaciones o recidiva. En la figura 2(panel inferior) se esquematiza un protocolo de seguimiento posquirúrgico para TNEH no funcionantes. La existencia de restos tumorales tras la cirugía, sobre todo invadiendo los senos cavernosos, es el factor que más define el riesgo de recurrencia y, tras analizar las distintas series, se calcula que esta recurrencia aparece en un 47% de los casos si existen restos vs. 15% si no existen55. Las variables que se relacionan con menor tasa de recurrencias son la edad avanzada y la mayor extensión de la resección tumoral61.
No existen marcadores específicos de recurrencia en los TNEH no funcionantes. El 85% de las recurrencias suelen darse en los primeros 5 años. Entre los pacientes no tratados mediante radioterapia, el 20% presenta recurrencia antes de los 5 años y más del 50% a los 10 años62. También son frecuentes las recurrencias tardías, por lo que debe realizarse el seguimiento con imagen RM a largo plazo al menos hasta que se hayan dilucidado otros métodos fiables que predigan la recurrencia del tumor62.
Pruebas de imagen en la planificación del tratamiento con radioterapiaLas secuencias volumétricas potenciadas en T1 con contraste aportan precisión a la hora de contornear los adenomas y los órganos de riesgo que los rodean, fundamentalmente el quiasma y los nervios ópticos. En radioterapia, y tras cirugía que requiera de injertos de grasa abdominal, las secuencias con supresión grasa pueden ser de utilidad para la definición del adenoma residual56,63. Se han de obtener reconstrucciones en plano axial, ya que la mayoría de los planificadores de radioterapia solo manejan este plano para poder realizar un registro rígido o deformable entre la RM de planificación y la TC de planificación. Este último será necesario en la mayoría de los casos (excepto en las unidades GammaKnife o MR-LINAC) para el cálculo de la dosis. En pacientes a los que no se les puede realizar una RM, una TC con reconstrucción de cortes cada 1-2 mm y adición de contraste yodado es la prueba de elección56.
Por el momento, el uso de la imagen metabólica en la planificación de la radioterapia para el tratamiento del adenoma de hipófisis es experimental, con diversas técnicas en estudio57,64-66.
Utilidad de la RM en el pronóstico de los TNEH y seguimiento de respuesta al tratamientoLa RM en el pronósticoUn marcador de agresividad de un TNEH es la invasión. No obstante, para considerar un adenoma agresivo, además debe de presentar una recurrencia temprana (6-12 meses tras cirugía) y un crecimiento tumoral rápido, unido a resistencia a tratamiento convencional40,67. En cualquier caso, la definición de un TNEH agresivo se alcanza en combinación con el diagnóstico histopatológico utilizando los indicadores de proliferación67 y los teragnósticos68.
La mayor parte de los trabajos que relacionan el aspecto radiológico y las características histológicas y moleculares de agresividad se han hecho con referencia a la acromegalia69-74. Se ha descrito según estas relaciones distintos subtipos de TNEH productores de GH70. En esta patología, la hipointensidad de señal en T2 se ha relacionado con otras características tumorales, histológicas (patrón densamente granulado) y clínicas (como la mejor respuesta de los análogos de somatostatina [ASS]) y, por lo tanto, con su pronóstico69,71-73. La expresión de SSTR3 (receptor de la somatostatina 3) y DRD5 (receptor D5 de dopamina) se asocian a extensión extraselar o supraselar. Además, la expresión de DRD5 es mayor en los adenomas hiperintensos en T2 y su expresión se relaciona directamente con los grados de Knosp y con el diámetro tumoral69. Por otro lado, la ausencia de la hiperseñal normal en T1 de la neurohipófisis, en la RMN prequirúrgica, es predictora de diabetes insípida posquirúrgica74.
En un reciente metaanálisis que incluía tumores de varias estirpes, de los cuales un 9,5% eran neuroendocrinos y un 2% hipofisarios, se relaciona el ADC con el grado de proliferación celular y con características histopatológicas como la expresión de diferentes receptores, el polimorfismo nuclear y el potencial de proliferación (especialmente MIB-1, ki67), lo que ayudaría a planificar el abordaje quirúrgico y predecir el comportamiento tumoral75. Se ha descrito una fuerte correlación entre valores bajos de ADC y MIB-1 (Ki67), demostrando el potencial de la imagen en difusión como biomarcador de los anteriormente conocidos como adenomas atípicos y proliferativos76.
Criterios morfológicos para determinar la respuesta al tratamiento radioterápicoEl parámetro que clásicamente ha ofrecido información sobre la respuesta al tratamiento es el tamaño de la lesión77. Dado que se trata de tumores de lento crecimiento, se ha considerado una respuesta favorable la disminución del tamaño e incluso la estabilidad. Por ello, es importante que además de las características tumorales se recoja también la reducción, la estabilidad o el aumento de volumen. Cuando el paciente ha recibido tratamiento con radioterapia, el aumento de la señal en la imagen potenciada en T2 se considera un criterio de respuesta favorable al tratamiento. Por otro lado, la pérdida de señal en T2 (hiposeñal) en el seguimiento de los adenomas debe ser valorada con cautela, pues puede reflejar una trasformación a un tumor más fibroso o más celular (degeneración maligna)77.
En adenomas mayores de 3cm se han evaluado las diferencias entre la medición previa a radioterapia y, tras esta, mediante un cálculo de volumen utilizando los 3 diámetros. Los resultados apoyan realizar análisis volumétrico 3D en lugar de 2 dimensiones para la medición de los adenomas grandes o gigantes78. La volumetría en 3D es más sensible a los cambios de tamaño, pero su obtención es más compleja79.
Predicción de la respuesta al tratamiento con ASS en la acromegaliaLa hipointensidad del TNEH en secuencias T2 se ha asociado con la presencia patrón densamente granulado80, así como con una respuesta significativamente mejor a ASS tras la cirugía73. Además, la reducción de la GH con el tratamiento también es significativamente mayor81-83, con mayor reducción de la producción de la GH y del tamaño tumoral cuanto mayor es la hipointensidad detectada84. La hipointensidad en T2 también se correlaciona con mayor reducción de GH tras test de octreótido y menor tamaño e invasividad en el diagnóstico82-84. No obstante, se desconoce la razón de la mejor respuesta a los ASS de los adenomas hipointensos33.
Es importante por ello establecer cómo definir la intensidad en T2 y puede realizarse de 2formas:
- –
Comparándola con la glándula hipofisaria sana, siempre que esta pueda discriminarse bien84.
- –
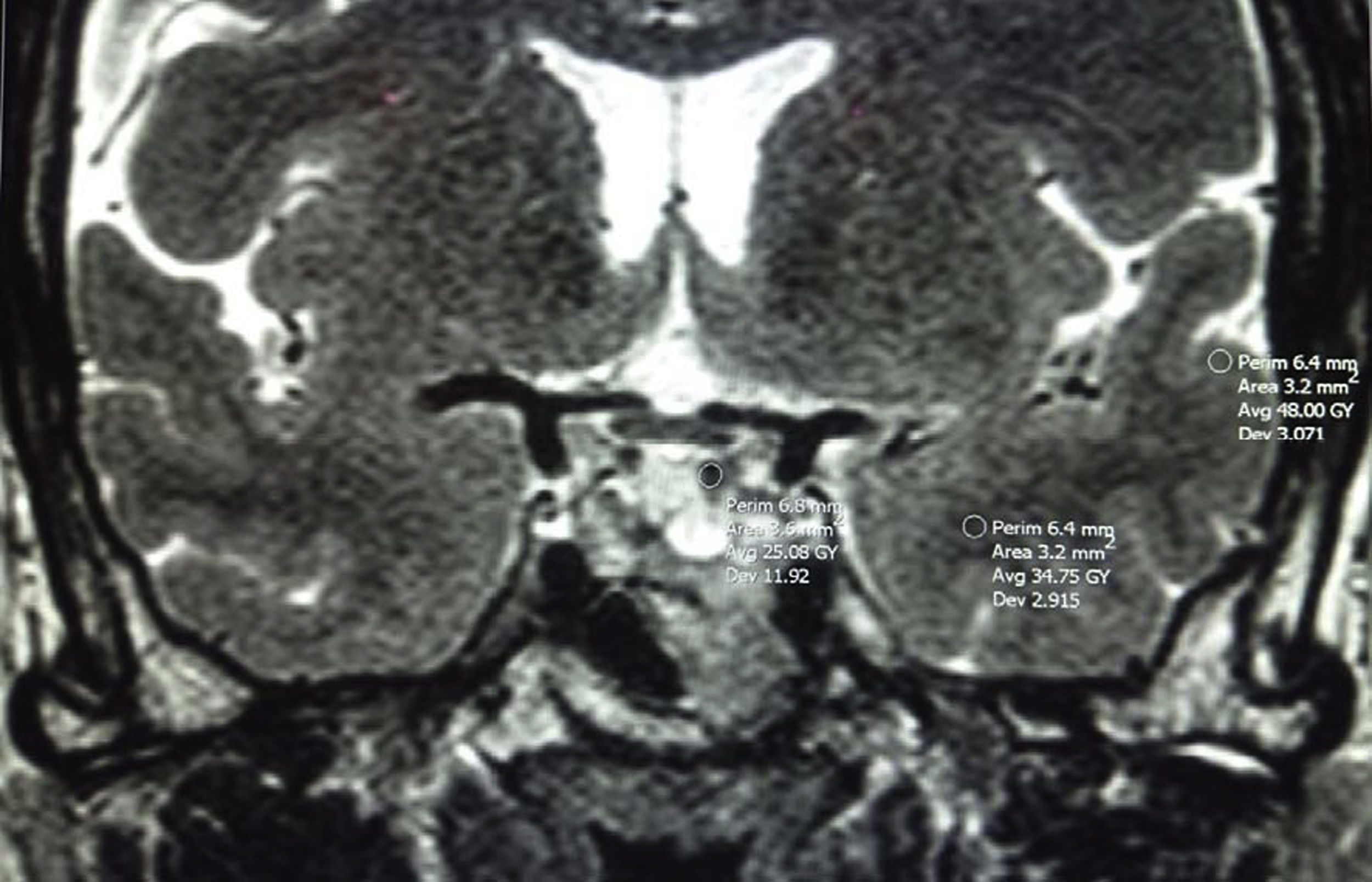
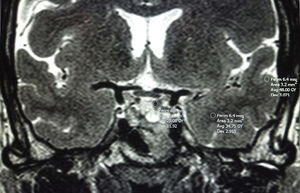
O comparándola con el lóbulo temporal adyacente (sustancia blanca y gris cerebrales [fig. 3])78,80,84. Será hipointensa cuando la señal de la RM sea igual o menor que la de la sustancia blanca y menor que la de la sustancia gris; hiperintensa cuando la señal es igual o mayor que la de la sustancia gris e isointensa cuando la señal esté entre las de sustancia blanca y gris. Potorac et al.84 proponen que como las características de los iso e hiperintensos son similares se podrían agrupar en 2 categorías; hipointensos y no hipointensos (iso e hiperintensos).
- –
Puede ser una comparación cualitativa o cuantitativa (utilizando las medidas de la región de interés (ROI) del TNEH, sustancia blanca y gris [fig. 3]). Metodológicamente se ha descrito una buena correlación entre el uso de ROI y la valoración visual directa33,84.
Otro parámetro radiológico es la homogeneidad/heterogeneidad del tumor. Los adenomas más homogéneos tienen mayores niveles de GH en el diagnóstico, pero no se correlaciona con la reducción de GH o el volumen o la invasividad del adenoma82,83.
Predicción de la respuesta al tratamiento con agonistas dopaminérgicos (AD) en la acromegaliaAunque los AD están indicados en casos con IGF-1 discretamente elevada85, no existe en la literatura evidencia de que la intensidad en T2 sea capaz de predecir la respuesta a AD. Sin embargo, se sugiere que, en caso de tumores escasamente granulados, con escasa expresión de SSTR2 e hiperintensos en T2 con IGF-1 discretamente elevada, el tratamiento a considerar serían los AD85.
Predicción de la respuesta al tratamiento con AD en los prolactinomasLos prolactinomas suelen ser hipointensos y ocasionalmente isointensos en T1, pero raramente hiperintensos (hemorragia o contenido proteico). En T2, el 80% de los prolactinomas son hiperintensos, aunque con diferencias según el sexo. La heterogeneidad en T2 es más frecuente en hombres con áreas de necrosis focal o hemorragia antigua, y la heterogeneidad se relaciona con peor respuesta a AD. En hombres jóvenes los prolactinomas suelen ser más grandes e invasivos, tienen cifras de PRL más elevadas y peor respuesta a AD, comparados con los homogéneos86.
También son más frecuentes en hombres los adenomas hipointensos en T2, posiblemente debido al depósito de material amiloide en estos tumores87-89. Se ha sugerido que la hipointensidad en T2 se relacionaría con resistencia a AD, aunque la evidencia es controvertida86-88,90.
Respecto a la respuesta al tratamiento con cabergolina, es fundamental la estandarización del informe reportando si existe reducción volumétrica del prolactinoma a los 3 meses como criterio de buena respuesta a largo plazo91.
Se ha descrito que los cambios precoces en la intensidad en T2 tras el tratamiento con cabergolina pueden predecir una respuesta favorable de regresión y casi desaparición del tumor92.
Los prolactinomas quísticos, más frecuentes en mujeres, son menos secretores de PRL86 y se han considerado clásicamente como resistentes. Sin embargo, se ha demostrado que pueden ser tratados eficazmente con AD, con normalización de PRL en 18/22 casos y reducción media de volumen del 83,5% en 20/22 casos93.
Una vez alcanzados niveles de PRL controlados, no es necesario el seguimiento rutinario con RM94,95.
Perspectivas futuras en pruebas de imagen hipofisariaNuevas técnicas en RMAdemás de la angiografía por RM, secuencia que ya se ha implementado en la práctica para la planificación quirúrgica, se han investigado otras secuencias con potencial utilidad en el estudio de los TNEH. En la tabla 4 se resume el uso experimental y potencial de dichas secuencias.
Secuencias de RM que se han aplicado en la investigación de trastornos hipofisarios
| Secuencia de RM | Características | Posibles aplicaciones |
|---|---|---|
| Angiografía por resonancia magnética | Proporciona imágenes detalladas del sistema arterial | Detección de aneurismas intraselares43Delimitación de nervios craneales en su segmento del seno cavernoso44 |
| 3D-GRE/3D-MPGRE | Mayor resolución de contraste y son una alternativa o un valor añadido al estudio dinámico. Adquisición volumétrica con vóxel de 1 mm | Detección de los microadenomas más pequeños y no visibles en la imagen convencional98-100 |
| FLAIR | Una secuencia de recuperación de inversión con un tiempo de inversión largo que elimina la señal del LCR que, por lo tanto, es más oscuro que brillante como normalmente se vería en las secuencias T2 | En la enfermedad de Cushing, el retardo de retirada del contraste de un microadenoma corticotropo puede detectarse como hiperintensidad FLAIR101 |
| DWI | Mide la difusión de moléculas de agua en tejidos biológicos; más comúnmente utilizado para detectar edema citotóxico en el contexto de isquemia/infarto cerebral agudo | Detección de apoplejía/infarto agudo de hipófisis102Distinguir lesiones quísticas intraselares/supraselares103Distinguir entre adenoma y craniofaringioma104Obtener información de consistencia para planificación quirúrgica105,106 |
| Tensor de difusión | Una extensión de DWI que analiza la difusión direccional de moléculas de agua en tejido biológico | Tractografía del nervio óptico para planificación quirúrgica y predecir la probabilidad de recuperación visual después de la cirugía transesfenoidal107-109 |
| Coeficiente de difusión aparente | Un subtipo de DWI | Su utilidad en la predicción de la consistencia del tumor para planificación quirúrgica es todavía controvertida110-117Valoración de agresividad, al determinar heterogeneidad del tumor (recurrencia y potencial proliferativo)110Diferenciar persistencia vs. tejido inflamatorio/granulación en adenomas tratados con cirugía, de forma más precoz que la imagen morfológica118 |
| Perfusión ponderada | Evalúa la perfusión tisular a nivel capilar | Evaluación de la vascularización del adenoma antes de la cirugía119Identificación de otras lesiones vasculares (p. ej., meningioma) que pueden confundirse120,121 |
| Espectroscopia de resonancia magnética | Proporciona información sobre la función metabólica mediante la medición de diferentes metabolitos (p. ej., N-acetilaspartato, compuestos de colina, creatina/fosfocreatina) | Diferenciación de adenoma de una glándula normal122Diagnóstico diferencial de lesiones supraselares123-126Predicción de la respuesta de los tumores somatotropos a la terapia con análogos de la somatostatina127 |
| Elastografía por resonancia magnética | Mide la propagación de ondas de corte a través del tejido de interés para proporcionar una estimación de la rigidez | Planificación quirúrgica estimando si es probable que un adenoma sea blando (y succionable), intermedio o firme (requiriendo legrado para la resección)128,129 |
| Precesión libre equilibrada en estado estacionario (p. ej., CISS; FIESTA-C) | Contraste de imagen determinado por la relación T2/T1 del tejido; en la práctica, con mucha agua (buen contraste entre el LCR y otras estructuras) pero también sensible al realce tras contraste | Detección mejorada de adenoma en la enfermedad de Cushing130Mejor evaluación de la invasión del seno cavernoso130Predicción de la consistencia del adenoma131Mejoras en la delimitación de los nervios ópticos y el quiasma en los grandes tumores pituitarios132 |
3D-GRE/3D-MPGRE: secuencias de eco de gradiente tridimensional/ Secuencias de eco de gradiente multiplanar tridimensional; DWI: difusión ponderada; FLAIR: recuperación de inversión de atenuación de fluidos; LCR: líquido cefalorraquídeo.
Adaptado de Bashari et al.20.
Una de las ventajas que tiene el estudio metabólico de la hipófisis es la afinidad variable por los distintos radiotrazadores. Esto permite combinar diferentes estudios para evaluar la hipófisis y guiar al clínico en las decisiones terapéuticas. La aparición de la PET/RM permite aunar la sensibilidad de las pruebas metabólicas con la resolución anatómica de la RM en un único estudio, pero estos equipos no tienen apenas disponibilidad en la clínica habitual por su novedad y precio, por lo que lo más habitual es el empleo de software de corregistro.
La combinación de FDG y 68Ga-DOTATE es de especial utilidad en pacientes con cambios estructurales importantes tras intervenciones previas66. En condiciones normales, la hipófisis no muestra avidez significativa por la FDG, pero los adenomas hipofisarios sí, incluso si son benignos. En el caso del DOTATE, tanto en tejido sano como en patológico de la hipófisis presentan avidez. La combinación de los 2estudios puede permitir diferenciar entre adenoma hipofisario (FDG+/DOTATE+) y tejido hipofisario normal (FDG–/DOTATE+)66. Si bien pueden emplearse métodos semicuantitativos (ratio FDG/DOTATE) para diferenciar entre tejido sano y patológico, no hay valores estandarizados en la actualidad.
Otro trazador útil en la valoración de los TNEH en un corregistro con metionina (MET). Permite diferenciar tumor activo de fibrosis, sangrado, quistes… Además, su mejor ratio de captación entre tumor/cerebro permite una mejor delineación de las lesiones y resolución. Presenta una mejor sensibilidad que la FDG para la detección de tumor residual, sobre todo en pacientes con microadenomas recurrentes22. No obstante, la FDG es altamente específica y, si un estudio es FDG positivo, es muy probable que ese paciente presente tejido tumoral residual96. En casos en los que la RM no es capaz de diferenciar entre tejido tumoral y cicatriz, el corregistro con estas técnicas metabólicas es muy útil. La principal limitación de la MET es su corta vida media, por lo que es preciso un ciclotrón en el propio centro. Actualmente se están desarrollando trazadores con 18F-metionina, con resultados prometedores.
FinanciaciónEl artículo fue financiado por la Fundación de la Sociedad Española de Endocrinología y Nutrición (FSEEN) gracias una beca sin restricciones de Pfizer. Pfizer no ha participado en la redacción ni en su contenido. Este documento ha recibido el aval de la SEEN y de la Sociedad Española de Neurorradiología (SENR).
Conflicto de interesesNinguno de los autores tiene conflictos de intereses con respecto al contenido de este artículo.
Los autores agradecen la colaboración de la Dra. Blanca Piedrafita, de Medical Statistics Consulting S.L., en la preparación y edición del manuscrito. Todos los autores contribuyeron en la redacción, realizaron revisión crítica de su contenido y aprobaron la versión final.