La hipercolesterolemia familiar es la causa genética más frecuente de enfermedad coronaria prematura. El retraso en el diagnóstico impide el correcto tratamiento precoz. No existen estrategias efectivas de cribado a nivel nacional que aseguren un correcto diagnóstico.
ObjetivoDeterminar la capacidad de un laboratorio centralizado para el diagnóstico de hipercolesterolemia familiar mediante la creación de un programa de salud para el cribado poblacional en la provincia de Huelva.
MétodoBúsqueda activa de pacientes con hipercolesterolemia primaria a través de las analíticas realizadas en los laboratorios de referencia con resultados de colesterol unido a lipoproteínas de baja densidad mayor de 200mg/dl y valoración en la Unidad de Lípidos de Huelva para identificar casos índice, con realización posterior de diagnóstico en cascada familiar.
ResultadosSe examinaron 37.440 analíticas con perfil lipídico. Tras el cribado fueron vistos en la Unidad de Lípidos 846 individuos, de los cuales fueron diagnosticados según criterios de la Red de Clínicas de Lípidos Holandesas como posibles 654 y probables/definitivos 192 individuos, lo que supone el 1,74% y el 0,51% de la población general examinada, respectivamente.
ConclusionesLa prevalencia puntual de hipercolesterolemia familiar en pacientes sometidos a pruebas de perfil lipídico de laboratorio fue de 1:195, mayor en comparación con la prevalencia de hipercolesterolemia familiar en la población general (basado en 1 de cada 200-300). La estrategia de búsqueda oportunista del caso índice a través de una alerta de laboratorio y cribado centralizado es una estrategia eficiente para implantar un cribado nacional para el diagnóstico de hipercolesterolemia familiar.
Familial Hypercholesterolemia is the most frequent genetic cause of premature coronary heart disease. The delay in the diagnosis prevents the correct early treatment. There are no effective screening strategies at the national level that ensure a correct diagnosis.
ObjectiveTo determine the capacity of a centralized laboratory for the diagnosis of Familial Hypercholesterolemia through the creation of a health program for population screening in the province of Huelva.
MethodActive search of patients with primary hypercholesterolemia through the blood tests carried out in the reference laboratories with results of low-density lipoprotein cholesterol greater than 200mg/dl and assessment in the Lipid Unit of Huelva to identify index cases, with subsequent family cascade screening.
Results37,440 laboratory tests with lipid profile were examined. After screening, 846 individuals were seen in the Lipid Unit, of which they were diagnosed according to criteria of the Dutch Lipid Clinic Network as possible 654 and probable/definitive 192 individuals, representing 1.74% and 0.51% of the general population examined respectively.
ConclusionsThe point prevalence of Familial Hypercholesterolemia in patients submitted to laboratory lipid profile tests was 1:195, higher compared to the prevalence of Familial Hypercholesterolemia in the general population (based on 1 in 200-300). The opportunistic search strategy of the index case through a laboratory alert and centralized screening is an efficient strategy to implement a national screening for the diagnosis of Familial Hypercholesterolemia.
La hipercolesterolemia familiar (HF) es una enfermedad genética causada por mutaciones en los genes involucrados en el metabolismo del colesterol, principalmente en el gen Low Density Lipoprotein Receptor (LDLR) (90%), y en menor medida en los genes de la apolipoproteína B100 (APOB) (5%) y de la proproteína convertasa de subtilisina/kexina 9 (PCSK9) (1%)1,2. La prevalencia de HF heterocigota (HFHe) se ha estimado en 1 cada 250-500 individuos, aunque un reciente metaanálisis estima la prevalencia de HFHe en 1 cada 311, afectando a 25 millones de personas en todo el mundo3.
Es el trastorno monogénico más común de enfermedad cardiovascular aterosclerótica prematura (Atherosclerotic Cardiovascular Disease, ASCVD). Estos pacientes presentan un riesgo promedio 3-13 veces mayor de ASCVD que la población general4, y la esperanza de vida se puede ver acortada de 20 a 30 años en comparación con los sujetos no afectos, debido a que la exposición de niveles elevados de colesterol unido a lipoproteínas de baja densidad (c-LDL) desde el nacimiento acelera la enfermedad aterosclerótica coronaria de 1 a 4 décadas5–8. El tratamiento con dieta, ejercicio y estatinas mejora el pronóstico de los pacientes con HF, disminuyendo en 10 veces el riesgo de aparición de ASCVD prematura. Por tanto, la detección precoz de la HF es fundamental.
La mayoría de los pacientes con HF se encuentran en el primer nivel asistencial, en general están sin diagnosticar y por tanto sin tratamiento o con tratamiento insuficiente. La actuación más extendida hasta ahora es la búsqueda oportunista desde Atención Primaria entre pacientes con hipercolesterolemia primaria y antecedentes personales/familiares de enfermedad cardiovascular prematura, mientras que desde la Atención Hospitalaria se buscan los casos índice (CI) entre pacientes con enfermedad cardiovascular prematura e hipercolesterolemia6. Sin embargo, esto es insuficiente para identificar la mayoría de HF. Actualmente se estima que 9 de cada 10 individuos nacidos en el mundo con HF permanecen sin diagnosticar9,10.
El análisis de los niveles de colesterol a través de laboratorio añadiendo sistemas de alerta ha sido estudiado como estrategia para establecer el diagnóstico de sospecha en algunos países11. Para utilizar estos sistemas de alerta como cribado es necesario también descartar causas secundarias y una valoración clínica que permita establecer el diagnóstico fenotípico de HF. Sin embargo, uno de los problemas es la escasa concienciación sobre esta enfermedad. No hay en España estudios publicados de estas características.
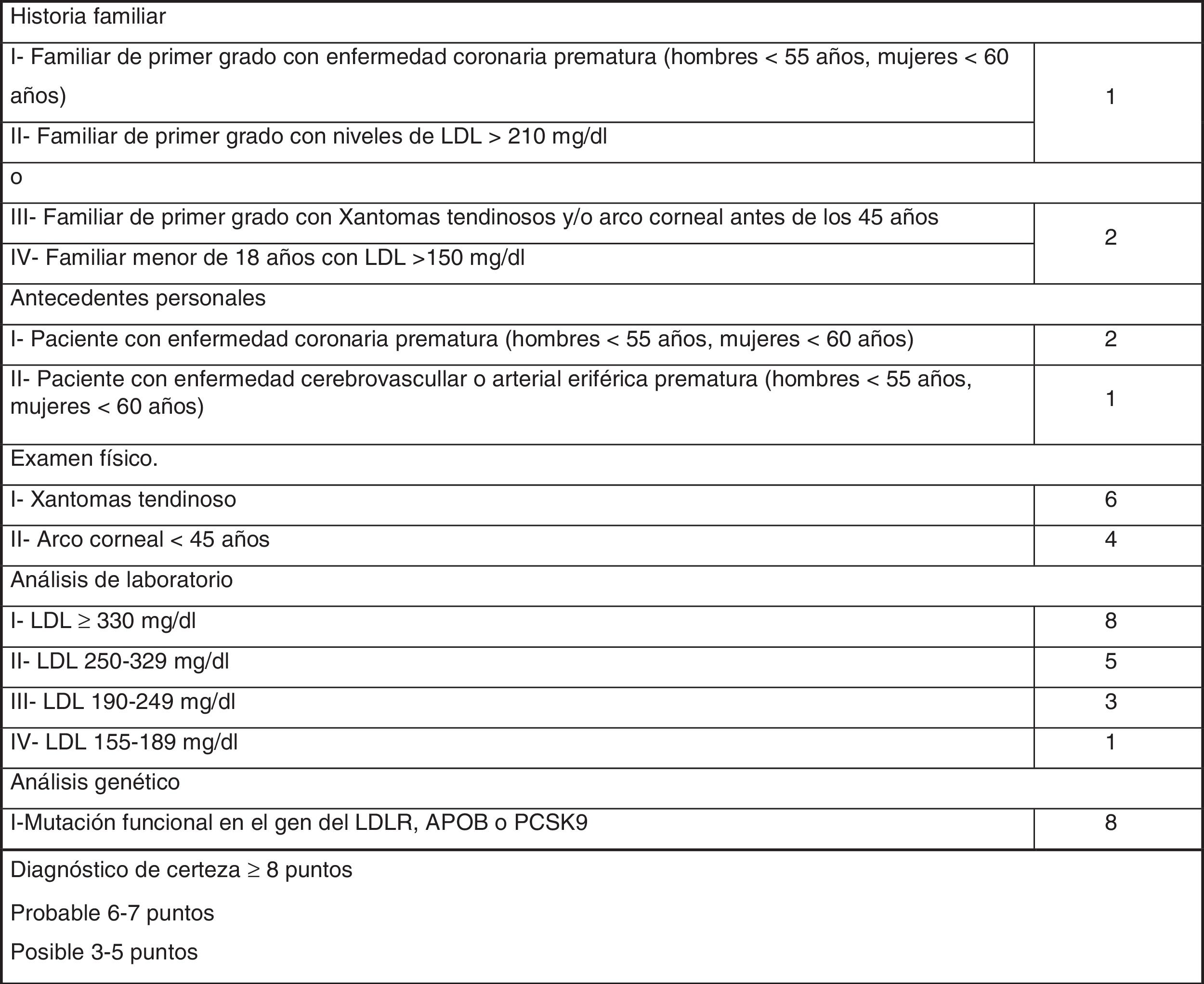
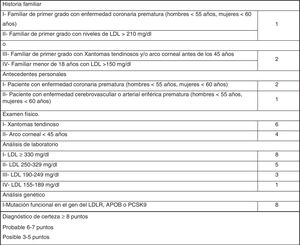
Los criterios diagnósticos fenotípicos de HF más extendidos son los Criterios de la Red de Clínicas de Lípidos Holandesas (Dutch Lipid Clinic Network, DLCN), que se deben utilizar solo en adultos >18años (fig. 1). Sobre la base del nivel de c-LDL, el examen clínico, los antecedentes familiares y las pruebas genéticas, las probabilidades de tener HF se determinan a través de los criterios DLCN: HF cierta, con una puntuación mayor o igual a 8; HF probable entre 6 y 7; HF posible entre 3 y 5; y HF poco probable inferior a 312.
Si combinamos la búsqueda activa de los CI a través del laboratorio de análisis clínicos centralizado y una valoración de los casos sospechosos a través de la historia clínica, podría lograrse un diagnóstico más amplio. Con este fin se creó el Programa de Salud DETECTA HF HUELVA. Existen algunas experiencias a través de las cuales se ha descrito que partiendo del nivel de c-LDL y tras descartar causas secundarias se alcanza un diagnóstico fenotípico de probable13.
El objetivo de este programa es estudiar la viabilidad potencial del laboratorio de un hospital como herramienta para la detección oportunista de CI, con el apoyo de la Unidad de Lípidos para establecer el diagnóstico de HF.
Material y métodoPoblación de estudioLa población de Huelva (localizada en el suroeste de España) es de 519.932 habitantes. Se revisaron todos los perfiles lipídicos realizados en los laboratorios de referencia de la provincia entre el 1 de enero de 2016 y el 31 de diciembre de 2018 y se seleccionaron todos aquellos pacientes con resultados de c-LDL mayor de 200mg/dl.
Se tomaron como criterios de exclusión: exitus, pacientes que no pertenecían a nuestra área sanitaria, menores de 18años, enfermedad neoplásica terminal, deterioro cognitivo avanzado, y aquellos pacientes que tenían datos insuficientes para una valoración completa o presentaron cifras de colesterol elevadas de forma aislada, así como aquellos con niveles de triglicéridos superiores a 200mg/dl.
Tras la identificación de estos pacientes se analizaron aquellos que presentaban datos clínicos o analíticos compatibles con hipercolesterolemia secundaria (síndrome nefrótico, enfermedad tiroidea no controlada, colestasis y embarazo) y fueron descartados.
Valoración en el programaAntes del inicio, el programa fue aprobado por el Comité de Ética Local (Referencia 0570-N-17). Los pacientes seleccionados con hipercolesterolemia primaria fueron evaluados en una primera visita por la enfermera del programa, quien realizaba un cuestionario y exploración física general que incluía valoración de presencia de xantomas y arco corneal, antecedentes familiares de hipercolesterolemia y enfermedad cardiovascular precoz, así como los factores de riesgo cardiovascular clásicos. Todos los pacientes que quisieron participar en el programa firmaron un consentimiento informado y se les realizó una analítica con perfil lipídico y bioquímico.
A todos estos pacientes se les aplicaron los criterios DLCN. Aquellos que tenían puntuación de DLCN≥6 se les solicitó estudio genético para HF. El estudio genético realizado incluía la secuenciación de los genes LDLR, APOB, PCSK9, APOE y STAP1 en el laboratorio de genética Gen Incode. Posteriormente, y con la colaboración de la Fundación de Hipercolesterolemia Familiar, se realizaron los estudios genéticos en cascada familiar durante las I Jornadas de Hipercolesterolemia Familiar de Huelva.
Análisis estadísticoLos datos cualitativos se expresan como porcentajes y los cuantitativos como media±desviación estándar (DE). Los límites de confianza se calcularon al 95% (IC). Se utilizó test de chi-cuadrado para comparación de proporciones. Para comparar medias se empleó la t de Student. La significación estadística se fijó en p<0,05.
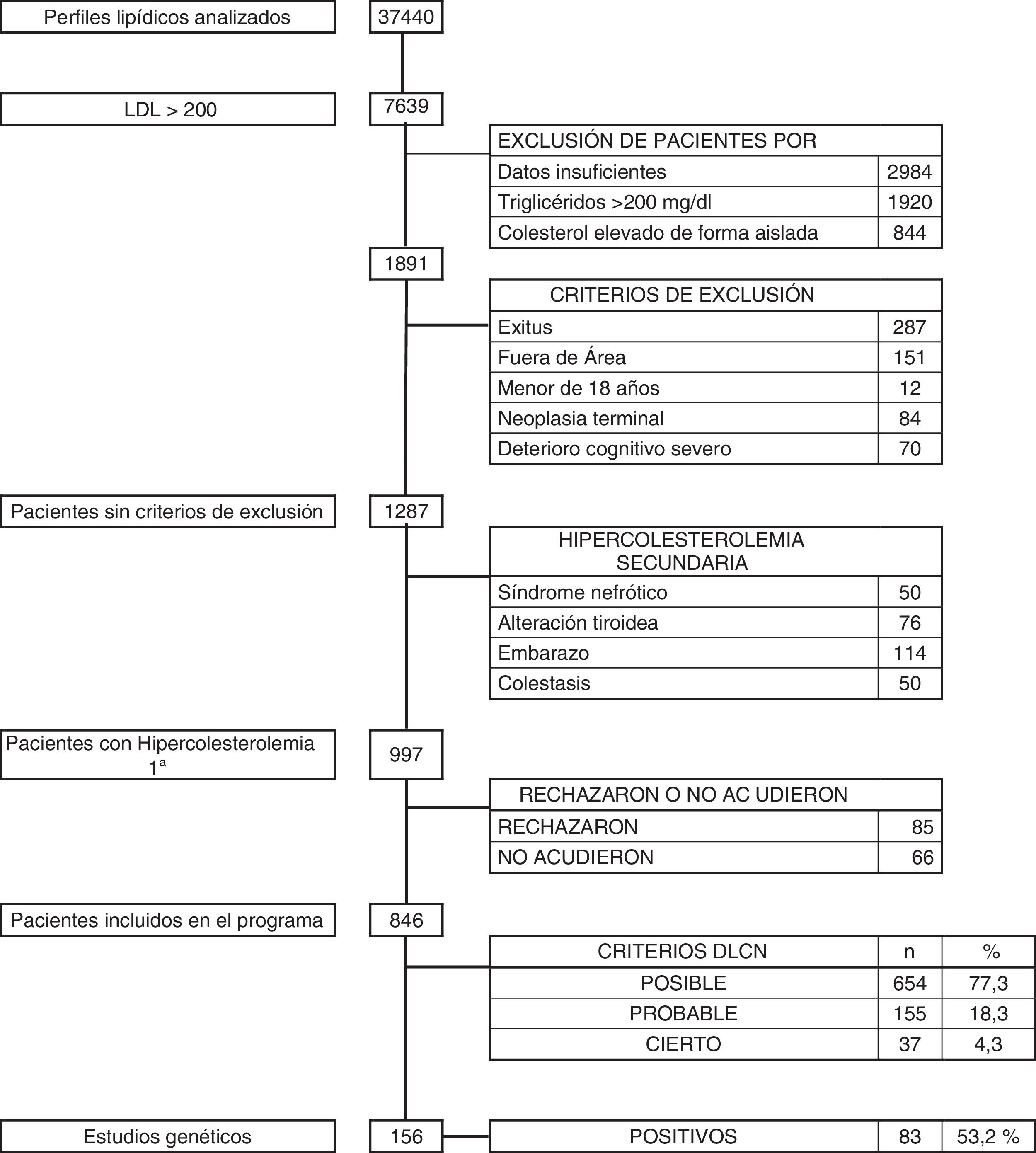
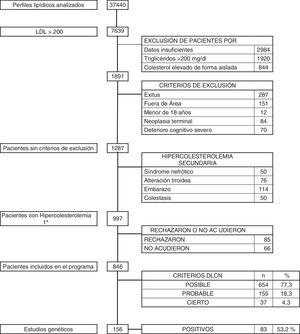
ResultadosDurante el período de 36 meses se revisaron un total de 37.440 analíticas con perfil lipídico. Hubo 1.891 sujetos con c-LDL mayor de 200mg/dl. Se descartaron aquellos pacientes que cumplían criterios de exclusión: 287 exitus, 151 pacientes que no pertenecían a nuestra área sanitaria, 12 menores de 18 años, 84 con enfermedad neoplásica terminal y 70 con deterioro cognitivo avanzado. Tras esta selección quedó un total de 1.287 pacientes, de los que se descartaron 290 (0,77%) que presentaban hipercolesterolemia secundaria: 50 por síndrome nefrótico, 114 por gestación, 76 por patología tiroidea no controlada y 50 por colestasis. Los restantes 997 pacientes (2,66%) se diagnosticaron de hipercolesterolemia primaria, y a todos ellos se les propuso participar en el programa de salud DETECTA HF HUELVA. Rechazaron participar o no acudieron a la cita 151 pacientes (fig. 2).
Finalmente se evaluaron en consulta 846 sujetos (2,25% del total inicial estudiado) con c-LDL mayor de 200mg/dl. El 1,7% (654/37.440) tuvo una puntuación DLCN de 3-5, (HF posible), el 0,41% (155/37.440) obtuvo 6-7 (HF probable), y el 0,10% (37/37.440) obtuvo una puntuación mayor o igual a 8 (HF cierta), indicando un diagnóstico posible, probable y definitivo de HF, respectivamente. La prevalencia puntual de HF fenotípica basada en criterios DLCN como probable/cierta y con un cLDL mayor de 200mg/dl se calculó en 0,51% (1 cada 195).
Durante el desarrollo del programa DETECTA se realizaron un total de 246 estudios genéticos, de los cuales 147 (53,2%) resultaron positivos. Dentro del programa DETECTA se realizaron 156 estudios genéticos a posibles CI, resultando 83 positivos (53,2%). En el grupo de DLCN mayor o igual a 8 había 37 pacientes, de los cuales se realizó estudio genético a 33 (89,12%), resultando positivo en 24 de ellos, lo que representa el 72,7% de los estudios realizados en este grupo. El grupo de DLCN 6-7 constaba de 155 pacientes, se realizó estudio genético a 103 (66,5%) resultando positivo en 51, correspondiendo al 49,5% de los estudiados. En el grupo DLCN 3-5 se realizó estudio genético a 20 individuos resultando 8 de ellos positivos, bajando la proporción de positivos al 40%. Tras la identificación de los CI por estudio genético se realizaron las I Jornadas de Hipercolesterolemia Familiar. Se seleccionó a 32 CI y se realizó estudio genético en cascada familiar a 90 individuos, resultando positivo en 62 de ellos (68,9%).
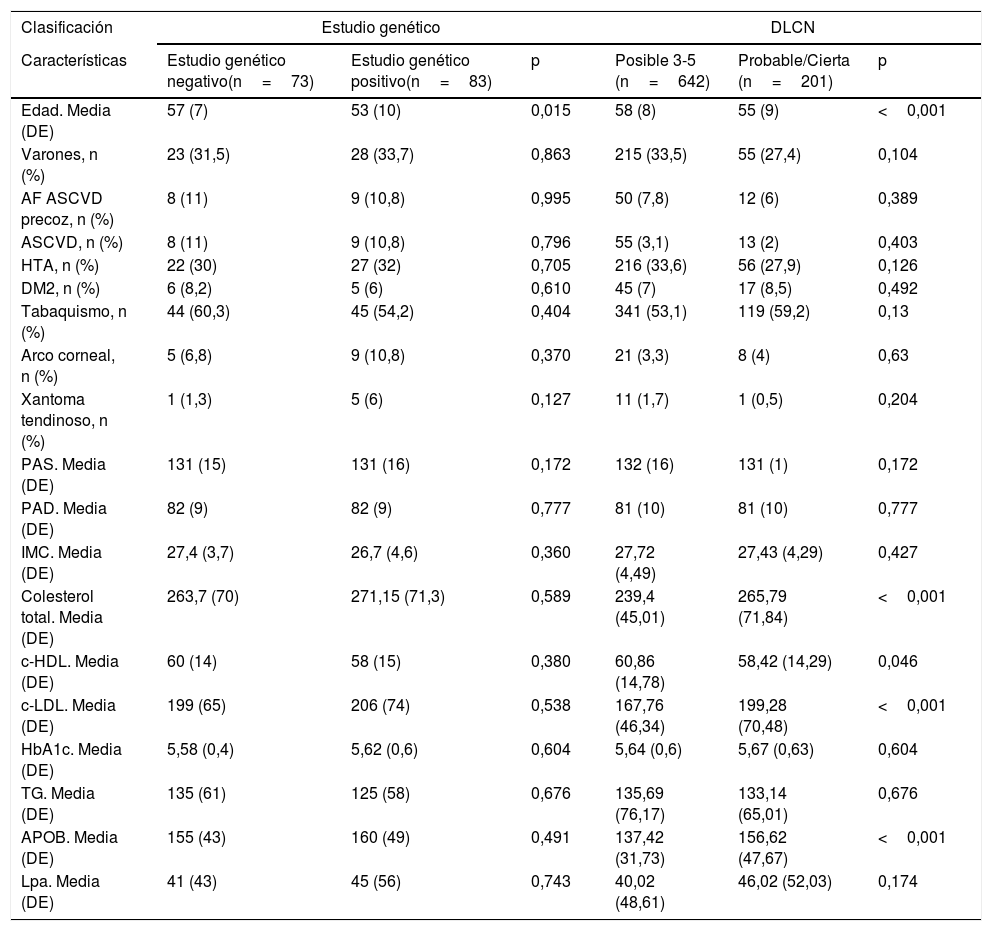
En la tabla 1 se comparan las características de los pacientes con diagnóstico genético. La edad media de los pacientes positivos fue de 53 años; el 76% eran mujeres. Ambos grupos son similares. También se comparan las características de los pacientes con diagnóstico por DLCN, presentando un incremento significativo aproximado de 30mg/dl, en el grupo de HF probable/cierto frente a HF posible, en niveles de colesterol (239,4 vs. 265,7), c-LDL (167,7 vs. 199,2) y apoB (137,4 vs. 156,6), respectivamente.
Características de los pacientes con hipercolesterolemia familiar participantes en el programa de salud DETECTA HF-HUELVA. Comparación de características de los pacientes según resultados de estudio genético y según criterios DLCN
| Clasificación | Estudio genético | DLCN | ||||
|---|---|---|---|---|---|---|
| Características | Estudio genético negativo(n=73) | Estudio genético positivo(n=83) | p | Posible 3-5 (n=642) | Probable/Cierta (n=201) | p |
| Edad. Media (DE) | 57 (7) | 53 (10) | 0,015 | 58 (8) | 55 (9) | <0,001 |
| Varones, n (%) | 23 (31,5) | 28 (33,7) | 0,863 | 215 (33,5) | 55 (27,4) | 0,104 |
| AF ASCVD precoz, n (%) | 8 (11) | 9 (10,8) | 0,995 | 50 (7,8) | 12 (6) | 0,389 |
| ASCVD, n (%) | 8 (11) | 9 (10,8) | 0,796 | 55 (3,1) | 13 (2) | 0,403 |
| HTA, n (%) | 22 (30) | 27 (32) | 0,705 | 216 (33,6) | 56 (27,9) | 0,126 |
| DM2, n (%) | 6 (8,2) | 5 (6) | 0,610 | 45 (7) | 17 (8,5) | 0,492 |
| Tabaquismo, n (%) | 44 (60,3) | 45 (54,2) | 0,404 | 341 (53,1) | 119 (59,2) | 0,13 |
| Arco corneal, n (%) | 5 (6,8) | 9 (10,8) | 0,370 | 21 (3,3) | 8 (4) | 0,63 |
| Xantoma tendinoso, n (%) | 1 (1,3) | 5 (6) | 0,127 | 11 (1,7) | 1 (0,5) | 0,204 |
| PAS. Media (DE) | 131 (15) | 131 (16) | 0,172 | 132 (16) | 131 (1) | 0,172 |
| PAD. Media (DE) | 82 (9) | 82 (9) | 0,777 | 81 (10) | 81 (10) | 0,777 |
| IMC. Media (DE) | 27,4 (3,7) | 26,7 (4,6) | 0,360 | 27,72 (4,49) | 27,43 (4,29) | 0,427 |
| Colesterol total. Media (DE) | 263,7 (70) | 271,15 (71,3) | 0,589 | 239,4 (45,01) | 265,79 (71,84) | <0,001 |
| c-HDL. Media (DE) | 60 (14) | 58 (15) | 0,380 | 60,86 (14,78) | 58,42 (14,29) | 0,046 |
| c-LDL. Media (DE) | 199 (65) | 206 (74) | 0,538 | 167,76 (46,34) | 199,28 (70,48) | <0,001 |
| HbA1c. Media (DE) | 5,58 (0,4) | 5,62 (0,6) | 0,604 | 5,64 (0,6) | 5,67 (0,63) | 0,604 |
| TG. Media (DE) | 135 (61) | 125 (58) | 0,676 | 135,69 (76,17) | 133,14 (65,01) | 0,676 |
| APOB. Media (DE) | 155 (43) | 160 (49) | 0,491 | 137,42 (31,73) | 156,62 (47,67) | <0,001 |
| Lpa. Media (DE) | 41 (43) | 45 (56) | 0,743 | 40,02 (48,61) | 46,02 (52,03) | 0,174 |
APOB: apolipoproteína B; AF ASCVD: antecedentes familiares de enfermedad cardiovascular aterosclerótica; ASCVD: enfermedad cardiovascular aterosclerótica; c-LDL: colesterol unido a lipoproteínas de baja densidad; DE: desviación estándar; DLCN: Dutch Lipid Clinic Network; DM2: diabetes mellitus tipo 2; HbA1c: hemoglobina glicosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; Lpa: lipoproteína a; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
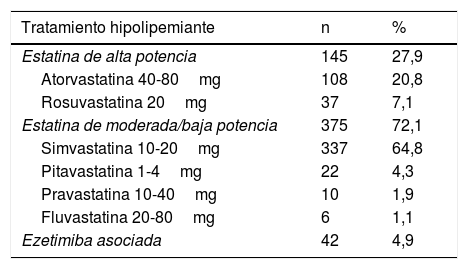
Solo 2 pacientes con diagnóstico probable de HF y c-LDL elevado tenían diagnóstico previo de HFHe. El 38,5% de los pacientes valorados en consulta no recibían tratamiento con estatinas. De los que recibían tratamiento con estatinas, el 72,1% recibían estatinas de baja o moderada potencia y solo el 4,95% realizaban tratamiento con estatina más ezetimiba (tabla 2).
Tratamiento hipolipemiante que recibían los pacientes al entrar en el programa de salud
| Tratamiento hipolipemiante | n | % |
|---|---|---|
| Estatina de alta potencia | 145 | 27,9 |
| Atorvastatina 40-80mg | 108 | 20,8 |
| Rosuvastatina 20mg | 37 | 7,1 |
| Estatina de moderada/baja potencia | 375 | 72,1 |
| Simvastatina 10-20mg | 337 | 64,8 |
| Pitavastatina 1-4mg | 22 | 4,3 |
| Pravastatina 10-40mg | 10 | 1,9 |
| Fluvastatina 20-80mg | 6 | 1,1 |
| Ezetimiba asociada | 42 | 4,9 |
Este estudio es el primero en demostrar un alto rendimiento diagnóstico con un cribado activo universal y secuencial de casos de HF. Nuestro estudio muestra una alta prevalencia, al menos 1 de cada 195 individuos dentro de la cohorte estudiada de pacientes con hipercolesterolemia grave (se considera con c-LDL>200mg/dl), y una tasa de confirmación mediante estudio genético en el grupo ≥6 de DLCN del 55,15%.
Nuestros resultados son más altos que los aproximadamente 1:311 descritos en la población general3. No obstante, no en todos los pacientes con escala DLCN de probable o cierta se identifica la mutación monogénica responsable. La discrepancia entre diagnóstico fenotípico y genotípico puede estar explicada por distintos factores: existencia de variantes o mutaciones en genes aún no reconocidos como causantes de HF; presencia de mutaciones en regiones no detectadas por las tecnologías disponibles en la actualidad como las mutaciones mapeadas en regiones intrónicas profundas o promotoras distales; efectos medioambientales sobre los genes (efectos epigenéticos); o interacciones entre diferentes genes en un mismo individuo14.
La valoración desde laboratorio centralizado tiene varias limitaciones, como la documentación subóptima de los registros médicos que conlleva el infradiagnóstico de la hipercolesterolemia secundaria. Por lo que el diagnóstico de HF precisa, además de un punto de corte de c-LDL, un filtro que permita el despistaje de hipercolesterolemia secundaria, consumo de fármacos y valoración de antecedentes familiares y personales, permitiendo la realización de un diagnóstico fenotípico más fiable, como hicimos en nuestro programa.
En nuestra provincia existían hasta la fecha pocos diagnósticos de HF y estos pacientes no tenían un seguimiento ni tratamiento adecuado, por este motivo desde la Unidad de Lípidos se crea el Programa de Salud DETECTA HF HUELVA, que tenía como objetivo la detección de CI y realización posterior de diagnóstico en cascada familiar. La muestra analizada, 37.440 individuos, representa solo el 7,2% de la población de Huelva. La detección a través de laboratorio utilizando punto de corte de c-LDL parece razonable. La diferencia principal con otros programas centralizados está en la coordinación entre laboratorio y Unidad de Lípidos para la correcta clasificación fenotípica de la HF.
La falta de diagnóstico previo de los CI detectados y, por tanto, sin tratamiento la gran mayoría de ellos pone de manifiesto que se requiere aún formación en el personal sanitario para detectar la HF. También respalda la creación de «sistemas de alerta» de rutina para todos los niveles de c-LDL mayor de 200mg/dl al médico solicitante para asegurar que se realicen más pruebas de detección de HF o se remita a Unidades de Lípidos. La detección activa mediante el programa de detección de HF desde la Unidad de Lípidos ha permitido hacer el diagnóstico de HFHe en el plazo de un año al 11,6% de nuestra población estimada con la estrategia descrita.
Los programas de cribado son esenciales para diagnosticar patologías prevalentes y cuyo diagnóstico y tratamiento correcto cambien el curso de la enfermedad. La HF cumple los criterios de la OMS para el cribado universal9. Los programas de cribado son muy variados según cada país, y en muchas ocasiones el diagnóstico de la HF se realiza tras la aparición de una enfermedad cardiovascular. Algunos de estos programas parten de la base de identificar a los pacientes con HF a partir de aquellos con evento coronario prematuro. En los registros holandeses se describió una prevalencia de enfermedad cardiovascular al diagnóstico de HF del 11%; en Reino Unido un 27% en varones y 18,7% en mujeres; en España en el registro SAFEHEART un 13%15,16; 36% en Israel8; y en Lituania un 15%17. Otros programas de cribado se realizan a partir del análisis de la población únicamente con criterios clínicos, según el país ya sea utilizando criterios Make Early Diagnosis to Prevent Early Deaths (MED-PED), DLCN o los criterios de Simon Broome, sin llegar a realizar estudios genéticos, debido probablemente a que en muchos países, estos no se encuentran financiados por su sistema sanitario8. En España no hay a nivel nacional un programa de cribado efectivo ni establecido de forma simétrica en todas las comunidades autónomas. Esto constituye una de las principales barreras para realizar una prevención eficaz de la enfermedad coronaria prematura de estos pacientes en nuestro país. Además, se dispone de estudios de coste-efectividad que apoyan el cribado en cascada familiar como una herramienta principal para su diagnóstico18–20.
Las características de los pacientes de la cohorte de nuestro programa de salud son similares a lo publicado previamente, aunque con una principal diferencia en la prevalencia de eventos cardiovasculares al diagnóstico que en nuestros pacientes es más baja de lo publicado, un 10,5%. En España aproximadamente el 15% de la población con HF ha presentado un evento cardiovascular aterosclerótico, con resultados similares en otros países como Estados Unidos, Dinamarca o Reino Unido7,21. La causa principal de esta baja prevalencia es achacable a la búsqueda activa de pacientes asintomáticos. Al identificarlos de forma precoz nos aseguramos de hacer una valoración completa y unas recomendaciones de tratamiento adecuadas, para así poder retrasar o evitar la aparición de estas complicaciones. Se ha demostrado que el uso temprano de estatinas en asociación o no a ezetimiba en HF reduce la morbimortalidad22–24. La ausencia de diagnóstico previo de HF en nuestros pacientes justifica en parte que menos del 12% recibieran tratamiento con estatinas de alta potencia. A pesar del correcto tratamiento con estatinas y/o ezetimiba, algunos pacientes no alcanzan el objetivo terapéutico con estas terapias. La introducción de nuevos tratamientos hipolipemiantes como los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9) ha demostrado potenciar el descenso de c-LDL en estos pacientes pudiendo alcanzar los objetivos recomendados4,25–27.
ConclusionesCon los resultados que publicamos, la estrategia de diagnóstico mediante alerta de laboratorio centralizado es efectiva. Haciendo un primer cribado desde Laboratorio a través de una alerta al médico que solicite la analítica, junto con la búsqueda oportunista de casos sospechosos y posterior derivación a clínicas especializadas, podría ser un programa de cribado nacional eficiente. La sensibilización y formación sobre HF de las distintas áreas médicas, y una estrecha colaboración con los médicos de Atención Primaria es fundamental para que este programa de cribado sea eficaz.
AutoríaConcepción y diseño del estudio: Manuel Jesús Romero Jiménez. Adquisición de datos: María Angustias Díaz Santos. Análisis e interpretación de datos: María Elena Mansilla Rodríguez, Elena Sánchez Ruiz-Granados. Redacción del artículo: Eva Nadiejda Gutiérrez-Cortizo. Revisión crítica de contenido intelectual: Manuel Jesús Romero-Jiménez, Francisco Javier Caballero Granados, José Luis Sánchez Ramos. Aprobación final de la versión a presentar: Eva Nadiejda Gutiérrez-Cortizo, Manuel Jesús Romero-Jiménez, Pedro Mata.
FinanciaciónPara poder llevar a cabo este programa de salud recibimos financiación de la Fundación Andaluza Beturia para la Investigación en Salud (FABIS).
Conflicto de interesesNinguno.