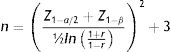La incorporación de herramientas hipolipemiantes muy potentes ha permitido conseguir reducciones significativas del riesgo cardiovascular (RCV). Si bien las proteínas portadoras de apolipoproteínaB (ApoB) son principalmente responsables de la lesión arteriosclerótica, existe un RCV residual que involucra otros factores contribuyentes. Entre estos factores se encuentra la lipoproteína(a) [Lp(a)]. Los estudios epidemiológicos iniciales, los estudios de asociación mediante análisis de genoma completo y los datos aportados por la aleatorización mendeliana demuestran que existe una relación causal entre la Lp(a) y la cardiopatía isquémica1, la enfermedad cerebrovascular isquémica y la estenosis de la válvula aórtica2-4. La duplicación del nivel de Lp(a) se asocia con un aumento de alrededor del 20% en el riesgo de infarto de miocardio, y niveles elevados de Lp(a) también están relacionados con una progresión acelerada de la estenosis aórtica4. En algún momento se postuló una relación entre los niveles elevados de Lp(a) y un aumento de riesgo de trombosis venosa, lo cual no se ha confirmado5. Sí parece existir una relación inversa entre la prevalencia de hiperlipoproteinemia(a) y la incidencia de diabetes tipo25.
La molécula de Lp(a) es el resultado de la fusión, mediante enlaces covalentes, de una partícula de ApoB con otra apolipoproteína denominada apolipoproteína(a) [Apo(a)]. Ambas son de síntesis hepática y no está aclarado si su ensamblaje se produce en el interior del hepatocito o en la superficie del mismo5. Por la estructura de su gen (LPA) se sabe que este es consecuencia del desdoblamiento ancestral del gen del plasminógeno (PLG), con el que tiene mucha homología, lo que podría permitir explicar algunas de las características fisiopatológicas de la Lp(a)4.
El PLG codifica 5 kringles (estructuras proteicas en triple bucle, de 80 a 90 aminoácidos, que recuerdan la morfología del pastel escandinavo y se numeran de I a V) y una región proteasa fibrinolítica. El LPA carece de los kringles I a III, específicos del PLG, pero codifica 10 subtipos de kringle IV (KIV-1 a KIV-10) y un dominio tipo kringle V, así como una región con actividad proteasa que es inactiva. Las moléculas de Apo(a) y, por tanto, las de Lp(a), tienen una gran variabilidad interindividual en su tamaño y densidad, porque el gen puede tener un número muy variable de copias del subtipo kringle IV-2. La heterogeneidad aumenta también por un grado variable de glicosilación interindividual2-4.
Cuanto más grande sea la molécula de Apo(a), por un mayor número de copias kringle IV-2, más bajos serán sus niveles plasmáticos. Esta heterogeneidad explica entre el 20% y el 70% de la variabilidad en la concentración de Lp(a)4. Además, los polimorfismos de un único nucleótido influyen también frecuentemente en la concentración, de forma no relacionada con el tamaño molecular (se han identificado más de 500 de estas variantes genéticas de Lp(a), algunas de las cuales tienen importantes efectos sobre su concentración)4,5.
Los niveles plasmáticos de Lp(a) surgen de la expresión codominante de 2 alelos LPA, por lo que hay dos isoformas de Lp(a) circulantes detectables, de tamaños potencialmente distintos, y los niveles que medimos corresponden a la suma de los aportados por cada alelo4. La isoforma más pequeña suele estar presente en niveles más altos. Se ha establecido un valor umbral de 50mg/dl o de 105nmol/l (superior al percentil 80) como límite con trascendencia clínica, pero incluso niveles superiores a 30mg/dl pueden aumentar el RCV2,6. La relación entre la concentración de Lp(a) y el RCV es continua, sin umbral: a mayor concentración, mayor riesgo. En comparación con los individuos con una concentración media de Lp(a) de 16nM, aquellos con niveles de 70, 115, 175, 230 y 350nmol/l tienen un aumento de 1,22, 1,40, 1,65, 1,95 y 2,72 veces en el riesgo de desarrollar enfermedad vascular arteriosclerótica (EVA), respectivamente5. Si la concentración de Lp(a) es superior a 180mg/dl (430nM), el RCV se equipara al de la hipercolesterolemia familiar (HF)7.
La distribución poblacional de la Lp(a) no es normal, por lo que los rangos de valores de los que se habla son siempre en término de «mediana» y no de «media» aritmética. Sus concentraciones elevadas son la forma más común de hiperlipidemia. Se estima que el nivel elevado de Lp(a) afecta entre el 10% y el 30% de la población mundial (aproximadamente 1,42×109 personas en todo el mundo) y al 20% de la europea2,6, y que tener valores de Lp(a) >100nmol/l (48mg/dl) representa el 5,7% de los eventos cardiovasculares6.
Dado que más del 90% de la concentración de Lp(a) está condicionada por el gen LPA5,8, sus valores son razonablemente constantes a lo largo de la vida y, por lo tanto, una determinación podría ser suficiente. Sin embargo, existe una variabilidad individual de hasta un 20%4 y, además, existen factores no genéticos que pueden modificar la concentración (procesos inflamatorios, enfermedad renal crónica, sobre todo el síndrome nefrótico, hepatopatías, entre otros)4,6,9, por lo que a veces se recomienda obtener una media de dos determinaciones de Lp(a) en diferentes momentos, en fases estables de la vida del paciente, para refinar la estratificación del RCV4,6. En cualquier caso, cuando se mida la Lp(a), debe hacerse con el paciente en una fase de estabilidad vital y sin enfermedad intercurrente.
La determinación de los niveles de Lp(a) se realiza mediante inmunoanálisis que utilizan anticuerpos específicos para la Apo(a), pero hay dos problemas que afectan a la precisión de los resultados y a su interpretación clínica. El primero se relaciona con la variabilidad del tamaño de Apo(a)4. Debido a una asociación inversa entre el número de repeticiones de kringle IV-2 y la concentración de partículas de Lp(a), los inmunoanálisis policlonales que reconocen epítopos en la Apo(a) pueden tender a subestimar las concentraciones altas de Lp(a) y a sobreestimar las concentraciones bajas si las isoformas son pequeñas o grandes, respectivamente3. Los métodos más recientes disponibles comercialmente reducen este factor de error si los calibradores del ensayo están bien validados4.
El segundo problema es que existen dos enfoques para la calibración de inmunoanálisis que dan como resultado dos unidades diferentes para informar los resultados de Lp(a). El primer análisis altamente sensible para medir Lp(a) estableció resultados en mg/dl, mientras que el estándar actual se calibró en nmol/l4. Dada la heterogeneidad existente entre el tamaño molecular de las diferentes isoformas de Lp(a), la determinación de sus niveles plasmáticos expresada en unidades de masa (mg/dl) puede no expresar de forma correcta el número de partículas que en realidad estamos midiendo. Esto puede tener especial importancia, además, si tenemos en cuenta que cada partícula de Lp(a) es 6 veces más aterogénica que cada una de ApoB10. Es por ello por lo que las recomendaciones para la medición de Lp(a) indican expresar su concentración en términos de molaridad11. La existencia de dos unidades diferentes para expresar los niveles de Lp(a) resulta confusa para los médicos y los pacientes y no existe un buen factor de conversión de mg/dl a nmol/l, o viceversa4. En cualquier caso, sea cual sea el método de determinación que se use, si está correctamente calibrado, nos permite identificar a los pacientes con más RCV por unos valores de Lp(a) más elevados3.
La medición de Lp(a) nos permite identificar individuos con sus niveles plasmáticos heredados muy altos. También permite una mejor estratificación del RCV de los pacientes y un mejor manejo de la enfermedad cardiovascular al ayudar a optimizar el tratamiento médico de los otros factores de RCV6. En determinadas situaciones en las que la Lp(a) está elevada, el valor de LDL debe corregirse con la fórmula:
Esta corrección del valor de LDL en función del de Lp(a) no se recomienda de forma rutinaria, sino en algunas situaciones: pacientes de origen subsahariano, pacientes con síndrome nefrótico o en diálisis peritoneal, o cuando el descenso de cLDL es insuficiente tras recibir tratamiento hipolipemiante12. También cuando se sospeche una HF, si la corrección del valor de LDL nos puede evitar la realización de un test diagnóstico genético13.
Dado que la herencia es autosómica, dependiente de un único gen, la detección de un caso de hiperlipoproteinemia(a) nos permite hacer un cribado en cascada e iniciar tratamientos a edades más precoces de la vida si es preciso14. En relación con el gasto que supone la medición de la Lp(a), teniendo en cuenta que solo sería necesaria su medición una vez en la vida, y la mejoría que representaría el ajuste del tratamiento de los factores de RCV en las personas que la tengan elevada, es de esperar que sea eficiente14.
La Sociedad Europea de Arteriosclerosis (EAS) y las de cardiología de otros países a título individual (p.ej., Francia, Alemania, Reino Unido, Canadá, Australia) han desarrollado guías clínicas que incluyen las recomendaciones acerca de la población en la que se debe hacer la determinación de Lp(a)5,6,15-18. Aunque todas recomiendan la medición rutinaria de Lp(a) en individuos con determinadas características (RCV elevado, HF, familiares de primer grado de personas con Lp(a) muy elevada, antecedentes familiares de enfermedad cardiovascular prematura, estenosis aórtica calcificada, o cuando el descenso de LDL no sea el esperado de acuerdo con el tratamiento establecido), no todas recomiendan la determinación universal. Esta determinación universal solo aparece en las directrices de la EAS, la Sociedad Española de Arteriosclerosis, las alemanas (asumen las de la EAS) y las canadienses5,6,15,17.
Teniendo en cuenta el RCV que comporta una Lp(a) elevada, la eficiencia de medirla y las metodologías actualmente existentes para ello, las recomendaciones de la EAS son perfectamente asumibles y aceptables para nuestro medio y las resumiríamos así5:
- •
La Lp(a) debe medirse al menos una vez en adultos para identificar a aquellos con alto RCV.
- •
También se recomienda la detección en jóvenes con antecedentes de accidente cerebrovascular isquémico o antecedentes familiares de EVA prematura o Lp(a) alta y sin otros factores de riesgo identificables.
- •
Se recomiendan pruebas en cascada para detectar Lp(a) alta en entornos de HF, antecedentes familiares de Lp(a) alta y antecedentes personales o familiares de EVA.
El autor declara no tener ningún conflicto de intereses.