El objetivo del manuscrito es describir la vía clínica de tratamiento precoz de pacientes con infección aguda por SARS-CoV-2 y evaluar los primeros resultados de su implementación.
MétodosEstudio descriptivo y retrospectivo de la implementación de una vía clínica de tratamiento en pacientes no hospitalizados (del 1 de enero al 30 de junio de 2022). Elaboración de vía clínica: sistemas de detección y derivación desde Atención Primaria, Servicio de Urgencias, especialidades médicas y sistema de detección automatizada; evaluación clínica y administración de tratamiento en hospital de día COVID-19, y seguimiento clínico posterior. Variables explicativas: demográficas, comorbilidad, estado vacunal, vías de derivación y administración de tratamiento. Variables de resultado: hospitalización y muerte a los 30 días, toxicidad grado 2-3 relacionada con el tratamiento.
ResultadosSe administró tratamiento a 262 pacientes (53,4% mujeres, mediana de edad 60 años). Criterio de indicación de tratamiento: inmunosupresión (68,3%), y la combinación de edad, estado vacunal y comorbilidad en el resto. El 47,3% de los pacientes recibieron remdesivir, el 35,9% nirmatrelvir/ritonavir, el 13,4% sotrovimab y el 2,4% tratamiento combinado, con una mediana de 4 días tras el inicio de síntomas. El 6,1% de los pacientes precisó ingreso hospitalario, el 3,8% por progresión de COVID-19. Ningún paciente falleció. El 18,7% presentaron toxicidad grado 2-3: 89,8% disgeusia y sabor metálico relacionado con nirmatrelvir/ritonavir. Siete pacientes interrumpieron tratamiento por toxicidad.
ConclusiónLa creación e implementación de una vía clínica para pacientes no hospitalizados con infección por SARS-CoV-2 es efectiva y permite la accesibilidad temprana y la equidad de los tratamientos actualmente disponibles.
The objective of this report is to describe the clinical pathway for early treatment of patients with acute SARS-CoV-2 infection and to evaluate the first results of its implementation.
MethodsThis is a descriptive and retrospective study of the implementation of a clinical pathway of treatment in outpatients (January 1 to June 30, 2022). Clinical pathway: detection and referral systems from Primary Care, Emergency services, hospital specialities and an automated detection system; clinical evaluation and treatment administration in the COVID-19 day-hospital and subsequent clinical follow-up. Explanatory variables: demographics, comorbidity, vaccination status, referral pathways and treatment administration. Outcome variables: hospitalization and death within 30 days, grade 2–3 toxicity related to treatment.
ResultsTreatment was administered to 262 patients (53.4% women, median age 60 years). The treatment indication criteria were immunosuppression (68.3%), and the combination of age, vaccination status and comorbidity in the rest; 47.3% of the patients received remdesivir, 35.9% nirmatrelvir/ritonavir, 13.4% sotrovimab and 2.4% combined treatment with a median of 4 days after symptom onset. Hospital admission was required for 6.1% of the patients, 3.8% related to COVID-19 progression. No patient died. Toxicity grade 2–3 toxicity was reported in 18.7%, 89.8% dysgeusia and metallic tasted related nirmatrelvir/ritonavir. Seven patients discontinued treatment due to toxicity.
ConclusionThe creation and implementation of a clinical pathway for non-hospitalized patients with SARS-CoV-2 infection is effective and it allows early accessibility and equity of currently available treatments.
En el inicio de la pandemia por SARS-CoV-2, los esfuerzos terapéuticos se centraron en los pacientes hospitalizados con enfermedad COVID-19 moderada-grave. Posteriormente, tras la identificación de las poblaciones con mayor riesgo de enfermedad grave y mortalidad, se han desarrollado ensayos clínicos en el tratamiento precoz de la infección, con el objetivo de prevenir su progresión a enfermedad grave. Durante 2021 se abre un nuevo campo en el tratamiento de la infección aguda por SARS-CoV-2 con el desarrollo de anticuerpos monoclonales dirigidos contra proteínas virales (bamlanivimab/etesivimab1 casirivimab/imdevimab2 y sotrovimab3), así como antivirales (remdesivir administrado en pauta de 3 días4, nirmatrelvir/ritonavir5 y molnupiravir6).
Dada la limitada disponibilidad de estos tratamientos, desde las agencias reguladoras (como los National Institutes of Health de Estados Unidos o la Agencia Española de Medicamentos y Productos Sanitarios [AEMPS]) se han establecido condiciones clínicas que priorizan poblaciones de mayor riesgo en las que estarían indicados estos tratamientos7.
En España, ante el inicio de la nueva ola epidémica producida por la variante ómicron (diciembre 2021-enero 2022), únicamente se disponía de remdesivir como tratamiento para pacientes con infección leve no hospitalizados. Posteriormente, se produjo una introducción gradual de los nuevos fármacos (regulada por la AEMPS), con la incorporación de sotrovimab (versión 2, 20 de enero de 2022) y nirmatrelvir/ritonavir o molnupiravir (versión 3, 24 marzo de 2022). En estas 2 últimas versiones se han ampliado los criterios de indicación de tratamiento (versión 4 y 5, 30 de mayo y 2 de agosto de 2022, respectivamente)8.
Desde el equipo PROA (equipo de optimización en tratamiento de las infecciones) de nuestro centro, nos propusimos en enero de 2022 optimizar el tratamiento de pacientes con infección aguda por SARS-CoV-2 con riesgo de progresión según los criterios de priorización de la AEMPS.
El objetivo de este manuscrito es describir esta vía clínica establecida y evaluar los primeros resultados de su implementación.
MétodosEstudio descriptivo de la implementación de una vía clínica de identificación, derivación y tratamiento antiviral precoz de los pacientes con infección por SARS-CoV-2 y elevado riesgo de progresión en nuestro Departamento de Salud (población de referencia: 280.000 habitantes). Evaluación de la efectividad de la vía clínica de los pacientes que recibieron tratamiento antiviral en el hospital de día COVID-19 (HD_COVID19).
Diseño e implementación de la vía clínicaSe estructuró una vía clínica basada en la identificación y derivación de pacientes, con la coordinación de la Unidad de Enfermedades Infecciosas dirigida a Atención Primaria, Urgencias y especialidades hospitalarias. Se creó el HD_COVID19 y una consulta para seguimiento clínico en las instalaciones del Hospital Polivalente de nuestro centro, con la atención de 2 facultativos de la Unidad de Enfermedades Infecciosas y 3 recursos de enfermería (uno para seguimiento telefónico), con dedicación parcial de aproximadamente el 20% de la jornada laboral.
Detección y derivación de pacientesDetección automatizada. Para facilitar la detección de pacientes con menor tiempo de evolución de la infección, se diseñó un sistema de detección automatizada de candidatos a tratamiento mediante:
- Generación de una base de datos de pacientes del Departamento de Salud (según criterios de priorización de la AEMPS): condiciones médicas o tratamiento farmacológico. Esta base de datos (base i) se elaboró a partir del sistema de asistencia ambulatoria de la Agencia de Salud y del registro del Servicio de Farmacia (tabla 1).
Fuentes de registros de pacientes inmunodeprimidos o con otras condiciones de alto riesgo para elaboración de base de datos de referencia de la vía automatizada
| Registro de Atención Primaria (SIA) |
| DiagnósticosTrasplante órgano sólidoTrasplante médula óseaEnfermedad renal crónica estadio 5 (tratamiento sustitutivo renal: hemodiálisis o diálisis peritoneal)Infección virus de la inmunodeficiencia humanaFibrosis quísticaSíndrome de Down>40 añosTratamientos: registro de prescripción de Atención PrimariaMetotrexatoLeflunomida6-mercaptopurinaAzatioprinaCiclosporina, micofenolato, tacrolimus, sirolimus y everolimus |
| Registro Servicio de Farmacia Hospitalaria y Unidad Farmacia Paciente Externos |
| Quimioterapia mielotóxica (6 últimos meses)Administración de fármacos en los últimos 6 mesesAnticuerpos monoclonales anti-CD20Inhibidores de la proliferación de células BProteínas de fusión supresoras de linfocitos TInhibidores de la interleucina 1Anticuerpos monoclonales anti-CD52Moduladores del receptor de la esfingosina-1-fosfatoInhibidores de la proteína cinasaInhibidores de la familia janus cinasa |
- Generación diaria por parte del Servicio de Microbiología de pacientes con diagnóstico de infección por SARS-CoV-2 (RT-PCR o antígeno) (base ii).
- Cruce diario de ambas bases (base i y base ii), lo que permitía la identificación de la infección por SARS-CoV-2 en pacientes candidatos a tratamiento. Revisión y evaluación por parte del equipo de la Unidad de Enfermedades Infecciosas.
Detección y derivación desde otras especialidades. Difusión de información para la derivación al HD_COVID19 de posibles candidatos a tratamiento en 3 áreas:
- Especialidades médicas hospitalarias con pacientes en riesgo de progresión: se presentaron los criterios de tratamiento y derivación en sesión clínica y mediante difusión de la información por correo electrónico.
- Servicio de Urgencias: se realizó un check-list de criterios para evaluación de tratamiento y derivación al HD_COVID19, presentada en sesiones clínicas.
- Atención Primaria: presentación de criterios de derivación en sesiones clínicas con el equipo PROA de Atención Primaria (coordinadores centros de salud, referentes PROA).
La derivación se realizó de forma telefónica o mediante interconsulta en el sistema informático hospitalario.
Se realizó actualización continua en función de los nuevos documentos de regulación emitidos por parte de la AEMPS y la Dirección General de Farmacia y Productos Sanitarios de la Consejería de Sanidad. Se realizó infografía con los criterios de tratamiento y vías de derivación disponible en la intranet y en la página web del equipo PROA.
Evaluación de pacientes en el Hospital de día COVID-19Evaluación telefónica inicial del paciente. Independientemente de la vía de derivación, se realizaba revisión de la historia clínica y tras confirmar al paciente como candidato a tratamiento, se establecía contacto telefónico para la evaluación de los síntomas con citación en HD_COVID19.
Evaluación clínica en el HD_COVID19. Con evaluación clínica directa, extracción analítica, prescripción y administración de tratamiento.
Indicación de tratamiento. Según las condiciones clínicas y los fármacos disponibles/autorizados, se estableció la indicación de tratamiento. Estos fueron: 1) sotrovimab, según los criterios establecidos por la AEMPS; 2) remdesivir como alternativa para pacientes con otros estados de inmunosupresión (no incluidos en los criterios de la AEMPS), o National Institutes of Health 1-2, y 3) nirmatrelvir/ritonavir según actualización de la AEMPS v.3 (24-3-22)8.
Administración del tratamiento. El tratamiento se administró en el HD_COVID19. De forma excepcional, en pacientes dependientes o con dificultad de traslado, se administró en el domicilio, mediante la Unidad de Hospitalización a Domicilio.
Seguimiento clínicoEn la atención de todos los pacientes se emitió un informe de asistencia dentro de la historia clínica electrónica del hospital, accesible desde Atención Primaria y desde otros centros del Departamento de Salud. Adicionalmente, en el caso de pacientes derivados por especialidades médicas hospitalarias se realizó contacto telefónico para informar del tratamiento administrado.
Se generó una aplicación informática mediante diagrama de flujos automáticos proporcionados por la plataforma AppSheet® (plataforma de desarrollo no-code de Google, LLC) para la gestión de los datos con registro de las principales variables y con generación de cita automatizada para seguimiento telefónico por parte de enfermería de la Unidad de Enfermedades Infecciosas.
Se realizó seguimiento hasta la resolución de los síntomas, con contacto final el día 30 tras la administración de tratamiento; en cada valoración telefónica se emitió un informe de seguimiento en la historia clínica electrónica.
Evaluación de resultadosEl estudio incluyó una cohorte retrospectiva de pacientes derivados y atendidos en HD_COVID19 entre el 1 de enero y el 30 de junio de 2022. Se evaluó la implantación de la vía clínica y su efectividad siguiendo el protocolo establecido.
Variables explicativasSe consideraron variables demográficas (edad, género, etnia/raza), sistema de derivación, comorbilidad asociada, criterio de indicación de tratamiento (estratificado según los criterios de priorización de la AEMPS), estado vacunal (número de dosis administradas), nivel de anticuerpos frente a proteína S cuantificados en BAU/ml (SARS-CoV-2 IgII Quant Reagent kit, Abbott) e infección por SARS-CoV-2 previa.
Variables de resultadoPara la evaluación de la vía clínica, se registró el número de sesiones clínicas. Se evaluó el número total de pacientes derivados, el medio de derivación y el porcentaje en que se indicó tratamiento.
Para la evaluación de la efectividad del tratamiento, se consideró como variable principal la hospitalización y/o muerte a los 30 días (excluyendo las producidas en las primeras 24h de inicio del tratamiento) y como variables secundarias, la presencia de toxicidad grado 2-3 y la suspensión del tratamiento.
Análisis estadísticoLas variables categóricas se expresan como frecuencias y sus porcentajes; las variables continuas, mediante medias y desviaciones estándar o medianas y rango intercuartílico (RIC), dependiendo de si siguen o no una distribución normal. La fecha índice fue la fecha de valoración en el HD_COVID19, y la fecha final del seguimiento fue a los 30 días, a menos que esté censurado. El análisis estadístico de los resultados se ha realizado con el programa IBM® SPSS® versión 22 (IBM Corp., Armonk, NY). Una p<0,050 se definió como estadísticamente significativa.
Aspectos éticosEl protocolo del estudio ha sido aprobado por el Comité Ético del hospital (PI2021) y al ser un estudio retrospectivo se ha solicitado la exención del consentimiento informado. Se ha seguido la guía de Buenas Prácticas Clínicas y la Declaración de Helsinki.
ResultadosImplementación y evaluación de la vía clínicaEn el primer mes del estudio se elaboró una vía clínica de derivación de pacientes candidatos a tratamiento con la elaboración de infografías para el Servicio de Urgencias (Fig. 1S) y Atención Primaria (Fig. 2S), con difusión en el Departamento de Salud (mediante correo electrónico, intranet corporativa y difusión en la página web www.proabalmis.com). Se realizaron 6 sesiones clínicas con el Servicio de Urgencias, 5 con especialidades médicas hospitalarias y 3 con coordinadores y referentes PROA de Atención Primaria.
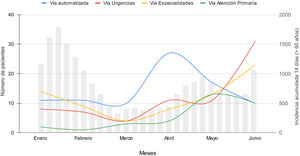
No se dispone de un registro completo de los pacientes derivados según la vía clínica durante todo el período del estudio. Se inicia el registro sistemático para la vía de detección automática desde el 1 de febrero de 2022, con tratamiento del 50,3% de los pacientes detectados (73/145), y desde el 1 de mayo para las vías de Urgencias y Atención Primaria, con tratamiento del 60,5% (72/119) y del 42,3% (33/78) de los pacientes derivados, respectivamente. La derivación desde las especialidades fue telefónica y no se dispone de registro hasta junio de 2022.
Administración y efectividad del tratamientoDesde el 1 de enero al 30 de junio de 2022 se indicó tratamiento en 262 pacientes: 53,4% mujeres, con una mediana de edad de 60 años (RIC 46-71,3). El 84,4% tenían la pauta de vacunación completa (con dosis de recuerdo). El 68,3% presentaban estados de inmunosupresión, con comorbilidades asociadas en más de la mitad de los pacientes (tabla 2).
Características de los pacientes tratados en el hospital de día COVID-19 (N=262)
| n (%) | |
|---|---|
| Aspectos demográficos | |
| Edad (años), mediana (RIC) | 60 (46-71,3) |
| Sexo, mujer | 140 (53,4) |
| Nacionalidad, no española | 18 (6,9) |
| COVID previo | 17 (6,5) |
| Vacunación (con una dosis de recuerdo) | 221 (84,4) |
| Vía de derivación | |
| Cribado automático | 86 (32,8) |
| Urgencias hospitalarias | 72 (27,5) |
| Especialidades hospitalarias | 71 (27,1) |
| Atención Primaria | 33 (12,6) |
| Antecedentes, comorbilidad | |
| Hipertensión arterial | 125 (47,7) |
| Diabetes mellitus | 42 (16,0) |
| Índice de masa corporal>30 | 49 (18,7) |
| Tabaquismo | 81 (31,0) |
| Cardiovascular | 41 (15,6) |
| Enfermedad renal crónicaa | 32 (12,2) |
| Diálisis | 22 (8,4) |
| Enfermedad cardiovascular | 13 (5,0) |
| Enfermedad pulmonar crónica | 9 (3,4) |
| Asma | 10 (3,8) |
| Inmunosupresión | 179 (68,3) |
| Criterio de tratamiento | |
| Inmunosuprimidos | |
| Inmunomoduladores biológicos | 116 (43,8) |
| Anti-CD20 | 46 (17,6) |
| Anti-TNF | 43 (16,4) |
| Otros biológicos | 11 (4,2) |
| Inhibidores de la JAK | 8 (3,1) |
| Inhibidores de la proteína cinasa | 8 (3,0) |
| Trasplante de órgano sólidob | 25 (9,5) |
| Neoplasia con QT activa | 17 (6,5) |
| Inmunomoduladores no biológicos | 12 (4,6) |
| Infección VIH<200cél. CD4/μl | 3 (1,1) |
| Inmunodeficiencia primaria | 3 (1,1) |
| Trasplante de progenitores hematopoyéticos | 1 (0,4) |
| Otras causas de inmunosupresión | 5 (1,9) |
| Otros criterios de tratamiento | |
| Edad avanzada, situación vacunal y comorbilidades | 59 (22,5) |
| Hemodiálisis | 14 (5,3) |
| No vacunados | 8 (3,1) |
| Fibrosis quística | 1 (0,4) |
| Síndrome de Down>40 años | 1 (0,4) |
| Tratamiento | |
| Días tras inicio de síntomas, mediana (RIC) | 4 (3-5) |
| Remdesivir 3 días | 124 (47,3) |
| Nirmatrelvir/ritonavir | 94 (35,9) |
| Sotrovimab | 35 (13,4) |
| Tratamientos combinados | 9 (3,4) |
| Toxicidad | 49 (18,7) |
| Digestiva | 44 (16,8) |
| Otras | 5 (1,9) |
| Interrupción del tratamiento por toxicidad | 7 (2,7) |
| Niveles de priorización según NIH | |
| 1. Inmunosuprimidos y no vacunados>75 o >65 años con factores de riesgo | 179 (68,3) |
| 2. No vacunados>65 o <65 años con factores de riesgo | 8 (3,1) |
| 3. Vacunados>75 o >65 años con factores de riesgo | 47 (17,9) |
| 4. Vacunados>65 o <65 años con factores de riesgo | 28 (10,7) |
| Evolución | |
| Hospitalización | 16 (6,1) |
| Hospitalización por COVID-19 | 10 (3,8) |
| Exitus a los 30 días | 0 (0) |
JAK: familia janus cinasa; NIH: National Institutes of Health; QT: quimioterapia; RIC: rango intercuartílico; TNF: factor de necrosis tumoral; VIH: virus de la inmunodeficiencia humana.
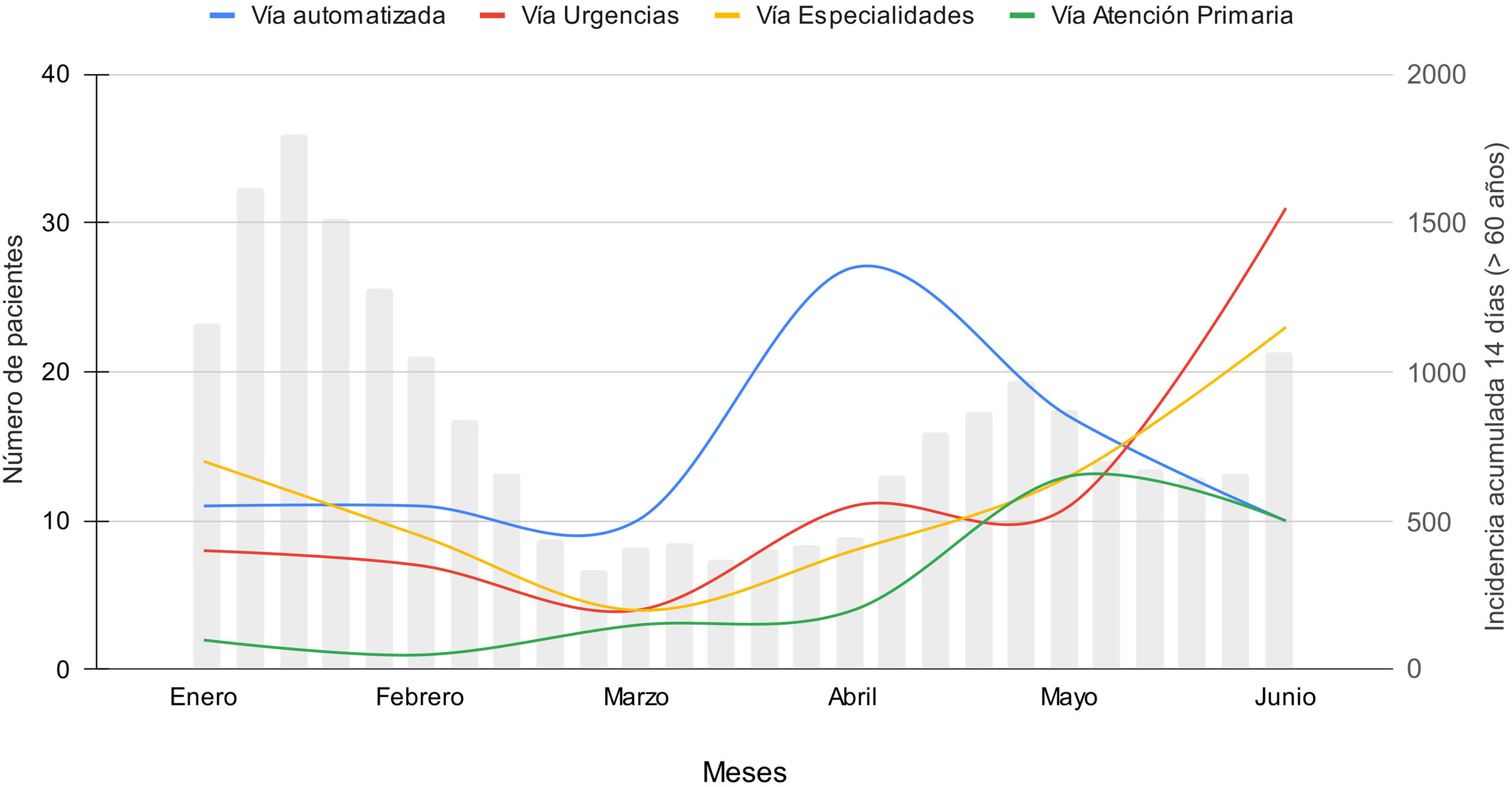
Estos pacientes fueron derivados con porcentajes similares desde el sistema de detección automática, especialidades médicas hospitalarias y Servicio de Urgencias (32,8, 27,1 y 27,5%, respectivamente) y desde Atención Primaria en un 12,6% para el período completo del estudio, pero con distribución diferente a lo largo de los 6 meses (fig. 1). La detección automatizada fue la principal vía de derivación hasta el 1 de mayo de 2022.
Se pudo contactar a todos los pacientes referidos de todas las vías de derivación; en 5 casos (1,87%) hubo rechazo por parte del paciente para la administración del tratamiento.
El criterio de indicación de tratamiento, según las condiciones de alto riesgo establecidas en criterios de la AEMPS, fue mayoritariamente la inmunosupresión (68,3%). En el resto, la combinación de edad, estado vacunal y comorbilidad (tabla 2).
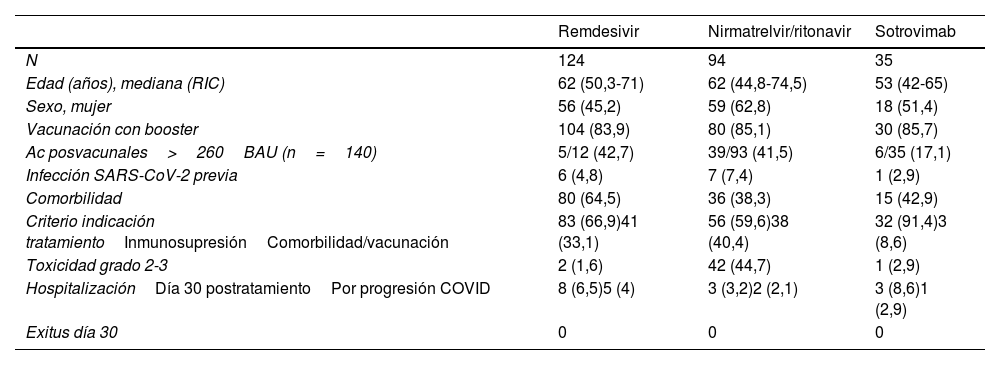
Se administró tratamiento con una mediana de 4 días (RIC 3-5) tras el inicio de los síntomas. El 47,3% de los pacientes recibieron remdesivir (n=124), el 35,9% nirmatrelvir/ritonavir (n=94), el 13,4% sotrovimab (n=25) y el 2,4% tratamiento combinado (n=9). Las características de los pacientes según el fármaco administrado se detallan en la tabla 3.
Características de los pacientes tratados en el hospital de día COVID-19 según el fármaco administrado
| Remdesivir | Nirmatrelvir/ritonavir | Sotrovimab | |
|---|---|---|---|
| N | 124 | 94 | 35 |
| Edad (años), mediana (RIC) | 62 (50,3-71) | 62 (44,8-74,5) | 53 (42-65) |
| Sexo, mujer | 56 (45,2) | 59 (62,8) | 18 (51,4) |
| Vacunación con booster | 104 (83,9) | 80 (85,1) | 30 (85,7) |
| Ac posvacunales>260BAU (n=140) | 5/12 (42,7) | 39/93 (41,5) | 6/35 (17,1) |
| Infección SARS-CoV-2 previa | 6 (4,8) | 7 (7,4) | 1 (2,9) |
| Comorbilidad | 80 (64,5) | 36 (38,3) | 15 (42,9) |
| Criterio indicación tratamientoInmunosupresiónComorbilidad/vacunación | 83 (66,9)41 (33,1) | 56 (59,6)38 (40,4) | 32 (91,4)3 (8,6) |
| Toxicidad grado 2-3 | 2 (1,6) | 42 (44,7) | 1 (2,9) |
| HospitalizaciónDía 30 postratamientoPor progresión COVID | 8 (6,5)5 (4) | 3 (3,2)2 (2,1) | 3 (8,6)1 (2,9) |
| Exitus día 30 | 0 | 0 | 0 |
Número de pacientes (%), salvo que se especifique lo contrario. Se excluyeron 9 pacientes con tratamiento combinado.
Ac: anticuerpos; RIC: rango intercuartílico.
El 6,1% de los pacientes precisó ingreso hospitalario (n=16), 10 por progresión de la infección por SARS-CoV-2 (3,8% del total), con una mediana de estancia hospitalaria de 9 días (RIC 6,8-13,3). Ningún paciente precisó ventilación no invasiva, ingreso en unidad de críticos, ni falleció.
Presentaron toxicidad 49 pacientes (18,7%), siendo grado 2 en 42 (16,03%) y grado 3 en 6 (2,29%), principalmente en el grupo tratado con nirmatrelvir/ritonavir, con disgeusia y sabor metálico en 44 pacientes (89,8%) y suspensión del tratamiento en 6 de ellos (6,1%), por grado 3 de toxicidad. Tres presentaron intolerancia gastrointestinal grado 2 por remdesivir, con suspensión del tratamiento tras la primera dosis en un paciente, y otro paciente tratado con remdesivir presentó una leve elevación de las transaminasas (AST y ALT ×2), finalizando el ciclo de tratamiento. Un paciente presentó náuseas con sotrovimab.
No hubo pérdidas de seguimiento en las valoraciones telefónicas por enfermería hasta la resolución de los síntomas y se pudo contactar a todos los pacientes o sus familiares el día 30 postratamiento para la evaluación del desenlace.
DiscusiónEn nuestra experiencia, la implementación de una vía clínica estructurada para tratamiento antiviral ambulatorio ha permitido la identificación, derivación y tratamiento efectivo de pacientes con infección por SARS-CoV-2 y riesgo elevado de progresión a enfermedad grave.
Durante los primeros meses de 2022, el tratamiento de la infección aguda por SARS-CoV-2 ha sido un reto en nuestro sistema sanitario. En primer lugar, porque su indicación ha estado determinada por criterios establecidos en las sucesivas actualizaciones de la AEMPS. En segundo, por la ausencia de alternativa oral (disponible desde el 24 de marzo de 2022), lo que supuso una dificultad para su administración. En tercero, por la necesidad de difusión de la información entre diferentes especialistas que atienden a los pacientes. En cuarto, porque debería garantizarse la adecuada indicación en función de la evidencia disponible, así como el seguimiento posterior. Y en último lugar, por el estrecho margen de tiempo tras el inicio de los síntomas que garantice la eficacia de los tratamientos, precisando circuitos asistenciales muy ágiles.
Estas dificultades nos llevaron al diseño e implementación de esta vía clínica. Esta tiene el potencial de mejorar los resultados en salud, ya que permite reducir la variabilidad, mejorar la calidad de la atención y optimizar la evolución para grupos específicos, así como favorecer la incorporación de las evidencias disponibles a la práctica clínica de forma rápida y eficiente. Pero su impacto depende de un diseño adecuado, buena coordinación y del correcto abordaje de las dificultades para su implementación9.
Los 4 principios que se proponen y que nos han servido de guía para el desarrollo de la vía clínica, según Jabbour et al.10, son: 1) elaboración de un plan de intervención estructurado y multidisciplinar; 2) debe trasladar las evidencias científicas o las guías clínicas generales a estructuras locales; 3) deben detallarse los pasos en el curso del tratamiento en forma de plan y algoritmo, y 4) debe buscar la estandarización de la atención para poblaciones específicas.
Así, durante estos 6 meses iniciales hemos evaluado alrededor de 500 pacientes, de los cuales 262 han sido tratados por condiciones de muy alto riesgo. Destacamos el sistema de detección automatizada, que identificó de forma muy precoz (<48h tras el diagnóstico) a más de un tercio de los pacientes tratados. La coordinación con las diferentes unidades asistenciales (Servicio de Urgencias, especialidades hospitalarias y Atención Primaria) y los servicios de Microbiología y Farmacia permitió su adecuada implementación y desarrollo.
En relación con las vías clínicas para pacientes no hospitalizados con infección por SARS-CoV-2, hay poca experiencia en la literatura científica. Únicamente Manciulli et al.11 describen una vía clínica de derivación de detección de pacientes de Atención Primaria a una unidad específica de tratamiento, con análisis únicamente desde el punto de vista económico. Plantean la necesidad de dedicación de especialistas en COVID-19 al tratamiento ambulatorio y el desarrollo de estructura asistencial con los «equipos territoriales de salud» o equipos de Atención Primaria.
En cuanto a la efectividad del tratamiento, aunque no disponemos de un grupo comparador que permita la evaluación adecuada de la misma, dada la población de muy alto riesgo, la ausencia de mortalidad, con un 6% de ingreso hospitalario global y un 3,8% por progresión de COVID-19 parece orientar hacia la efectividad de los tratamientos.
En poblaciones infectadas por ómicron y mayoritariamente vacunadas, como es la nuestra, la evidencia de estos tratamientos en «la vida real» es escasa y procedente de estudios observacionales y no comparables entre sí, dadas las diferentes características de las poblaciones incluidas.
La experiencia con sotrovimab se centra fundamentalmente en población con inmunodepresión severa. Martin-Blondel et al.12 describen 116 pacientes tratados con sotrovimab (edad media 55 años, 77% inmunodepresión severa, y vacunados con booster en el 77%); se describe una incidencia de hospitalización del 3% con ausencia de exitus. Solera et al.13, en una serie de 300 pacientes trasplantados de órgano sólido, 109 tratados con sotrovimab (edad media 55 años, 65% con 3 o más dosis de vacuna), se demuestra una reducción del riesgo de hospitalización (RR 0,24, 0,1-0,59). Chavarot et al.14, en otra serie de 125 trasplantados, comparan 25 que recibieron sotrovimab frente al resto no tratados, con ingreso hospitalario del 16 y 35%, y exitus de 0 y 4%, respectivamente.
En relación con nirmatrelvir/ritonavir, se han comunicado recientemente grandes estudios poblacionales. En el primero, realizado en 5.282 pacientes de bajo riesgo (58% menores de 65 años, 72% vacunados y 43% sin comorbilidad), presentaron hospitalización y/o visitas al Servicio de Urgencias menos del 1%15. En otro estudio, de 4.737 pacientes tratados con nirmatrelvir/ritonavir comparados con 175.214 no tratados (75% vacunados, población con al menos un factor de riesgo), el análisis multivariante demostró una reducción del riesgo de hospitalización del 80% para la vacunación y del 40% para el tratamiento, independientemente del estado vacunal. El impacto mayor se observó en pacientes mayores, con neoplasia o inmunosupresión asociada16. Una última serie realizada en Israel compara 3.902 pacientes tratados con 109.254 pacientes no tratados, todos con algún factor de riesgo de progresión (90% con inmunización previa), demostrando una reducción de las hospitalizaciones (HR ajustada 0,27, IC 95% 0,15-0,49) y muerte (HR ajustada 0,21, IC 95% 0,05-0,82) en mayores de 65 años17.
Según nuestro conocimiento, no existe experiencia publicada con remdesivir, más allá del ensayo clínico PINETREE4.
Estos estudios tienen una población muy diferente de la nuestra, ceñida a las condiciones de tratamiento establecidas por la AEMPS. En nuestra experiencia, así como en las series comentadas, destaca la seguridad de todos los tratamientos administrados, con mínima incidencia de interrupción de los mismos.
Nuestro estudio presenta limitaciones inherentes al diseño observacional retrospectivo unicéntrico, y al tamaño muestral limitado. No obstante, la existencia de historia clínica estandarizada y la ausencia de pérdidas en el seguimiento garantiza la calidad de la información. El estudio infraestima el porcentaje de pacientes tratados respecto a los derivados, puesto que no se realizó un registro sistemático desde el inicio de los pacientes derivados de los diferentes niveles asistenciales y tratados de forma ambulatoria, ya que la estrategia de tratamiento ambulatorio comienza en enero de 2022 durante la ola epidémica e inicialmente teníamos dificultad con el registro de pacientes y no estaban completamente estructuradas las vías de derivación, gestionándose principalmente a través de contacto telefónico. Por último, la ausencia de grupo control, puesto que no disponemos actualmente de la evolución de los pacientes no tratados, no permite una adecuada evaluación de la efectividad del tratamiento.
Como línea de futuro, planteamos la necesidad del desarrollo y optimización de nuestra vía actual en 2 áreas: la descentralización de los tratamientos con prescripción desde los diferentes niveles asistenciales, iniciada actualmente, y la necesidad de información a la población vulnerable, con elevada frecuencia de autodiagnóstico y retraso en la demanda de atención sanitaria.
ConclusiónLa creación e implementación de una vía clínica para pacientes con infección por SARS-CoV-2 es efectiva y permite la accesibilidad temprana y la equidad de los tratamientos actualmente disponibles para pacientes vulnerables candidatos a tratamiento según las recomendaciones.
El liderazgo por clínicos expertos (infectólogos) en el seno de equipos multidisciplinares en enfermedades infecciosas (PROA) permite optimizar su implementación en nuestro sistema sanitario.
NotaHPC y EM tienen el acceso completo a los datos, que podrán ser proporcionados bajo solicitud adecuada y justificada.
FinanciaciónEsta investigación no recibió ninguna subvención específica de agencias de financiación en los sectores público, comercial o sin ánimo de lucro.
AutoríaManuscrito original: HPC, SOR, JMRR, EM. Escritura, revisión y edición: HPC, SOR, JMRR, EM, PGA, JCRD, OMP, EC, PCS, GR, PL, MA, IM, VB. Conceptualización: HPC, EM, JMRR. Investigación: HPC, SOR, EM, PGA. Metodología: EM, JMR. Análisis formal: HPC, SOR, JMRR, EM. Administración del proyecto: EM.
Conflicto de interesesEM ha participado en ponencias financiadas por GILEAD, GSK y Pfizer. El resto de los autores declara no tener ningún conflicto de intereses.
Agradecemos todo el personal de enfermería del HD COVID19, Lourdes Rodríguez, y de la Unidad de Enfermedades Infecciosas, María Jesús Alcazo y María José de la Encarnación, su importante colaboración para la puesta en marcha de esta vía clínica.