Nuestro objetivo fue evaluar la variabilidad en el procesamiento de muestras osteoarticulares para el diagnóstico microbiológico entre distintos centros nacionales.
MétodosSe diseñó una encuesta online con 13 preguntas y se difundió a través de la SEIMC a los servicios de microbiología de los distintos centros.
ResultadosObtuvimos 72 respuestas. En más de la mitad de los centros, de tercer nivel, se reciben al menos 5 muestras. Aproximadamente la mitad de los centros agitan con vórtex las muestras de hueso/implante, utilizándose la sonicación sobre todo en centros de tercer nivel. Se realizan cultivos para bacterias aerobias y anaerobias durante 6-10 días de incubación, pero con diferencias en los medios de cultivo líquidos. El diagnóstico molecular se realiza en menos del 50% de los centros, siendo la PCR universal (ARNr 16S) la técnica más empleada.
ConclusionesExiste heterogeneidad fundamentalmente en el empleo de sonicación, los medios líquidos de cultivo o el diagnóstico molecular, probablemente en relación directa con los recursos y capacidades de cada centro.
Our aim was to evaluate the variability in the processing of osteoarticular samples for microbiological diagnosis between different national centers.
MethodsAn online survey with 13 questions was designed and it was sent through SEIMC to the Microbiology Departments of the different centers.
ResultsWe obtained 72 answers. In more than half of the tertiary-care centers, at least 5 samples are received. Approximately half of the centers vortex bones/implant samples. Sonication is used mostly in tertiary-care centers. Cultures for aerobic and anaerobic bacteria are performed during 6-10 days of incubation but with differences in liquid culture media. Molecular diagnosis is performed in less than 50% of the centers. Universal PCR (16S rRNA) is the most widely used technique.
ConclusionWe found heterogeneity especially in the use of sonication, liquid culture media or molecular diagnosis, probably in direct relation to the resources and capacities of each center.
El envejecimiento de la población y el aumento de los accidentes de tráfico, así como el desarrollo tecnológico han supuesto un aumento de cirugías con implantes ortopédicos. Esto supone un número no despreciable de infecciones osteoarticulares (1-2% en prótesis articulares o hasta un 15% en fracturas abiertas complejas). Estas infecciones conllevan una importante morbimortalidad, además de los costes económicos para el sistema sanitario, por ello cada vez es más importante un manejo multidisciplinar para un óptimo diagnóstico y tratamiento1.
El diagnóstico microbiológico de estas infecciones es complejo, puesto que en ocasiones los microorganismos responsables son de lento crecimiento y con implicación en la formación de biopelículas, lo que hace más difícil su aislamiento en cultivo y su identificación microbiológica. Por otro lado, las infecciones crónicas pueden aparecer de manera parcheada exigiendo tomar varias muestras de diferentes sitios anatómicos para aumentar la probabilidad de recuperación del microorganismo causal1. El cultivo continúa siendo el gold standard para el diagnóstico de las infecciones osteoarticulares2. Nuestro objetivo fue evaluar la variabilidad en el procesamiento de muestras osteoarticulares para el diagnóstico microbiológico entre distintos centros nacionales.
MétodosSe elaboró una encuesta con 13 preguntas de respuesta única y multirrespuesta (tabla 1) acerca del procesamiento microbiológico de muestras osteoarticulares. La encuesta se envió online a través de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) a todos los socios con 30 días de plazo para su contestación. Pasado ese tiempo, se cerró la encuesta y se recopilaron los resultados obtenidos. Las 2 primeras preguntas fueron referentes al nivel de asistencia y gestión del centro hospitalario y las 11 restantes con relación a la cantidad y el tipo de muestras osteoarticulares recibidas, preprocesamiento y procesamiento de las mismas para la realización del diagnóstico microbiológico. Las preguntas englobaron aspectos como la realización de tinciones rápidas, los cultivos en medios sólidos y/o líquidos, los tiempos de incubación y la realización de técnicas de diagnóstico molecular.
Preguntas de respuesta única y multirrespuesta realizadas a los centros encuestados
| Pregunta | Respuestas |
|---|---|
| 1. El hospital en el que trabaja esa: | - Público.- Público de gestión privada.- Privado. |
| 2. ¿En qué tipo de hospital trabaja?a: | - Hospital de primer nivel (hospital comarcal o de distrito, pocas especialidades, hasta 200 camas aprox.).- Hospital de segundo nivel (hospital provincial o regional, varias especialidades, hasta 800 camas aprox.).- Hospital de tercer nivel (hospital central, universitario o de referencia, muy especializado, hasta 1.500 camas aprox.). |
| 3. En una infección de prótesis articular ¿Cuántas muestras osteoarticulares suelen recibirse habitualmente por cada paciente?a: | - ≤3 muestras.- Cinco muestras.- >5 muestras.- Variable. |
| 4. En una infección de prótesis articular ¿Qué tipo de muestras se reciben?b: | - Líquido articular/sinovial.- Tejido/biopsia.- Hueso.- Material protésico/osteosíntesis. |
| 5. En cuanto al procesamiento de las muestrasb: | - Se realiza centrifugación de las muestras líquidas.- Se realiza machacado de los tejidos/biopsias.- Se realiza vorteado para hueso y/o material protésico/osteosíntesis.- Se realiza sonicación para material protésico/osteosíntesis. |
| 6. ¿Qué tinciones rápidas utiliza para el examen directo de la muestra?b: | - Tinción de Gram.- Blanco de calcoflúor.- Ziehl-Neelsen y/o auramina. |
| 7. En cuanto a la siembra en medios sólidosa: | - Se realiza la siembra en medios únicamente aerobios.- Se realiza la siembra en medios únicamente anaerobios.- Se realiza la siembra en medios aerobios y anaerobios.- No se realiza la siembra en medios sólidos, únicamente líquidos. |
| 8. En cuanto a la siembra en medios líquidosa: | - Se utiliza caldo tioglicolato o BHI.- Se utiliza inoculación directa en botella de hemocultivo.- Se utiliza caldo tioglicolato o BHI más inoculación directa en botella de hemocultivo.- No se realiza la siembra en medios líquidos, únicamente sólidos. |
| 9. ¿Qué condiciones de incubación utiliza para las muestras líquidas (líquido articular/sinovial)?a: | - 2-5 días de incubación a 37°C en CO2/anaerobiosis.- 6-10 días de incubación a 37°C en CO2/anaerobiosis.- 11-14 días de incubación a 37°C en CO2/anaerobiosis.- 15-21 días de incubación a 37°C en CO2/anaerobiosis. |
| 10. ¿Qué condiciones de incubación utiliza para las muestras sólidas (tejidos/biopsias...)?a: | - 2-5 días de incubación a 37°C en CO2/anaerobiosis.- 6-10 días de incubación a 37°C en CO2/anaerobiosis.- 11-14 días de incubación a 37°C en CO2/anaerobiosis.- 15-21 días de incubación a 37°C en CO2/anaerobiosis. |
| 11. En cuanto a la realización de técnicas diagnósticas por biología molecular (PCR)b: | - Se realizan de forma paralela al cultivo.- Se realizan cuando el cultivo es negativo.- Se realizan cuando el paciente ha recibido antibióticos antes de la obtención de las muestras.- No se realizan.- Otro. |
| 12. En caso afirmativo, ¿En qué muestras se realiza?b: | - En líquido articular/sinovial.- En tejido/biopsia.- En el líquido de vorteado o sonicado de hueso y/o material protésico/osteosíntesis.- En cualquier muestra. |
| 13. En caso afirmativo, ¿Qué tipo de técnica realiza?b: | - PCR universal (16S).- PCR casera dirigida frente a los patógenos más frecuentes.- PCR comercial dirigida frente a los patógenos más frecuentes (Filmarray®, Unyvero®...).- PCR específica frente a Staphylococcus aureus.- Otro. |
BHI: caldo infusión cerebro-corazón; CO2: dióxido de carbono; PCR: reacción en cadena de la polimerasa.
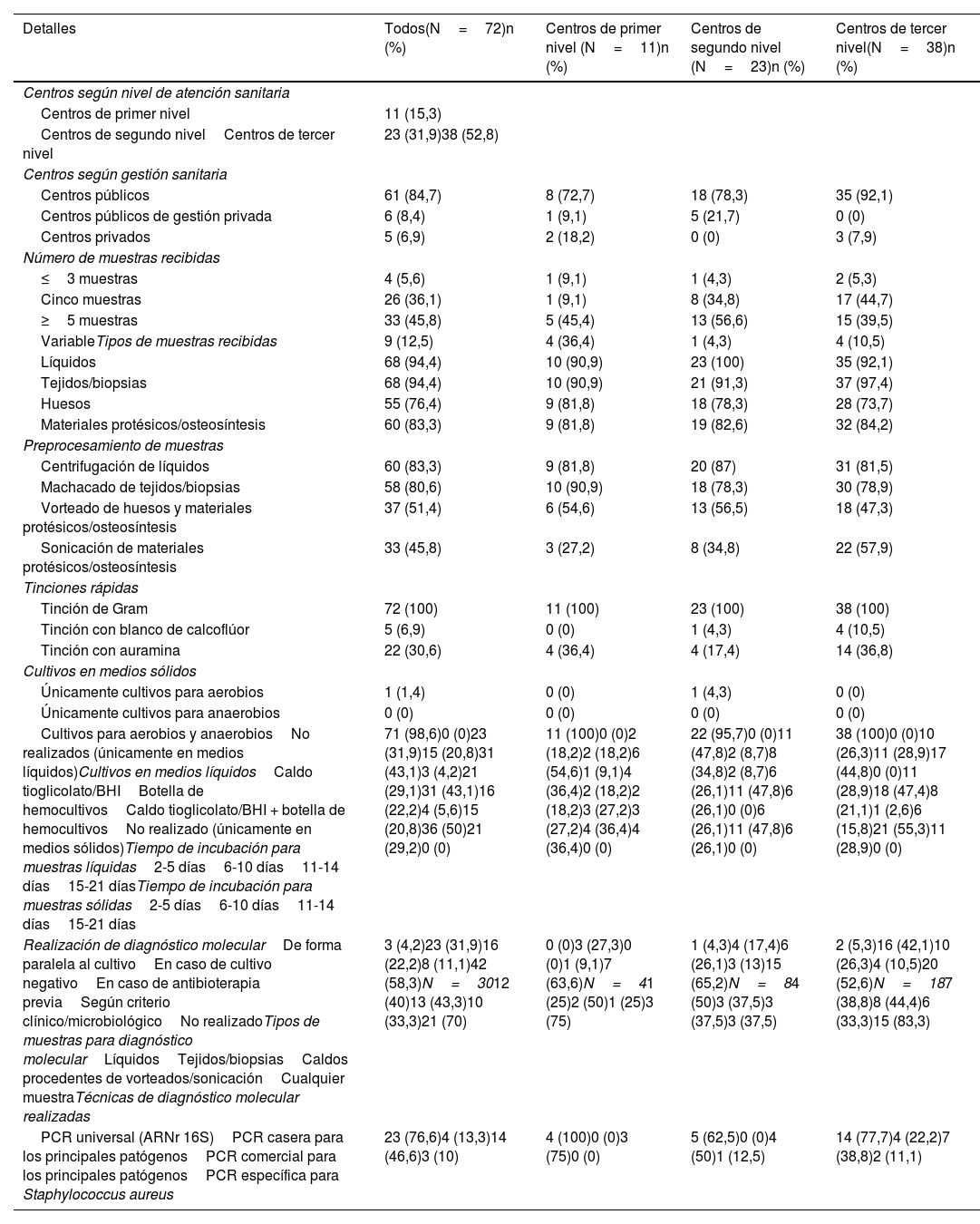
Se recopilaron un total de 72 respuestas pertenecientes a distintos centros nacionales. Según nivel de atención sanitaria, más de la mitad (52,8%) fueron centros de tercer nivel, seguidos de centros de segundo nivel (31,9%) y de primer nivel (15,3%), siendo la gran mayoría centros públicos (84,7%). Los detalles extraídos de la encuesta, totales y desglosados según el tipo de centro, se muestran en la tabla 2. En los servicios de microbiología se reciben al menos 5 muestras osteoarticulares en aproximadamente la mitad de los centros de segundo y tercer nivel, mostrándose más variabilidad en los centros de primer nivel. En todos los centros, en más del 90% de los casos se reciben muestras de líquidos y tejidos/biopsias, seguidos estrechamente de muestras óseas y materiales protésicos/osteosíntesis (73-84%). Por encima del 75% se preprocesan los líquidos y los tejidos/biopsias mediante centrifugación y machacado respectivamente, mientras que alrededor del 50% se realiza agitado con vórtex de huesos y/o materiales protésicos/osteosíntesis. La sonicación en materiales protésicos/osteosíntesis se realiza en el 45,8% de los centros, aunque en centros de tercer nivel esta técnica llega a un 57,9% de realización. La tinción de Gram se realiza en todos los casos (100%) y en todos los centros, mientras que la tinción con blanco de calcoflúor y con auramina se realiza ocasionalmente. En prácticamente la totalidad de los casos se realizan cultivos en medios sólidos para microorganismos tanto aerobios como anaerobios. En cuanto a medios de cultivo líquidos, existe variabilidad entre distintos centros, aunque la inmensa mayoría (95,8%) utiliza algún tipo de medio líquido y el 43,1% de los centros utiliza en combinación el caldo tioglicolato o caldo infusión cerebro-corazón (BHI) más la botella de hemocultivo. Los tiempos de incubación de muestras líquidas y sólidas presentan también bastante heterogeneidad, pero tiende a ser durante 6-10 días, y muy rara vez superior a los 14 días. El diagnóstico molecular sobre muestras directas se realiza hasta en un 41,7% de los centros y cuando se realiza, es sobre cualquier tipo de muestra sin diferencias claras. Mayoritariamente se realiza en caso de cultivos negativos y antibioterapia previa del paciente. De los centros que realizan biología molecular, la técnica que más se emplea es la PCR universal (ARNr 16S) desarrollada en el propio laboratorio en un 76,6% de los centros, seguida de PCR comerciales que detectan selectivamente los principales patógenos causantes de infecciones osteoarticulares. En un 26,7% combinan la utilización de la PCR universal 16S con otras técnicas como PCR caseras y comerciales frente a los patógenos osteoarticulares más frecuentes y con PCR específicas para Staphylococcus aureus.
Procesamiento microbiológico de muestras osteoarticulares en los diferentes centros encuestados
| Detalles | Todos(N=72)n (%) | Centros de primer nivel (N=11)n (%) | Centros de segundo nivel (N=23)n (%) | Centros de tercer nivel(N=38)n (%) |
|---|---|---|---|---|
| Centros según nivel de atención sanitaria | ||||
| Centros de primer nivel | 11 (15,3) | |||
| Centros de segundo nivelCentros de tercer nivel | 23 (31,9)38 (52,8) | |||
| Centros según gestión sanitaria | ||||
| Centros públicos | 61 (84,7) | 8 (72,7) | 18 (78,3) | 35 (92,1) |
| Centros públicos de gestión privada | 6 (8,4) | 1 (9,1) | 5 (21,7) | 0 (0) |
| Centros privados | 5 (6,9) | 2 (18,2) | 0 (0) | 3 (7,9) |
| Número de muestras recibidas | ||||
| ≤3 muestras | 4 (5,6) | 1 (9,1) | 1 (4,3) | 2 (5,3) |
| Cinco muestras | 26 (36,1) | 1 (9,1) | 8 (34,8) | 17 (44,7) |
| ≥5 muestras | 33 (45,8) | 5 (45,4) | 13 (56,6) | 15 (39,5) |
| VariableTipos de muestras recibidas | 9 (12,5) | 4 (36,4) | 1 (4,3) | 4 (10,5) |
| Líquidos | 68 (94,4) | 10 (90,9) | 23 (100) | 35 (92,1) |
| Tejidos/biopsias | 68 (94,4) | 10 (90,9) | 21 (91,3) | 37 (97,4) |
| Huesos | 55 (76,4) | 9 (81,8) | 18 (78,3) | 28 (73,7) |
| Materiales protésicos/osteosíntesis | 60 (83,3) | 9 (81,8) | 19 (82,6) | 32 (84,2) |
| Preprocesamiento de muestras | ||||
| Centrifugación de líquidos | 60 (83,3) | 9 (81,8) | 20 (87) | 31 (81,5) |
| Machacado de tejidos/biopsias | 58 (80,6) | 10 (90,9) | 18 (78,3) | 30 (78,9) |
| Vorteado de huesos y materiales protésicos/osteosíntesis | 37 (51,4) | 6 (54,6) | 13 (56,5) | 18 (47,3) |
| Sonicación de materiales protésicos/osteosíntesis | 33 (45,8) | 3 (27,2) | 8 (34,8) | 22 (57,9) |
| Tinciones rápidas | ||||
| Tinción de Gram | 72 (100) | 11 (100) | 23 (100) | 38 (100) |
| Tinción con blanco de calcoflúor | 5 (6,9) | 0 (0) | 1 (4,3) | 4 (10,5) |
| Tinción con auramina | 22 (30,6) | 4 (36,4) | 4 (17,4) | 14 (36,8) |
| Cultivos en medios sólidos | ||||
| Únicamente cultivos para aerobios | 1 (1,4) | 0 (0) | 1 (4,3) | 0 (0) |
| Únicamente cultivos para anaerobios | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Cultivos para aerobios y anaerobiosNo realizados (únicamente en medios líquidos)Cultivos en medios líquidosCaldo tioglicolato/BHIBotella de hemocultivosCaldo tioglicolato/BHI + botella de hemocultivosNo realizado (únicamente en medios sólidos)Tiempo de incubación para muestras líquidas2-5 días6-10 días11-14 días15-21 díasTiempo de incubación para muestras sólidas2-5 días6-10 días11-14 días15-21 días | 71 (98,6)0 (0)23 (31,9)15 (20,8)31 (43,1)3 (4,2)21 (29,1)31 (43,1)16 (22,2)4 (5,6)15 (20,8)36 (50)21 (29,2)0 (0) | 11 (100)0 (0)2 (18,2)2 (18,2)6 (54,6)1 (9,1)4 (36,4)2 (18,2)2 (18,2)3 (27,2)3 (27,2)4 (36,4)4 (36,4)0 (0) | 22 (95,7)0 (0)11 (47,8)2 (8,7)8 (34,8)2 (8,7)6 (26,1)11 (47,8)6 (26,1)0 (0)6 (26,1)11 (47,8)6 (26,1)0 (0) | 38 (100)0 (0)10 (26,3)11 (28,9)17 (44,8)0 (0)11 (28,9)18 (47,4)8 (21,1)1 (2,6)6 (15,8)21 (55,3)11 (28,9)0 (0) |
| Realización de diagnóstico molecularDe forma paralela al cultivoEn caso de cultivo negativoEn caso de antibioterapia previaSegún criterio clínico/microbiológicoNo realizadoTipos de muestras para diagnóstico molecularLíquidosTejidos/biopsiasCaldos procedentes de vorteados/sonicaciónCualquier muestraTécnicas de diagnóstico molecular realizadas | 3 (4,2)23 (31,9)16 (22,2)8 (11,1)42 (58,3)N=3012 (40)13 (43,3)10 (33,3)21 (70) | 0 (0)3 (27,3)0 (0)1 (9,1)7 (63,6)N=41 (25)2 (50)1 (25)3 (75) | 1 (4,3)4 (17,4)6 (26,1)3 (13)15 (65,2)N=84 (50)3 (37,5)3 (37,5)3 (37,5) | 2 (5,3)16 (42,1)10 (26,3)4 (10,5)20 (52,6)N=187 (38,8)8 (44,4)6 (33,3)15 (83,3) |
| PCR universal (ARNr 16S)PCR casera para los principales patógenosPCR comercial para los principales patógenosPCR específica para Staphylococcus aureus | 23 (76,6)4 (13,3)14 (46,6)3 (10) | 4 (100)0 (0)3 (75)0 (0) | 5 (62,5)0 (0)4 (50)1 (12,5) | 14 (77,7)4 (22,2)7 (38,8)2 (11,1) |
BHI: caldo infusión cerebro-corazón; PCR: reacción en cadena de la polimerasa.
Para el diagnóstico de las infecciones de prótesis articulares, los centros encuestados en nuestro trabajo obtienen la mayoría al menos 5 muestras intraoperatorias de distintas localizaciones. Atkins et al. fueron los primeros en evaluar la sensibilidad y la rentabilidad del número de muestras para el correcto diagnóstico de infección de prótesis articular. Evaluaron prospectivamente 297 artroplastias, concluyendo que la obtención de 5-6 cultivos tenían la mayor sensibilidad diagnóstica3. Las guías americanas (IDSA 2013) recomendaron obtener al menos 3 muestras intraoperatorias y de forma óptima 5-6 muestras de distintas localizaciones periprótesis4. Posteriormente Bémer et al. concluyeron que el uso de 4 muestras procesadas en 3 medios de cultivos diferentes era un método altamente sensible y económico para el diagnóstico de las infecciones osteoarticulares5, al igual que Peel et al. y el último documento de consenso International Consensus Meeting (ICM) Philadelphia 2018, que apuestan por un mínimo de 3 muestras con la utilización adicional de botellas de hemocultivo6,7.
Por otro lado, las muestras de hueso y material protésico se procesan mayoritariamente mediante agitado con vórtex, y en menor medida mediante sonicación principalmente en centros de tercer nivel, algo probablemente dependiente de los recursos hospitalarios disponibles. Existe variabilidad en la encuesta entre la combinación de medios de cultivo líquidos y sólidos, aunque homogeneidad en el tiempo de incubación. Para obtener una mayor sensibilidad se deberían combinar medios líquidos (preferiblemente botella de hemocultivo) con los sólidos6,7. Respecto a la incubación, principalmente de entre 6-10 días en los distintos centros, coincide con lo recomendado por la SEIMC, un cultivo convencional no inferior a 7 días que debe prolongarse cuando se sospechen microorganismos de lento crecimiento1.
Por último, la biología molecular se realiza en un importante porcentaje de los centros encuestados, principalmente de tercer nivel, siendo la PCR universal (ARNr 16S) la técnica más utilizada, probablemente debido a los recursos hospitalarios disponibles como se ha señalado anteriormente. De forma solapada, utilizan también la PCR universal 16S junto con las otras técnicas moleculares disponibles caseras y comerciales. En general, la PCR universal es menos sensible que el cultivo convencional, pero es de gran utilidad en cultivos negativos, pacientes con antibioterapia previa y en infecciones causadas por microorganismos exigentes de difícil crecimiento1. En casos concretos de altas sospechas se podría recurrir a PCR dirigidas frente a patógenos concretos como S. aureus, con una mayor sensibilidad que la PCR universal1,8. Independientemente de la técnica molecular utilizada, siempre debería utilizarse en combinación con el resto de metodología diagnóstica microbiológica y no microbiológica que se dispone para optimizar al máximo el diagnóstico.
En conclusión, hemos encontrado heterogeneidad en cuanto al empleo de medios líquidos, sonicación y diagnóstico molecular, estos 2 últimos en probable relación directa con los recursos del propio centro. Sería recomendable estandarizar la metodología de trabajo al máximo, en la medida de lo posible, siguiendo las recomendaciones de las guías clínicas nacionales e internacionales para minimizar esta variabilidad inter-centro y evitar así posibles discrepancias en los resultados obtenidos.
FinanciaciónLos autores declaran no haber recibido financiación alguna.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Nuestro agradecimiento a la Sociedad Española de Microbiología Clínica y Enfermedades Infecciosas (SEIMC) por su soporte y apoyo y a los participantes de los distintos centros que han respondido a esta encuesta.