La neumonía es uno de los síndromes infecciosos más frecuentes y una importante causa de mortalidad y de consumo de recursos. Constituido por expertos en Enfermedades Infecciosas y Microbiología, el Grupo OPENIN (Optimización de procesos clínicos para el diagnóstico y tratamiento de infecciones) tiene por objeto la generación de recomendaciones que contribuyan a mejorar el abordaje de procesos con elevado impacto sobre el sistema sanitario a partir de una revisión crítica de la evidencia científica disponible. La primera reunión del Grupo (celebrada en octubre de 2023) trató de contestar las siguientes preguntas: ¿cómo podemos optimizar el diagnóstico sindrómico y etiológico de la neumonía?, ¿es posible reducir de forma segura la duración del tratamiento antibiótico?, y ¿tienen un papel las estrategias de inmunomodulación basadas en el tratamiento adyuvante con esteroides, macrólidos o inmunoglobulinas? La presente revisión sintetiza la literatura revisada para aquella ocasión y ofrece una serie de recomendaciones de expertos.
Pneumonia continues to be one of the most frequent infectious syndromes and a relevant cause of death and health resources utilization. The OPENIN (Optimización de procesos clínicos para el diagnóstico y tratamiento de infecciones) Group is composed of infectious diseases specialists and microbiologists and aims at generating recommendations that can contribute to improve the approach to processes with high impact on the health system. Such task relies on a critical review of the available scientific evidence. The first group meeting (held in October 2023) aimed at answering the following questions: Can we optimize the syndromic and microbiological diagnosis of pneumonia? Is it feasible to safely shorten the length of antibiotic therapy? And, is there any role for the immunomodulatory strategies based on the adjuvant use of steroids, macrolides or immunoglobulins? The present review summarizes the literature reviewed for that meeting and offers a series of expert recommendations.
La neumonía adquirida en la comunidad (NAC) constituye la tercera causa de mortalidad en los países industrializados y la primera de naturaleza infecciosa, estimándose en tres millones las muertes anuales atribuibles a nivel mundial. La incidencia de hospitalización por NAC de etiología neumocócica en España entre 2016 y 2020 fue de 2,91 episodios por 10.000 habitantes, con una letalidad del 8,47%1. En un estudio retrospectivo realizado entre 2017 y 2019 sobre más de 7.000 casos de NAC de cualquier etiología la duración media del ingreso hospitalario fue de 5,4días, con un coste por episodio de 3.955euros2. Si bien las guías clínicas generadas por las sociedades científicas estadounidenses y europeas están ampliamente implantadas en la práctica habitual, la generación de nuevas evidencias —en ocasiones no exentas de resultados discordantes— obliga a una permanente actualización en el manejo tanto de la NAC como de la neumonía adquirida en el hospital (NAH) y la neumonía asociada a la ventilación mecánica (NAVM).
El Grupo OPENIN (Optimización de procesos clínicos para el diagnóstico y tratamiento de infecciones) ha sido constituido con el objetivo de contribuir a la mejora del abordaje clínico de procesos con elevada incidencia e impacto sobre el sistema sanitario. Nace como un foro con vocación de permanencia que pretende propiciar el intercambio de opiniones y la discusión entre expertos que resulte en la generación de recomendaciones sustentadas en la mejor evidencia científica disponible. El Grupo está formado por especialistas en enfermedades infecciosas y microbiología procedentes de diversos centros españoles y celebró su primera reunión el pasado 26 de octubre de 2023 en Madrid. Teniendo en cuenta su carga de mortalidad y el consumo asociado de recursos, la primera actividad del Grupo estuvo centrada en la neumonía en sus diversas formas: NAC (con o sin criterios de ingreso hospitalario), NAH y NAVM. Las particularidades que estas entidades adquieren en el paciente inmunodeprimido quedaron al margen de la iniciativa. Las siguientes tres preguntas habían sido previamente consensuadas por el Comité Ejecutivo del Grupo OPENIN: ¿cómo podemos optimizar su diagnóstico, tanto sindrómico como etiológico?, ¿es posible reducir la duración del tratamiento antibiótico sin que conlleve un impacto negativo sobre su pronóstico? y, finalmente, ¿tienen un papel las estrategias que tratan de modular la respuesta inmune en los pacientes con neumonía? A continuación fueron seleccionados tres ponentes para que llevaran a cabo una revisión narrativa de la literatura (basada en una búsqueda bibliográfica en PubMed sin restricciones preestablecidas en cuanto a fecha de publicación, tipo de artículo o idioma), cuyas conclusiones fueron presentadas en dicha reunión. Tras varias rondas iterativas de discusión, los ponentes y el Comité Ejecutivo elaboraron una serie de recomendaciones, que fueron circuladas entre los demás miembros en un proceso público de consulta y revisión. El presente documento fue finalmente sometido a la consideración del Grupo en su conjunto antes de su envío para publicación. Los ponentes seleccionados en esta primera edición fueron los tres primeros autores del manuscrito, en tanto que los miembros del Comité Ejecutivo ocupan las restantes autorías de cabecera. En consonancia con el carácter eminentemente deliberativo del Grupo OPENIN, este documento no contiene una revisión sistemática de la literatura ni ofrece una gradación formal de las opiniones de expertos emitidas.
¿Podemos mejorar el proceso diagnóstico en pacientes con neumonía?Neumonía adquirida en la comunidadEl diagnóstico microbiológico rápido es esencial para un tratamiento adecuado y dirigido de la NAC con criterios de ingreso. La identificación precoz del patógeno causante resulta crucial para orientar el tratamiento antibiótico, prevenir la aparición de resistencias y reducir los potenciales efectos adversos asociados al empleo de antibióticos3. Sin embargo, hasta en el 30-50% de los episodios de NAC con necesidad de ingreso no se alcanza un diagnóstico etiológico, por lo que el tratamiento con frecuencia se basa en un planteamiento exclusivamente empírico4,5. En ese sentido, los paneles moleculares sindrómicos para infecciones del tracto respiratorio inferior podrían contribuir a mejorar la tasa de diagnóstico microbiológico, si bien su efecto sobre la evolución clínica y pronóstico es aún controvertido5.
Las recomendaciones para el diagnóstico etiológico de la NAC difieren con arreglo al entorno asistencial, la gravedad clínica y la presencia de comorbilidades (con especial atención a los pacientes inmunodeprimidos). En entornos comunitarios (atención primaria, clínicas ambulatorias, servicios de urgencias e instituciones sociosanitarias), a menudo el tratamiento antibiótico es prescrito sin que exista disponibilidad de pruebas diagnósticas. En estas circunstancias, las pruebas denominadas point of care pueden ser útiles para diferenciar entre infecciones de origen bacteriano y vírico, facilitando la adecuación del uso de antimicrobianos en la comunidad3,6. Aunque las técnicas de diagnóstico rápido (TDR) basadas en la detección de antígenos (virus de la gripe, virus respiratorio sincitial [VRS] o metaneumovirus humano) tienen una elevada especificidad (superior al 80%), todas ellas presentan una sensibilidad subóptima (entre el 49% y el 84%)6. Por otro lado, la determinación de los niveles de proteínaC reactiva y de procalcitonina (PCT) ha mostrado su utilidad a la hora de reducir la prescripción de antibióticos en diversos ámbitos asistenciales, incluida la atención primaria5,7. La presencia de niveles de PCT <0,1μg/l es sugerente de infección vírica, en tanto que la probabilidad de infección bacteriana aumenta con niveles ≥0,25μl7. Sin embargo, la actualización del 2019 de las guías de práctica clínica elaboradas por la Sociedad Americana de Tórax (American Thoracic Society [ATS]) y por la Sociedad de Enfermedades Infecciosas de Estados Unidos (Infectious Diseases Society of America [IDSA]) (ATS/IDSA) no recomienda el empleo de la PCT para tomar la decisión de iniciar un tratamiento antimicrobiano en pacientes con sospecha clínica y evidencia radiológica de NAC. Se considera que la sensibilidad de los niveles de este biomarcador para el diagnóstico de infección bacteriana presenta un rango demasiado amplio (entre el 38% y el 91%) como para sustituir al criterio clínico3. Por otra parte, las más recientes (2023) guías europeas y latinoamericanas (European Respiratory Society [ERS], European Society of Intensive Care Medicine [ESICM], European Society of Clinical Microbiology and Infectious Diseases [ESCMID] y Asociación Latinoamericana de Tórax [ALAT]) contemplan la monitorización de los niveles de PCT para determinar la duración del tratamiento en la NAC grave, si bien no hace referencia a la potencial utilidad de este biomarcador a la hora de decidir su indicación8.
En pacientes que acuden a servicios de urgencias con sospecha de NAC la utilidad de las pruebas microbiológicas rutinarias para racionalizar el uso de antibióticos y mejorar los resultados clínicos no ha sido claramente establecida. La tasa de positividad de los hemocultivos en pacientes que requieren ingreso es baja (4-16%), y el rendimiento diagnóstico de los cultivos de esputo no supera el 50%9,10. Sin embargo, en adultos con NAC grave y en pacientes inmunodeprimidos se recomienda obtener hemocultivos en el momento del diagnóstico y realizar una tinción de Gram y cultivo de secreciones respiratorias antes de iniciar el tratamiento. También se debe realizar una tinción de Gram y cultivo en pacientes con sospecha de infección por Staphylococcus aureus resistente a meticilina (SARM) o Pseudomonas aeruginosa (p.ej., antecedente de infección por estos microorganismos o exposición a antibióticos en los 90 días previos)3,9,10. En este escenario, el cribado del estado de colonización en el exudado nasal mediante cultivo o reacción en cadena de la polimerasa (PCR) presenta un excelente valor predictivo negativo (VPN) para descartar la neumonía por SARM; en un metaanálisis basado en 22 estudios se estimó en el 98,1% para la NAC y las formas relacionadas con la asistencia sanitaria y en el 94,8% para la NAVM11. Las TDR basadas en la detección en orina del antígeno de Streptococcus pneumoniae y Legionella pneumophila son pruebas simples, no invasivas y rápidas que no se ven afectadas por la administración previa de antibióticos. Los datos de un metaanálisis mostraron una sensibilidad y una especificidad del 70% y del 83%, respectivamente6. Es importante destacar que la mayoría de las pruebas comerciales disponibles para L.pneumophila solo detectan las infecciones producidas por el serogrupo1, circunstancia que teóricamente limita la sensibilidad de esta TDR. Por ello, en adultos con NAC grave se recomienda realizar cultivo para Legionella spp. en medios selectivos o el uso de técnicas de amplificación de ácidos nucleicos (TAAN) a partir de muestras respiratorias3,12. A pesar de su potencial utilidad, las últimas guías de la ATS/IDSA no recomiendan de forma rutinaria la detección del antígeno en orina de Legionella excepto en el caso de NAC grave y en pacientes con riesgo epidemiológico (como en el contexto de un brote)3, o bien si el cuadro se acompaña de cefalea intensa, diarrea, hiponatremia, elevación de la creatinfosfocinasa o un viaje reciente. Las indicaciones para la detección del antígeno de S.pneumoniae en orina incluyen el ingreso en la unidad de cuidados intensivos (UCI), el fracaso del tratamiento antibiótico ambulatorio, el alcoholismo, el derrame pleural, la leucopenia, la enfermedad hepática crónica y la esplenectomía12,13.
En los últimos años, las TAAN han surgido como herramientas útiles para el diagnóstico de patógenos respiratorios, particularmente virus, pero también para la detección de bacterias de cultivo difícil y de algunos genes de resistencia. Estos ensayos moleculares deben usarse para la detección de los virus de la gripe durante la temporada de circulación en la comunidad y del coronavirus del síndrome respiratorio agudo grave 2 (SARS-CoV-2)3,5,6. En la actualidad, la amplia disponibilidad de paneles sindrómicos respiratorios comerciales ha reducido el tiempo de respuesta diagnóstica. Estas pruebas se ven poco afectadas por la administración previa de antibióticos5. Los beneficios de estos paneles incluyen su elevada sensibilidad, especificidad y VPN, sin bien no deben reemplazar a los cultivos convencionales y las pruebas de susceptibilidad antimicrobiana. Entre sus limitaciones destacan la imposibilidad para detectar agentes no incluidos en el panel, la falta de información completa acerca de la susceptibilidad a antibióticos, el coste, la ocasional ausencia de correlación con los resultados de los cultivos, y la posibilidad de resultados falsamente positivos debido a la detección de ácidos nucleicos de patógenos no viables11,12,14. Por otra parte, la rentabilidad diagnóstica comunicada en la literatura para estas plataformas moleculares debe ser tomada con cierta cautela, ya que en muchos estudios la técnica de referencia no está claramente definida ni se detalla la calidad de las muestras analizadas. De hecho, las guías de la ATS/IDSA no recomiendan la realización de TAAN para patógenos bacterianos ante la dificultad para determinar el perfil de paciente que podría beneficiarse en mayor medida de su utilización3,15.
Neumonía adquirida en hospital y neumonía asociada a la ventilación mecánicaLa NAH y la NAVM representan un problema sanitario de gran magnitud, ya que ambas entidades se asocian a una considerable morbimortalidad. La NAH es definida como aquella que se desarrolla en pacientes que llevan hospitalizados más de 48horas. Dentro del espectro de esta entidad, el término NAVM se reserva a los pacientes ingresados en la UCI y sometidos a ventilación mecánica durante al menos 48horas16. En las anteriores guías de la ATS/IDSA, publicadas en 2007, la neumonía relacionada con la asistencia sanitaria era considerada como una categoría diferenciada de la NAC, al desarrollarse en pacientes que no están hospitalizados pero en los que concurren factores de riesgo para la colonización por microorganismos multirresistentes (ingreso en los 90días previos, procedencia de una institución sociosanitaria o un centro de media estancia, o recepción de quimioterapia, hemodiálisis o antibioterapia por vía parenteral, entre otros); también se reconocía, no obstante, la existencia de cierta superposición con la NAC en ciertos perfiles de pacientes13. De hecho, las guías de 2019 recomiendan abandonar esta distinción y hacer énfasis en la epidemiología local y en la presencia de factores de riesgo bien establecidos3.
Según datos publicados en el último informe del Estudio de Prevalencia de Infecciones Asociadas a la Atención Sanitaria y Uso de Antimicrobianos en Hospitales de Atención Aguda en España (EPINE) correspondiente a 2022, P.aeruginosa (18,2%) y S.aureus (12,2%) fueron los principales patógenos identificados en la NAH, seguidos por Klebsiella pneumoniae (6,9%) y Escherichia coli (6,7%). Estos datos son similares a los aportados por el Estudio Nacional de Vigilancia de Infección Nosocomial en Servicios de Medicina Intensiva (ENVIN-HELICS), en cuya última actualización disponible, correspondiente a 2023, P.aeruginosa (20,7%) y K.pneumoniae (10,2%) figuraban igualmente como los microorganismos más frecuentemente aislados en pacientes con NAVM17. La NAH también puede ser de etiología vírica, con predominio de SARS-CoV-2, gripe, VRS y rinovirus18. Si bien tanto la precocidad como la adecuación del tratamiento antibiótico empírico son cruciales, las TDR pueden jugar un papel a la hora de establecer el diagnóstico etiológico16. Se recomienda realizar una tinción de Gram con cultivo semicuantitativo en muestras de tracto respiratorio de adecuada calidad, priorizando para ello los procedimientos no invasivos (esputo o aspirado endotraqueal en pacientes intubados) sobre los invasivos (lavado broncoalveolar [LBA] o cepillado bronquial protegido)19. También se deben obtener hemocultivos y llevar a cabo la detección del antígeno de Legionella y neumococo en orina, así como el cribado de la colonización por SARM en el frotis nasofaríngeo19. Existen varias plataformas comerciales para patógenos respiratorios (virus respiratorios, bacterias y hongos) y para los principales genes de resistencia de las bacterias más comunes. Estas TAAN se basan en la PCR, PCR de transcripción inversa y ensayos de microarrays, y permiten establecer un diagnóstico etiológico en el plazo de pocas horas20-22. Como ocurre con todas las técnicas microbiológicas, los métodos moleculares no están exentos de las limitaciones anteriormente mencionadas en términos de sensibilidad, especificidad, reproducibilidad y posibilidad de resultados discordantes entre diversas plataformas. Así, la implementación en la práctica rutinaria de estas TDR moleculares presenta desafíos y no deben ser consideradas como un reemplazo de los métodos convencionales, con los que más bien deben complementarse.
Implementación de técnicas de imagen en el diagnóstico de la neumoníaLa radiografía de tórax sigue siendo la técnica estándar en la evaluación inicial de un paciente con sospecha de neumonía3,19. Sin embargo, el uso de la tomografía computarizada (TC) ha experimentado un aumento en los últimos años. En determinados contextos clínicos o epidemiológicos la TC torácica puede ser útil para establecer el origen bacteriano, vírico o fúngico del cuadro, como ha puesto de manifiesto la pandemia producida por el SARS-CoV-223. Además, proporciona una mayor información sobre la localización y la extensión del infiltrado, su patrón y gravedad. Por otra parte, la TC juega un papel importante en el diagnóstico de las complicaciones y en el seguimiento de los cuadros producidos por patógenos multirresistentes u hongos24.
La radiografía de tórax es el método de imagen más utilizado para el diagnóstico de la NAC gracias a su disponibilidad y a su bajo coste. Sin embargo, la sensibilidad de esta técnica puede verse comprometida en algunos pacientes inmunocompetentes que presentan evidencia radiológica de neumonía en la TC pero no en la radiología convencional (como ocurre ocasionalmente en ancianos). En la NAH la radiografía de tórax también puede tener una sensibilidad subóptima en pacientes encamados con comorbilidades importantes o en pacientes críticos con criterios de gravedad. En estos escenarios la obtención de imágenes de calidad en la radiografía de tórax puede constituir un desafío en la práctica clínica. Por otra parte, la rápida aparición de los síntomas en las infecciones adquiridas en el hospital puede conllevar una demora en la demostración de los cambios radiológicos, especialmente en pacientes inmunodeprimidos25. En el contexto de la NAH, la TC torácica presenta una mayor sensibilidad y facilita la identificación temprana en pacientes gravemente enfermos. En efecto, se ha comprobado que la TC es capaz de revelar hallazgos sugestivos de neumonía hasta 5días antes que la radiografía convencional, además de permitir un diagnóstico diferencial basado en los diferentes patrones (neumonía alveolar, necrosante, intersticial, bronconeumonía, etc.). Sin embargo, la atribución etiológica basada exclusivamente en la radiología no está exenta de limitaciones, ya que un determinado microorganismo puede producir diferentes patrones radiológicos (que, por otra parte, pueden modificarse según el estado inmunológico del paciente)24.
La ecografía pulmonar ha surgido como una herramienta diagnóstica alternativa, ya que proporciona imágenes en tiempo real y evita la exposición a radiación. Varios estudios han evaluado su precisión para el diagnóstico de neumonía. Una revisión sistemática y metaanálisis, que incluyó 16 estudios con un total de 2.378 pacientes, comunicó una sensibilidad del 94% y una especificidad del 96%26. Además, la ecografía pulmonar tiene una mayor rentabilidad diagnóstica que la radiografía de tórax y una precisión comparable a la TC torácica. Una de sus ventajas es la posibilidad de realización a la cabecera del paciente y con disponibilidad inmediata de los resultados. Además, se pueden realizar exámenes seriados para monitorizar la progresión de la enfermedad y la respuesta al tratamiento. Si bien la ecografía pulmonar es altamente precisa para diagnosticar una neumonía26, presenta limitaciones a la hora de identificar la causa específica. Por otra parte, su rendimiento puede verse limitado por la constitución física del paciente o la presencia de enfermedades pulmonares subyacentes, como el enfisema, que puede dificultar la obtención de imágenes claras y precisas. Además, requiere una formación especializada, circunstancia que puede limitar la aplicación generalizada de esta herramienta diagnóstica27.
¿Podemos reducir la duración del tratamiento en pacientes con neumonía?Las infecciones del tracto respiratorio inferior, tanto de origen comunitario como nosocomial, son una de las principales causas de prescripción antibiótica en los hospitales. Por ello, estas entidades constituyen uno de los objetivos prioritarios de los programas de optimización de antibióticos (PROA), debido a que pequeñas reducciones en la duración de su tratamiento implican una gran disminución en el consumo global de antibióticos. Se revisarán a continuación las principales evidencias disponibles respecto a la eficacia y la seguridad de las estrategias de reducción en la duración del tratamiento antimicrobiano en la NAC y en la NAH, así como el valor que la monitorización de los niveles de PCT puede tener con esta finalidad. Han sido excluidas aquellas situaciones no incluidas habitualmente en los estudios clínicos y en las que hay general acuerdo a la hora de recomendar el uso de pautas prolongadas de tratamiento, como el absceso pulmonar, el empiema pleural, la neumonía necrosante, la fibrosis quística, la neumonía bacteriémica por S.aureus o los pacientes inmunodeprimidos.
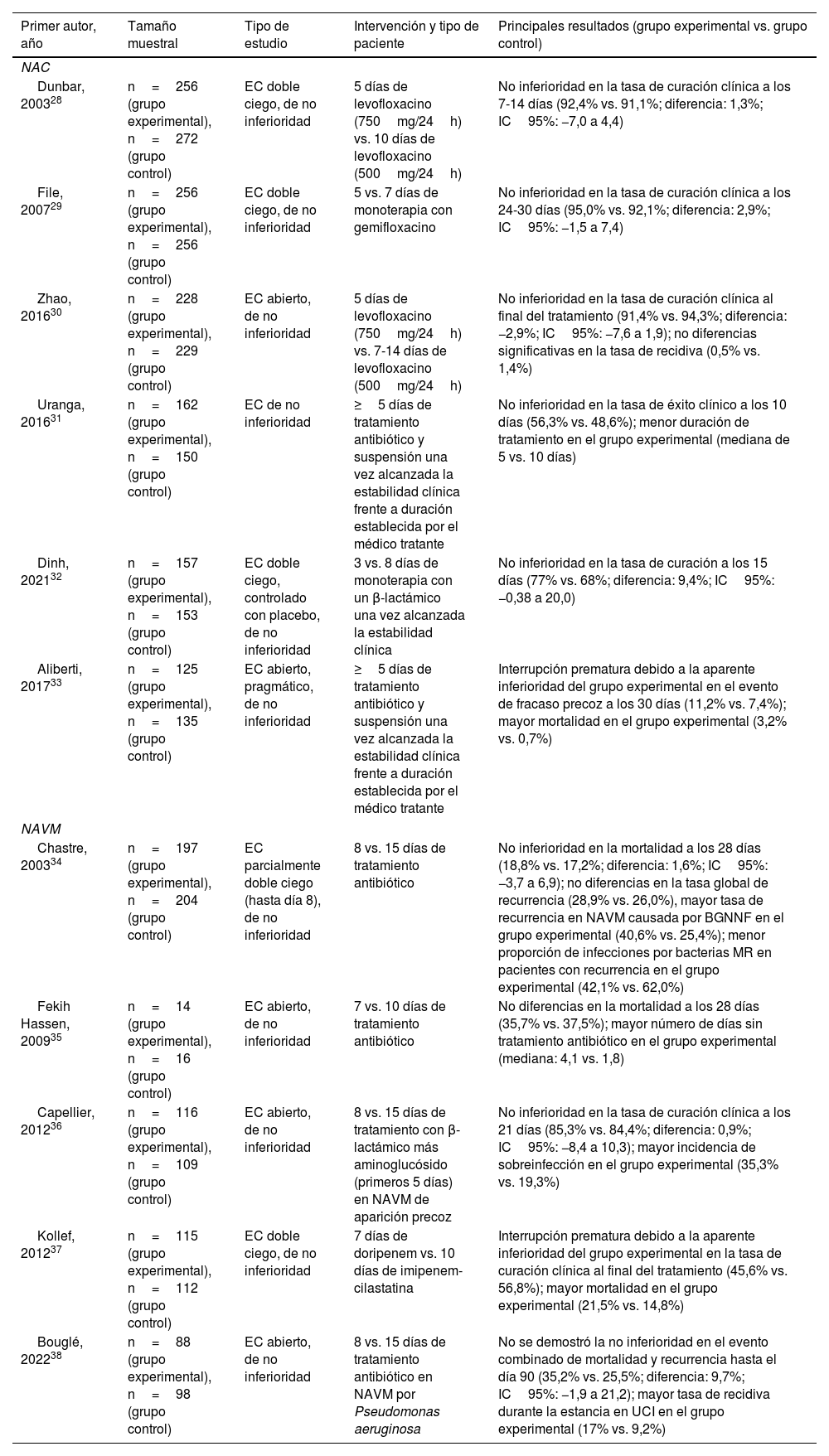
Neumonía adquirida en la comunidadEn la actualidad existen evidencias que apoyan el empleo de tratamientos de corta duración en pacientes con NAC o NAVM que alcanzan de forma precoz la situación de estabilidad clínica. Múltiples ensayos clínicos (EC) aleatorizados han evaluado la eficacia y la seguridad de la reducción de la duración del tratamiento antibiótico (tabla 1)28-38. La mayoría de ellos ha concluido que las pautas cortas (3-5días para la NAC no complicada sin criterio de ingreso en UCI y 7-8días para la NAVM) son al menos no inferiores respecto a las más prolongadas28-36, si bien también se han comunicado resultados negativos37,38. En uno de estos ensayos de no inferioridad, realizado en cuatro centros españoles, Uranga et al.31 demostraron que la administración de tratamiento antibiótico durante 5días en pacientes con NAC en los que se objetiva una temperatura ≤37,8°C durante 48horas y que no presentan más de un signo de inestabilidad es comparable a las pautas más prolongadas, con tasas de respuesta clínica comprables entre el grupo experimental y el grupo control a los 10 (56,3% y 48,6%) y los 30días (91,9% y 88,6%), respectivamente. Otro EC más reciente mostró que, en pacientes que alcanzan la estabilidad clínica al cabo de 3días de terapia con β-lactámicos, la estrategia de suspensión del tratamiento en ese momento cumplía el criterio preestablecido de no inferioridad respecto a la alternativa de mantenerlo hasta un total de 8días (tasas de curación clínica a los 15días del 68% y del 77%, respectivamente)32. De la misma forma, los resultados de algunos estudios observacionales bien diseñados y ajustados mediante scores de propensión han comunicado una eficacia comparable entre tratamientos de duración igual o inferior a 7días respecto a las pautas más prolongadas39.
Resumen de los EC más relevantes que han evaluado la eficacia y la seguridad de las pautas cortas de tratamiento antibiótico (en comparación con las pautas largas) en pacientes adultos con NAC y NAVM
| Primer autor, año | Tamaño muestral | Tipo de estudio | Intervención y tipo de paciente | Principales resultados (grupo experimental vs. grupo control) |
|---|---|---|---|---|
| NAC | ||||
| Dunbar, 200328 | n=256 (grupo experimental), n=272 (grupo control) | EC doble ciego, de no inferioridad | 5 días de levofloxacino (750mg/24h) vs. 10 días de levofloxacino (500mg/24h) | No inferioridad en la tasa de curación clínica a los 7-14 días (92,4% vs. 91,1%; diferencia: 1,3%; IC95%: −7,0 a 4,4) |
| File, 200729 | n=256 (grupo experimental), n=256 (grupo control) | EC doble ciego, de no inferioridad | 5 vs. 7 días de monoterapia con gemifloxacino | No inferioridad en la tasa de curación clínica a los 24-30 días (95,0% vs. 92,1%; diferencia: 2,9%; IC95%: −1,5 a 7,4) |
| Zhao, 201630 | n=228 (grupo experimental), n=229 (grupo control) | EC abierto, de no inferioridad | 5 días de levofloxacino (750mg/24h) vs. 7-14 días de levofloxacino (500mg/24h) | No inferioridad en la tasa de curación clínica al final del tratamiento (91,4% vs. 94,3%; diferencia: −2,9%; IC95%: −7,6 a 1,9); no diferencias significativas en la tasa de recidiva (0,5% vs. 1,4%) |
| Uranga, 201631 | n=162 (grupo experimental), n=150 (grupo control) | EC de no inferioridad | ≥5 días de tratamiento antibiótico y suspensión una vez alcanzada la estabilidad clínica frente a duración establecida por el médico tratante | No inferioridad en la tasa de éxito clínico a los 10 días (56,3% vs. 48,6%); menor duración de tratamiento en el grupo experimental (mediana de 5 vs. 10 días) |
| Dinh, 202132 | n=157 (grupo experimental), n=153 (grupo control) | EC doble ciego, controlado con placebo, de no inferioridad | 3 vs. 8 días de monoterapia con un β-lactámico una vez alcanzada la estabilidad clínica | No inferioridad en la tasa de curación a los 15 días (77% vs. 68%; diferencia: 9,4%; IC95%: −0,38 a 20,0) |
| Aliberti, 201733 | n=125 (grupo experimental), n=135 (grupo control) | EC abierto, pragmático, de no inferioridad | ≥5 días de tratamiento antibiótico y suspensión una vez alcanzada la estabilidad clínica frente a duración establecida por el médico tratante | Interrupción prematura debido a la aparente inferioridad del grupo experimental en el evento de fracaso precoz a los 30 días (11,2% vs. 7,4%); mayor mortalidad en el grupo experimental (3,2% vs. 0,7%) |
| NAVM | ||||
| Chastre, 200334 | n=197 (grupo experimental), n=204 (grupo control) | EC parcialmente doble ciego (hasta día 8), de no inferioridad | 8 vs. 15 días de tratamiento antibiótico | No inferioridad en la mortalidad a los 28 días (18,8% vs. 17,2%; diferencia: 1,6%; IC95%: −3,7 a 6,9); no diferencias en la tasa global de recurrencia (28,9% vs. 26,0%), mayor tasa de recurrencia en NAVM causada por BGNNF en el grupo experimental (40,6% vs. 25,4%); menor proporción de infecciones por bacterias MR en pacientes con recurrencia en el grupo experimental (42,1% vs. 62,0%) |
| Fekih Hassen, 200935 | n=14 (grupo experimental), n=16 (grupo control) | EC abierto, de no inferioridad | 7 vs. 10 días de tratamiento antibiótico | No diferencias en la mortalidad a los 28 días (35,7% vs. 37,5%); mayor número de días sin tratamiento antibiótico en el grupo experimental (mediana: 4,1 vs. 1,8) |
| Capellier, 201236 | n=116 (grupo experimental), n=109 (grupo control) | EC abierto, de no inferioridad | 8 vs. 15 días de tratamiento con β-lactámico más aminoglucósido (primeros 5 días) en NAVM de aparición precoz | No inferioridad en la tasa de curación clínica a los 21 días (85,3% vs. 84,4%; diferencia: 0,9%; IC95%: −8,4 a 10,3); mayor incidencia de sobreinfección en el grupo experimental (35,3% vs. 19,3%) |
| Kollef, 201237 | n=115 (grupo experimental), n=112 (grupo control) | EC doble ciego, de no inferioridad | 7 días de doripenem vs. 10 días de imipenem-cilastatina | Interrupción prematura debido a la aparente inferioridad del grupo experimental en la tasa de curación clínica al final del tratamiento (45,6% vs. 56,8%); mayor mortalidad en el grupo experimental (21,5% vs. 14,8%) |
| Bouglé, 202238 | n=88 (grupo experimental), n=98 (grupo control) | EC abierto, de no inferioridad | 8 vs. 15 días de tratamiento antibiótico en NAVM por Pseudomonas aeruginosa | No se demostró la no inferioridad en el evento combinado de mortalidad y recurrencia hasta el día 90 (35,2% vs. 25,5%; diferencia: 9,7%; IC95%: −1,9 a 21,2); mayor tasa de recidiva durante la estancia en UCI en el grupo experimental (17% vs. 9,2%) |
BGNNF: bacilos gramnegativos no fermentadores; EC: ensayo clínico; IC95%: intervalo de confianza del 95%; MR: multirresistente; NAC: neumonía adquirida en la comunidad; NAVM: neumonía asociada a ventilación mecánica; RIC: rango intercuartílico; UCI: unidad de cuidados intensivos.
La mayoría de los estudios que han comparado la eficacia de pautas cortas de tratamiento frente a duraciones prolongadas en la NAH se han centrado en el contexto específico de la NAVM. Hace dos décadas, Chastre et al.34 compararon en el seno de un EC una estrategia de 8días de tratamiento frente a 15días en pacientes con NAVM, sin encontrar diferencias significativas en la mortalidad a los 28días entre ambos brazos. Al analizar los subgrupos de pacientes con NAVM producida por bacilos gramnegativos no fermentadores (BGNNF) y SARM tampoco se observaron diferencias en las tasas de mortalidad. Es importante recordar, a la hora de interpretar estos resultados, que en este ensayo solo fueron aleatorizados aquellos pacientes que habían recibido un tratamiento empírico adecuado. Un metaanálisis40 y una revisión sistemática41 —con inclusión de 4 y 6EC que comparaban pautas cortas (7-8días) frente a otras más prolongadas (10-15días), respectivamente— tampoco demostraron diferencias en términos de mortalidad. Por otra parte, se puso de manifiesto una mayor incidencia de infecciones por microorganismos resistentes asociada a los tratamientos más prolongados41.
Esta evidencia ha motivado que tanto las guías europeas (ERS/ESICM/ESCMID) como las de la ATS/IDSA recomienden en sus últimas actualizaciones una duración del tratamiento para la NAH y la NAVM de 7-8días19,42.
Duración del tratamiento en la neumonía por Pseudomonas aeruginosaTradicionalmente el tratamiento en la neumonía causada por P.aeruginosa ha sido más prolongado que el de otras etiologías. Por ejemplo, en un EC comparativo entre meropenem y ceftolozano/tazobactam en NAH y NAVM y en el que la duración de la pauta era decidida por el clínico responsable, la mediana de días de tratamiento fue de 7,7 en los casos producidos por Enterobacterales en comparación con los más de 12días administrados en los pacientes con infección por P. aeruginosa43. Las pautas más prolongadas en esta indicación han sido clásicamente justificadas por los resultados derivados de un estudio de sensibilidad en el EC de Chastre et al.34 centrado en uno de sus objetivos secundarios, en el que los pacientes con NAVM por BGNNF asignados al brazo de 8días presentaron un mayor riesgo de sobreinfección y recidiva (40,6% frente al 25,4% en el grupo de control). Sin embargo, se ha propuesto que estos resultados podrían explicarse por un posible sesgo de evaluación, al existir un mayor tiempo de evolución desde la finalización del tratamiento hasta la evaluación de la recurrencia en el grupo de tratamiento corto. Por otro lado, la naturaleza abierta del ensayo conllevaba una mayor probabilidad de error de interpretación de los síntomas atribuidos a recurrencia en los pacientes que recibieron pautas más cortas44. De hecho, ni las guías de la ERS/ESICM/ESCMID ni las de la ATS/IDSA establecen pautas diferenciadas para los casos producidos por P.aeruginosa en su recomendación general de limitar la duración del tratamiento de la NAH y la NAVM a 7-8días19,42. No obstante, algunos autores han criticado estas recomendaciones al aducir una serie de inconsistencias metodológicas en el metaanálisis en el que se fundamentan las guías ATS/IDSA; partiendo de los mismos EC, Albin et al.45 extraen una conclusión alternativa de esta evidencia en la que los cursos cortos de tratamiento se asociarían a un mayor riesgo de recurrencia de la NAVM por BGNNF. La respuesta proporcionada por los autores de las guías sugiere que esta cuestión no ha sido aún definitivamente resuelta44.
Papel de la PCT en la duración del tratamiento de la neumoníaAdemás del papel diagnóstico ya comentado, la monitorización de la PCT ha sido propuesta como un biomarcador útil para el seguimiento de infecciones bacterianas graves. En un EC realizado en pacientes críticos (60% de los cuales presentaba neumonía) que fueron aleatorizados a la suspensión del tratamiento antibiótico con arreglo a la evolución de la PCT en términos relativos (descenso ≥80% respecto al nivel máximo) o absolutos (≤0,5μg/l) o según la práctica clínica habitual, se demostró una reducción significativa de la duración mediana del tratamiento en el grupo experimental (5días) frente al control (7días)46. Un metaanálisis posterior basado en 6.708 pacientes (procedentes de 26EC) con otros tipos de infección del tracto respiratorio además de neumonía reveló igualmente una menor duración del tratamiento antibiótico asociada al empleo de la PCT como marcador evolutivo (media de 5,7 frente a 8,1días) y de la incidencia de eventos adversos relacionados47. Los resultados de estos estudios, no obstante, deben ser interpretados con cautela, puesto que la duración del tratamiento en los pacientes en los que no se monitorizó la PCT con la finalidad de guiar su suspensión fue mucho más prolongada que lo recomendado en las guías clínicas. En este sentido, se considera actualmente que la determinación de los niveles de PCT no es necesaria en aquellos pacientes que se encuentren clínicamente estables al cabo de 48-72horas del inicio del tratamiento antibiótico y que, por tanto, no requerirían su prolongación más allá de los 5días recomendados para la NAC y los 7-8días para la NAH y la NAVM4,19. Como se ha señalado previamente, las guías ERS/ESICM/ESCMID/ALAT proponen que los niveles de PCT pueden ser empleados, en combinación con el criterio clínico, para determinar la duración del tratamiento en la NAC grave. Su utilidad tampoco está clara, por otra parte, en pacientes que ya hayan alcanzado la estabilidad clínica, en los que la duración prevista del tratamiento sea de 5-7días8.
¿Podemos modular la respuesta inmune del huésped en pacientes con neumonía?Las ventajas teóricas derivadas del empleo de terapias inmunomoduladoras en la neumonía grave se fundamentan en el conocimiento acumulado acerca del papel de la interacción huésped-patógeno en la patogénesis de la sepsis48. Las moléculas liberadas por los microorganismos y desde el interior de las células dañadas (patrones moleculares asociados a patógenos y a daño, respectivamente) son capaces de inducir una respuesta inflamatoria deletérea al actuar como ligandos de diversos receptores involucrados en la respuesta innata. Entre estos destacan los receptores de tipo Toll (Toll-like receptor [TLR]) y de tipo Nod, y los receptores de manosa de tipoC. La liberación consiguiente de citoquinas (interleucina [IL]-1β, IL-6 e IL-8, entre otras) genera un daño tisular —que en el caso de neumonía puede evolucionar hacia un síndrome de distrés respiratorio agudo— y conduce eventualmente a una situación de fracaso multiorgánico. El estado hiperinflamatorio inducido por esta respuesta desregulada se acompaña además de una situación de inmunoparálisis y agotamiento (exhaustion) de la inmunidad celular48. La relevancia clínica de este proceso se ha puesto ampliamente de manifiesto en la infección por SARS-CoV-2, en la que el uso de dexametasona y de agentes bloqueantes de IL-1β e IL-6 ha sido efectiva para reducir la mortalidad en el contexto de EC en pacientes con neumonía y marcadores de inflamación elevados. Este beneficio contrasta llamativamente con la evidencia previa en pacientes con gripe, que aunque de peor calidad sugería un efecto negativo en términos de mortalidad y riesgo de sobreinfección asociado a la administración de esteroides adyuvantes.
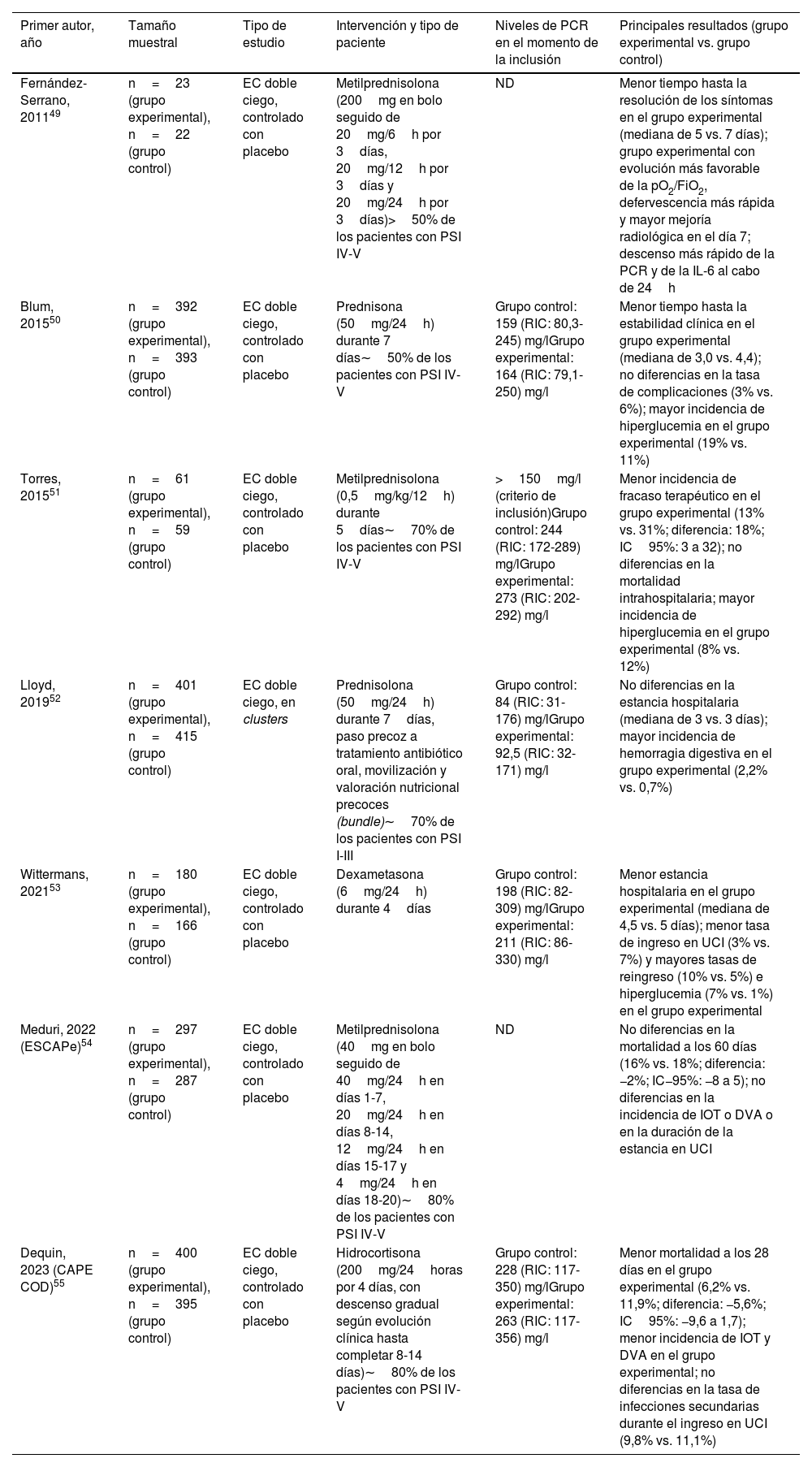
Tratamiento con esteroides en la neumonía adquirida en la comunidadVarios estudios de intervención han evaluado el papel de los esteroides en la NAC (tabla 2)49-55. Por ejemplo, en 2015 Torres et al.51 comunicaron los resultados de un EC en el que pacientes con formas graves y niveles elevados de proteínaC reactiva (>15mg/dl) fueron aleatorizados en las primeras 36horas de ingreso a recibir metilprednisolona (0,5mg/kg cada 12horas) o placebo durante 5días. La tasa de fracaso terapéutico se redujo de forma significativa en el grupo experimental respecto al de control, sin diferencias en la mortalidad intrahospitalaria. Un metaanálisis basado en 10EC publicados hasta enero de 2018 (con un total de 665 pacientes) confirmó que el tratamiento adyuvante con esteroides se asociaba a una reducción en la mortalidad de cualquier causa, la incidencia de shock séptico y la necesidad de ventilación mecánica, así como a menores niveles de proteínaC reactiva a lo largo del seguimiento. Este beneficio parecía más evidente con el uso de dosis bajas o intermedias (≤86mg de prednisona o equivalente) durante más de 5días56. Hay que señalar, no obstante, que todos estos estudios adolecían de un reducido tamaño muestral, por lo que la calidad de esta evidencia resultaba discutible. De hecho, ni las guías ATS/IDSA para la NAC publicadas en 2007 ni las de NAH/NAVM de 2016 hicieron mención expresa al tratamiento con esteroides (con excepción de los pacientes con shock séptico e insuficiencia suprarrenal)13,19.
Resumen de los EC que han evaluado el papel de los esteroides como tratamiento inmunomodulador en pacientes adultos con NAC
| Primer autor, año | Tamaño muestral | Tipo de estudio | Intervención y tipo de paciente | Niveles de PCR en el momento de la inclusión | Principales resultados (grupo experimental vs. grupo control) |
|---|---|---|---|---|---|
| Fernández-Serrano, 201149 | n=23 (grupo experimental), n=22 (grupo control) | EC doble ciego, controlado con placebo | Metilprednisolona (200mg en bolo seguido de 20mg/6h por 3días, 20mg/12h por 3días y 20mg/24h por 3días)>50% de los pacientes con PSI IV-V | ND | Menor tiempo hasta la resolución de los síntomas en el grupo experimental (mediana de 5 vs. 7 días); grupo experimental con evolución más favorable de la pO2/FiO2, defervescencia más rápida y mayor mejoría radiológica en el día 7; descenso más rápido de la PCR y de la IL-6 al cabo de 24h |
| Blum, 201550 | n=392 (grupo experimental), n=393 (grupo control) | EC doble ciego, controlado con placebo | Prednisona (50mg/24h) durante 7 días∼50% de los pacientes con PSI IV-V | Grupo control: 159 (RIC: 80,3-245) mg/lGrupo experimental: 164 (RIC: 79,1-250) mg/l | Menor tiempo hasta la estabilidad clínica en el grupo experimental (mediana de 3,0 vs. 4,4); no diferencias en la tasa de complicaciones (3% vs. 6%); mayor incidencia de hiperglucemia en el grupo experimental (19% vs. 11%) |
| Torres, 201551 | n=61 (grupo experimental), n=59 (grupo control) | EC doble ciego, controlado con placebo | Metilprednisolona (0,5mg/kg/12h) durante 5días∼70% de los pacientes con PSI IV-V | >150mg/l (criterio de inclusión)Grupo control: 244 (RIC: 172-289) mg/lGrupo experimental: 273 (RIC: 202-292) mg/l | Menor incidencia de fracaso terapéutico en el grupo experimental (13% vs. 31%; diferencia: 18%; IC95%: 3 a 32); no diferencias en la mortalidad intrahospitalaria; mayor incidencia de hiperglucemia en el grupo experimental (8% vs. 12%) |
| Lloyd, 201952 | n=401 (grupo experimental), n=415 (grupo control) | EC doble ciego, en clusters | Prednisolona (50mg/24h) durante 7días, paso precoz a tratamiento antibiótico oral, movilización y valoración nutricional precoces (bundle)∼70% de los pacientes con PSI I-III | Grupo control: 84 (RIC: 31-176) mg/lGrupo experimental: 92,5 (RIC: 32-171) mg/l | No diferencias en la estancia hospitalaria (mediana de 3 vs. 3 días); mayor incidencia de hemorragia digestiva en el grupo experimental (2,2% vs. 0,7%) |
| Wittermans, 202153 | n=180 (grupo experimental), n=166 (grupo control) | EC doble ciego, controlado con placebo | Dexametasona (6mg/24h) durante 4días | Grupo control: 198 (RIC: 82-309) mg/lGrupo experimental: 211 (RIC: 86-330) mg/l | Menor estancia hospitalaria en el grupo experimental (mediana de 4,5 vs. 5 días); menor tasa de ingreso en UCI (3% vs. 7%) y mayores tasas de reingreso (10% vs. 5%) e hiperglucemia (7% vs. 1%) en el grupo experimental |
| Meduri, 2022 (ESCAPe)54 | n=297 (grupo experimental), n=287 (grupo control) | EC doble ciego, controlado con placebo | Metilprednisolona (40mg en bolo seguido de 40mg/24h en días 1-7, 20mg/24h en días 8-14, 12mg/24h en días 15-17 y 4mg/24h en días 18-20)∼80% de los pacientes con PSI IV-V | ND | No diferencias en la mortalidad a los 60 días (16% vs. 18%; diferencia: −2%; IC−95%: −8 a 5); no diferencias en la incidencia de IOT o DVA o en la duración de la estancia en UCI |
| Dequin, 2023 (CAPE COD)55 | n=400 (grupo experimental), n=395 (grupo control) | EC doble ciego, controlado con placebo | Hidrocortisona (200mg/24horas por 4 días, con descenso gradual según evolución clínica hasta completar 8-14 días)∼80% de los pacientes con PSI IV-V | Grupo control: 228 (RIC: 117-350) mg/lGrupo experimental: 263 (RIC: 117-356) mg/l | Menor mortalidad a los 28 días en el grupo experimental (6,2% vs. 11,9%; diferencia: −5,6%; IC95%: −9,6 a 1,7); menor incidencia de IOT y DVA en el grupo experimental; no diferencias en la tasa de infecciones secundarias durante el ingreso en UCI (9,8% vs. 11,1%) |
DVA: droga vasoactiva; EC: ensayo clínico; IC95%: intervalo de confianza del 95%; IL-6: interleucina-6; IOT: intubación orotraqueal; ND: no disponible; PCR: proteínaC reactiva; PSI: Pneumonia Severity Index; RIC: rango intercuartílico; UCI: unidad de cuidados intensivos.
En ese sentido, la publicación en el último año de dos EC multicéntricos con un elevado número de pacientes podría haber contribuido a clarificar el papel de esta intervención terapéutica54,55. En el estudio ESCAPe, Meduri et al.54 aleatorizaron 586 pacientes con NAC grave y necesidad de ingreso en la UCI a recibir metilprednisolona (40mg diarios durante 7días con descenso progresivo posterior) o placebo. No pudieron detectar diferencias significativas en el objetivo primario de mortalidad por cualquier causa a los 60días, ni en la población total (16% frente al 18% en los grupos experimental y control, respectivamente) ni en ninguno de los subgrupos analizados. En contraste, Dequin et al.55 llevaron a cabo un EC en 31 hospitales franceses (estudio CAPECOD) en el que 800 participantes, igualmente con NAC grave y criterio de ingreso en la UCI, recibieron hidrocortisona (200mg diarios durante 4-7días con reducción progresiva hasta el día 14) o placebo. Un análisis intermedio reveló una menor mortalidad a los 28días en el grupo tratado con esteroides (6,2% frente al 11,9%), así como una menor necesidad de intubación y de soporte con fármacos vasoactivos (objetivos secundarios). El análisis de subgrupos previamente especificados sugiere que este beneficio fue mayor en pacientes con unos niveles elevados de proteínaC reactiva (>15mg/dl). ¿Cómo reconciliar estos resultados contradictorios a pesar de la aparente similitud en la intervención analizada y los criterios de inclusión? Son varias las diferencias metodológicas que deben ser señaladas. El ensayo ESCAPe fue realizado en la Administración de Veteranos de Estados Unidos y, por tanto, reclutó casi exclusivamente varones con una edad media próxima a los 70años. El estudio CAPECOD, por el contrario, incluyó una tercera parte de mujeres, y la edad media de los participantes fue de 67años. A diferencia del ensayo estadounidense, el diagnóstico de gripe fue un criterio de exclusión en el estudio CAPECOD en vista de la ya citada literatura que sugería un efecto deletéreo asociado a los esteroides. La diferencia probablemente más importante es la ventana para el inicio del tratamiento esteroideo desde el momento del reclutamiento, que fue de 24horas en el estudio francés frente a las 96horas en el estadounidense. También fueron notables las diferencias en la duración efectiva del tratamiento con esteroides, con medianas de 5 y 20días, respectivamente. La inclusión de estos dos EC en un metaanálisis reciente (basado en 3.367 pacientes) confirmó los hallazgos de revisiones previas, con una menor mortalidad a los 30días en los pacientes tratados con esteroides y sin evidencia de un mayor riesgo de eventos adversos. Este metaanálisis también reveló diferencias significativas en función de la dosis de esteroide administrada (menor mortalidad en presencia de dosis acumulativas ≥400mg de prednisona o equivalente respecto a dosis menores)57. En cualquier caso, las últimas guías de la ATS/IDSA desaconsejan expresamente el uso rutinario de esteroides en pacientes con NAC con o sin criterios de gravedad (recomendación condicional y fuerte, respectivamente), si bien hay que señalar que en el momento de su redacción aún no se habían comunicado los resultados de los ensayos CAPECOD y ESCAPe3. Las últimas guías de la ERS/ESICM/ESCMID de manejo de la NAC grave publicadas en 2023, por su parte, sí tienen en cuenta los hallazgos del ensayo ESCAPe, si bien restringen la recomendación del uso de corticoides a pacientes con shock séptico en ausencia de diabetes mal controlada, siempre que el cuadro no sea de etiología vírica (gripe o SARS-CoV-2) ni esté causado por SARM (recomendación condicional con bajo nivel de evidencia). La pauta sugerida es de 0,5mg/kg de metilprednisolona cada 12horas durante 5días (que en un paciente de 70kg sería equivalente aproximadamente a una dosis acumulativa total de 430mg de prednisona)8.
Papel inmunomodulador de los macrólidosAl margen de su papel antibiótico, los macrólidos ejercen una amplia gama de efectos antiinflamatorios y de modulación de la respuesta inmune in vitro58. Disminuyen la liberación de patrones moleculares asociados a patógenos y la expresión de TLR en macrófagos, reduciendo el daño alveolar inducido por el reclutamiento de células inflamatorias y la producción de citoquinas y quimiocinas. Son capaces de potenciar la fagocitosis y la muerte (killing) intracelular de bacterias, e inhiben las señales del quorum sensing bacteriano y la formación de biopelículas. Estimulan además la apoptosis de los neutrófilos y orientan la diferenciación de los monocitos hacia un fenotipo M2 (tolerógeno), acciones que limitan la respuesta inflamatoria excesiva y facilitan la reparación tisular tras la infección59. Existen ciertas evidencias acerca de la traslación biológica de estos hallazgos in vitro. Por ejemplo, el empleo de regímenes que contienen un macrólido se ha asociado a menores concentraciones de IL-6 y de factor de necrosis tumoral-α en el LBA de pacientes con NAC y pobre respuesta clínica tras 72horas de tratamiento antibiótico58.
Numerosos estudios observacionales y de intervención han tratado de establecer el potencial beneficio asociado al empleo de macrólidos en la NAC, con resultados no siempre concluyentes. Un amplio EC que reclutó 560 pacientes reveló una tendencia no significativa hacia una mayor probabilidad de estabilidad clínica al cabo de 7días de tratamiento con un β-lactámico asociado a claritromicina en comparación con el β-lactámico en monoterapia59. En un metaanálisis de 47 estudios (que contribuyeron con más de 58.000 pacientes), el uso de un macrólido se asoció a una menor mortalidad a los 30días y a una mayor probabilidad de resolución. Los patógenos más frecuentemente identificados fueron S.pneumoniae (24,9% de los casos) y K.pneumoniae (12,9%), hallazgo que sugeriría que el efecto del macrólido no se explica por completo por su espectro más amplio respecto a los β-lactámicos gracias a su actividad frente a microorganismos intracelulares60. En un EC recientemente publicado (estudio ACCESS), 278 pacientes adultos con NAC y síndrome de respuesta inflamatoria sistémica, una puntuación ≥2 en la escala Sequential Organ Failure Assessment (SOFA) y unos niveles de PCT ≥0,25ng/ml fueron aleatorizados a recibir un β-lactámico asociado a claritomicina oral o a placebo. Las posibilidades de alcanzar el objetivo primario (mejoría clínica y descenso del SOFA y de los niveles de PCT) a las 72horas de tratamiento fueron significativamente mayores en el grupo que recibió claritromicina (67,9% frente al 38,3%). Estos pacientes presentaron además menores niveles séricos de IL-10 y del cociente IL-18/IL-10, lo que sugiere un efecto protector del macrólido frente al fenómeno de inmunoparálisis inducido por la neumonía61.
Por otra parte, el presunto beneficio de la asociación del macrólido al tratamiento con β-lactámico no es tan evidente cuando el comparador es una quinolona. En efecto, un metaanálisis elaborado a partir de 18EC demostró que eran los pacientes tratados con una fluoroquinolona respiratoria en monoterapia (fundamentalmente levofloxacino y moxifloxacino) los que presentaban una mayor probabilidad de curación clínica y de erradicación microbiológica, en comparación con los que recibieron un β-lactámico asociado a un macrólido, sin diferencias en la mortalidad o la incidencia de eventos adversos62. En línea con el carácter no concluyente de esta evidencia, las guías de la ATS/IDSA no priorizan uno u otro tipo de régimen a la hora de seleccionar el tratamiento empírico de la NAC con o sin criterios de ingreso hospitalario3. Las guías de la ERS/ESICM/ESCMID/ALAT de manejo de la NAC grave sí que priorizan la asociación de β-lactámico más un macrólido (administrado durante 3-5días) respecto a la combinación alternativa de β-lactámico más una fluoroquinolona. Esta recomendación se basa en un metaanálisis realizado para la elaboración de la guía que reveló una menor mortalidad en aquellos pacientes en los que el β-lactámico fue administrado en combinación con un macrólido respecto a una fluoroquinolona (19,4% frente al 26,8%, respectivamente). Cabe destacar, no obstante, que el documento no se pronuncia en relación con el uso de fluoroquinolonas en monoterapia8.
Papel inmunomodulador de las inmunoglobulinas por vía parenteralVarios estudios han demostrado el impacto negativo sobre la evolución de la NAC de los niveles séricos disminuidos de inmunoglobulinaG (IgG) en el momento del diagnóstico en pacientes inmunocompetentes. Por ejemplo, en un estudio realizado en tres centros españoles la presencia de niveles de IgG ≤680mg/dl fue un factor predictivo independiente de la necesidad de ingreso en la UCI63. Además de su contribución directa a la eliminación de los microorganismos (mediante los procesos de opsonofagocitosis, citotoxicidad celular mediada por anticuerpos o activación del complemento por la vía clásica, entre otros), las inmunoglobulinas desempeñan un papel inmunomodulador y de neutralización de toxinas bacterianas. Por ese motivo se recomienda la administración de preparados de inmunoglobulinas policlonales a dosis elevadas (habitualmente 0,5-1g/kg) por vía intravenosa en pacientes con shock tóxico por cocos grampositivos, si bien la calidad de la evidencia que sustenta esta recomendación es baja.
A partir de esta evidencia se ha postulado que la administración de inmunoglobulinas policlonales podría ser útil como terapia inmunomoduladora en la NAC grave, aun en ausencia de hipogammaglobulinemia de base. Sin embargo, un estudio retrospectivo multicéntrico japonés no mostró diferencias en la mortalidad o en la evolución en la UCI en pacientes inmunocompetentes con NAC y shock séptico que recibieron hasta 5g diarios de inmunoglobulinas durante 3días en comparación con un grupo control emparejado mediante un score de propensión64. El uso de un preparado enriquecido en IgM («Trimodulin») a dosis de 42mg/kg/día durante 5días tampoco se asoció a un mayor número de días libres de ventilación mecánica invasiva o de soporte con fármacos vasoactivos en un EC en fase2 realizado en pacientes críticos con NAC grave65. Un análisis post hoc de este estudio sugirió, no obstante, una normalización más rápida del recuento de neutrófilos y de los reactantes de fase aguda en el brazo de Trimodulin, así como un posible beneficio clínico circunscrito al subgrupo de pacientes con niveles bajos de IgM y elevados de proteínaC reactiva en el momento del reclutamiento66.
Diez recomendaciones de expertos del Grupo OPENIN- A.
Diagnóstico
- 1.
No consideramos que esté indicada la realización de estudios microbiológicos en los pacientes con NAC de bajo riesgo tratados de forma ambulatoria.
- 2.
Recomendamos la obtención de hemocultivos, tinción de Gram y cultivo de muestras de tracto respiratorio (preferentemente esputo de buena calidad o aspirado endotraqueal) y detección de antígenos de neumococo y L.pneumophila en orina en los pacientes con NAC con criterios de gravedad que requieren ingreso hospitalario. En estos casos recomendamos igualmente la obtención de un exudado nasofaríngeo para detectar la colonización por S.aureus y descartar la infección por virus respiratorios comunitarios (virus de la gripe, SARS-CoV-2, VRS).
- 3.
No consideramos que exista la evidencia suficiente para recomendar el uso rutinario de paneles sindrómicos respiratorios basados en TAAN en pacientes con NAC. Su empleo en pacientes con NAVM puede ser recomendable, especialmente para la detección precoz de mecanismos de resistencia o de determinados microorganismos en pacientes críticos o inmunodeprimidos.
- 4.
En los pacientes con NAH o NAVM recomendamos realizar una tinción de Gram con cultivo semicuantitativo en muestras de tracto respiratorio (priorizando el esputo o el aspirado endotraqueal sobre el LBA o el cepillado bronquial protegido), así como la obtención de hemocultivos y la detección de antígenos de neumococo y L.pneumophila en orina.
- B.
Tratamiento
- 5.
Recomendamos que la duración del tratamiento antibiótico en los pacientes con NAC sin necesidad de ingreso en la UCI y con un curso clínico favorable sea de 5días. No consideramos que exista en el momento actual la evidencia suficiente para aplicar esta pauta corta en las formas con criterios de gravedad.
- 6.
Recomendamos que la duración del tratamiento antibiótico en los pacientes con NAVM (incluidos los casos causados por P.aeruginosa) con un curso clínico favorable sea de 7-8días. La persistencia del microorganismo causal en muestras de seguimiento del tracto respiratorio inferior obtenidas al cabo de 4-5días obligaría a la prolongación del tratamiento.
- 7.
No recomendamos basar la decisión del inicio de tratamiento antibiótico (ni su duración) en la determinación de los niveles de PCT en los pacientes con NAC, NAH o NAVM.
- C.
Modulación respuesta inmune del huésped
- 8.
Recomendamos la administración de corticosteroides en pacientes con NAC y shock séptico, así como en los que requieren ingreso en UCI, siempre que haya podido ser descartada una etiología gripal. Si bien no existe una clara evidencia en cuanto a la pauta más apropiada, sugerimos el empleo de metilprednisolona a una dosis de 0,5mg/Kg cada 12 horas. Este tratamiento adyuvante debe ser iniciado de forma precoz (primeras 24 horas) y mantenido durante no más de 5-7 días.
- 9.
Consideramos que la asociación de un macrólido al tratamiento con un agente β-lactámico es preferible a la asociación de una fluoroquinolona o al empleo del β-lactámico en monoterapia en pacientes con NAC grave (particularmente de etiología neumocócica) con criterio de ingreso.
- 10.
No consideramos que exista evidencia que sustente el tratamiento adyuvante con inmunoglobulinas por vía parenteral con finalidad inmunomoduladora en pacientes con NAC sin hipogammaglobulinemia.
Los autores declaran no tener ningún conflicto de intereses.
La reunión del Grupo OPENIN contó con la ayuda financiera de MSD España. La fuente de financiación no ha participado en la elaboración del presente manuscrito, en su contenido o en la decisión de envío para su publicación. Mario Fernández Ruiz disfruta de un contrato «Miguel Servet» (CP18/00073) del Instituto de Salud CarlosIII, Ministerio de Ciencia e Innovación.