El test del aliento con 13C-urea (TAU) es la prueba no invasiva más utilizada para diagnosticar Helicobacter pylori (H. pylori). La posible interferencia de la toma de antiácidos en su resultado es aún controvertida. El estudio se dirige a confirmar la no interferencia del almagato en la determinación de H. pylori mediante el TAU.
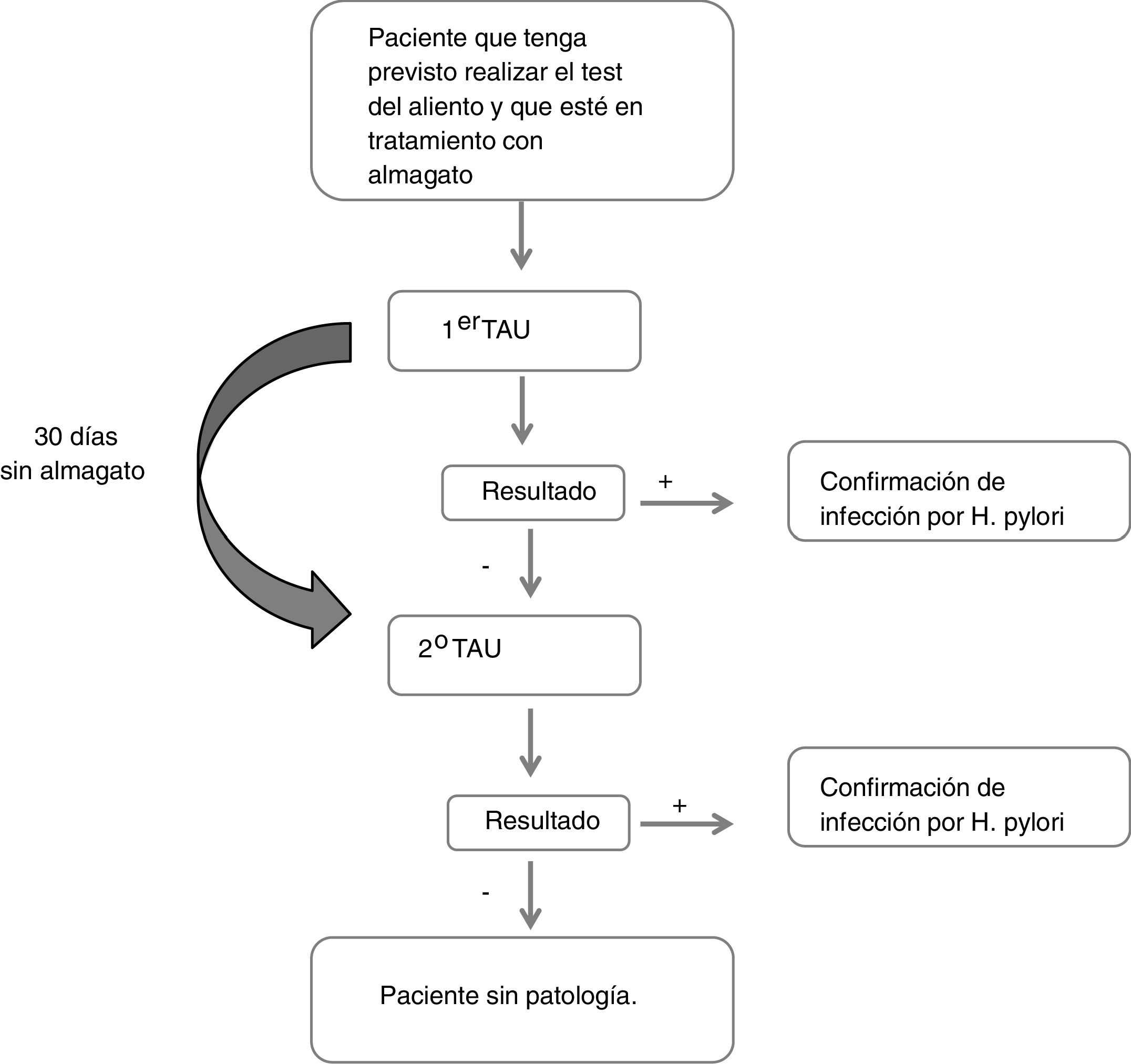
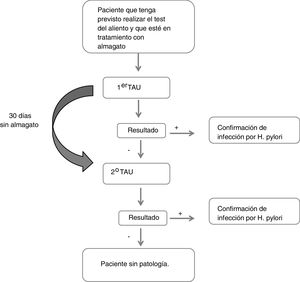
Pacientes y métodosEstudio observacional, multicéntrico, en pacientes adultos en tratamiento con almagato y a los que se indicó un TAU (TAUKIT®). Cuando el resultado del TAU fue negativo, se suprimió la toma de almagato durante 30 días y se repitió un segundo TAU. En los pacientes cuyo resultado fue positivo, no se realizaron más determinaciones. La variable principal a estudio fue el porcentaje de pacientes que teniendo resultado negativo en la primera prueba de aliento, tras suprimir la toma de almagato y repetirla, ésta se positivizó (falsos negativos del TAU, posiblemente atribuibles a almagato).
ResultadosDe los 167 pacientes evaluables, 59% fueron mujeres, la media de edad fue de 49 años y 97% de los casos presentaban sintomatología digestiva. El resultado del primer TAU fue negativo en un 71% de casos. De éstos, en la segunda prueba de TAU tras suprimir almagato, este resultado se confirmó en el 97,5%. El porcentaje de falsos negativos sobre el total de casos evaluados fue del 1,8%.
ConclusionesLa toma de almagato tiene una interferencia mínima o nula en el resultado del TAU para el diagnóstico de la infección por H. pylori; por tanto, se puede utilizar en las semanas previas a la realización del TAU.
The 13C-urea breath test (UBT) is the most widely used non-invasive diagnostic test for Helicobacter pylori. Debate continues to surround the possible interference of antacid intake on its result. This study aims to confirm the non-interference of almagate in the determination of H. pylori by UBT.
Patients and methodsObservational, multicentre study in adult patients treated with almagate in whom a UBT (TAUKIT®) was indicated. When the UBT result was negative, use of almagate was stopped for 30 days and the UBT was repeated. When the result was positive, no further determinations were made. The primary endpoint was the percentage of patients who, having had a negative result in the first breath test, were positive in the second after having stopped taking almagate (UBT false negatives, possibly attributable to almagate).
ResultsOf the 167 evaluable patients, 59% were female, average age was 49 and 97% had gastrointestinal symptoms. The result of the first UBT was negative in 71% of cases. Of these, in the second UBT test after stopping the almagate, the negative result was confirmed in 97.5%. Out of the total number of cases evaluated, the rate of false negatives was 1.8%.
ConclusionsTaking almagate has minimal or no interference in the result of UBT for the diagnosis of H. pylori infection. It can therefore be used in the weeks prior to a UBT.
A pesar de que datos recientes indican que en los últimos años la infección por Helicobacter pylori (H. pylori) está disminuyendo, sigue siendo altamente prevalente a nivel mundial1, afectando a un tercio de la población del norte de América y Europa y hasta en un 50% de la población de Europa del sur y del este y de Asia2.
En España se considera que alrededor del 50% de la población general está infectada3, siendo la prevalencia más alta en algunas comunidades (hasta el 60% en la Comunidad de Madrid)4, y especialmente en los pacientes que consultan por dispepsia (67%)5.
Las pruebas diagnósticas para la infección por H. pylori pueden ser invasivas, es decir, que requieren endoscopia, o no invasivas. Entre las no invasivas, la más utilizada es la prueba o test de aliento con urea C13 (TAU), basada en la actividad ureásica del H. pylori y que presenta una elevada precisión diagnóstica5.
No obstante, estudios previos han demostrado frecuentes falsos negativos del TAU, siendo las causas más frecuentes que el paciente haya recibido tratamiento con antibióticos6 o con inhibidores de la bomba de protones (IBP)7. Por ello, el tratamiento con IBP debería suspenderse dos semanas antes de la prueba7. Con respecto a los antagonistas de los receptores H2 de la histamina (anti-H2), los resultados son controvertidos, aunque mayoritariamente muestran evidencia de no afectar, o afectar mínimamente, la precisión del TAU8.
Los IBP son ampliamente utilizados para el tratamiento de la dispepsia y el reflujo9, pero para el manejo sintomático (pirosis y ardor), se utilizan a menudo antiácidos como almagato10, que está indicado en adultos y mayores de 12 años11. Conocer la posible interferencia de los antiácidos en el TAU es importante, tanto para evitarlos antes de la realización de la prueba, en caso de que interfirieran, como para usarlos como posible alternativa a los IBP en las semanas previas al TAU, en caso de que no interfieran.
En un estudio preliminar realizado por nuestro grupo en 30 pacientes, se observó que el uso de almagato no interfirió en los resultados del TAU12. El estudio actual tiene como objetivo principal confirmar que el uso de almagato no interfiere en la determinación de H. pylori por medio del TAU. Además, se analiza si almagato interfiere en determinadas situaciones clínicas o subgrupos de pacientes.
Pacientes y métodosSe trata de un estudio observacional, multicéntrico, postautorización, realizado en 10 servicios digestivos españoles, siguiendo las condiciones de actuación médica y práctica clínica habituales.
Participaron pacientes de ambos sexos, mayores de 18 años, con previsión de realizarse la prueba del TAU y que estuvieran en tratamiento con almagato durante 30 días a la dosis de 1,5 g de almagato suspensión oral cada 12 h y hasta las 24 h previas a la realización del TAU. Se excluyeron pacientes embarazadas o en lactancia, en tratamiento con IBP o antibióticos en los 30 días previos a la realización del TAU o aquellos que a juicio del investigador fueran incapaces de cumplir con los requisitos del estudio.
El TAU se realizó con el kit TAUKIT® 100 mg de 13C-urea (Isomed Pharma), que contiene una solución enriquecida con ácido cítrico5. Las muestras se analizaron en un laboratorio centralizado de referencia en Madrid. El punto de corte fue 5 por 1.000; de modo que cuando la diferencia del valor de la relación 13C/12C entre basal y 30 minutos fuera > 50/00 se consideraba positivo para infección por Helicobacter.
El estudio se realizó de acuerdo con la declaración de Helsinki y los procedimientos de las Buenas Prácticas Clínicas y fue aprobado por el Comité Ético de Investigación Clínica (CEIC) del Hospital Universitario de Bellvitge [EPA010/14 aprobado el 08/05/2014)]. Todos los pacientes otorgaron su consentimiento informado por escrito.
Descripción del estudioDurante la primera visita en la que se realizó el primer TAU, se recogió el motivo de indicación de TAU, los datos respecto al tratamiento con almagato (fecha de administración y posología), otros tratamientos por enfermedades digestivas u otras patologías concomitantes. Del mismo modo, se recogieron datos sociodemográficos (sexo, edad, talla, peso, IMC, raza) y clínicos (síntomas gástricos, antecedentes de patología gástrica y tiempo desde el diagnóstico, antecedentes familiares de cáncer gástrico). Si el resultado de esta primera prueba era negativo, el paciente se abstenía de tomar almagato y se repetía la prueba en una segunda visita 30 días después (fig. 1). Se consideró que un paciente presentaba un resultado falso negativo si en el primer TAU obtenía un resultado negativo y en el segundo obtenía un resultado positivo.
Todos los análisis se realizaron a partir de una única muestra de pacientes evaluables, que incluyó a todos los que cumplían los criterios de selección y el protocolo para poder analizar la variable principal de estudio. Dicha variable se definió como el porcentaje de pacientes con resultado negativo en el primer TAU que resultaron positivos en el segundo tras dejar de tomar almagato (falsos negativos del primer TAU). Estos pacientes fueron clasificados en función del resultado obtenido en la segunda prueba.
El análisis de las variables secundarias ha permitido caracterizar los pacientes en función del resultado del TAU. Dichas variables descriptivas biodemográficas, clínicas, detalles del tratamiento con almagato, patologías y tratamientos concomitantes se compararon mediante porcentajes o medias en función de la naturaleza de la propia variable.
Análisis estadísticoEl cálculo del tamaño muestral se estableció con base en la hipótesis principal del estudio que era evaluar la no interferencia de almagato en el resultado del test de aliento de urea C13. Un estudio piloto12, realizado en una serie corta de pacientes, detectó un resultado negativo en el 51,9% de casos; en todos ellos (100%) se confirmó el resultado negativo cuando se repitió la prueba tras un mes de retirada de almagato. A partir de la distribución binomial, se estimó la proporción de pacientes con falsos negativos del TAU realizado en dos determinaciones, con un intervalo de confianza del 95%. Un tamaño muestral de 182 pacientes proporcionaría una precisión de ± 7,5% para estimar la proporción de pacientes con falsos negativos del TAU realizado en dos determinaciones, con un intervalo de confianza del 95%. Suponiendo un 10% de pacientes no válidos para el análisis, el número a reclutar ascendía a aproximadamente 200 pacientes. Los cálculos fueron realizados con la ayuda del programa PASS versión 2011.
Se reclutaron 192 pacientes de los que se excluyeron 25: uno por haber sido tratado con IBP en los 30 días previos a la realización del TAU, siete por no haber tomado almagato, según descrito en el protocolo (mínimo de 25 días antes del TAU), y 17 por no haberse realizado el segundo test del aliento en los casos que lo exigía el protocolo. Así pues, la muestra final evaluable fue de 167 pacientes (87% de los reclutados).
Dado que finalmente se contó con 167 pacientes valorables para el análisis, la proporción de pacientes con falsos negativos del TAU fue estimada con una precisión de ± 7,8%, considerando que la proporción de negativos es igual que la calculada en el tamaño muestral (51,9%).
El cálculo de los intervalos de confianza (IC 95%) para las proporciones de pacientes se han calculado por el método de Wilson.
Las variables categóricas se describieron mediante frecuencias absolutas y relativas y las continuas, mediante la media, la desviación típica, la mediana, el mínimo y el máximo, incluyendo el número total de valores válidos.
Para la comparación de subgrupos de pacientes en las variables cuantitativas, se utilizó la prueba paramétrica t de Student o la prueba no paramétrica U de Mann-Whitney, según características de normalidad de las variables. Para las variables cualitativas se realizó la prueba χ2 o, en caso de que no se cumplieran las condiciones necesarias, el test exacto de Fisher. En todas las pruebas estadísticas se aplicó un nivel de significación estadística de 0,05.
ResultadosDatos demográficos y clínicosLos datos se muestran en la tabla 1. La edad media fue de 48,7 años, el 59,3% eran mujeres y el 79,6% de raza caucásica.
Características sociodemográficas y clínicas
| n = 167 | |
|---|---|
| Sexo (mujer) | 99 (59,3) |
| Edad (años) | 48,7 ± 14,5 |
| Peso (kg) | 70,3 ± 12,1 |
| Talla (cm) | 167,0 ± 8,0 |
| IMC (kg/m2) | 25,1 ± 3,5 |
| Raza | |
| Caucásica | 133 (79,6) |
| Hispana | 32 (19,2) |
| Afroamericana | 2 (1,2) |
| * Síntomas gástricos | 162 (97) |
| Dispepsia | 88 (52,7) |
| Pirosis | 53 (31,7) |
| Dolor abdominal | 26 (15,6) |
| Náuseas aisladas | 13 (7,8) |
| Gastroenteritis | 1 (0,6) |
| a Otros síntomas GI | 12 (7,2) |
| * Antecedentes patología gástrica | 83 (49,7) |
| Tiempo desde diagnóstico (años) | 1 [0; 30,4] |
| b Gastritis no erosiva ± H. pylori | 35 (20,9) |
| c Reflujo o hernia hiatal | 31 (18,6) |
| d Enfermedad ulcerosa | 18 (10,8) |
| Dispepsia funcional | 9 (5,4) |
| Dolor abdominal/divertículos y síndr. intestino irritable | 3 (1,8) |
| Cáncer gástrico | 1 (0,6) |
| Pólipos gástricos | 1 (0,6) |
| Enfermedad de Crohn | 1 (0,6) |
| Antecedentes familiares de cáncer gástrico | 21 (12,6) |
| * Patología concomitante | 25 (15) |
| Enfermedades cardiovasculares | 6 (3,6) |
| Hepatopatías | 4 (2,4) |
| Enfermedades endocrinas: hipotiroidismo | 4 (2,4) |
| Enfermedades hematológicas | 3 (1,8) |
| Enfermedades infecciosas | 1 (0,6) |
| Enfermedades respiratorias | 2 (1,2) |
| e Otras | 9 (5,4) |
IMC: índice de masa corporal; GI: gastrointestinales; H. pylori: Helicobacter pylori.
Datos cuantitativos expresados como media ± DE o mediana [min; máx] y cualitativos como n (%).
Flatulencia (n = 5), enfermedad por reflujo gastroesofágico (n = 3), diarrea (n = 1), distensión abdominal (n = 1), hemorragia gastrointestinal alta (n = 1), hipersecreción salival (n = 1), halitosis (n = 1), vómitos (n = 1).
Gastritis (n = 11), gastritis crónica (n = 5), metaplasia (n = 1), infección aislada por H. pylori (n = 18).
La indicación para realizar el test de aliento fue por diagnóstico previo de infección por H. pylori en el 38,9% (n = 65) de los pacientes. De estos 65 participantes, el diagnóstico se había realizado por la prueba de aliento en 37 de ellos y por biopsia endoscópica en los 28 restantes. En el resto, 63,5% (n = 106), la prueba se realizó para conocer si estaban o no infectados por diferentes motivos clínicos.
El 97% de los pacientes evaluables habían presentado sintomatología digestiva, siendo los síntomas más frecuentes la dispepsia (52,7%) y el reflujo (31,7%). Cinco pacientes no presentaban ninguna sintomatología digestiva.
En casi la mitad de los pacientes (49,7%) existía un diagnóstico previo de certeza de patología digestiva, con un tiempo medio desde el diagnóstico de 2,4 años (± 4,7), siendo los diagnósticos más frecuentes las gastritis (20,9%) y el reflujo o hernia hiatal (18,6%). La otra mitad (50,3%) sin diagnóstico previo de enfermedad digestiva, se incluyó para estudiar mejor una dispepsia no investigada o por tener antecedentes familiares de cáncer gástrico (12,6% de los casos) o de infección por H. pylori. Un pequeño número fue incluido por deseo del propio paciente de conocer si era portador de la infección.
Se describieron patologías concomitantes en un 15% de pacientes, siendo las más frecuentes las alteraciones cardiovasculares (3,6%), seguidas de las alteraciones hepáticas y de los trastornos endocrinos (2,4%, en ambos casos).
TratamientosEl tiempo medio desde el inicio del tratamiento con almagato hasta la realización del primer TAU fue de 1,1 meses (± 1,0). Todos los pacientes evaluables recibieron almagato durante un mínimo de 25 días previos a la realización del TAU, con una media de 29,9 días. Un 97% de los pacientes tomó las dosis descritas en el protocolo (1,5 g/12 h) y el 3% restante tomó una posología inferior (1,5 g/24 h) (cuatro casos) o superior (1,5 g/8 h) (un caso).
Solo dos pacientes de los que habían indicado tener alguna patología digestiva recibían algún tratamiento para la misma, en el momento de realizar el TAU o en los últimos 30 días. Uno recibía loperamida y el otro omeprazol (en este caso antes del segundo TAU).
En cuanto a otras patologías no digestivas asociadas, el 22,2% de los pacientes evaluados indicó estar recibiendo tratamientos concomitantes en el momento de la realización del TAU. Los más frecuentes fueron los antihipertensivos (5,4%) y los preparados hormonales sistémicos (levotiroxina 4,8%), seguidos por hipolipemiantes (4,2%) y antidepresivos (3,6%). Es de destacar que tres pacientes (1,8%) recibían ranitidina.
Resultados TAUEl tiempo medio entre la realización del primer y el segundo test fue de 48,5 días (± 26,4), con una mediana de 38,5 días.
El 70,7% (IC 95%: 63,4%; 77%) de los pacientes presentó un resultado negativo en la primera prueba de aliento. De estos, el segundo test confirmó el resultado negativo en el 97,5% (IC 95%: 92,8%; 99,1%), y fue positivo (falsos negativos) en el 2,5% (IC 95%: 0,9%; 7,2%) (tabla 2). La proporción de falsos negativos sobre el total de pacientes evaluados (n = 167) fue del 1,8% (IC 95%: 0,6%; 5,1%).
Resultados del TAU
| n | % | %* | |
|---|---|---|---|
| TAU test 1 | 167 | 100 | - |
| Positivo | 49 | 29,3% (23%; 36,6%) | - |
| Negativo | 118 | 70,7% (63,4%; 77%) | - |
| TAU test 2 | 118 | 70,7 | 100 |
| Positivo | 3 | 1,8% (0,6%; 5,1%) | 2,5% (0,9%; 7,2%) |
| Negativo | 115 | 68,9% (61,5%; 75,4%) | 97,5% (92,8%; 99,1%) |
Los datos entre paréntesis indican el intervalo de confianza del 95%.
TAU: test del aliento con 13C-urea.
Tras analizar los grupos y modificarlos con los falsos negativos del estudio, los resultados finales fueron 115 pacientes no infectados o 68,9% (IC 95%: 61,5%; 75,4%) y 52 infectados o 31,1% (IC 95%: 24,6%; 38,5%) (tabla 3).
Total de pacientes infectados y no infectados
| 1er TAU | Infectado | No infectado | Total |
|---|---|---|---|
| Positivo | 49 | 0 | 49 |
| Negativo | 3 | 115 | 118 |
| Total | 52 | 115 | 167 |
TAU: test del aliento con 13C-urea.
Sensibilidad: 49/52 = 0,94; 94,2% (IC 95%: 84,4%; 98,0%).
Especificidad: 115/115 = 1; 100% IC 95% No calculable.
Valor predictivo positivo (VPP): 49/49 = 1; 100% IC 95% No calculable.
Valor predictivo negativo (VPN): 115/118 = 0,97; 97,5% (IC 95%: 92,8%; 99,1%).
De estos 52 infectados, 13 pertenecían al grupo que había sido previamente diagnosticado con H. pylori, luego la prevalencia de infección en este grupo era del 20% (IC 95% 12,1; 31,3) (13/65), y 39 pertenecían al grupo que no había sido previamente diagnosticado, luego la prevalencia de infección en este otro grupo era del 38,2% (IC 95% 29,4; 47,9) (39/102).
Resultado del TAU en función de otras variablesNo se observaron diferencias estadísticamente significativas en el resultado del TAU en relación con características demográficas, antecedentes de patología digestiva previa, otras enfermedades asociadas o tratamientos concomitantes.
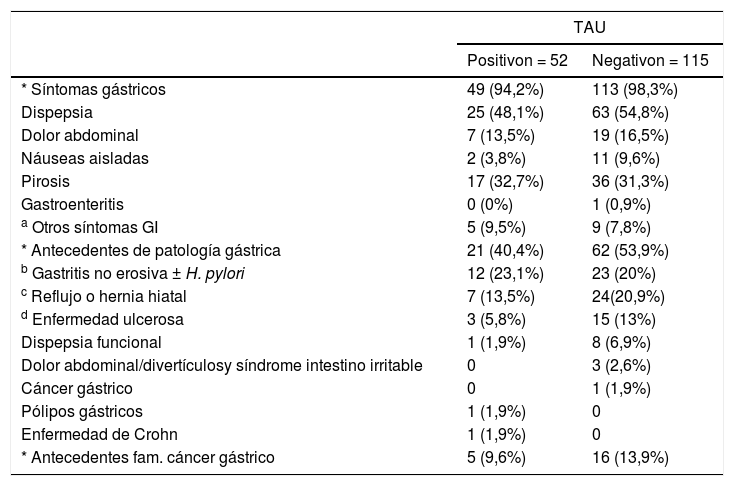
No se observaron diferencias estadísticamente significativas para ninguno de los síntomas digestivos en función del resultado del TAU (prueba χ2; test exacto de Fisher; p > 0,05) (tabla 4). Cinco pacientes (tres con resultado positivo y dos con resultado negativo) no presentaron ninguna sintomatología dispéptica.
Síntomas gástricos y antecedentes en función del resultado del TAU
| TAU | ||
|---|---|---|
| Positivon = 52 | Negativon = 115 | |
| * Síntomas gástricos | 49 (94,2%) | 113 (98,3%) |
| Dispepsia | 25 (48,1%) | 63 (54,8%) |
| Dolor abdominal | 7 (13,5%) | 19 (16,5%) |
| Náuseas aisladas | 2 (3,8%) | 11 (9,6%) |
| Pirosis | 17 (32,7%) | 36 (31,3%) |
| Gastroenteritis | 0 (0%) | 1 (0,9%) |
| a Otros síntomas GI | 5 (9,5%) | 9 (7,8%) |
| * Antecedentes de patología gástrica | 21 (40,4%) | 62 (53,9%) |
| b Gastritis no erosiva ± H. pylori | 12 (23,1%) | 23 (20%) |
| c Reflujo o hernia hiatal | 7 (13,5%) | 24(20,9%) |
| d Enfermedad ulcerosa | 3 (5,8%) | 15 (13%) |
| Dispepsia funcional | 1 (1,9%) | 8 (6,9%) |
| Dolor abdominal/divertículosy síndrome intestino irritable | 0 | 3 (2,6%) |
| Cáncer gástrico | 0 | 1 (1,9%) |
| Pólipos gástricos | 1 (1,9%) | 0 |
| Enfermedad de Crohn | 1 (1,9%) | 0 |
| * Antecedentes fam. cáncer gástrico | 5 (9,6%) | 16 (13,9%) |
TAU: test del aliento con 13C-urea; GI: gastrointestinales; H. pylori: Helicobacter pylori; fam.: familiar.
Flatulencia (n = 5), enfermedad por reflujo gastroesofágico (n = 3), diarrea (n = 1), distensión abdominal (n = 1), hemorragia gastrointestinal alta (n = 1), hipersecreción salival (n = 1), halitosis (n = 1), vómitos (n = 1).
Uno de los 118 pacientes con resultado negativo en el primer test indicó haber recibido omeprazol en el período previo a la realización del segundo TAU; el resultado negativo de este caso se confirmó en el segundo test del aliento, motivo por el que no se excluyó para su evaluación.
Tratamiento con almagato en función del resultado del TAUNo se observaron diferencias estadísticamente significativas en el resultado del TAU (prueba U de Mann-Whitney; p > 0,05), en función de la duración del tratamiento previo con almagato, ni en la posología, según el resultado del TAU (test exacto de Fisher; p > 0,05).
DiscusiónLa prevalencia de infección por H. pylori en España es elevada y similar a la de otros países del sur de Europa2, alcanzando el 65% en pacientes con dispepsia13.
La dispepsia es un cuadro muy prevalente que afecta al 20-25% de las poblaciones occidentales14,15. En población con edad < 50-55 años y sin signos de alarma, el manejo inicial recomendado es la estrategia de «test and treat», que implica realizar un test no invasivo para H. pylori, seguido de un tratamiento erradicador en los casos positivos16.
En general, la precisión diagnóstica del TAU es buena, con una sensibilidad y especificidad > 95%, en la mayoría de los casos5. Para su realización se usan diferentes técnicas y la utilizada en este estudio incluye ácido cítrico. El punto de corte establecido es de cinco unidades, y su sensibilidad, del 96% (lo que indica que hay un pequeño porcentaje de falsos negativos). Su especificidad es del 100% y los valores predictivos positivos (VPP) y negativos (VPN) son del 100 y del 92%17, respectivamente.
El test de aliento sin ácido cítrico18 y la determinación fecal de antígeno de H. pylori19 tienen una sensibilidad inferior, pero buena especificidad para el diagnóstico de novo de H. pylori. Sin embargo, la prueba del antígeno fecal presenta una tasa considerable de falsos positivos cuando se emplea para el control posterior a la erradicación20.
Los datos obtenidos en nuestro estudio, con una sensibilidad del 94,2% (IC 95%: 84,4%; 98%), especificidad del 100% (IC 95% no calculable) y altos valores predictivos [VPP: 100% (IC 95% no calculable) y VPN: 97,5% (IC 95%: 92,8%; 99,1%)] (tabla 3), como es esperable en zonas con una alta prevalencia de la infección, son similares a los del estudio de referencia de la técnica17. La aparente mayor sensibilidad [96% (IC 95%: 81%; 99%)] del de referencia puede deberse a que en éste, los resultados del TAU eran confirmados con otras dos pruebas diagnósticas y cuando éstas eran discordantes, lo que sucedió en tres pacientes, éstos fueron excluidos para los cálculos de sensibilidad y especificidad17. De cualquier modo, el intervalo de confianza de la sensibilidad de nuestro estudio se incluye dentro del IC de la sensibilidad del estudio de referencia.
Según el VPN, la probabilidad de no tener H. pylori, si el resultado del TAU es negativo, es de casi 98%, luego cuando el resultado de la prueba es negativo, todavía hay un 2% de probabilidad de que realmente esté infectado y quedara sin diagnosticar (1-VPN). El rango del IC 95% (92,8%; 99,1%) indica que en la población en tratamiento con almagato, la probabilidad de quedar sin diagnosticar puede variar del 0,9 al 7,2%.
Diferentes fármacos pueden interferir en el resultado del TAU. Los antibióticos pueden causar falsos negativos6, por lo que se recomienda evitarlos durante al menos cuatro semanas antes de realizar el TAU21.
Los IBP son los fármacos más ampliamente utilizados en el tratamiento de la dispepsia y el H. pylori11. Sin embargo, su utilización se asocia con una disminución en la supervivencia del Helicobacter y de su actividad ureásica22, lo que puede conducir a falsos negativos. Por ello, la prueba del TAU no es fiable si se realiza antes de transcurridas dos semanas desde la interrupción del tratamiento con IBP7,21,22. Uno de los pacientes con resultado negativo en el primer test había recibido omeprazol en el período previo a su realización; sin embargo, el resultado negativo fue confirmado. Está documentado que omeprazol es uno de los IBP que interfieren con el TAU22, pero algún trabajo ha sugerido que la tasa de falsos negativos es menor que con otros IBP23.
El impacto de los anti-H2, como la ranitidina, en el resultado del TAU es controvertido24,25; sin embargo, parece que no interfiere, o que si lo hace, es de forma poco relevante24,26. Existen diferencias en los resultados entre estudios que analizan la posible interferencia de anti-H2 con el TAU, que pueden ser atribuibles tanto al tiempo de duración del tratamiento previo con anti-H2 como a cuestiones inherentes a la propia prueba del TAU (si incluye ácido cítrico y en qué dosis y el punto de corte establecido)26. En cuanto a los antiácidos, su mecanismo de acción consiste en alcalinizar y neutralizar el ácido acumulado en el estómago27 y no presentan actividad conocida frente a H. pylori. Si bien se ha afirmado que los antiácidos no interfieren en la sensibilidad de las pruebas de aliento para H. pylori28, no se han realizado muchos estudios que lo confirmen. Almagato es uno de los antiácidos más utilizados10 y está indicado para el alivio y tratamiento sintomático de la acidez y el ardor de estómago en adultos y mayores de 12 años11. En un estudio piloto en 27 pacientes, en 14 se descartó infección en el TAU inicial y la negatividad se confirmó en todos los casos tras suspender almagato; es decir, no se observó ningún falso negativo. El presente estudio, realizado con la misma metodología, pero en una muestra adecuada de casos, ha constatado un resultado falso negativo del TAU en 1,8% (n = 3) de los pacientes (n = 167). Este dato demuestra que el test de aliento se altera en un porcentaje mínimo de pacientes que han recibido tratamiento previo con almagato a las dosis habituales recomendadas y confirma los resultados del estudio piloto mencionado12.
Otros factores que condicionan que el test tenga un pequeño porcentaje de falsos negativos17 son el tiempo de ayuno (mínimo ocho horas antes de la realización del test), y la duración del tiempo de tratamiento del fármaco potencialmente causante de la interferencia29.
En nuestro estudio, cabe señalar que otros dos pacientes que también habían sido expuestos a ranitidina no fueron falsos negativos, ya que uno de ellos fue positivo en el primer TAU y el otro, que fue negativo, se confirmó como tal en el segundo.
Merece la pena analizar a los tres pacientes catalogados en el presente estudio como falsos negativos por almagato y que eran del mismo centro. Uno de ellos había tomado también ranitidine, que podría influir en el resultado del test (aun cuando el kit utilizado tiene ácido cítrico y alta concentración de urea). Por tanto, es difícil concluir a qué tratamiento, el antiácido o la ranitidina, debemos responsabilizar del falso negativo. El segundo falso negativo puede explicarse por datos de su historia clínica en la que constaba haber recibido tratamiento erradicador unos años antes, sin que se comprobara su erradicación, por lo que es probable que no fuera erradicado. El tercer caso había recibido tratamiento erradicador años antes y el resultado del primer TAU lo catalogó como negativo (con un delta de 4, límite) que pasó a positivo (delta de 8) en el segundo TAU, lo que trae a colación el tema de los valores límite entre 2 y 5. Aunque el punto de corte del test está establecido en 5, se ha visto que los resultados positivos y negativos del TAU se agrupan fuera del rango 2/1.000 y 5/1.000, lo que indica que los valores entre el 2 y el 5, deberían ser confirmados30.
El estudio tiene las limitaciones propias de su carácter observacional, siendo más proclive a posibles interferencias de factores de confusión. Por otro lado, al incluir pacientes que habían sido previamente diagnosticados, y por tanto, con posibilidad de haber sido tratados y erradicados, se disminuye la prevalencia de la infección en la muestra. Al disminuir la prevalencia, un resultado positivo no permitirá confirmar el diagnóstico, y estos positivos no se confirmaron con ninguna otra prueba de referencia, lo que afectaría al VPP, que puede ser menor de lo esperado. Sin embargo, a la vista de los resultados del presente estudio, muy similares al estudio piloto, y teniendo en cuenta que el tamaño muestral es adecuado, creemos que puede apuntarse que almagato no interfiere de forma significativa en el resultado del TAU.
ConclusionesEn conclusión, almagato no interfiere o produce una interferencia mínima en el resultado de la prueba de aliento para el diagnóstico de infección por H. pylori. Almagato es una alternativa farmacológica para tratar la sintomatología que presentan los pacientes en las semanas previas a la realización del test del aliento, en los que hay que suspender el tratamiento con IBP, un mínimo de dos semanas antes de realizar la prueba TAU para evaluar si están o no infectados por H. pylori.
FinanciaciónEl presente trabajo ha sido financiado por Almirall, S.A., Barcelona y también ha sido posible gracias a la aportación gratuita de los test de urea por parte de Isomed Pharma (kit TAUKIT 100 mg de 13C).
Conflictos de interésEl Dr. Gisbert ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas para las compañías Mayoly, Allergan y DiaSorin. Los doctores Pons, Varas y Barenys no tienen conflictos de intereses. Los doctores Pajuelo y Fernández son empleados de Almirall.
También agradecer la participación de los siguientes investigadores principales en sus centros de referencia: Dr. Josep Merlo Mas (Centre Medicoquirúrgic Servidigest), Dra. Llúcia Titó (Hospital de Mataró), Dr. Josep María Botargues (Hospital Bellvitge), Dr. José A. Pajares Díaz (Hospital Gregorio Marañón).
Esther Parramón Altarriba del Hospital CIMA Sanitas de Barcelona ha realizado los tests TAU en dicho centro.
Almudena Pardo Mateos, PhD, ha contribuido con labores de medical writing, que han sido financiadas por Almirall, S.A.