La ecografía intestinal se considera una alternativa para la evaluación de la recurrencia posquirúrgica (RPQ) de la enfermedad de Crohn. El objetivo de este estudio es evaluar la correlación entre los hallazgos ecográficos y endoscópicos.
MétodosSe recogieron de forma retrospectiva los datos de pacientes con enfermedad de Crohn y resección ileocecal en los que se había realizado una colonoscopia y una ecografía intestinal para la detección de RPQ. La RPQ se evaluó empleando el índice de Rutgeerts (IR). Los hallazgos ecográficos analizados fueron el grosor de la pared intestinal, la hiperemia parietal por Doppler, la desestructuración del patrón de capas y la proliferación fibrograsa.
ResultadosSe incluyó a un total de 31 pacientes, 15 (48,4%) sin recurrencia (IR? <!--?2b) y 16 (51,6%) con recurrencia (IR?≥?2b). Se identificó una asociación significativa entre el grosor parietal y la presencia de recurrencia endoscópica (media 2,75-->mm vs. 5,68mm; p?<0,001). La hiperemia también se asoció de forma significativa con la recurrencia endoscópica (p?=?0,03). Para el grosor parietal se obtuvo un área bajo la curva ROC (AUC) del 92,9% y, con punto de corte en 3,4mm, la sensibilidad fue del 100% y la especificidad del 86,6%. Al comparar con los biomarcadores principales (calprotectina fecal y PCR sérica) se obtuvo un AUC superior para el grosor (72,3% y 72,3% vs. 92,9%).
ConclusionesEn nuestra experiencia, la ecografía tiene una alta rentabilidad diagnóstica para la detección de RPQ y puede considerarse en muchas ocasiones como una alternativa válida y no invasiva a la ileocolonoscopia.
Intestinal ultrasound is considered to be a valid alternative for the evaluation of post-operative recurrence (POR) of Crohn's disease. The aim of this study is to assess the correlation between ultrasound and endoscopic findings.
MethodsPatients with Crohn's disease were retrospectively recruited who had undergone ileocecal resection, and for whom a colonoscopy and intestinal ultrasound had been performed for the detection of POR. Recurrence was assessed using the Rutgeerts score (RS). The ultrasound findings analysed were bowel wall thickness (BWT), parietal hyperaemia using power Doppler, loss of layer pattern and mesenteric fat hypertrophy.
ResultsA total of 31 patients were included, of which 15 (48.4%) had no POR (RS<2b) and 16 (51.6%) had POR (RS≥2b). A statistically significant association was identified between BWT and the presence of endoscopic recurrence (a mean of 2.75mm vs. 5.68mm, P>0.001). There was also a statistically significant difference in hyperaemia between the 2groups (P=0.03). For wall thickness, an area under the ROC curve (AUC) of 92.9% was obtained, and with a cut-off point of 3.4mm, a sensitivity of 100% and specificity of 86.6%. When comparing with the most frequent biomarkers (fecal calprotectin and serum CRP), a higher AUC was obtained for wall thickness (72.3% and 72.3% vs. 92.9%).
ConclusionsIn our experience, ultrasound has high diagnostic efficacy in the detection of POR and can be considered a valid non-invasive alternative to endoscopy.
Dos terceras partes de los pacientes con enfermedad de Crohn (EC) requerirán cirugía al menos una vez en el curso de la enfermedad1. Si bien las tasas de recurrencia posquirúrgica (RPQ) cambian según el tipo de estudio o las poblaciones consideradas, al año de la cirugía, hasta el 80% de los pacientes tienen RPQ endoscópica (RPQe) y el 25% experimenta síntomas clínicos2.
La aparición de RPQe, si no es tratada, puede ocasionar la aparición de complicaciones que, en último caso, derivarán en una nueva intervención quirúrgica. Por este motivo, es esencial un reconocimiento precoz para iniciar o adaptar el tratamiento lo antes posible. Para ello se ha aconsejado la realización precoz de la colonoscopia tras la cirugía, generalmente a los 6 meses3,4.
Sin embargo, no existe acuerdo sobre la frecuencia con la que se deben hacer nuevas exploraciones endoscópicas tras esta primera evaluación. Dado que la colonoscopia es un procedimiento invasivo que precisa preparación, sedación y, además, conlleva riesgos, se han evaluado alternativas no invasivas para la detección de la RPQ. Entre las técnicas de imagen postuladas para su manejo la ecografía intestinal, la enteroresonancia magnética y la tomografía computarizada ofrecen ventajas sobre la endoscopia. Estas permiten explorar tramos que, por la presencia de estenosis o dificultad técnica, no pueden ser valorados adecuadamente por la endoscopia. Por otra parte, son capaces de detectar la presencia de otras complicaciones transmurales, como las fístulas o los abscesos5,6.
Entre las pruebas endoscópicas no invasivas, la cápsula endoscópica podría ser útil para la detección de la RPQ, pero es hasta 10 veces más cara que una ecografía y tiene riesgo de complicaciones, como la retención.
La ecografía intestinal presenta ventajas con respecto al resto de técnicas, como son la accesibilidad, la inmediatez, su carácter no invasivo, la ausencia de radiación, su bajo coste y que es muy bien tolerada por los pacientes. Además, ha demostrado una buena correlación con los hallazgos endoscópicos, quirúrgicos y con otras técnicas de imagen6,7.
En diferentes revisiones sistemáticas y en documentos de posicionamiento, la ecografía se ha propuesto como una técnica válida en el diagnóstico inicial de la enfermedad de Crohn, en la valoración de la actividad, en la monitorización, en la detección de complicaciones (estenosis, fístulas y masas inflamatorias) y en la RPQ8-11. De los diferentes parámetros ecográficos empleados para la evaluación de la actividad, el grosor parietal y la hiperemia son los de mayor rentabilidad diagnóstica12,13. En el contexto de la RPQ, la ecografía tiene una sensibilidad y especificidad del 83,3% y 97,7%, respectivamente14.
Con base en lo expuesto, pretendemos determinar la correlación entre los diferentes parámetros ecográficos de actividad con el índice endoscópico de Rutgeerts, así como evaluar la ecografía como método de monitorización no invasivo de la RPQ.
Pacientes y métodosPacientesSe recogió de forma retrospectiva a un total de 31 pacientes con enfermedad de Crohn y resección ileocecal a los que se les había realizado una colonoscopia y una ecografía intestinal para valoración de RPQ entre los años 2014 y 2018. Se seleccionó solo a los pacientes en los que el plazo entre pruebas era inferior a 6 meses, siempre y cuando no hubiera existido ningún cambio clínico o terapéutico entre ambas.
De los pacientes seleccionados se recogieron todas las variables demográficas (edad, sexo, hábito tabáquico) así como las relativas a la enfermedad de Crohn (localización, fenotipo, tratamiento y número de cirugías) que pudieran ser trascendentes para el objetivo del estudio. Por último, se incluyeron las variables biológicas de actividad más utilizadas en la práctica clínica (proteína C reactiva y calprotectina). Respecto a la calprotectina fecal, se consideró un punto de corte de 50μg/g para definir la remisión de la enfermedad.
IleocolonoscopiaLas ileocolonoscopias las realizaron endoscopistas expertos de la unidad de enfermedad inflamatoria intestinal con amplia experiencia en el empleo de índices endoscópicos de dicha dolencia. Se utilizaron colonoscopios Olympus® 180/190 (Tokyo, Japón) y la exploración se hizo después de 48 h de dieta líquida y, el día previo a la exploración, se empleó la preparación para limpieza intestinal indicada por el médico. En algunos casos, se procedió a la dilatación de la anastomosis para una adecuada evaluación del neoíleon.
Para la valoración de la RPQe se utilizó la escala de Rutgeerts (IR), que establece 5grados de lesiones (tabla 1): grado 0, sin lesiones; grado 1, menos de 5 aftas con mucosa normal entre ellas; grado 2, más de 5 lesiones aftosas o úlceras con mucosa normal entre las lesiones, diferenciando si se encontraban confinadas a la anastomosis (i2a) o no (i2b); grado 3, ileítis difusa y grado 4, ileítis difusa con grandes úlceras, nódulos o estenosis. Se consideró RPQe los casos con lesiones ≥i2b y ausencia de recurrencia para los grados 0, 1 y 2a. Asimismo, los grados 3 y 4 se consideraron RPQe grave. La exploración seleccionada no fue necesariamente la primera evaluación endoscópica tras la cirugía, sino aquellas que se realizaron según práctica clínica en el seguimiento de los pacientes. Tan solo se recogió a aquellos pacientes que disponían de ambas técnicas en un plazo inferior a 6 meses. En ningún caso incluido se recogió más de un estudio endoscópico y ecográfico del mismo paciente.
Índice endoscópico de Rutgeerts y sus modificaciones
| Grado 0: Mucosa normal |
| Grado i1: Presencia de ≤ 5 aftas |
| Grado i2: Presencia > 5 aftas o úlceras con mucosa normal entre ellas |
| Grado i2a: Lesiones confinadas a < 1cm de la anastomosis |
| Grado i2b: Lesiones discontinuas en el neoíleon terminal |
| Grado i3: Ileítis aftosa difusa |
| Grado i4: Ileítis con úlceras profundas, amplias, nódulos o estenosis |
La ecografía intestinal la realizaron 2gastroenterólogos expertos en esta técnica (JP y CS), empleando un equipo Esaote ® My Lab Desk 70 XVG (Génova, Italia). Para la exploración se emplearon 2sondas, una sonda cónvex de 3-5MHz y otra sonda lineal de alta frecuencia de 7-10MHz. No se utilizó ni contraste oral ni intravenoso, tan solo ayuno de al menos 5 h.
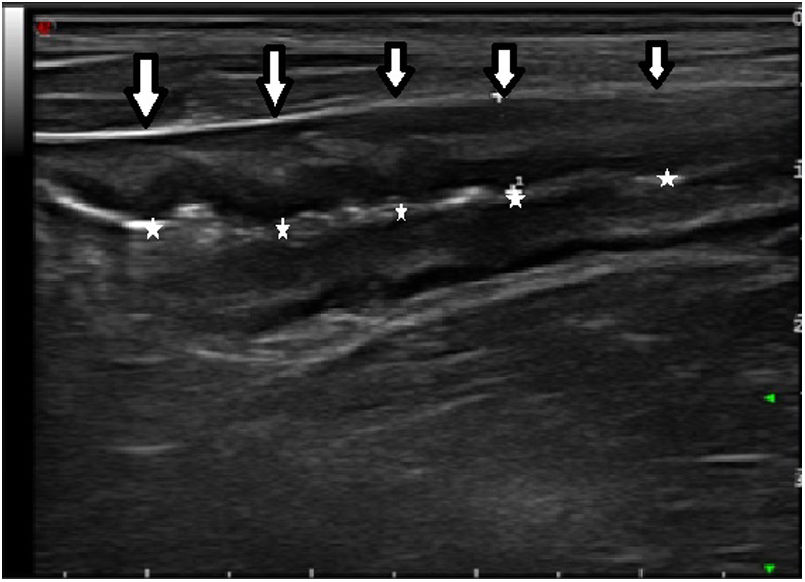
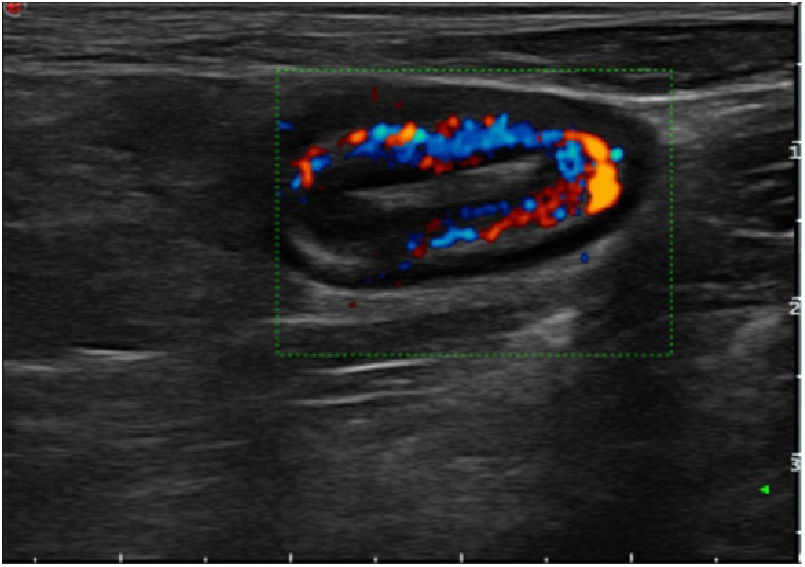
Los hallazgos ecográficos recogidos fueron el grosor máximo de un corte longitudinal de la pared del neoíleon (expresada en milímetros), la hiperemia parietal, la pérdida del patrón de capas, la proliferación fibrograsa y la presencia de adenopatías y de complicaciones transmurales (como estenosis, fístulas o abscesos). Para la evaluación de la hiperemia parietal se empleó la escala de Limberg modificada15, que gradúa de 0 a 3 la densidad de vasos (grado 0, ausente; grado 1, cuando se identifican 1-2 puntos por cm2; grado 2, cuando se identifican 3-5 puntos por cm2 y grado 3, cuando se identifican más de 5 puntos por cm2 e incluso vasos fuera de la pared). Se consideró ausencia de hiperemia los grados 0 y 1 e hiperemia los grados 2 y 3. El diagnóstico de estenosis de la anastomosis se consideró cuando se identificaba una disminución de la luz intestinal precedida de una dilatación fija del asa previa con contenido líquido o ecogénico en su interior7.
Estudio estadísticoSe realizó un análisis descriptivo de los datos obtenidos, tanto de las características basales de los pacientes como de lo relativo a su enfermedad inflamatoria intestinal, fenotipo, localización, tipo de intervención quirúrgica, anastomosis y su tratamiento. Para las variables continuas, se calculó la media y la desviación estándar; para las categóricas, los porcentajes. En el análisis univariante, se empleó la t de Student para las variables cuantitativas comparando medias y el test de chi2 para las variables categóricas y la comparación de proporciones. Para estudiar la sensibilidad y especificidad de la prueba se han elaborado las curvas ROC. Se realizó un análisis multivariante mediante regresión logística, utilizando como variable dependiente la presencia de recurrencia endoscópica significativa de forma categórica. Un valor de p < 0,05 se consideró estadísticamente significativo. El análisis estadístico se ha llevado a cabo con el programa Stata. El estudio cuenta con la aprobación del Comité Ético y de Investigación local.
ResultadosEn nuestra muestra, un 29% (9 pacientes) eran fumadores, un 45% (14) exfumadores y un 25% (8) eran no fumadores. La mayoría de los pacientes, un 87% (27) habían sido tratados mediante una única resección quirúrgica y el 13% restante (4) habían sido operados en 2ocasiones. En la tabla 2 se resumen las características basales de los pacientes.
Características basales de la población del estudio
| Mujeres, n (%) | 16 (51%) |
|---|---|
| Edad al diagnóstico, n (%) | A1: 2 (6,7); A2: 22 (73,3); A3: 6 (20) |
| Edad (años), media (DE) | 53,48 (15,33) |
| Tiempo de evolución de la enfermedad (meses), mediana (IQR) | 205 (102,5-306,25) |
| Comportamiento de la enfermedad, n (%) | B1: 3 (9,7); B2: 17(54,8); B3: 11 (35,5) |
| Hábito tabáquico, n (%) | Fumador: 9 (29); exfumador: 14 (45); no fumador: 8 (26) |
| Número de cirugías, n (%) | Una: 27 (87); dos: 4 (13) |
| Tratamiento, n (%) | Ninguno 6 (20); azatioprina 5 (16); anti-TNF 8 (26,7); combinado 11 (36) |
| Índice de Rutgeerts, n (%) | i0-i1: 9 (29); i2a: 6 (19); i2b: 5 (16); i3-i4: 11 (35,5) |
| Recurrencia endoscópica significativa, n (%) | ≥i2b: 16 (51,61) |
| Recurrencia grave, n (%) | i3-i4: 11 (35,5) |
Respecto al tratamiento que recibían los pacientes para el control de su enfermedad, hasta un 20% (6 pacientes) estaban sin tratamiento, un 16,7% (5) estaban en tratamiento con azatioprina, un 26,7% (8) con anti-TNF y un 36,6% (11) estaban en tratamiento combinado con anti-TNF y azatioprina.
El intervalo de tiempo entre la endoscopia y la ecografía tuvo una mediana de 2 meses (x?=?1,74 meses; DE?= 1,29).
Hallazgos endoscópicos y ecográficosEl 48,4% (15 pacientes) no presentaban RPQe (i0: 7; i1: 2; i2a: 6), el 16,1% (5 pacientes) i2b y, por último, el 35,5% restante tenía RPQe grave (i3-i4). Por lo tanto, en la mitad de los pacientes (el 51,6%; 16 pacientes) se identificó RPQe.
Se valoró la relación entre el grosor parietal y el IR, y se encontraron diferencias estadísticamente significativas entre el grosor de los pacientes sin RPQe y los pacientes con RPQe (media 2,75 vs. 5,68mm ≥i2b; p < 0,001).
También se analizó el grosor medio por cada grado del IR, donde encontramos que el grosor aumentaba de forma progresiva según el IR, siendo de media 2,17mm (DE 0,45) en i0; de 4,15mm (DE: 3,04) en i1; de 2,96mm (DE: 1,55) en i2; de 3,8mm (DE: 0,32) en i2b; de 7,2mm (DE: 0) en i3 y de 6,47mm (DE: 1,26) en i4. Estas diferencias observadas alcanzaron la significación estadística en el test ANOVA (p < 0,004). Además, se observaron diferencias significativas entre el grosor medio de los subgrupos i0-i1 y el de i2-i4 del IR (2,61 vs. 4,94mm; p = 0,003).
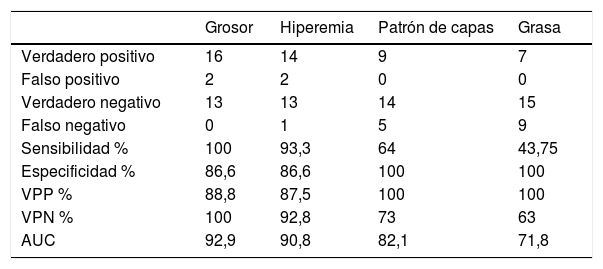
Mediante una curva ROC se determinaron la sensibilidad y especificidad del grosor para detectar RPQe, con un área bajo la curva del 92,9%. Con un punto de corte de 3,4mm de grosor parietal, se obtuvo una sensibilidad del 100%, una especificidad del 86,6%, un valor predictivo positivo (VPP) del 88,8% y un valor predictivo negativo (VPN) del 100%. De los 2pacientes con falso positivo, un paciente tenía lesiones endoscópicas i2a y el otro paciente, i1. Cabe destacar que cuando el grosor parietal era superior a 6mm, se observó una especificidad diagnóstica del 95% para la detección de RPQe grave.
Respecto a la hiperemia de la pared evaluada por Doppler, el 92,8% (13/14) de los pacientes sin hiperemia no presentaba RPQe. En los pacientes con RPQe, el 93% presentaba hiperemia. Un hallazgo destacable es que ninguno de los pacientes sin RPQe tenía hiperemia. Por el contrario, el 100% de los pacientes con RPQe grave la presentaban. Estas diferencias alcanzaron la significación estadística (p = 0,03). Con estos resultados, el Doppler color mostraba una sensibilidad del 93,3%, una especificidad del 86,6%, un VPP del 87,5% y un VPN del 92,8%.
Al comparar el patrón de capas con los hallazgos endoscópicos, identificamos que el 100% (14/14) de los pacientes sin RPQe presentaba preservación del patrón de capas. Además, el 100% (9/9) de los pacientes con desestructuración de la pared presentaba RPQe, en la mayor parte de los casos como recurrencia grave (i4, en 6 de 9) (p < 0,001).
Por último, se analizó la asociación entre la afectación de la grasa mesentérica por ecografía con la RPQe. En nuestra serie permaneció respetada en todos los casos sin RPQe (15 pacientes), mientras que se encontraba afectada en el 54% de los casos (6/11 pacientes) con i3-i4 (p = 0,014).
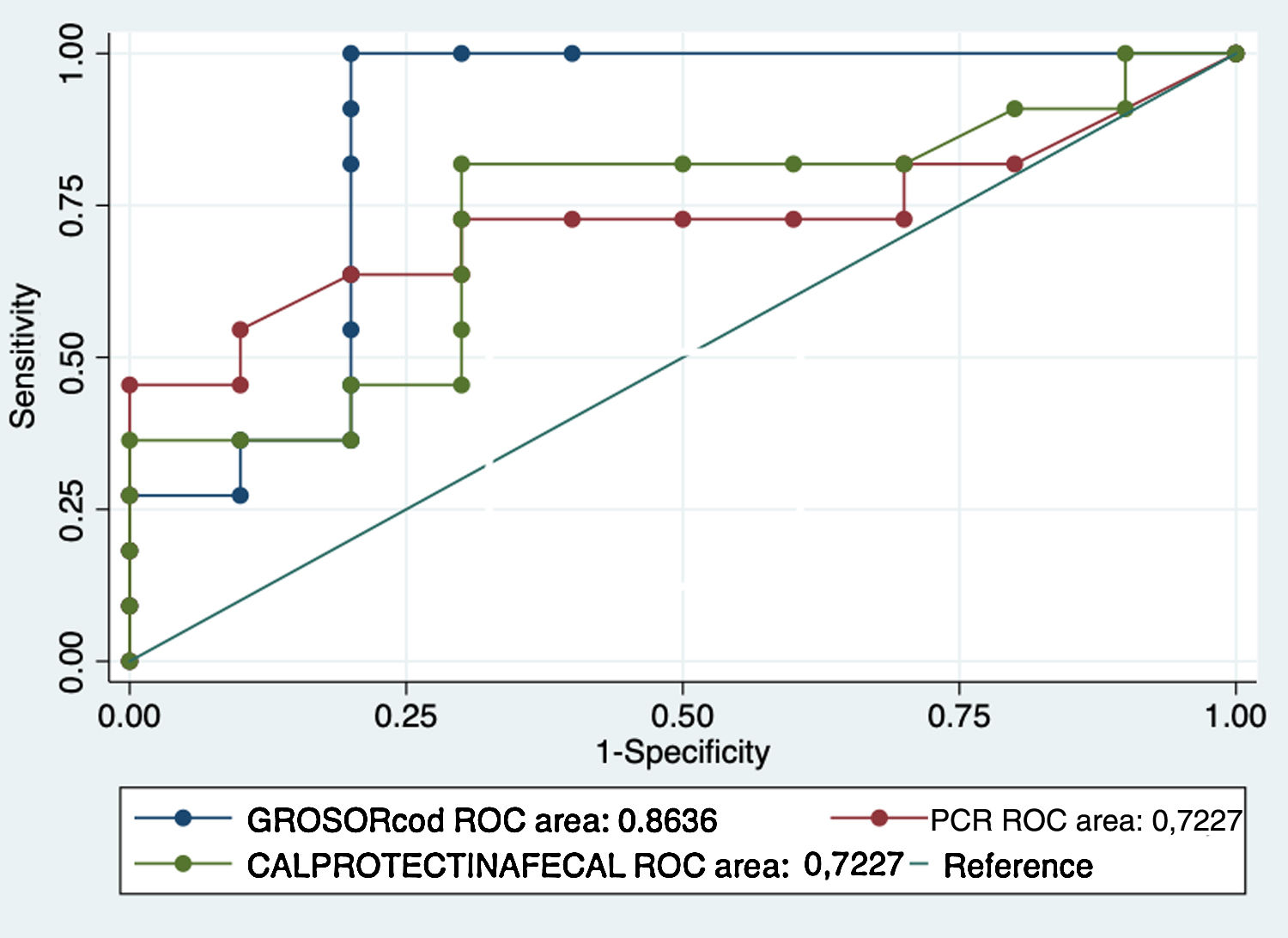
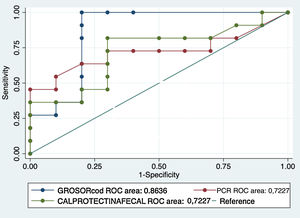
Al analizar la calprotectina como biomarcador de recurrencia, el 57,1% (12 pacientes) tenían valores elevados (>50μg/g) mientras que en el 42% era normal. En nuestra serie el valor medio de los pacientes sin RPQ fue de 74,7μg/g frente a 232,7μg/g en pacientes con RPQ ((p = 0,047). En el análisis de la curva ROC se obtuvo un área bajo la curva del 72,2%; con un punto de corte de 68μg/g, se obtuvo una sensibilidad y especificidad del 81% y del 70%, respectivamente (VPP: 75%; VPN: 77% AUC: 72,2%) (figs. 1-2).
Comparando las áreas bajo la curva ROC (AUC) de los biomarcadores principales (calprotectina fecal y PCR sérica) con el grosor, se han obtenido valores superiores del grosor y, por tanto, valores de sensibilidad y especificidad más elevados. Los resultados se muestran en la figura 3.
Se llevó a cabo un análisis multivariante para establecer el peso específico de la calprotectina, del grosor parietal, de la hiperemia y del patrón de capas y se observó una asociación con el grosor de la pared (OR: 4,6) y la calprotectina (OR: 3,2) (tabla 3).
Valores de sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y área bajo la curva de los parámetros ecográficos
| Grosor | Hiperemia | Patrón de capas | Grasa | |
|---|---|---|---|---|
| Verdadero positivo | 16 | 14 | 9 | 7 |
| Falso positivo | 2 | 2 | 0 | 0 |
| Verdadero negativo | 13 | 13 | 14 | 15 |
| Falso negativo | 0 | 1 | 5 | 9 |
| Sensibilidad % | 100 | 93,3 | 64 | 43,75 |
| Especificidad % | 86,6 | 86,6 | 100 | 100 |
| VPP % | 88,8 | 87,5 | 100 | 100 |
| VPN % | 100 | 92,8 | 73 | 63 |
| AUC | 92,9 | 90,8 | 82,1 | 71,8 |
Hasta en 2/3 de los pacientes con enfermedad de Crohn y resección ileocecal presentan recurrencia de su enfermedad1. En la actualidad se dispone de varias opciones terapéuticas para su prevención, entre las que destacan los fármacos inmunosupresores y las terapias biológicas. La indicación u optimización de estas terapias se basa en gran medida en la exploración endoscópica del neoíleon terminal, pero, dado que se trata de un procedimiento invasivo, no exento de complicaciones e incómodo para el paciente, en los últimos años la ecografía se ha postulado como método de imagen alternativo a la ileocolonoscopia para valorar la recurrencia posquirúrgica7,8,10,16.
Según nuestros resultados, los parámetros ecográficos presentan una buena correlación con la presencia de recurrencia endoscópica y su gravedad. En nuestra serie, había diferencias estadísticamente significativas en cuanto al grosor de la pared del neoíleon de los pacientes con RPQe frente a los que no presentaban RPQe. Además, el grosor aumentaba de forma progresiva según aumentaba el IR, que alcanzaba también la significación estadística, a excepción del subgrupo i1. Esta anomalía puede explicarse por la escasa representación de este subgrupo, en el que solo había 2 pacientes. Estos hallazgos son acordes con estudios previos, en los que el grosor de la pared intestinal ha demostrado ser un buen indicador de recurrencia6,14,17.
El Doppler también muestra una muy buena correlación y aporta una información adicional que apoya la obtenida por el grosor. En nuestra serie, todos los casos con grosor < 3,4mm estaban libres de hiperemia, a excepción de un paciente. Este paciente, en concreto, era un falso positivo, con un grosor parietal de 6,2mm, pero con una actividad Doppler (1/3) que presentaba índice endoscópico i1. En el estudio prospectivo de Paredes et al.18 ningún paciente con grosor < 3mm tenía hiperemia Doppler en la pared intestinal.
A diferencia del grosor, la disrupción del patrón de capas se muestra menos sensible pero más específico (64 y 100%, respectivamente) y se asocia a formas graves de recurrencia endoscópica (i3-i4). Según Rigazio et al.19, la distorsión del patrón de capas es un buen marcador de actividad de la enfermedad e incluso se asocia a un incremento en el riesgo de cirugía. Nuestros resultados apoyan lo reflejado en la literatura y demuestran que, además, se trata de un buen marcador de recurrencia.
La afectación de la grasa mesentérica mostró una especificidad del 100%, que permaneció preservada en todos los pacientes sin recurrencia. Sin embargo, tiene una baja sensibilidad diagnóstica (40%) para la detección de recurrencia posquirúrgica; también es un hallazgo más frecuente en recurrencias graves.
Como novedad, nuestro estudio evaluó el grosor parietal determinado por ecografía como herramienta en el seguimiento de estos pacientes; es decir, con posterioridad a la primera evaluación tras la cirugía. Mediante la curva ROC, se obtuvo un área bajo la curva del 92,9% para un grosor de 3,4mm (sensibilidad 100%; especificidad 88%; VPP 86% y VPN 100%). Estos resultados son similares a los de un metaanálisis reciente de Rispo et al.14, que incluyó 5 estudios y un total de 219 pacientes, con valores de sensibilidad 94%; especificidad 84%; VPP 100% y VPN 25,3%. Encontramos diferencias entre los valores predictivos obtenidos en nuestro estudio y el metaanálisis citado, probablemente debidas a la diferente probabilidad preprueba. Los estudios incluidos en el metaanálisis consideraban recurrencia la presencia de cualquier lesión endoscópica, es decir, a partir del subgrupo i1 y, por tanto, con mayor proporción de pacientes con recurrencia (53-78%). Sin embargo, en nuestra serie se consideró RPQe las lesiones iguales o mayores a i2b por su mayor interés clínico y terapéutico, ya que es a partir de este subgrupo cuando se indica que se optimiza el tratamiento de la recurrencia4. Esta elección ha condicionado una prevalencia del 51,6% de RPQ, significativamente menor que en otras series. Además, en dicho metaanálisis se observó que, cuando el grosor de la pared era de más de 5,5mm, la especificidad era del 97,7%, cifra similar a la observada en nuestra muestra, con una especificidad del 95% para RPQe grave cuando el grosor era superior a 6,0mm.
El nivel de calprotectina fecal también se relacionó de forma significativa con la presencia de recurrencia, al igual que se ha descrito en otros estudios20,21. La calprotectina fecal como biomarcador de RPQ mostró una elevada sensibilidad (81%) y VPN (77%), aunque inferior a lo observado por otros estudios, que obtuvieron un VPN más elevado (91-94%) para descartar RPQ22,23. Estas diferencias se deben a que el punto de corte empleado para el diagnóstico de recurrencia era más alto, en torno a 150-250μg/g, y a que, en nuestra serie, tan solo disponíamos de los niveles de calprotectina de 21 pacientes y, por tanto, se hubiera necesitado un mayor tamaño muestral.
Tras comparar el área bajo la curva ROC de los biomarcadores (calprotectina fecal y PCR sérica) con el grosor parietal, el que presenta una mayor rentabilidad diagnóstica era el grosor, con una mejor sensibilidad, especificidad y valores predictivos positivo y negativo que los biomarcadores. Por tanto, en nuestra muestra, no obtendríamos una mayor rentabilidad con su combinación.
A la vista de nuestros resultados, proponemos que la ecografía es una prueba diagnóstica no invasiva que podría considerarse una alternativa a la ileocolonoscopia, con gran rentabilidad diagnóstica para la monitorización de la RPQ, ya que nos permite un adecuado seguimiento y toma de decisiones terapéuticas, disminuyendo la indicación de ileocolonoscopias en nuestros pacientes. Este manejo nos hubiera permitido descartar los pacientes sin RPQ (i?≤?2a) con un 100% de VPN, evitando así realizar endoscopia hasta en un 48% de nuestros pacientes. Es también interesante señalar que los pacientes con un grosor parietal superior a 6,0mm presentaban formas graves de recurrencia con un 95% de especificidad, con la posibilidad de valorar modificaciones terapéuticas sin necesidad de confirmarlo mediante endoscopia.
Como limitaciones, cabe reflejar que se trata de un estudio retrospectivo, con limitado número de pacientes (n = 31), por lo que se precisa de estudios prospectivos con un mayor tamaño muestral para validar nuestros resultados. Además, la realización de la endoscopia y la ecografía no coincidían en el tiempo, aunque de media no se distanciaron más de 2 meses. El tiempo de evolución de la enfermedad no ha sido evaluado en cada sujeto y probablemente difiera entre ellos. Por otra parte, presenta como ventaja que se trata de un estudio de práctica clínica real.
ConclusiónEn nuestra experiencia, existe una buena correlación entre los parámetros ecográficos de actividad, principalmente del grosor de la pared intestinal, y la presencia de recurrencia endoscópica. Postulamos la ecografía intestinal como una prueba de imagen con una elevada rentabilidad diagnóstica y que en muchas ocasiones evitaría la realización de endoscopias o de pruebas de imagen menos accesibles, como la resonancia magnética, en nuestros pacientes.
FinanciaciónNinguna.
Conflicto de interésNinguno.