Los inhibidores del punto de control inmunitario (immune checkpoint inhibitors [ICI]) son fármacos eficaces en el tratamiento de diversas neoplasias. Sin embargo, se han relacionado con eventos adversos inmunomediados (EAI) gastrointestinales y hepáticos que pueden desencadenar su interrupción temporal o definitiva.
ObjetivoEvaluar, en condiciones de práctica real, la eficacia y la toxicidad gastrointestinal y hepática de los ICI en tratamientos oncológicos.
Material y métodosEstudio retrospectivo con inclusión de pacientes con diagnóstico de neoplasia avanzada que habían recibido al menos una dosis de ICI entre mayo de 2015 y septiembre de 2018.
ResultadosSe incluyeron 132 pacientes con neoplasia de pulmón no microcítico (65,15%, n=86), melanoma (22,7%, n=30), carcinoma renal (9,09%, n=12) y otros tumores (3%, n=4). Los fármacos empleados fueron nivolumab (n=82), pembrolizumab (n=28), atezolizumab (n=13), durvalumab (n=2), ipilimumab (n=1) y la combinación anti-CTLA-4/PD-1 (n=6). El 38,6% (n=51) desarrollaron EAI, de tipo gastrointestinal en el 12,9% (n=17). De ellos, el 47% (n=8) requirieron esteroides, y un paciente precisó cirugía por perforación intestinal. En el 3,03% (n=4) se objetivaron EAI hepáticos gradoI: el 50% (n=2) requirieron corticoterapia y en un paciente fue preciso interrumpir el tratamiento. Entre los pacientes con tratamiento combinado, el 66,6% (n=4) presentaron EAI gastrointestinales. La incidencia de EAI no se relacionó con la edad, ni con el sexo, ni con la respuesta al fármaco empleado.
ConclusionesLos EAI gastrointestinales figuran entre los más frecuentemente observados en pacientes en tratamiento con ICI. El manejo multidisciplinar y un mayor conocimiento de dichos eventos podrían ayudarnos a reducir su morbilidad, así como las interrupciones del tratamiento.
Immune checkpoint inhibitors (ICIs) are effective agents against several malignancies. However, they are associated with gastrointestinal and liver immune-related adverse events (GI-IrAEs and LI-IrAEs), which can lead to their temporary or permanent discontinuation.
AimThe aim of this study was to evaluate the efficacy and gastrointestinal and liver toxicity of ICIs in oncological treatments in actual clinical practice.
Material and methodsPatients with advanced cancer who received at least 1ICI dose between May 2015 and September 2018 were retrospectively assessed.
Results132 patients with non-small cell lung cancer (65.15%, n=86); melanoma (22.7%, n=30); renal carcinoma (9.09%, n=12); and other tumours (3%, n=4) were included. The treatments administered were nivolumab (n=82), pembrolizumab (n=28), atezolizumab (n=13), durvalumab (n=2), ipilimumab (n=1) and the antiCTLA-4/PD-1 combination (n=6). In total, 51 patients (38.6%) developed IrAEs, 17 (12.9%) of which experienced GI-IrAEs. Of these, 8 (47%) needed steroids and 1patient required surgery due to intestinal perforation. Grade I Li-IrAEs were observed in 4 patients (3.03%): 2 (50%) required corticosteroids and 1 patient had to discontinue treatment. Four patients (66.6%) who received combination therapy experienced GI-IrAEs. IrAE incidence were not associated with age, gender or drug response.
ConclusionsGI-IrAEs are one of the most common adverse events in patients receiving ICIs. A multidisciplinary approach and a greater understanding of these events could help to reduce morbidity and therapy discontinuation.
En los últimos años el enfoque del tratamiento frente al cáncer ha cambiado sustancialmente con la introducción de nuevas dianas terapéuticas que han permitido mejorar la expectativa y la calidad de vida del paciente.
Los puntos de control, o checkpoints, son moléculas de la superficie celular que actúan como reguladores endógenos de la respuesta inmunitaria mediante la coinhibición de las vías de señalización. Juegan, por lo tanto, un papel crucial en la prevención de la autoinmunidad y en la protección de tejidos frente a una infección patogénica.
Las células malignas pueden regular dichos checkpoints con el fin de evadir la respuesta inmune. Por ello, en los últimos años se han desarrollado los denominados fármacos inhibidores del punto de control inmunitario (immune checkpoint inhibitors [ICI]) con el fin de potenciar la respuesta inmune dirigida a las células neoplásicas1.
Ipilimumab, receptor del antígeno4 del linfocitoT citotóxico (CTLA-4), fue el primer ICI aprobado por la Food and Drug Administration (FDA) estadounidense en 2011 para el tratamiento del melanoma en estadio avanzado2. Posteriormente han surgido nuevos fármacos dirigidos contra diferentes dianas terapéuticas, como el de la proteína1 de muerte celular programada (PD-1, y sus ligandos PD-L1 y 2), que han aumentado la supervivencia en pacientes con neoplasia renal, pulmonar no microcítica, melanoma o incluso hepatocarcinoma, entre otros3-5.
A raíz de su uso creciente, se han identificado una gran variedad de efectos adversos secundarios, denominados eventos adversos inmunomediados (EAI), cuya fisiopatología no es bien conocida, si bien las célulasT, los anticuerpos y las citoquinas podrían participar en su desarrollo6-9. Sus características y su manejo varían respecto a la toxicidad habitualmente observada con otros tratamientos oncológicos10-12. Suelen presentarse en las primeras semanas tras el inicio del tratamiento, si bien se han observado EAI incluso en las semanas posteriores a la finalización del tratamiento. La toxicidad cutánea es la manifestación más frecuente y precoz13. En el caso del anti-CTLA-4, como ipilimumab, aparecen EAI hasta en el 60-85% de los pacientes, siendo la mayoría grado1-212.
Respecto a la toxicidad gastrointestinal, estudios previos indican una incidencia de diarrea del 12,1 al 13,7% en pacientes en tratamiento con anti-PD-1, y del 30,2 al 35,4% con anti-CTLA-4, así como una incidencia de colitis del 0,7 al 1,6% en anti-PD-1, del 5,7 al 9,1% en anti-CTLA4, y del 13,6% en terapia combinada14-16. Por otra parte, se ha descrito una incidencia de hepatotoxicidad del 2 al 5%, siendo del 1 al 4% de grado3 y417,18.
Los EAI obligan a la interrupción del tratamiento hasta en el 25% de los pacientes, según el fármaco empleado19, y los EAI gastrointestinales son una de sus principales causas11,16. Sin embargo, la posibilidad de reintroducción del fármaco no está bien definida20. Existen diferentes guías clínicas para el manejo de la toxicidad producida por estos fármacos12,21. En el caso de diarrea-colitis inmunomediada leve (grado1) la observación y el manejo sintomáticos del paciente serán suficientes, con la retirada del ICI a partir del grado2, y valorando el inicio de esteroides a dosis bajas (metilprednisolona 0,5-1mg/kg/día) o intermedias-altas (1-2mg/kg/día) si hay persistencia de síntomas grado1 o presencia de síntomas grado3 o4. En el caso de la hepatotoxicidad se deberá suspender temporalmente el ICI y realizar una monitorización analítica más estrecha en grado1 y2, suspender definitivamente el ICI en grado3 e introducir esteroides a dosis de 0,5-1 o 1-2mg/kg/día en grado2 persistente o grado3, respectivamente. El uso de tratamientos biológicos, como infliximab, o inmunomoduladores, como micofenolato mofetil, está indicado en casos de colitis o hepatitis inmunomediada graves, sin respuesta a tratamientos previos.
El objetivo de nuestro estudio consiste en analizar la incidencia de EAI de tipo gastrointestinal y hepático en pacientes oncológicos tratados con ICI en nuestro hospital.
Material y métodosSe trata de un estudio observacional, retrospectivo y unicéntrico basado en nuestra experiencia en práctica clínica real en el empleo de los ICI entre mayo de 2015 y septiembre de 2018 en el Hospital Universitario Miguel Servet de Zaragoza.
Se incluyeron todos los pacientes con diagnóstico de cualquier tipo de neoplasia en estadio avanzado que habían recibido al menos una dosis de ICI. La toxicidad gastrointestinal y hepática se caracterizó, de acuerdo a los criterios de toxicidad CTCAE 4.0 (del inglés Common Terminology Criteria for Adverse Event)22, de grado1 a grado4, según la gravedad. En el caso de toxicidad gastrointestinal: grado1, asintomático o alteración clínica o diagnóstica leve que no requiere tratamiento; grado2, clínica moderada que requiere tratamiento médico; grado3, clínica grave que requiere tratamiento médico, y grado4, amenaza de muerte. En el caso de hepatoxicidad: grado1, AST o ALT 1-2,5×límite superior de la normalidad (LSN) y/o bilirrubina total (BiT) 1-1,5×LSN; grado2, AST o ALT 2,5-5×LSN y/o BiT 1,5-3×LSN; grado3, AST o ALT>5×LSN y/o BiT>3×LSN, y grado4, AST o ALT>8×LSN. Se definió el patrón de hepatotoxicidad según el ratio (R) (alanina-aminotransferasa [ALT] ×LSN/fosfatasa alcalina [FA] ×LSN) en hepatocelular (R≥5), colestásico (R≤2) y mixto (R2-5)23,24.
La respuesta al tratamiento se definió en base a los criterios iRECIST: respuesta completa, ante la desaparición completa de las lesiones malignas y ausencia de ganglios patológicos (<10mm); respuesta parcial, si reducción de la carga tumoral de la lesión principal >30%, o desaparición de la lesión principal con persistencia de lesiones secundarias; enfermedad estable, en ausencia de progresión tumoral, sin cumplir criterios de respuesta parcial o completa; y progresión de la enfermedad, ante aumento del tamaño de la lesión principal ≥20% (al menos ≥5mm) o aumento significativo de las lesiones secundarias25.
Las variables cuantitativas se describieron con la media y la desviación estándar y las cualitativas mediante la distribución de frecuencias y los porcentajes de cada categoría. Para comparar proporciones de las variables categóricas se utilizó la prueba de chi cuadrado con corrección de continuidad. Para las variables continuas se utilizó la prueba de la t de Student. Se tomó como nivel de significación p<0,05. Todos los cálculos estadísticos se han realizado utilizando el software estadístico R versión 3.1.3 (www. https://www.r-project.org/).
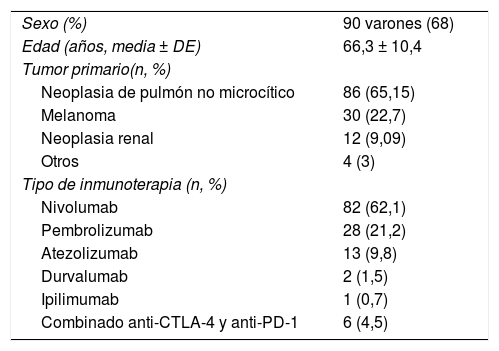
ResultadosSe incluyeron un total de 132 pacientes: 32% mujeres (n=42) y 68% hombres (n=90), con una edad media de 66,3años (DE: 10,4). Las neoplasias primarias tratadas fueron: 86 (65,15%) neoplasia de pulmón no microcítico; 30 (22,7%) melanoma; 12 (9,09%) neoplasia urotelial, y 4 (3%) otros tumores. Los fármacos empleados fueron: 82 (62,1%) nivolumab, 28 (21,2%) pembrolizumab, 13 (9,8%) atezolizumab, 2 (1,5%) durvalumab y 1 (0,7%) ipilimumab. Seis pacientes (4,5%) recibieron tratamiento combinado con anti-CTLA-4 y anti-PD-1 (tabla 1).
Características basales de los pacientes
| Sexo (%) | 90 varones (68) |
| Edad (años, media ± DE) | 66,3 ± 10,4 |
| Tumor primario(n, %) | |
| Neoplasia de pulmón no microcítico | 86 (65,15) |
| Melanoma | 30 (22,7) |
| Neoplasia renal | 12 (9,09) |
| Otros | 4 (3) |
| Tipo de inmunoterapia (n, %) | |
| Nivolumab | 82 (62,1) |
| Pembrolizumab | 28 (21,2) |
| Atezolizumab | 13 (9,8) |
| Durvalumab | 2 (1,5) |
| Ipilimumab | 1 (0,7) |
| Combinado anti-CTLA-4 y anti-PD-1 | 6 (4,5) |
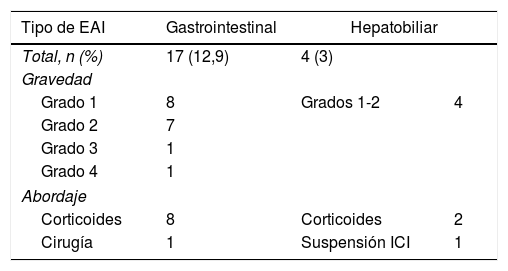
Ningún paciente obtuvo respuesta completa al tratamiento, y en 30 pacientes la respuesta no fue evaluada por fallecimiento. Del resto, el 19,6% (n=20) de los pacientes obtuvieron respuesta parcial; el 27,5% (n=28) presentaron criterios de enfermedad estable, y en el 52,9% (n=54) de los pacientes la enfermedad progresó a pesar del tratamiento. El 38,6% (n=51) desarrollaron algún tipo de EAI, con afectación hepática en el 3,03% y gastrointestinal tipo colitis en el 12,9% (n=17): 8 grado1, 7 grado2, 1 grado3 y 1 grado4. De ellos, 7 pacientes acudieron al servicio de urgencias, con una media de 1,71 visitas (1-3visitas), de los cuales 6 requirieron hospitalización, con una estancia media de 18,8días (rango 1-70días). Se realizó colonoscopia en 2 pacientes que cumplían criterios de colitis grado2, con hallazgo de proctitis moderada y pancolitis leve confirmadas histológicamente. El 47% (n=8) requirieron esteroides vía oral (1mg/kg/día) con buena respuesta, excepto en un paciente, que requirió cirugía por perforación intestinal, sin tratamiento posterior. Por otra parte, en el 3,03% (n=4) se objetivaron EAI hepáticos consistentes en hepatitis de carácter leve (grado1 y2), con patrón hepatocelular en 3 pacientes (ratio medio 11,03, rango 7,48-18) y colestásico en uno (ratio 0,47), resueltos con la retirada del fármaco excepto en los 2 casos con hepatotoxicidad grado2, que requirieron corticoterapia vía oral (1mg/kg/día) por persistencia de alteración analítica. De los 6 pacientes con tratamiento combinado, 4 (66,6%) presentaron efectos adversos gastrointestinales, no describiéndose afectación hepática en ningún caso (tabla 2). Además, se observaron EAI de tipo cutáneo, endocrino, pulmonar y renal en el 9,09% (n=12), el 9,09% (n=12), el 6% (n=8) y el 2,27% (n=3) de los pacientes, respectivamente. La incidencia de EAI no se relacionó con la edad, con el sexo ni con la respuesta al fármaco empleado. No se produjo ningún fallecimiento como consecuencia de los efectos adversos gastrointestinales ni hepáticos.
Descripción de los efectos adversos inmunomediados gastrointestinales y hepáticos
| Tipo de EAI | Gastrointestinal | Hepatobiliar | |
|---|---|---|---|
| Total, n (%) | 17 (12,9) | 4 (3) | |
| Gravedad | |||
| Grado 1 | 8 | Grados 1-2 | 4 |
| Grado 2 | 7 | ||
| Grado 3 | 1 | ||
| Grado 4 | 1 | ||
| Abordaje | |||
| Corticoides | 8 | Corticoides | 2 |
| Cirugía | 1 | Suspensión ICI | 1 |
| Tratamiento combinado (n=6) | |
|---|---|
| Hepatobiliar, n (%) | 0 (0) |
| Gastrointestinal, n (%) | 4 (66) |
EAI: efecto adverso inmunomediado.
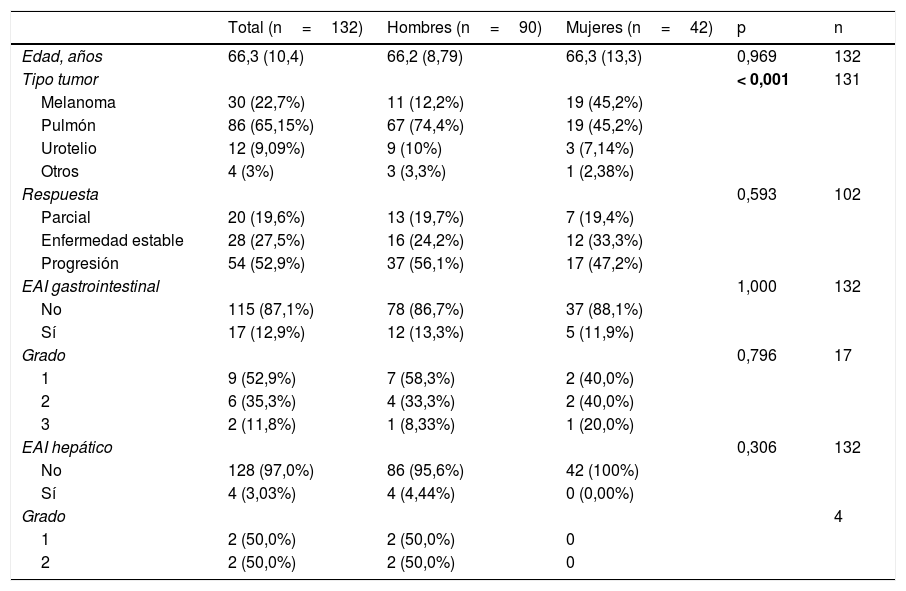
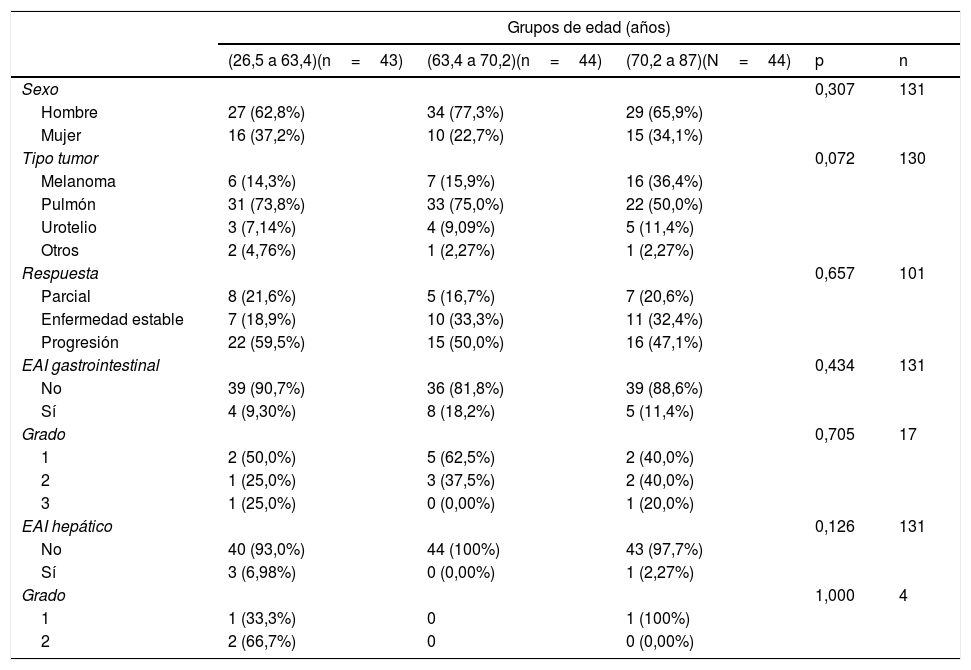
El análisis estratificado por sexo reveló que sí se identificaron resultados estadísticamente significativos en cuanto al tipo de tumor y el sexo, siendo el más prevalente entre los hombres el cáncer de pulmón; entre mujeres, igualmente prevalentes el cáncer de pulmón y el melanoma. No existieron diferencias entre hombres y mujeres en términos de edad, tipo de respuesta a la inmunoterapia, presencia o no de toxicidad y grado de la misma (tabla 3). En el análisis estratificado por grupos de edad no se obtuvieron diferencias estadísticamente significativas en relación con el sexo, con la respuesta a la inmunoterapia ni con la incidencia y el grado de EAI (tabla 4).
Análisis de pacientes estratificado por sexo
| Total (n=132) | Hombres (n=90) | Mujeres (n=42) | p | n | |
|---|---|---|---|---|---|
| Edad, años | 66,3 (10,4) | 66,2 (8,79) | 66,3 (13,3) | 0,969 | 132 |
| Tipo tumor | < 0,001 | 131 | |||
| Melanoma | 30 (22,7%) | 11 (12,2%) | 19 (45,2%) | ||
| Pulmón | 86 (65,15%) | 67 (74,4%) | 19 (45,2%) | ||
| Urotelio | 12 (9,09%) | 9 (10%) | 3 (7,14%) | ||
| Otros | 4 (3%) | 3 (3,3%) | 1 (2,38%) | ||
| Respuesta | 0,593 | 102 | |||
| Parcial | 20 (19,6%) | 13 (19,7%) | 7 (19,4%) | ||
| Enfermedad estable | 28 (27,5%) | 16 (24,2%) | 12 (33,3%) | ||
| Progresión | 54 (52,9%) | 37 (56,1%) | 17 (47,2%) | ||
| EAI gastrointestinal | 1,000 | 132 | |||
| No | 115 (87,1%) | 78 (86,7%) | 37 (88,1%) | ||
| Sí | 17 (12,9%) | 12 (13,3%) | 5 (11,9%) | ||
| Grado | 0,796 | 17 | |||
| 1 | 9 (52,9%) | 7 (58,3%) | 2 (40,0%) | ||
| 2 | 6 (35,3%) | 4 (33,3%) | 2 (40,0%) | ||
| 3 | 2 (11,8%) | 1 (8,33%) | 1 (20,0%) | ||
| EAI hepático | 0,306 | 132 | |||
| No | 128 (97,0%) | 86 (95,6%) | 42 (100%) | ||
| Sí | 4 (3,03%) | 4 (4,44%) | 0 (0,00%) | ||
| Grado | 4 | ||||
| 1 | 2 (50,0%) | 2 (50,0%) | 0 | ||
| 2 | 2 (50,0%) | 2 (50,0%) | 0 |
EAI: efecto adverso inmunomediado.
Análisis de pacientes estratificado por grupos de edad
| Grupos de edad (años) | |||||
|---|---|---|---|---|---|
| (26,5 a 63,4)(n=43) | (63,4 a 70,2)(n=44) | (70,2 a 87)(N=44) | p | n | |
| Sexo | 0,307 | 131 | |||
| Hombre | 27 (62,8%) | 34 (77,3%) | 29 (65,9%) | ||
| Mujer | 16 (37,2%) | 10 (22,7%) | 15 (34,1%) | ||
| Tipo tumor | 0,072 | 130 | |||
| Melanoma | 6 (14,3%) | 7 (15,9%) | 16 (36,4%) | ||
| Pulmón | 31 (73,8%) | 33 (75,0%) | 22 (50,0%) | ||
| Urotelio | 3 (7,14%) | 4 (9,09%) | 5 (11,4%) | ||
| Otros | 2 (4,76%) | 1 (2,27%) | 1 (2,27%) | ||
| Respuesta | 0,657 | 101 | |||
| Parcial | 8 (21,6%) | 5 (16,7%) | 7 (20,6%) | ||
| Enfermedad estable | 7 (18,9%) | 10 (33,3%) | 11 (32,4%) | ||
| Progresión | 22 (59,5%) | 15 (50,0%) | 16 (47,1%) | ||
| EAI gastrointestinal | 0,434 | 131 | |||
| No | 39 (90,7%) | 36 (81,8%) | 39 (88,6%) | ||
| Sí | 4 (9,30%) | 8 (18,2%) | 5 (11,4%) | ||
| Grado | 0,705 | 17 | |||
| 1 | 2 (50,0%) | 5 (62,5%) | 2 (40,0%) | ||
| 2 | 1 (25,0%) | 3 (37,5%) | 2 (40,0%) | ||
| 3 | 1 (25,0%) | 0 (0,00%) | 1 (20,0%) | ||
| EAI hepático | 0,126 | 131 | |||
| No | 40 (93,0%) | 44 (100%) | 43 (97,7%) | ||
| Sí | 3 (6,98%) | 0 (0,00%) | 1 (2,27%) | ||
| Grado | 1,000 | 4 | |||
| 1 | 1 (33,3%) | 0 | 1 (100%) | ||
| 2 | 2 (66,7%) | 0 | 0 (0,00%) | ||
EAI: efecto adverso inmunomediado.
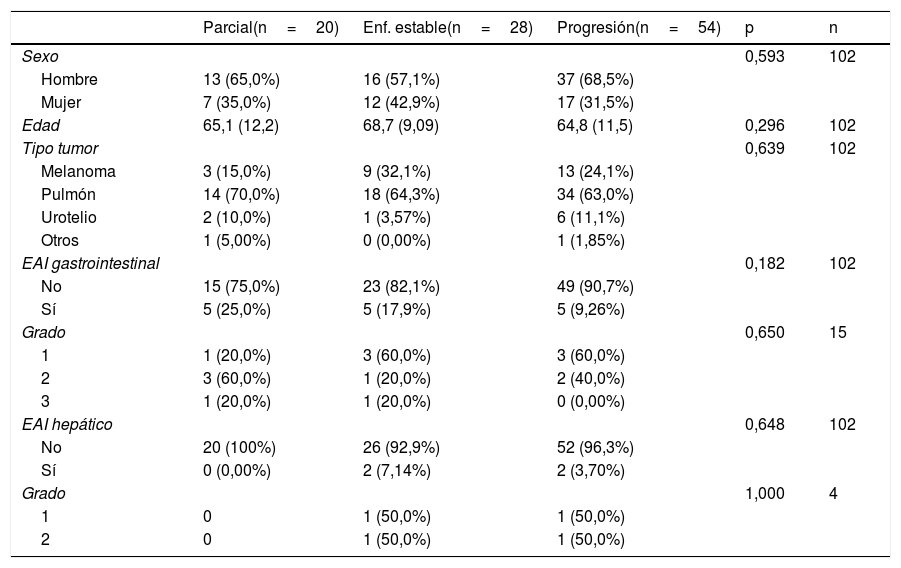
En términos de aparición de toxicidad digestiva según el tipo de respuesta al tratamiento, el 25% (n=5) de los que obtuvieron respuesta parcial presentaron dicho evento adverso, siendo del 17,9% (n=5) en los que presentaron estabilidad de la enfermedad y del 9,26% (n=5) en los que presentaron progresión de la misma. En cuanto a toxicidad hepática, ninguno de los pacientes que presentaron respuesta parcial presentó hepatotoxicidad; sí apareció en el 7,14% de los pacientes que presentaron criterios de enfermedad estable y en el 3,7% (n=2) de los que presentaron progresión. Estos resultados no fueron estadísticamente significativos (tabla 5).
Análisis de pacientes estratificado por tipo de respuesta
| Parcial(n=20) | Enf. estable(n=28) | Progresión(n=54) | p | n | |
|---|---|---|---|---|---|
| Sexo | 0,593 | 102 | |||
| Hombre | 13 (65,0%) | 16 (57,1%) | 37 (68,5%) | ||
| Mujer | 7 (35,0%) | 12 (42,9%) | 17 (31,5%) | ||
| Edad | 65,1 (12,2) | 68,7 (9,09) | 64,8 (11,5) | 0,296 | 102 |
| Tipo tumor | 0,639 | 102 | |||
| Melanoma | 3 (15,0%) | 9 (32,1%) | 13 (24,1%) | ||
| Pulmón | 14 (70,0%) | 18 (64,3%) | 34 (63,0%) | ||
| Urotelio | 2 (10,0%) | 1 (3,57%) | 6 (11,1%) | ||
| Otros | 1 (5,00%) | 0 (0,00%) | 1 (1,85%) | ||
| EAI gastrointestinal | 0,182 | 102 | |||
| No | 15 (75,0%) | 23 (82,1%) | 49 (90,7%) | ||
| Sí | 5 (25,0%) | 5 (17,9%) | 5 (9,26%) | ||
| Grado | 0,650 | 15 | |||
| 1 | 1 (20,0%) | 3 (60,0%) | 3 (60,0%) | ||
| 2 | 3 (60,0%) | 1 (20,0%) | 2 (40,0%) | ||
| 3 | 1 (20,0%) | 1 (20,0%) | 0 (0,00%) | ||
| EAI hepático | 0,648 | 102 | |||
| No | 20 (100%) | 26 (92,9%) | 52 (96,3%) | ||
| Sí | 0 (0,00%) | 2 (7,14%) | 2 (3,70%) | ||
| Grado | 1,000 | 4 | |||
| 1 | 0 | 1 (50,0%) | 1 (50,0%) | ||
| 2 | 0 | 1 (50,0%) | 1 (50,0%) |
EAI: efecto adverso inmunomediado.
En todo paciente bajo tratamiento con ICI y con síntomas gastrointestinales hay que considerar la posibilidad de toxicidad. La clínica e incluso los hallazgos radiológicos o endoscópicos pueden simular otras entidades, siendo necesario su manejo multidisciplinar y el diagnóstico diferencial con la enfermedad inflamatoria intestinal, infecciones (clostridioides, citomegalovirus, etc.)26 o incluso la progresión tumoral, entre otros27.
En nuestro estudio la toxicidad gastrointestinal y cutánea fueron las más frecuentemente observadas, con una incidencia de EAI similar a las descritas en otras series: 12,9% de toxicidad gastrointestinal y 3% de toxicidad hepática14-18. Respecto a la hepatotoxicidad, no se registró ningún caso de insuficiencia hepática grave. No se produjo ningún fallecimiento derivado del uso del ICI, identificando tan solo un caso de toxicidad gastrointestinal grado4 en un paciente bajo tratamiento combinado. En otras series se han descrito la toxicidad pulmonar y cardiaca como las principales causas de mortalidad28,29.
Según las recomendaciones vigentes de la Sociedad Europea de Oncología Médica (European Society for Medical Oncology [ESMO])12, en pacientes con diarrea leve (grado1) un manejo sintomático será suficiente, pudiendo mantener el tratamiento en la mayoría de las ocasiones. En los casos moderados-graves (grado2-4) será necesario aplazar o interrumpir el ICI, considerando el empleo de corticoides o inmunosupresores como antiTNF si persiste la situación de gravedad a pesar de la suspensión del fármaco30. También se ha descrito el empleo de vedolizumab en estos pacientes, si bien los datos disponibles son todavía escasos31.
Por otra parte, en casos de hepatotoxicidad se recomienda la monitorización de los niveles de transaminasas e iniciar corticoterapia o incluso inmunosupresores en casos de hepatitis grave, valorando la realización de biopsia hepática, así como el traslado del paciente a un centro de referencia si fuera preciso12. Hay que tener en cuenta que el inicio de un tratamiento inmunosupresor en estos pacientes supone un riesgo adicional de complicaciones que habrá que vigilar de forma estrecha32.
En el caso de nuestro estudio, el manejo de los EAI se realizó acorde a las guías clínicas actualmente vigentes12,33, aunque se hicieron algunas excepciones en cuanto al empleo de esteroides: en 3 de los 9 pacientes con colitis grado1 se emplearon corticoides a dosis bajas por persistencia de los síntomas a pesar del tratamiento sintomático. En todos los casos fue posible la retirada del corticoide sin empeoramiento posterior clínico ni analítico del paciente. Por otra parte, en 2 de los 6 pacientes con toxicidad gastrointestinal grado2 se obtuvo la remisión con un manejo conservador, sin ser preciso el uso de corticoides.
En la actualidad no disponemos de factores predictores de toxicidad ni se ha establecido una clara relación entre la dosis de ICI empleada y su gravedad34,35. En este sentido, en los últimos años se ha trabajado en la búsqueda de marcadores que permitan detectar o predecir el riesgo de dichos efectos adversos. La calprotectina fecal presenta una alta sensibilidad y especificidad en el diagnóstico de diarrea inflamatoria. No obstante, no es específica para la detección de colitis inmunomediada, y a pesar de que su elevación refleja inflamación intestinal, no predice el desarrollo de dicha toxicidad36. En cuanto a otros marcadores, como la proteínaC reactiva y la albúmina sérica, estos pueden ser de utilidad, pero debe tenerse en cuenta su baja especificidad, ya que sus valores pueden verse afectados por otros procesos inflamatorios sistémicos. Otros estudios han valorado la utilidad de otros biomarcadores, como la interleucina-17 sérica y el recuento sanguíneo de eosinófilos en estos pacientes, identificando un incremento de sus valores en casos de toxicidad, pero sin ser claros predictores de esta37,38.
Por otra parte, se han descrito las enfermedades inflamatorias o autoinmunes, así como el trasplante de órgano sólido o células hematopoyéticas, entre otros, como posibles factores de riesgo de desarrollo de EAI, si bien los datos publicados hasta la fecha son contradictorios, y nuestro estudio tampoco identificó un claro perfil de riesgo39,40. Del mismo modo, el grado de toxicidad inmunomediada no parece ser un factor predictor de la eficacia de dichas terapias, lo cual se ha visto reproducido en el análisis que hemos llevado a cabo41. No obstante, estudios previos han descrito una mayor respuesta oncológica con algunos tratamientos combinados, así como una mayor incidencia de determinados EAI con ciertos ICI15,42-44, llegando incluso a relacionar su aparición con la microbiota intestinal del paciente45,46.
ConclusionesLos EAI gastrointestinales figuran entre los más frecuentemente observados en pacientes en tratamiento con ICI. La aparición de EAI no se relacionó con la respuesta al tratamiento en nuestro estudio. El manejo multidisciplinar y un mayor conocimiento de dichos eventos podría ayudarnos a reducir su morbimortalidad, así como las interrupciones del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.