Los pacientes con lesión medular (LM) pueden presentar alteraciones de la motilidad intestinal y síntomas digestivos que se asocian a sobrecrecimiento bacteriano del intestino delgado (SIBO). El objetivo de este estudio es investigar la prevalencia de SIBO en pacientes con LM y los factores asociados a su desarrollo.
MétodosSe estudió a 29 pacientes consecutivos con LM (10 mujeres/19 hombres; edad media 47 años), 16 con lesiones subagudas (< 9 meses) y 13 con lesiones crónicas (> 1 año). Nueve pacientes estaban afectados de tetraplejía y 15 de paraplejía. A cada paciente se realizó un test del aliento con glucosa de acuerdo con el Consenso Norteamericano y se evaluó la presencia de síntomas abdominales durante la prueba.
Los resultados se compararon con los de 15 pacientes con SIBO sin enfermedad neurológica.
ResultadosSeis pacientes fueros positivos para SIBO (21%), todos ellos afectados de LM en fase subaguda, 6/16 vs. 0/13 en fase crónica (p<0,05) y la mayoría afectados de tetraplejía, 5/9 vs. 1/19 con paraplejía (p<0,05). No se encontró relación estadísticamente significativa con otros parámetros clínicos. Todos los test fueron positivos para metano o mixto (metano e hidrógeno), mientras que solo el 67% de los controles tenían producción predominante de metano (p>0,05).
ConclusiónLos pacientes con LM pueden desarrollar SIBO, siendo más frecuente en fase subaguda y en tetrapléjicos, destacando la alta producción de metano. Esta complicación debe tenerse en cuenta en el manejo del intestino neurógeno.
Spinal cord injury (SCI) patients may have intestinal dysmotility and digestive symptoms that are associated with small intestinal bacterial overgrowth (SIBO). The aim of this study is to describe the prevalence of SIBO in SCI patients and the risk factors of its development.
MethodsTwenty-nine consecutive SCI patients were studied (10 women/19 men; mean age 47 years), 16 with subacute injuries (<9 months) and 13 with chronic injuries (>1 year). Nine patients were affected by tetraplegia and 15 by paraplegia. Each patient underwent a glucose breath test according to the North American Consensus and the presence of abdominal symptoms was evaluated during the test.
The results were compared with 15 non-neurological patients with SIBO.
ResultsSix patients tested positive for SIBO (21%), all of them affected by SCI in the subacute phase, 6/16 vs. 0/13 in the chronic phase (P<.05) and the majority with tetraplegia, 5/9 vs. 1/19 with paraplegia (P<.05). No statistically significant relationship was found with other clinical characteristics. All the tests were positive for methane or mixed (methane and hydrogen), while only 67% of the controls had methane-predominant production (P>.05).
ConclusionSCI patients can develop SIBO, more frequently in the subacute phase and in tetraplegic patients, highlighting a high production of methane. This complication should be considered in neurogenic bowel management.
El sobrecrecimiento bacteriano del intestino delgado, conocido con el acrónimo en inglés SIBO (small intestinal bacterial overgrowth), se caracteriza por la presencia de un número excesivo de bacterias en el intestino delgado que normalmente se hallan en el intestino grueso. La mayoría de los autores consideran que para el diagnóstico de SIBO se requiere un hallazgo de ≥ 105 unidades formadoras de colonias / ml, en la aspiración de la porción proximal del yeyuno1,2.
Los pacientes con SIBO pueden presentar síntomas gastrointestinales, e incluso no gastrointestinales, debido a los efectos negativos del número excesivo de bacterias en la digestión de los alimentos1. Estos incluyen: hinchazón, flatulencias, dolor abdominal, náuseas, dispepsia, fatiga; en lo que se refiere a las deposiciones, la diarrea es un síntoma frecuente, aunque aquellos con SIBO de predominancia metanógena tienen 5veces más probabilidades de tener estreñimiento, cuya severidad dependerá del nivel de metano3. La disminución de absorción de nutrientes, la pérdida de peso, la anemia y la deficiencia de vitaminas y hierro son síntomas menos frecuentes, pero manifestaciones más graves de SIBO4.
La fisiopatología del SIBO es compleja y está asociada a múltiples causas: reducción de la producción de ácido gástrico (inhibidores de la bomba de protones, gastritis crónica, edad avanzada), alteración de la motilidad intestinal (neuropatía visceral primaria, esclerodermia, fármacos anticolinérgicos, mórficos, narcóticos y antidiarreicos), alteraciones anatómicas del intestino (obstrucción intestinal, divertículos, fístulas, resecciones íleo-cecales previas, adherencias), alteraciones inmunitarias sistémicas o localizadas, entre otras. Además, se ha observado SIBO en diversas enfermedades neurológicas y no neurológicas, como la enfermedad de Parkinson, el síndrome del intestino irritable, la cirrosis, la pancreatitis crónica, la obesidad, la fibrosis quística, el fallo renal crónico, la enfermedad celiaca, la diabetes mellitus, el hipotiroidismo, la encefalopatía hepática o la fibromialgia2,4.
Las personas que han presentado una lesión medular (LM) sufren alteraciones de la movilidad, la sensibilidad, el control autonómico y las funciones esfinterianas, presentando una vejiga y un intestino neurógenos. El grado de afectación dependerá del nivel neurológico de la lesión (tetraplejía o paraplejía) y su gravedad (completa o incompleta). En cuanto al intestino neurógeno, los 2síntomas principales son el estreñimiento y la incontinencia anal. Los mecanismos fisiopatológicos responsables de esta disfunción son el enlentecimiento del tiempo de tránsito colónico, la alteración de la sensibilidad anorrectal, la alteración del control voluntario del esfínter anal externo y la musculatura del periné, la alteración de los reflejos extrínsecos (reflejo recto-anal excitatorio y reflejo de la tos) y alteración de la maniobra defecatoria5,6. A estos mecanismos se le suma la disminución de la actividad física, la pérdida de independencia y la necesidad de medicación que favorece el estreñimiento, como los anticolinérgicos o antiálgicos. El estreñimiento y la incontinencia anal se acompañan de otros síntomas, como la distensión y el dolor abdominal con una prevalencia del 22-40% y el 18-33%, respectivamente7-9.
Pocos estudios se han publicado sobre SIBO y LM. Cheng et al.10 investigaron la asociación entre SIBO y trombosis venosa profunda en pacientes con LM, encontrando una asociación estadísticamente significativa entre ambos y una prevalencia de SIBO del 38%. Ojetti et al.11 estudiaron la prevalencia del sobrecrecimiento bacteriano y la producción de CH4 en pacientes con mielomeningocele, encontrando SIBO en el 39% de los niños, además de una correlación entre la producción de CH4, el aumento del tiempo de tránsito intestinal y las infecciones del tracto urinario.
Dado que los pacientes con LM tienen factores de riesgo para presentar SIBO, y clínica compatible, así como la escasa literatura al respecto, se ha realizado este estudio con los siguientes objetivos: 1) evaluar la prevalencia de SIBO en un grupo de pacientes con LM; 2) determinar los factores que puedan contribuir a la presencia de SIBO y su relación con las características neurológicas de la lesión y de la función intestinal, y 3) comparar los resultados del test del aliento de los pacientes con SIBO con los resultados en pacientes sin lesión neurológica y SIBO.
Pacientes y métodosSe ha realizado un estudio observacional transversal de 29 pacientes consecutivos atendidos en el Institut Guttmann.
Se excluyó a los pacientes menores de 18 años y los mayores de 75 años, y a los que presentaban alteraciones cognitivas que impedían la comprensión del estudio o su colaboración.
A todos los pacientes se les realizó una evaluación clínica y un test del aliento con glucosa para investigar el SIBO.
Como grupo control se incluyó a 15 pacientes consecutivos con resultado positivo para SIBO del test de aliento con glucosa realizado en el Laboratorio de Pruebas Funcionales Digestivas del Hospital Germans Trias i Pujol, que no tenían LM ni otra enfermedad neurológica, con el objetivo de comparar, entre los 2grupos, las características del resultado positivo del test.
Evaluación clínicaLa evaluación clínica ha consistido en una entrevista estructurada personal y una exploración física.
La entrevista estructurada recogía datos del paciente, de la LM (fecha, etiología), medicación habitual y las características del programa de evacuación: lugar de evacuación y dependencia de otra persona, método de evacuación (digitación anal, estimulación química con supositorio y presión intraabdominal) y los resultados del programa de evacuación: frecuencia, tiempo empleado, consistencia de las heces (escala de Bristol), incontinencia anal, evaluada mediante la escala de Wexner12, estreñimiento mediante los criterios Roma IV13, dolor abdominal y distensión abdominal evaluadas cada una mediante una escala numérica del 0 al 10 (0=ausencia/10=máximo). También se ha incluido una valoración subjetiva de la función intestinal mediante una escala numérica del 0 al 10 y la severidad del intestino neurógeno mediante el Neurogenic Dysfunction Bowel Score14.
En la exploración física se han evaluado las características neurológicas de la lesión, el peso y la talla, y el perímetro a nivel umbilical. Las características de la lesión se han evaluado de acuerdo con la International Standards for Neurological Classification of Spinal Cord Injury15, determinando el nivel neurológico de la lesión (cervical, dorsal o lumbar) y su severidad mediante la American Spinal Injury Association Impairment Scale (ASIA) (A, B, C y D). Los pacientes se han agrupado según el nivel de lesión en tetraplejía y paraplejía, y en cuanto a la severidad de la lesión en completos motores (sin actividad motora voluntaria por debajo del nivel neurológico de la lesión, ASIA A o B) y con lesión motora incompleta (presencia de actividad motora voluntaria por debajo del nivel neurológico de la lesión, ASIA C o D).
Test del alientoA todos los pacientes se les realizó el test del aliento con glucosa siguiendo las recomendaciones del Consenso Norteamericano16.
Dos semanas previas al test los pacientes no debían haber tomado antibióticos ni laxantes con contenido en fibra o derivados de azúcares, así como preparaciones de laxantes para endoscopia o radiología del colon. La noche antes de la prueba debían seguir una dieta sin alimentos fermentables como los hidratos de carbono complejos.
El test se realizó tras 8-12h de ayuno habiendo realizado higiene bucal con un antiséptico y evitándose, durante la prueba, el tabaco y la actividad física. Se administraron 75g de glucosa diluidos en agua. Previamente a la toma de la glucosa y cada 15 min tras la toma, hasta un periodo total de 120 min, se recogió una muestra de aire espirado en bolsas herméticas metalizadas (Quintron, Millwalkee, EE. UU.) para su posterior análisis.
Tras insuflar aire en cada una de las 9 bolsas, el paciente debía valorar la presencia de los siguientes síntomas: dolor abdominal, distensión abdominal, flatulencia, retortijones, diarrea u otros síntomas mediante una escala categórica (0=nada, 1=leve, 2=moderado, 3=intenso).
Las muestras fueron analizadas antes de las 6h posteriores a su recolección mediante un cromatógrafo de gases (Quintron, Milwalkee, EE. UU.), determinando simultáneamente los valores de H2, CH4 y CO2.
Se consideró el test positivo cuando hubo un incremento ≥ 20 p.p.m. de H2 o ≥ 10 p.p.m. de metano por encima de la línea de la medición basal (previa a la administración de glucosa) en 2mediciones consecutivas.
El estudio fue aprobado por el Comité de Ética del Instituto Guttmann y previamente al inicio de este los pacientes firmaron el consentimiento informado.
Análisis de datosSe realizó un análisis descriptivo de las principales características de la muestra de estudio, en cuanto a variables demográficas y clínicas, así como los resultados del test del aliento. Las variables categóricas se han descrito mediante frecuencia y porcentajes. Las variables continuas se han detallado con la media y la desviación estándar.
Se ha realizado un estudio bivariante utilizando la prueba de la t de Student para las variables continuas y la prueba de la chi-cuadrado para las variables categóricas. De acuerdo a esto, se construyeron tablas de contingencia de los pacientes en función de las características del paciente y su función intestinal, el nivel neurológico y la escala ASIA, y el tiempo de evolución de la lesión, y se compararon los resultados del test de aliento (positivo/negativo). Finalmente, se estudió la asociación entre el resultado del test del aliento y la presencia o no de LM.
Se ha considerado un nivel de significación p < 0,05.
ResultadosCaracterísticas de los pacientes y de su función intestinalLa muestra está constituida por 10 mujeres y 19 hombres con una edad media de 47 años (18-75), 16 con una LM en fase subaguda (< 9 meses de evolución [media 5; rango 2-9]) y 13 en fase crónica (> 1 año de evolución [media 14; rango 2-29]). La etiología de la lesión fue traumática en 25 casos y no traumática en 4. De acuerdo con la International Standards for Neurological Classification of Spinal Cord Injury, el nivel neurológico de la lesión era tetraplejía en 9 pacientes y paraplejía en 20. Según la ASIA, 19 pacientes eran completos motores (ASIA A o B) y 10 incompletos motores (ASIA C o D).
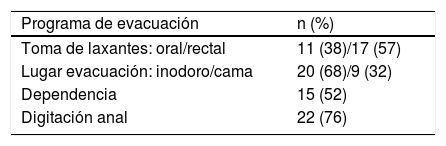
El 65% (n=19) tomaba alguna medicación con riesgo de contribuir a la presencia de SIBO, la mayoría anticolinérgicos, opioides o inhibidores de la bomba de protones. Las características de la función intestinal de los pacientes estudiados quedan recogidas en la tabla 1.
Características de la función intestinal de los pacientes con lesión medular incluidos en el estudio
| Programa de evacuación | n (%) |
| Toma de laxantes: oral/rectal | 11 (38)/17 (57) |
| Lugar evacuación: inodoro/cama | 20 (68)/9 (32) |
| Dependencia | 15 (52) |
| Digitación anal | 22 (76) |
| Resultados programa de evacuación | n (%)/media (rango) |
| Ritmo: > 24-48 h/72 h-> 72 h | 28 (97)/1 (3) |
| Tiempo empleado: < 30 min/> 30 min | 21 (72)/8 (28) |
| Consistencia heces (escala de Bristol) | 3,5 (1-6) |
| Incontinencia anal (escala de Wexner) | 6,6 (1-14) |
| Estreñimiento (Criterios Roma IV) | 23 (79) |
| Neurogenic bowel dysfunction score | 12,7 (1-26) |
| Distensión abdominal | 4 (1-10) |
| Dolor abdominal | 2,3 (0-10) |
| Valoración subjetiva de la función intestinal | 5,5 (0-10) |
El grupo de pacientes sin lesión neurológica eran 4 hombres y 11 mujeres con una edad media de 60,4 años (40-79).
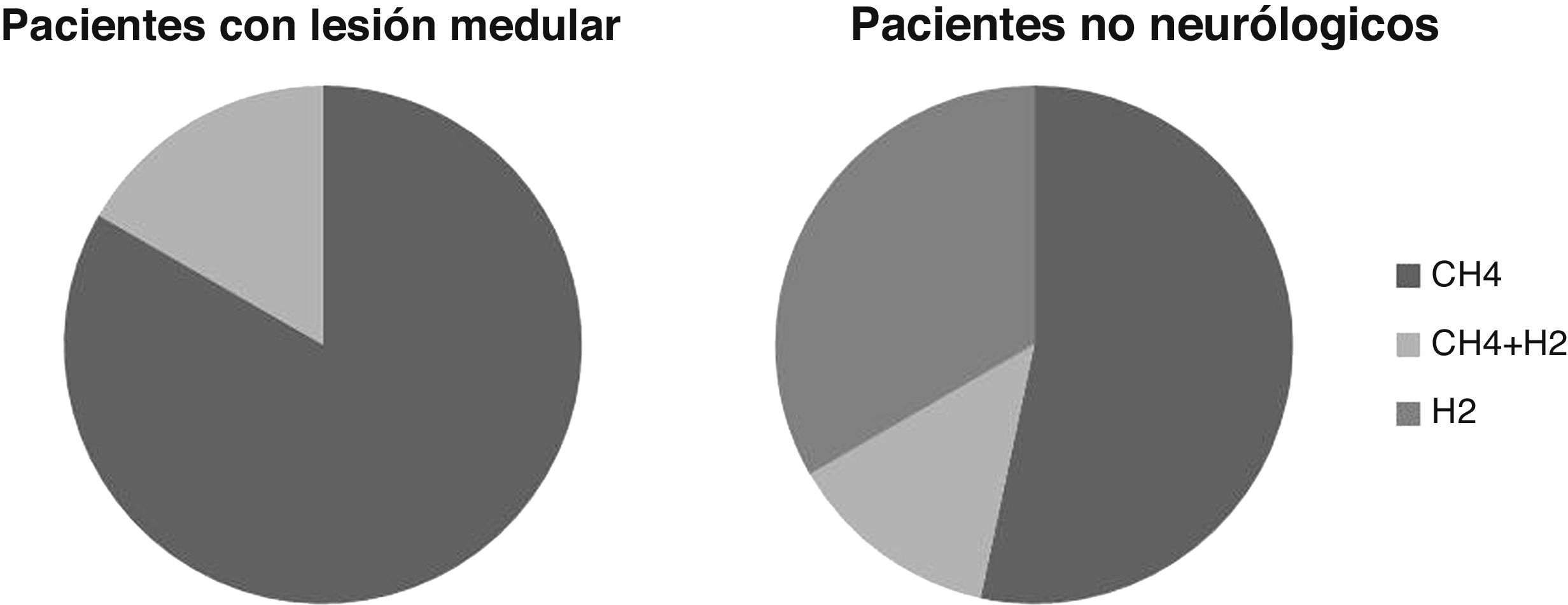
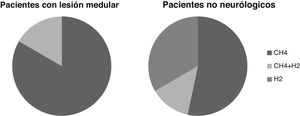
Test del alientoEl test del aliento fue positivo para SIBO en 6 casos, un 21% de los pacientes estudiados. En 5casos fue positivo por incremento de CH4 y en uno por incremento de CH4 y H2. Ninguno fue positivo solo por incremento aislado de H2.
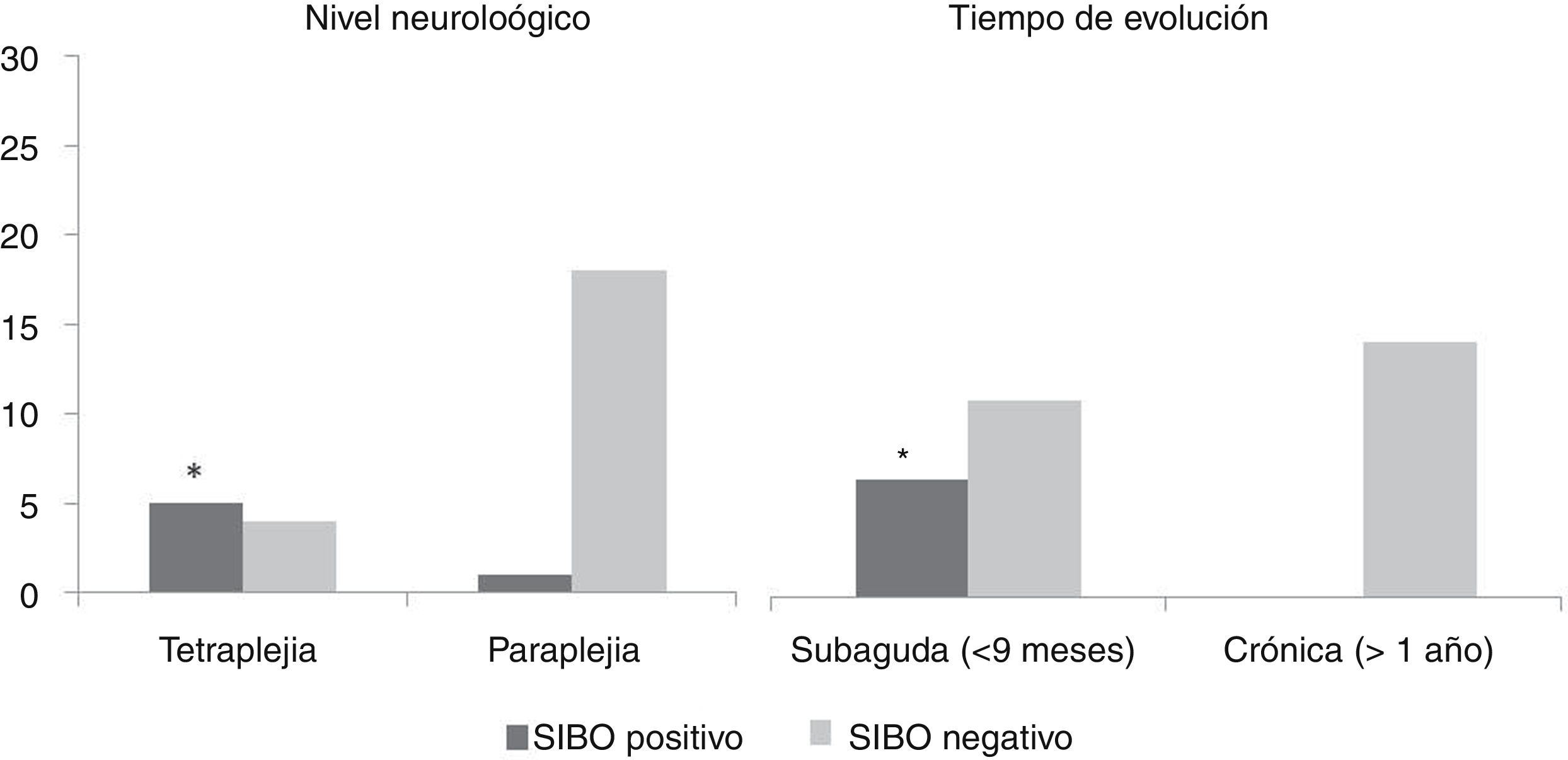
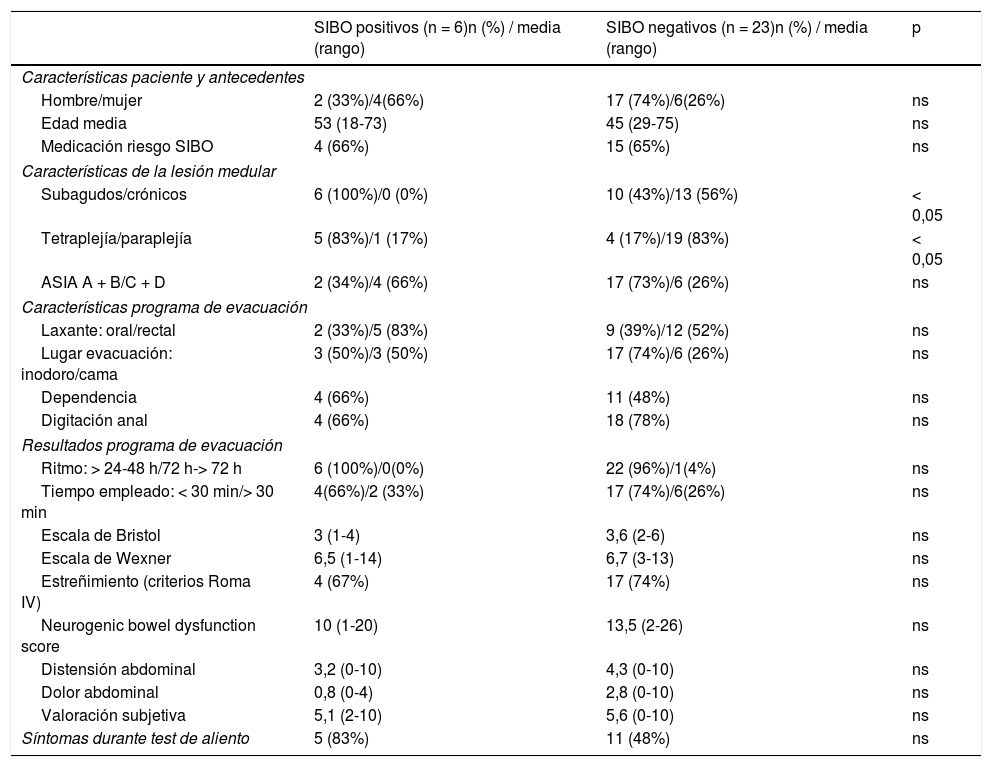
En la tabla 2 se muestra un análisis comparativo entre los casos positivos y negativos para el test de SIBO en cuanto a las características demográficas, de la LM características programa de evacuación y de los síntomas digestivos. No se han encontrado diferencias estadísticamente significativas en cuanto al género y la edad, las características de la función intestinal y los síntomas digestivos ni la clínica presentada durante la realización del test. Sí que se han encontrado diferencias estadísticamente significativas (p < 0,05) en relación con el tiempo de evolución de la lesión (todos los pacientes con test positivo se encontraban en la fase subaguda de la lesión) y con el nivel neurológico de la lesión (más frecuente en pacientes con tetraplejía). No se encontró relación en cuanto a la etiología de la lesión y a la escala de deficiencia de ASIA (fig. 1)
Características de los pacientes con lesión medular con test del aliento positivo y negativo para SIBO
| SIBO positivos (n = 6)n (%) / media (rango) | SIBO negativos (n = 23)n (%) / media (rango) | p | |
|---|---|---|---|
| Características paciente y antecedentes | |||
| Hombre/mujer | 2 (33%)/4(66%) | 17 (74%)/6(26%) | ns |
| Edad media | 53 (18-73) | 45 (29-75) | ns |
| Medicación riesgo SIBO | 4 (66%) | 15 (65%) | ns |
| Características de la lesión medular | |||
| Subagudos/crónicos | 6 (100%)/0 (0%) | 10 (43%)/13 (56%) | < 0,05 |
| Tetraplejía/paraplejía | 5 (83%)/1 (17%) | 4 (17%)/19 (83%) | < 0,05 |
| ASIA A + B/C + D | 2 (34%)/4 (66%) | 17 (73%)/6 (26%) | ns |
| Características programa de evacuación | |||
| Laxante: oral/rectal | 2 (33%)/5 (83%) | 9 (39%)/12 (52%) | ns |
| Lugar evacuación: inodoro/cama | 3 (50%)/3 (50%) | 17 (74%)/6 (26%) | ns |
| Dependencia | 4 (66%) | 11 (48%) | ns |
| Digitación anal | 4 (66%) | 18 (78%) | ns |
| Resultados programa de evacuación | |||
| Ritmo: > 24-48 h/72 h-> 72 h | 6 (100%)/0(0%) | 22 (96%)/1(4%) | ns |
| Tiempo empleado: < 30 min/> 30 min | 4(66%)/2 (33%) | 17 (74%)/6(26%) | ns |
| Escala de Bristol | 3 (1-4) | 3,6 (2-6) | ns |
| Escala de Wexner | 6,5 (1-14) | 6,7 (3-13) | ns |
| Estreñimiento (criterios Roma IV) | 4 (67%) | 17 (74%) | ns |
| Neurogenic bowel dysfunction score | 10 (1-20) | 13,5 (2-26) | ns |
| Distensión abdominal | 3,2 (0-10) | 4,3 (0-10) | ns |
| Dolor abdominal | 0,8 (0-4) | 2,8 (0-10) | ns |
| Valoración subjetiva | 5,1 (2-10) | 5,6 (0-10) | ns |
| Síntomas durante test de aliento | 5 (83%) | 11 (48%) | ns |
ASIA: American Spinal Injury Association Impairment Scale; SIBO: sobrecrecimiento bacteriano del intestino delgado.
En los pacientes sin lesión neurológica el test del aliento fue positivo para SIBO debido al aumento aislado de H2 en 5 pacientes, de CH4 en 8 casos y de H2 y CH4 en 2 casos. El porcentaje de pacientes positivos por incremento de H2 es mayor que en los pacientes con LM, aunque estas diferencias no son estadísticamente significativas (p > 0,05) (fig. 2).
DiscusiónEn este estudio se ha demostrado que los pacientes con LM pueden presentar SIBO, especialmente en la fase subaguda de la lesión y en los pacientes afectados de tetraplejía.
Al producirse una LM la motilidad intestinal se ve afectada por la alteración de su regulación nerviosa extrínseca (sistemas simpático/parasimpático y somático), además de por otros factores que también pueden causar dismotilidad secundaria, como la inmovilidad o la toma de determinados fármacos. Se ha descrito un enlentecimiento del tránsito del intestino delgado en los pacientes con LM17, así como del tiempo de tránsito colónico5,6. Ya que la motilidad intestinal es el mecanismo de protección más importante para la prevención del SIBO1,2, deberá tenerse en cuenta como factor predisponente en estos pacientes.
Por otro lado, hay que tener en cuenta que el 83% de los casos con SIBO corresponden a pacientes con lesiones cervicales, donde el nivel de afectación de la musculatura que ejerce su influencia sobre las funciones intestinales es muy importante, siendo además los que tienen una mayor afectación funcional digestiva derivada de la LM18.
Otro hallazgo del presente estudio es la mayor existencia de SIBO en pacientes en fase subaguda de la lesión. Aquí debe recordarse que el frágil equilibrio de la microbiota intestinal, en cuanto a su composición y crecimiento, puede verse alterado por múltiples factores1 que pueden estar presentes en los pacientes con LM en fase subaguda como son la toma de antibióticos, debido al incremento en el número de infecciones a los que se ven expuestos, la alteración en los hábitos dietéticos durante su estancia hospitalaria, el estrés al que los pacientes en fase subaguda se ven sometidos tras la LM, en especial la alteración en los hábitos de vida que comporta una lesión cervical. Este factor no solo influirá a nivel de la microbiota intestinal, sino que hay estudios que muestran su influencia sobre la permeabilidad intestinal19, la alteración en la producción de ácido gástrico y en la motilidad intestinal20. Otros factores que pueden estar presentes en la fase aguda de la lesión y contribuir a la presencia de SIBO son mecanismos inmunitarios, el sistema inmune deprimido acrecienta el riesgo de presentar SIBO21 y afectación de la barrera gástrica/pH, por el efecto de fármacos como los inhibidores de bomba de protones.
Por otra parte, pueden existir otros factores inherentes al propio paciente, tales como alteraciones en los mecanismos endógenos de defensa para prevenir el sobrecrecimiento bacteriano: disfunción de la válvula íleo-cecal, alteración de las secreciones pancreático-biliares, entre otros1,2.
Existe escasa literatura científica sobre el SIBO en pacientes con LM y no describen las relaciones con las características de la lesión como en nuestro trabajo. Los 2estudios publicados previamente, ya comentados en la introducción, describen una mayor prevalencia de SIBO que en nuestro trabajo, 38-39%, y encuentran una relación entre el SIBO y síntomas como el dolor abdominal11, la distensión abdominal y la flatulencia10. En cambio, en nuestro caso, no hemos encontrado relación con la clínica digestiva que presentan los pacientes. El estudio de Cheng et al.10 valora una muestra de pacientes agudos, mucho más amplia que la nuestra (469 pacientes), y el estudio de Ojetti et al.11 es en pacientes pediátricos con una lesión congénita, por lo que los resultados podrían diferir por las características diferentes de los sujetos. Aunque en nuestro estudio no hemos encontrado relación con las características de la disfunción intestinal, pensamos que el SIBO puede haber contribuido a los trastornos intestinales que presentan, si bien, no como único factor, ya que la fisiopatología del intestino neurógeno es compleja y son muchos los mecanismos fisiopatológicos implicados5,6.
De todas formas, con Ojetti et al.11 coincidimos en encontrar una alta producción de CH4 y la relacionan con un tiempo de tránsito intestinal más largo y una mayor prevalencia de infecciones del tracto urinario, aspectos que nosotros no hemos estudiado. Del mismo modo, Cheng et al.10 relacionan la presencia de SIBO con una mayor incidencia de trombosis venosa profunda. Destaca la relación que encuentran en ambos estudios entre SIBO y complicaciones frecuentes en pacientes con LM (infecciones urinarias y trombosis venosa profunda).
Las limitaciones de este estudio son el tamaño pequeño de la muestra que no nos permite ser concluyentes con la repercusión del SIBO en la clínica digestiva de los pacientes con LM y buscar su relación con otras complicaciones presentes en las personas con LM. Por el contrario, consideramos que sus puntos fuertes consisten en el estudio del SIBO con relación a las características de la LM y la comparación con pacientes no neurológicos.
En conclusión, los pacientes con LM pueden presentar SIBO durante la fase subaguda de la lesión y especialmente en tetraplejías, con una producción marcada de CH4. Aunque no se ha encontrado relación con las características de su función intestinal, debe considerarse la presencia de SIBO en estos pacientes. Se precisan estudios más amplios para poder correlacionar la presencia de SIBO con los síntomas digestivos en la LM.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.