La inteligencia artificial (IA) se ha convertido en una de las herramientas tecnológicas más importantes y de mayor impacto en diversos aspectos de la salud, incluyendo el desempeño clínico y el tratamiento médico o quirúrgico, con el subsecuente incremento en la calidad de vida de los pacientes1. Se trata de un software constituido por complejos algoritmos diseñados para aprender de una gran cantidad de datos y, a la vez, actualizarse de manera automática. Su propósito es ayudar a los médicos a interpretar imágenes, mejorar el flujo de trabajo y reducir los errores médicos2.
Machine learning (ML) es un sistema de aprendizaje computacional que, una vez entrenados para realizar una tarea en específico, se centra en la capacidad de inferir y aprender de estos algoritmos informáticos para así realizar predicciones de un conjunto de datos nuevos. Tiene la habilidad de aprender y mejorar automáticamente a partir de cada experiencia sin ser programados explícitamente1,3.
El aprendizaje profundo, o deep learning, es una forma avanzada y compleja de ML estructurado con diferentes niveles de algoritmos específicos denominados redes neuronales convolucionales (convolutional neural network [CNN/ConvNet]) que brindan una poderosa predicción de datos proporcionados4. Estas redes pueden aprender las características de las imágenes basadas en imágenes acumuladas que, al procesarse de manera automática y rápida, pueden ser especialmente valiosas en la medicina clínica para el análisis de imágenes médicas y en el diagnóstico basado en imágenes3,5,6.
Aplicaciones endoscópicas por IA en GastroenterologíaLa esofagogastroduodenoscopia, junto con la colonoscopia, son los procedimientos más comúnmente realizados por los gastroenterólogos, siendo estos extremadamente operadores dependientes7. Esto significa que una endoscopia de alta calidad dependerá de ciertas variables, como, por ejemplo, el tiempo empleado durante el procedimiento, además del entrenamiento y de la técnica del endoscopista para reconocer ciertas patologías. Es probable que estas variables en la práctica endoscópica perjudiquen el descubrimiento de patologías3,7. En los últimos años se han propuesto y desarrollado una amplia variedad de aplicaciones para los algoritmos de IA en endoscopia digestiva para así ayudar a garantizar procedimientos de alta calidad.
Las dos áreas de la endoscopia en las que la IA se ha estudiado y desarrollado más ampliamente son: la detección asistida por ordenador (CADe) y el diagnóstico asistido por ordenador (CADx). La primera se encarga de desarrollar algoritmos para detectar patologías, mientras que, en el segundo caso, los algoritmos se encuentran dirigidos principalmente a clasificar patologías, correctamente mediante biopsia óptica y caracterización de lesiones3.
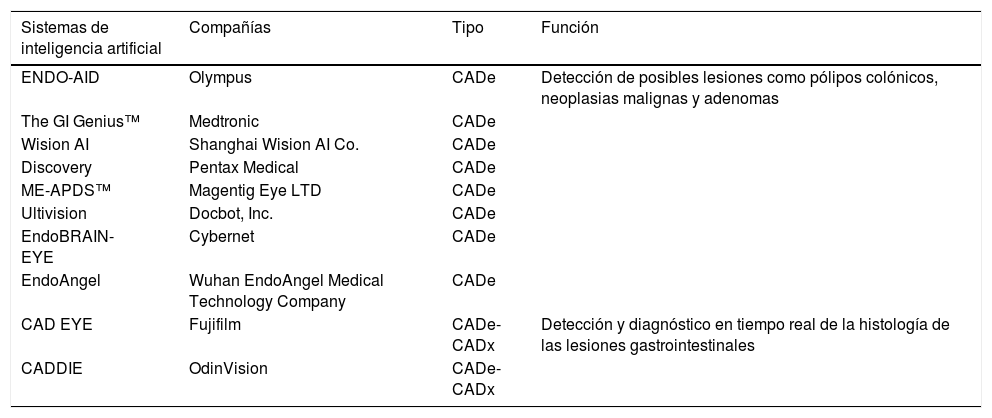
El uso de CADx ha atraído una mayor atención debido a su utilidad en la colonoscopia. Se ha demostrado que permite la clasificación histológica de pólipos de colon sin necesidad de tomar biopsias. Se trata de realizar una biopsia óptica basada en la cantidad de microestructuras superficiales que reflejan las características histológicas de una lesión. Este procedimiento ayuda al endoscopista a «resecar y desechar» los pólipos en cada situación sin necesidad de tomar una muestra y realizar análisis histológico. En la tabla 1 se describen ejemplos de modelos IA disponibles8.
Ejemplos de sistemas de inteligencia artificial
| Sistemas de inteligencia artificial | Compañías | Tipo | Función |
|---|---|---|---|
| ENDO-AID | Olympus | CADe | Detección de posibles lesiones como pólipos colónicos, neoplasias malignas y adenomas |
| The GI Genius™ | Medtronic | CADe | |
| Wision AI | Shanghai Wision AI Co. | CADe | |
| Discovery | Pentax Medical | CADe | |
| ME-APDS™ | Magentig Eye LTD | CADe | |
| Ultivision | Docbot, Inc. | CADe | |
| EndoBRAIN-EYE | Cybernet | CADe | |
| EndoAngel | Wuhan EndoAngel Medical Technology Company | CADe | |
| CAD EYE | Fujifilm | CADe-CADx | Detección y diagnóstico en tiempo real de la histología de las lesiones gastrointestinales |
| CADDIE | OdinVision | CADe-CADx |
El adenocarcinoma de esófago generalmente se diagnostica en una etapa avanzada, cuando ya tiene un mal pronóstico. Por este motivo, el adecuado seguimiento del esófago de Barrett y la erradicación de lesiones displásicas y neoplásicas tempranas asociadas son la clave para prevenir la transformación a adenocarcinoma, dado que en la actualizad disponemos de tratamientos mínimamente invasivos con alto índice curativo9.
Actualmente el cribado se basa en la visualización endoscópica directa junto con biopsias guiadas o aleatorias. La displasia dentro del esófago de Barrett puede ser difícil de identificar, lo que resulta en una baja sensibilidad de las muestras de biopsia, a pesar de los protocolos estandarizados, por lo que se considera relativamente ineficiente, ya que requiere mucho tiempo y proporciona una baja tasa de diagnósticos certeros.
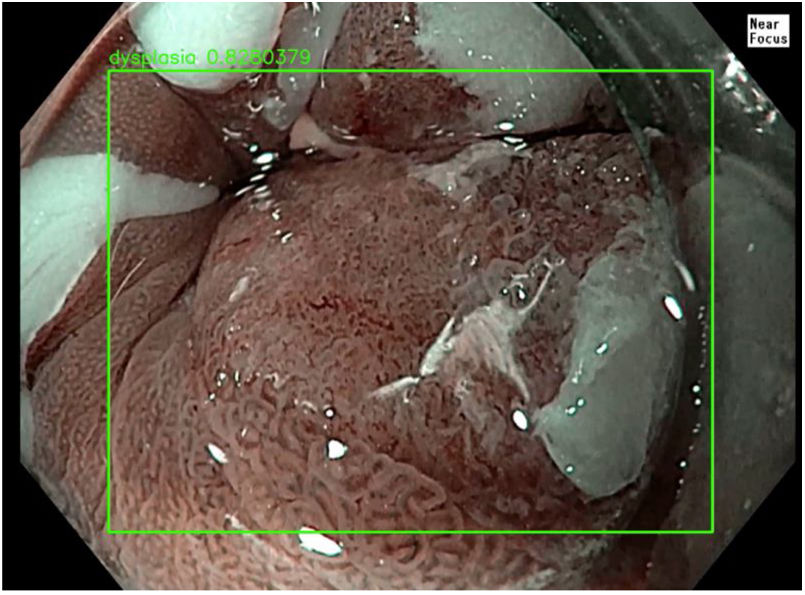
El papel de la IA en la evaluación del esófago de Barrett se enfoca en mejorar el cribado de adenocarcinoma de esófago. El uso conjunto de IA con técnicas avanzadas de imagen, como la endomicroscopia láser volumétrica (VLE), la luz blanca endoscópica y endomicroscopia con láser confocal, han demostrado altas métricas de rendimiento en comparación con endoscopistas expertos, mejorando así la sensibilidad y la rapidez del procedimiento. Esto ayuda a los endoscopistas a realizar biopsias dirigidas con mayor precisión y elimina la necesidad de realizar biopsias aleatorias, las cuales tienen una sensibilidad relativamente baja, alrededor del 64% para la detección de displasia3,10. La IA ha demostrado tener sensibilidades superiores al 90% y especificidades superiores al 80% en el diagnóstico del adenocarcinoma de esófago precoz, con apariencia endoscópica muy sutil3. Los sistemas de IA son capaces de detectar lesiones precancerosas y formas tempranas de carcinoma de células escamosas de esófago incluso con un tamaño inferior 10mm, con una sensibilidad del 98,04% y una especificidad del 95,03%3,11. En la figura 1 se demuestra displasia severa en un segmento de esófago de Barret.
Cáncer gástricoLa detección del cáncer gástrico se lleva a cabo principalmente mediante la realización de una endoscopia digestiva alta; una predicción precisa basada en imágenes endoscópicas es importante para crear una mejor estrategia de manejo para el paciente.
Por este motivo es primordial determinar la profundidad de invasión para indicar la mejor estrategia de manejo; sin embargo, la precisión general de la endoscopia convencional para definir invasión es insuficiente (69-79%)12.
Actualmente los sistemas de IA han demostrado ser útiles en el diagnóstico del cáncer gástrico con una gran precisión, detectando los puntos ciegos y las lesiones menores de 5mm; de esta manera discrimina áreas malignas de áreas no cancerosas en el estómago, implementado con ello una importante mejora en la calidad del cribado de cáncer gástrico. De la misma manera, la IA es útil en la evaluación de la profundidad de invasión del cáncer gástrico, diferenciando las lesiones que invaden más de 500μm de la submucosa de aquellas más superficiales3,12,13.
En un estudio reciente realizado por Mori et al.14, en el cual se evaluaron 790 imágenes de diferentes pacientes con cáncer gástrico, la IA presentó una sensibilidad del 76% y una especificidad del 96% en la identificación de cánceres más profundos, con respecto a la inspección visual realizada por endoscopistas. Similares resultados fueron reportados en paralelo en el estudio de Zhu et al.12.
Identificación de infección por Helicobacter pyloriHelicobacter pylori ha demostrado estar asociado al cáncer gástrico al inducir atrofia de la mucosa gástrica además de metaplasia intestinal. La gastroscopia es útil para mejorar la precisión diagnóstica de la gastritis asociada a H.pylori, aunque tiene una sensibilidad del 62% y una especificidad del 89%15. La IA es una herramienta de apoyo en la toma de decisiones relacionadas con el diagnóstico de la infección por H.pylori. Shichijo et al.16 desarrollaron un algoritmo CNN profundo de 22 capas para predecir la infección por H.pylori durante la gastroscopia y compararon su precisión diagnóstica con la de endoscopistas. La sensibilidad, la especificidad y la precisión de la CNN fueron del 81,9, del 83,4 y del 83,1%, respectivamente. Asimismo, Nakashima et al.10 crearon un sistema de IA para diagnosticar H.pylori utilizando imágenes brillantes con láser azul e imágenes en color vinculadas, demostrando cifras de sensibilidad del 96,7 y del 96,7%, respectivamente, para este modelo, adecuadas para su introducción en la práctica clínica.
Cápsula endoscópicaLa cápsula endoscópica es una técnica desarrollada con el objetivo de obtener imágenes endoscópicas de todo el intestino delgado para detectar y diagnosticar las diferentes patologías. La interpretación de las imágenes obtenidas es un desafío para la mayoría de los gastroenterólogos, debido a que requiere un alto nivel de concentración y dedicación9,11.
La inteligencia artificial, específicamente la visión por ordenador y las metodologías de aprendizaje automático, utilizan algoritmos centrados fundamentalmente en la detección de hemorragia y lesiones, disminución del tiempo de visualización, localización de la posición de la cápsula en el intestino delgado y/o mejoras en la calidad del vídeo. Con todas estas herramientas se ayuda a los médicos a leer e interpretar imágenes, mejorando su eficiencia y su precisión diagnóstica3,17.
Los algoritmos de diagnóstico asistido por ordenador ayudan a incrementar la precisión del diagnóstico mediante la clasificación de anomalías. Las características de las imágenes obtenidas endoscópicamente se pueden clasificar utilizando algoritmos de aprendizaje automático, como una máquina de vectores de soporte, una red neuronal o un clasificador binario17. La herramienta más eficaz realizada en el diagnóstico asistido por ordenador ha sido la identificación de hemorragia del intestino delgado. Este sistema de IA utiliza la extracción de características basada en colores, utilizando proporciones de los valores de intensidad de las imágenes en el dominio de rojo, verde y azul, o bien tono, saturación e intensidad, para ayudar a distinguir los segmentos intestinales que contienen o no restos hemáticos9.
Leenhardt et al.18 reportaron el uso de redes neuronales convolucionales para mejorar la detección de angiectasias gastrointestinales en el intestino delgado identificadas con cápsula endoscópica inalámbrica. La sensibilidad y la especificidad del algoritmo de diagnóstico asistido por ordenador fueron del 100 y del 96%, respectivamente, para la detección de estas ectasias vasculares. Por otro lado, Tsuboi et al.19, después de entrenar un sistema de red neuronal convolucional profundo basado en 2.237 imágenes de cápsula endoscópica de angiectasias, encontraron que tenía una sensibilidad y una especificidad del 98,8 y del 98,4%, respectivamente. En cuanto a su efectividad en la detección de pólipos, Saito et al.6 entrenaron una red neuronal convolucional profunda: utilizando 30.584 imágenes de cápsula endoscópica de lesiones protuberantes de 292 pacientes, las usaron como un conjunto de datos de imágenes de entrenamiento. Un total de 17.507 imágenes de 93 pacientes se utilizaron para probar la CNN. La sensibilidad y la especificidad de las redes neuronales convencionales fueron del 90,7% (IC95%: 90,0-91,4%) y del 79,8% (IC95%: 79,0-80,6%), respectivamente. En un análisis de subgrupos de la categoría de lesiones protuberantes, como pólipos, nódulos, tumores epiteliales, tumores submucosos y estructuras venosas, las sensibilidades fueron del 86,5, del 92,0, del 95,8, del 77,0 y del 94,4%, respectivamente.
Aunque estos sistemas tienen el potencial de ser un excelente método de detección identificando áreas de sangrado y/o lesiones vasculares y neoplásicas, aún tiene margen de mejora y son necesarios más estudios para lograr un mejor rendimiento diagnóstico.
Detección de pólipos colorrectalesEl cáncer colorrectal es una de las principales causas de muerte en todo el mundo. La colonoscopia es la técnica de elección para prevenir el cáncer colorrectal, cuya incidencia se puede reducir mediante la detección y la resección de adenomas. Sin embargo, está descrito que la tasa de detección de lesiones varía entre endoscopistas, con un porcentaje de pérdida de hasta el 27% debido a factores relacionados con las propias características del pólipo y del operador8. Esta reducción en la detección de lesiones aumenta las posibilidades posteriores de progresión de la lesión a un cáncer colorrectal. Por cada aumento del 1,0% en la tasa de detección de adenomas hay una disminución asociada del 3,0% en el riesgo de cáncer colorrectal de intervalo1,9.
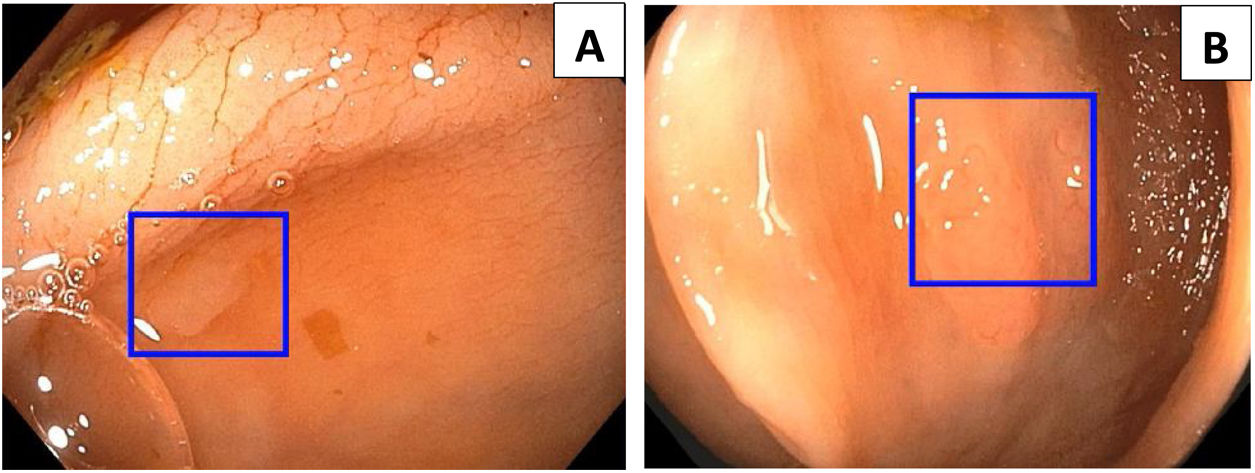
Los sistemas de IA y el aprendizaje automático, específicamente dentro del ámbito del deep learning, han llevado al desarrollo de programas de detección asistida por ordenador para ayudar a los endoscopistas en la detección de pólipos y adenomas durante la colonoscopia, fundamentalmente centrados en la detección de lesiones planas o pequeñas20. El sistema de CADe utilizado en la figura 2 es el Wision AI, el cual ayuda al operador a localizar pólipos difíciles de detectar por su tamaño o localización.
Imágenes endoscópicas captadas por el sistema de detección automática de pólipos, o CADe (por sus siglas en inglés) donde se visualizan pólipos colónicos resaltados en la pantalla por un cuadro azul que indica su ubicación. A)Pólipo de 3mm, IIA según la clasificación de París. B)Pólipo de 5mm, IS según la clasificación de París.Imágenes cortesía del Dr. Tyler Berzin, Co-director del Departamento de Endoscopia Avanzada en el Beth Israel Deaconess Medical Center.
El metaanálisis de ensayos prospectivos publicado por Barua et al.20 mostró que la colonoscopia con IA aumentaba las tasas de detección de adenomas (tasa del 29,6% [IC95%: 22,2-37,0]) y de pólipos en comparación con la colonoscopia sin IA (tasa del 19,3% [IC95%: 12,7-25,9]). Otro estudio realizado por Wang et al.17 demostró que el sistema automático de detección de pólipos en tiempo real aumenta significativamente la detección de la tasa de adenomas (29,1% frente al 20,3%, p<0,001). Min et al. crearon un sistema CADx para predecir pólipos adenomatosos frente a histología de pólipos no adenomatosos utilizando imágenes en color. Este sistema alcanzó una sensibilidad del 83,3%, una especificidad del 70,1% y una precisión del 78,4%11, demostrando que el sistema CADe puede combinarse con un sistema CADx para respaldar la estrategia de detección y diagnóstico de pólipos hiperplásicos que no requieran polipectomías para mejorar así el flujo y la carga de trabajo a los endoscopistas, así también como a los patólogos.
Ultrasonido endoscópicoEl ultrasonido endoscópico (UE) se estableció como una herramienta importante para el diagnóstico y el tratamiento de enfermedades del sistema digestivo, pero tiene algunas limitaciones, como por ejemplo la interpretación de las imágenes21. El procesamiento y el análisis de imágenes de UE utilizando CAD relacionado con la IA (IA-CAD) pueden superar esas limitaciones22.
Los datos de CNN basados en UE aún son limitados, pero hay algunos estudios que han demostrado resultados positivos con su uso. En el estudio, realizado por Chang et al. donde desarrollaron una UE-CNN para discriminar tumores subepiteliales gástricos en imágenes de UE, distinguiendo GIST del leiomioma, se logró un AUC por imagen de 0,9234, con una sensibilidad correspondiente del 95,6% y una especificidad del 82,1%, y un AUC por paciente de 0,9929, con una sensibilidad correspondiente del 100,0% y una especificidad del 85,7%23. Estos resultados podrían deberse a la capacidad de la UE-CNN para analizar imágenes a nivel de píxeles, lo que es difícil de lograr para los humanos. En otro estudio, Minoda et al.22 obtuvieron resultados similares, concluyendo que la UE-AI tiene un alto rendimiento de predicción de GIST y una buena predicción para el diagnóstico de tumores subepiteliales gástricos23. Todavía se están investigando otros usos de la IA en la UE, como la UE elastografía, la UE con contraste y la aspiración con aguja fina guiada, pero aunque los resultados sugieren ser positivos para evaluar patologías tanto benignas como malignas, aún se requieren más estudios21.
Costes para los sistemas de saludLa AI se ha implementado de forma efectiva en diferentes técnicas endoscópicas. No obstante, pese a que se espera que se acompañe de una disminución en los costes, la evidencia en este momento es escasa. Un único estudio en la literatura, publicado por Mori et al.24, aborda este tema, donde se calcularon los costos de colonoscopia al aplicar una estrategia de diagnosticar con AI y no resecar pólipos diminutos definidos como no neoplásicos, o bien el abordaje de resecar todos los pólipos identificados. En 207 pacientes con 250 pólipos diminutos localizados en recto y colon sigmoide, utilizando la primera estrategia se demostró reducir el coste de procedimientos en el 18,9, el 6,9, el 7,6 y el 10,9% en Japón, Inglaterra, Noruega y Estados Unidos, respectivamente, en comparación con el segundo tipo de abordaje.
ConclusiónLos algoritmos de la IA aparecieron inicialmente con el objetivo de limitar la variabilidad interoperadores, evitar errores humanos y disminuir fallos diagnósticos. De esta manera conducen a un aumentando en la productividad, de la capacidad y de la calidad diagnóstica, así como a la realización de una forma de trabajo más eficiente que impacta de manera positiva en el cuidado del paciente. En el campo de la endoscopia digestiva la IA ha progresado mucho en los últimos años, destacando su potencial impacto en la mejora de la calidad de la misma en diferentes aspectos.
El futuro de la IA es prometedor, ya que existen múltiples estudios que demuestran que permite mejorar la tasa de detección de numerosas patologías, como la identificación de lesiones polipoideas, la detección de cánceres gastrointestinales, de áreas de hemorragia del intestino delgado, e incluso la identificación endoscópica de H.pylori.
A pesar de todos estos avances, todavía existen retos en cuanto a su aplicación en la práctica clínica. Se necesitan ensayos clínicos prospectivos de alta calidad para evaluar el verdadero impacto clínico y de costos para los sistemas de salud. Además, es posible que se requieran muchas más imágenes endoscópicas para la base de datos y mejorar así los modelos continuamente a través de actualizaciones periódicas, y de esta manera lograr un desempeño confiable en el entorno clínico. Creemos que esta nueva tecnología para la endoscopia podría implementarse a gran escala en la práctica clínica en un futuro próximo.
FinanciaciónEstudio no financiado.
AutoríaTodos los autores han contribuido equitativamente a este trabajo.
Conflicto de interesesKenneth Ernest-Suárez es consultor para Janssen, Pfizer, Astra Zeneca, Ferring y Sandoz.
Tyler M. Berzin ha actuado como consultor para Wision AI, Mangentiq Eye, Docbot, Endovigilant y Medtronic.
Los autores restantes no tienen ningún conflicto de intereses que declarar.