Analizar si existen diferencias en desenlaces clínicos según el tratamiento inmunosupresor recibido en pacientes con neumonía grave por SARS-CoV-2 e inflamación moderada.
MétodosEstudio de cohortes retrospectivo de 142 pacientes con neumonía grave COVID-19 e inflamación moderada. Se dividieron en tres grupos de tratamiento (pulsos de metilprednisolona solo [grupoI], tocilizumab solo [grupoII] y metilprednisolona más tocilizumab [grupoIII]). Analizamos las diferencias intergrupos en el curso clínico con un seguimiento de 60días y factores clínicos analíticos relacionados.
ResultadosFallecieron 14 pacientes (9,8%): 8 (10%) del grupoI y 6 (9,5%) de los gruposII yIII. Quince (10,6%) ingresaron en UCI: 2 (2,5%) del grupoI, 4 (28,5%) del grupoII y 9 (18,4%) del grupoIII. La estancia media hospitalaria fue mayor en los del grupoII. La evolución clínica no se asoció al tratamiento administrado.
ConclusionesEl uso de tocilizumab debería reservarse para escenarios de ensayos clínicos. Su utilización generalizada podría acompañarse de mayor estancia media hospitalaria e ingreso en UCI sin diferencias en la mortalidad con un potencial aumento de efectos adversos.
To assess clinical outcomes according to the immunosuppressive treatment administered to patients with severe SARS-CoV-2 pneumonia and moderate inflammation.
MethodsA retrospective observational cohort study involving 142 patients with severe COVID-19 pneumonia and moderate inflammation divided into three treatment groups (pulses of methylprednisolone alone [groupI], tocilizumab alone [groupII] and methylprednisolone plus tocilizumab [groupIII]). The aim was to assess intergroups differences in the clinical course with a 60-day follow-up and related analytical factors.
Results14 patients (9,8%) died: 8 (10%) in groupI and 6 (9,5%) in groupsII andIII. 15 (10,6%) were admitted to ICU: 2 (2,5%) from groupI, 4 (28,5%) from groupII and 9 (18,4%) from groupIII. The mean hospital stay was longer in groupII and clinical outcome was not associated with treatment.
ConclusionsTocilizumab seems to be not associated with better clinical outcomes and should be reserved for clinical trial scenario, since its widespread use may result in higher rate of ICU admission and longer mean hospital stay without differences in mortality rate and potentially adverse events.
En diciembre de 2019 se identificó un síndrome respiratorio grave asociado a un nuevo coronavirus humano, SARS-CoV-2, que rápidamente se ha convertido en un problema de salud pública mundial. Este síndrome comprende diversas fases clínicas con una hiperinflamatoria, que suele suceder entre el 6.°-13.° días tras el inicio de la infección. Existe una correlación directa entre esta hiperinflamación, la gravedad de la neumonía y la progresión hacia fallo respiratorio y muerte1. Diversos tratamientos se han utilizado en esta fase, aunque solo los glucocorticoides han demostrado reducir la estancia media hospitalaria, el ingreso en UCI y la mortalidad2,3. Estudios observacionales sugieren que otros fármacos como el tocilizumab, un anticuerpo monoclonal humanizado dirigido frente al receptor de la IL-6, reduce la mortalidad y la necesidad de ventilación mecánica4,5. Sin embargo, ensayos clínicos al respecto no han confirmado una menor mortalidad6-8 con el uso de tocilizumab. En estos ensayos muy pocos pacientes recibían glucocorticoides y no se diseñaron para valorar si tocilizumab más glucocorticoides podría tener un beneficio clínico adicional. El uso de glucocorticoides y tocilizumab ha sido muy utilizado en nuestro país, por lo que nos propusimos analizar diferencias en el curso clínico con un seguimiento de 60días entre los pacientes ingresados en nuestro hospital con neumonía grave asociada a infección por SARS-CoV-2 tratados con solo glucocorticoides frente a los que recibieron tocilizumab solo o con glucocorticoides.
Material y métodosEstudio de cohortes retrospectivo realizado en el Hospital San Cecilio de Granada. Pacientes ingresados consecutivamente entre el 15 de marzo y el 15 de mayo de 2020 con neumonía grave por SARS-CoV-2 confirmada por PCR de exudado nasofaríngeo, fiebre >38°C durante al menos 5días y que cumplían criterios de inflamación moderada definida por dos de los siguientes: PCR >100mg/l, ferritina >500, dímeroD >1mg/l con una procalcitonina <0,05. Se consideró neumonía grave si además existía una saturación de O2 basal <93% o una presión parcial de O2 <65mmHg con evidencia radiológica de afectación uni o multilobar compatible con COVID-19.
Los pacientes recibieron tratamiento estándar según protocolo de nuestro Hospital en esa fecha, salvo contraindicación, consistente en hidroxicloroquina, azitromicina y lopinavir/ritonavir, junto con profilaxis de enfermedad tromboembólica con heparina de bajo peso molecular.
Clasificamos a los pacientes en tres grupos en función del tratamiento inmunosupresor administrado: grupoI, glucocorticoides solo (metilprednisolona 2mg/kg/día intravenoso durante 3días con la posibilidad de otros 2días si la mejoría clínica era parcial); grupoII, tocilizumab solo (dosis única intravenosa de 400mg si peso <75kg o 600mg si peso >75kg); grupoIII, glucocorticoides y tocilizumab.
Se recogieron comorbilidades, se calcularon los índices PROFUND, CURB65 y qSOFA. Los datos de laboratorio analizados fueron: ferritina, PCR, linfocitos con subpoblaciones CD4/CD8, dímeroD y procalcitonina. Además se analizó la extensión de la neumonía en base a la radiografía o TAC torácica.
Para el análisis estadístico se utilizó StatGraphics Centurion Versión XVII y SPSS Versión 23. Tras un análisis descriptivo previo se realizó el test de independencia chi-cuadrado para estudiar la asociación entre los tratamientos con los factores considerados. La comparación de medias de los datos analíticos según tratamiento se llevó a cabo mediante un análisis de la varianza para muestras independientes (ANOVA). Para comparar medias y porcentajes también se usaron análisis descriptivos de subgrupos, diagramas de barras y gráficos de caja y bigotes.
El estudio fue realizado según los principios de la declaración de Helsinki. Cada paciente, su representante legal o familiar más cercano fue informado sobre la utilización de estos tratamientos fuera de ficha técnica, obteniéndose consentimiento informado para su administración.
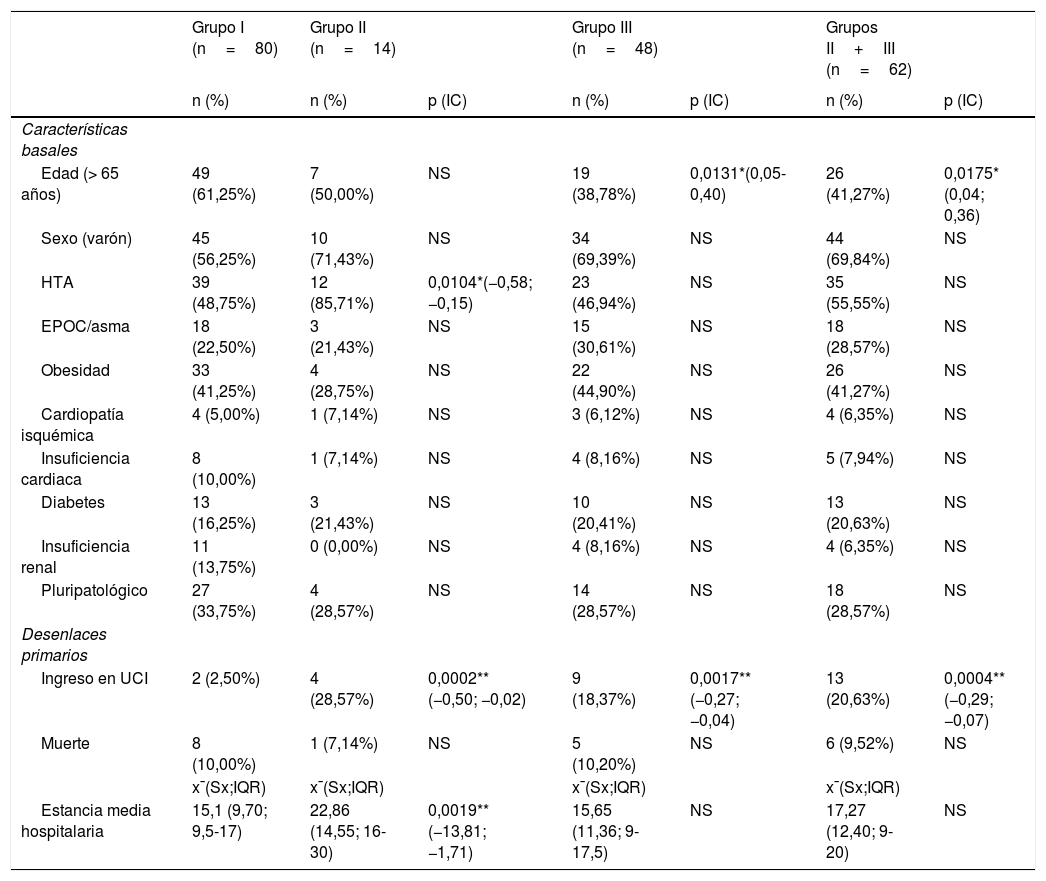
ResultadosSe incluyeron 142 pacientes ingresados de forma consecutiva. Las características basales, comorbilidades y tratamientos recibidos se recogen en la tabla 1. De los 142 pacientes, 80 (56,4%) recibieron solo glucocorticoides, 14 (9,8%) solo tocilizumab y 48 (33,8%) glucocorticoides y tocilizumab.
Características basales, comorbilidades y evolución según tratamiento
| Grupo I (n=80) | Grupo II (n=14) | Grupo III (n=48) | Grupos II+III (n=62) | ||||
|---|---|---|---|---|---|---|---|
| n (%) | n (%) | p (IC) | n (%) | p (IC) | n (%) | p (IC) | |
| Características basales | |||||||
| Edad (> 65 años) | 49 (61,25%) | 7 (50,00%) | NS | 19 (38,78%) | 0,0131*(0,05-0,40) | 26 (41,27%) | 0,0175* (0,04; 0,36) |
| Sexo (varón) | 45 (56,25%) | 10 (71,43%) | NS | 34 (69,39%) | NS | 44 (69,84%) | NS |
| HTA | 39 (48,75%) | 12 (85,71%) | 0,0104*(−0,58; −0,15) | 23 (46,94%) | NS | 35 (55,55%) | NS |
| EPOC/asma | 18 (22,50%) | 3 (21,43%) | NS | 15 (30,61%) | NS | 18 (28,57%) | NS |
| Obesidad | 33 (41,25%) | 4 (28,75%) | NS | 22 (44,90%) | NS | 26 (41,27%) | NS |
| Cardiopatía isquémica | 4 (5,00%) | 1 (7,14%) | NS | 3 (6,12%) | NS | 4 (6,35%) | NS |
| Insuficiencia cardiaca | 8 (10,00%) | 1 (7,14%) | NS | 4 (8,16%) | NS | 5 (7,94%) | NS |
| Diabetes | 13 (16,25%) | 3 (21,43%) | NS | 10 (20,41%) | NS | 13 (20,63%) | NS |
| Insuficiencia renal | 11 (13,75%) | 0 (0,00%) | NS | 4 (8,16%) | NS | 4 (6,35%) | NS |
| Pluripatológico | 27 (33,75%) | 4 (28,57%) | NS | 14 (28,57%) | NS | 18 (28,57%) | NS |
| Desenlaces primarios | |||||||
| Ingreso en UCI | 2 (2,50%) | 4 (28,57%) | 0,0002** (−0,50; −0,02) | 9 (18,37%) | 0,0017** (−0,27; −0,04) | 13 (20,63%) | 0,0004** (−0,29; −0,07) |
| Muerte | 8 (10,00%) | 1 (7,14%) | NS | 5 (10,20%) | NS | 6 (9,52%) | NS |
| x¯(Sx;IQR) | x¯(Sx;IQR) | x¯(Sx;IQR) | x¯(Sx;IQR) | ||||
| Estancia media hospitalaria | 15,1 (9,70; 9,5-17) | 22,86 (14,55; 16-30) | 0,0019** (−13,81; −1,71) | 15,65 (11,36; 9-17,5) | NS | 17,27 (12,40; 9-20) | NS |
NS: no significativo.
En las comparaciones significativas se indican los intervalos de confianza para la diferencia de proporciones o diferencia de medias según corresponda.
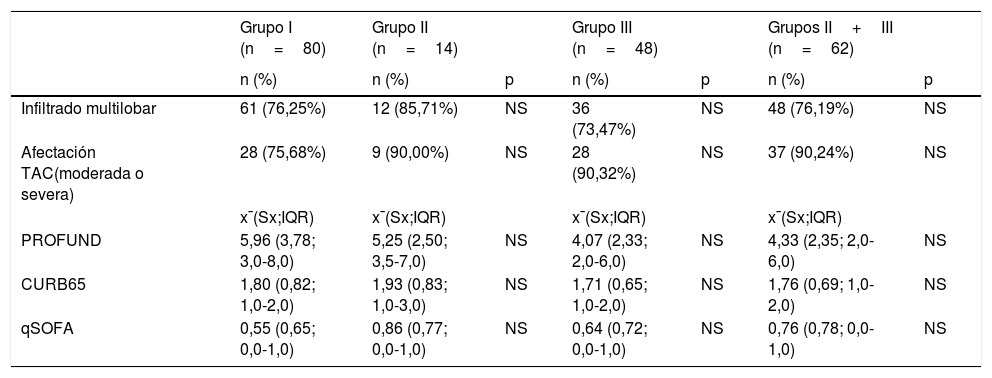
No hubo diferencias en el porcentaje de comorbilidades entre los distintos grupos de tratamiento, salvo por un mayor porcentaje de hipertensos en el grupoII frente al grupoI y un menor porcentaje de mayores de 65años en el grupoIII frente al grupoI. No hubo diferencias en el momento del ingreso con respecto a los índices PROFUND, CURB 65, qSOFA ni grado de afectación radiológica (tabla 2). Cuarenta y nueve (34%) eran pluripatológicos con un índice PROFUND medio de 5,31; 109 pacientes (76%) presentaban infiltrado multilobar en la radiografía y 65 (46%) afectación moderada/severa en la TAC torácica.
Escalas clínicas, afectación por radiografía y/o TAC torácica según grupos de tratamiento
| Grupo I (n=80) | Grupo II (n=14) | Grupo III (n=48) | Grupos II+III (n=62) | ||||
|---|---|---|---|---|---|---|---|
| n (%) | n (%) | p | n (%) | p | n (%) | p | |
| Infiltrado multilobar | 61 (76,25%) | 12 (85,71%) | NS | 36 (73,47%) | NS | 48 (76,19%) | NS |
| Afectación TAC(moderada o severa) | 28 (75,68%) | 9 (90,00%) | NS | 28 (90,32%) | NS | 37 (90,24%) | NS |
| x¯(Sx;IQR) | x¯(Sx;IQR) | x¯(Sx;IQR) | x¯(Sx;IQR) | ||||
| PROFUND | 5,96 (3,78; 3,0-8,0) | 5,25 (2,50; 3,5-7,0) | NS | 4,07 (2,33; 2,0-6,0) | NS | 4,33 (2,35; 2,0-6,0) | NS |
| CURB65 | 1,80 (0,82; 1,0-2,0) | 1,93 (0,83; 1,0-3,0) | NS | 1,71 (0,65; 1,0-2,0) | NS | 1,76 (0,69; 1,0-2,0) | NS |
| qSOFA | 0,55 (0,65; 0,0-1,0) | 0,86 (0,77; 0,0-1,0) | NS | 0,64 (0,72; 0,0-1,0) | NS | 0,76 (0,78; 0,0-1,0) | NS |
CURB65: escala de predicción de mortalidad utilizada en pacientes con neumonía adquirida en la comunidad; NS: no significativo; PROFUND: escala pronóstica para pacientes pluripatológicos en población hospitalaria y de atención primaria; qSOFA: quick Sequential Organ Failure Assessment.
Al ingreso los pacientes del grupoI presentaron menores valores de PCR e IL6 y cifras inferiores de ferritina a los 3días y al mes.
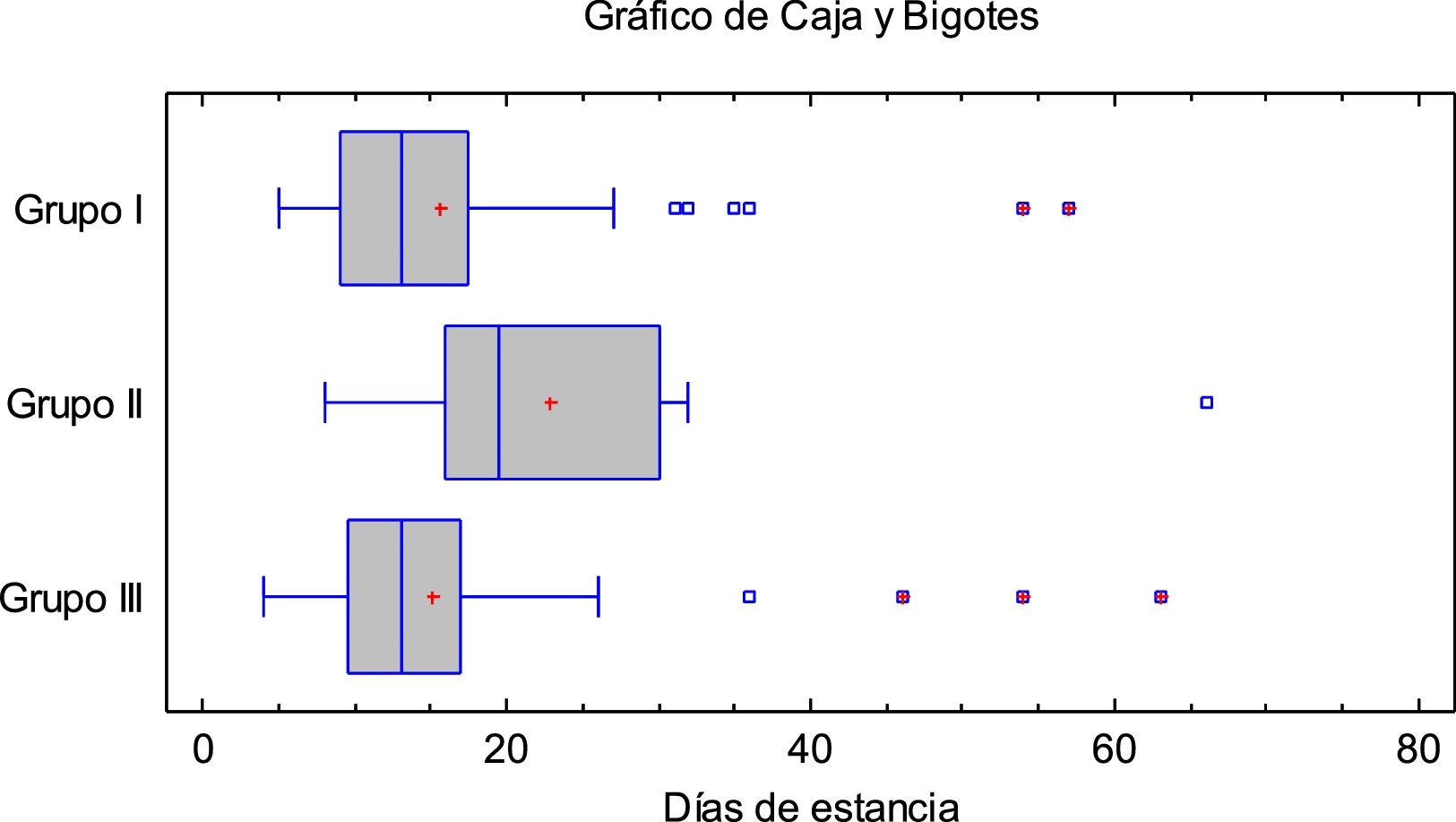
La figura 1 muestra la estancia media hospitalaria según el tratamiento recibido. Con respecto a la evolución de los pacientes a los dos meses: 14 (9,8%) habían fallecido: 8 (10%) del grupoI y 6 (9,5%) en los grupos que recibieron tocilizumab; 15 (10,6%) requirieron ingreso en UCI: 2 (2,5%) del grupoI, 4 (28,5%) del grupoII (p=0,0002 vs grupoI, 9 (18,4%) del grupoIII (p=0,0017 vs grupoI. De ellos, 12 (80%) precisaron intubación orotraqueal: 2 (16,67%) del grupoI, 3 (25%) del grupoII y 7 (58,3%) del grupoIII.
No hubo diferencias en la estancia media hospitalaria entre los pacientes de los gruposI yIII, siendo mayor en los del grupoII (15,1 vs 22,86 vs 15,65días para gruposI, II yIII; p=0,0019). Además, en base a la prueba chi-cuadrado la evolución a los 2meses no dependió del tratamiento administrado.
DiscusiónEn pacientes con neumonía grave por SARS CoV-2 e inflamación moderada se emplean terapias inmunosupresoras debido al papel patogénico de citocinas proinflamatorias. Los glucocorticoides han demostrado disminuir la mortalidad y el ingreso en UCI2-3. El tocilizumab ha sido ampliamente utilizado en base a estudios observacionales que sugieren una reducción del riesgo de intubación y/o muerte4,5, aunque ensayos clínicos6-8 no han demostrado una menor mortalidad a 28días. Dadas las discrepancias en la evidencia científica, nos propusimos analizar en nuestra cohorte de pacientes la evolución clínica a 60días según el tratamiento inmunosupresor recibido.
No encontramos diferencias significativas en mortalidad o estancia media entre los distintos grupos de tratamiento. Un menor número de pacientes del grupoI (2,5%) ingresaron en UCI en comparación con aquellos que recibieron tocilizumab solo (28,5%) o glucocorticoides y tocilizumab (18,4%). Esto podría deberse a un sesgo de selección, dado que en esos primeros meses de pandemia, por la saturación de las UCI, probablemente los pacientes con menor esperanza de vida recibieron únicamente glucocorticoides y se desestimaron de cuidados intensivos. Sin embargo, a pesar de que los pacientes que recibieron únicamente glucocorticoides ingresaron menos en UCI, la mortalidad a 60días entre los distintos grupos fue similar, lo que concuerda con las conclusiones de los principales ensayos clínicos de tocilizumab6-8.
En nuestro estudio, el uso de tocilizumab con o sin glucocorticoides no se acompañó de un beneficio clínico en términos de mortalidad, ingreso en UCI o estancia media hospitalaria. Rodríguez-Baño et al.9 encuentran que hay un mayor porcentaje de pacientes que requieren intubación o fallecen (seguimiento de 21días) en los que reciben glucocorticoides y tocilizumab frente al grupo de «no tratamiento» (26,5% vs 20,1%).
Otros estudios observacionales10 han sugerido un beneficio de los glucocorticoides tras tocilizumab con menor mortalidad (20% vs 62%). Nosotros no observamos diferencias con el uso concomitante de glucocorticoides y tocilizumab, aunque no incluimos ningún grupo que hubiera recibido tocilizumab antes de glucocorticoides.
Nuestros datos parecen sugerir que el uso de tocilizumab en estos pacientes no aporta beneficio en términos de mortalidad, ingreso en UCI o estancia media hospitalaria. Creemos que hasta la aparición de evidencia más concluyente y la identificación de perfiles de pacientes respondedores a tocilizumab podría ser prudente limitar su utilización en este contexto clínico.
FinanciaciónLa presente investigación no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a todo el personal sanitario que está luchando a diario en primera línea en esta pandemia y al Dr. Luis Aliaga Martínez por sus valiosos consejos en la redacción de este manuscrito.
Agradecimiento al proyecto P18-RT-1765. BIGDATAMED. Análisis de datos en medicina: de las historias clínicas al Big Data. I+D+I project of the Junta de Andalucía, Spain.