Analizar la incidencia de la enfermedad del coronavirus 19 (COVID-19) en pacientes consumidores crónicos de hidroxicloroquina.
Pacientes y métodosEstudio multicéntrico observacional retrospectivo transversal en Áreas de Salud de Castilla La-Mancha y distritos sanitarios de Andalucía. De los 4.451 participantes incluidos en el primer reclutamiento se seleccionaron 3.817 sujetos con datos válidos. La variable principal del estudio ha sido la presencia o ausencia de infección por la COVID-19 por diagnóstico clínico, serológico o por reacción en cadena de la polimerasa. Se registraron variables sociodemográficas, clínicas y tratamientos y comorbilidades concomitantes.
ResultadosCiento sesenta y nueve (4,45%) pacientes presentaron infección por la COVID-19, de los cuales fallecieron 12 (7,1%) y 32 (18,9%) requirieron ingreso hospitalario. La enfermedad respiratoria previa se relacionó con la infección por la COVID-19 (p<0,05). La maculopatía aparece en un 5,3% de los pacientes y está relacionada significativamente con la dosis de hidroxicloroquina consumida (p<0,05).
ConclusiónNo existe relación entre consumo crónico de hidroxicloroquina e incidencia de la COVID-19.
To analyze the incidence of Covid-19 in patients who are chronic users of hydroxychloroquine.
Patients and methodsCross-sectional retrospective observational multicenter study in health areas and districts from Castilla La-Mancha and Andalucia. Of the 4451 participants included in the first recruitment, 3817 with valid data were selected. The main variable of the study is the presence or absence of Covid-19 infection by clinical, serological or polymerase chain reaction diagnosis. Sociodemographic and clinical variables and treatment and concomitant comorbidities were recorded.
Results169 (4,45%) patients had Covid-19 infection, of which 12 (7.1%) died and 32 (18.9%) required hospital admission. Previous respiratory pathology was related to Covid-19 infection (P<.05). Maculopathy appears in 5.3% of patients and is significantly related to the dose of hydroxychloroquine consumed (P<.05).
ConclusionThere is no relationship between chronic use of hydroxychloroquine and the incidence of Covid-19.
La cloroquina e hidroxicloroquina (HCQ), debido a su efecto inmunomodulador, son fármacos ampliamente utilizados en el tratamiento de diferentes enfermedades como la artritis reumatoide aguda o crónica y el lupus eritematoso. La HCQ también se usa para la profilaxis y tratamiento de la malaria no complicada causada por especies de plasmodium sensibles, como alternativa a cloroquina. El uso de la HCQ fuera de indicación también se halla bastante extendido en enfermedades como el síndrome antifosfolípido y diferentes afecciones dermatológicas.
La utilización en indicaciones fuera de ficha técnica de la HCQ en COVID-19ha puesto sobre la mesa diferentes dilemas éticos; la lucha contra la pandemia como factor más prominente que todo lo justifica ha llevado a socavar la toma de decisiones basadas en la evidencia1,2. A raíz de su uso generalizado para el tratamiento de la COVID-19 en centros sanitarios en todo el mundo, la Sociedad Americana de Enfermedades Infecciosas ha recomendado que la HCQ solo sea usada en el contexto de un ensayo clínico3.
Ante la necesidad inmediata de tratamientos efectivos para el manejo de la infección por la COVID-19, los datos publicados han originado una gran expectativa sobre estos fármacos, a pesar del limitado nivel de evidencia, que se suma a las incertidumbres sobre aspectos de la propia enfermedad y sus diferentes fases de gravedad, que puede condicionar la eficacia o el balance beneficio-riesgo del tratamiento dependiendo de en qué estadio se use.
No hay ensayos clínicos publicados con HCQ y cloroquina, aunque sí datos in vitro y una revisión sobre el papel de la cloroquina en el manejo de la infección por SARS-CoV-24. La HCQ parece ser efectiva para limitar la replicación del SARS-CoV-2 in vitro, a través de la inhibición de la síntesis de ácidos nucleicos, glucosilación de proteínas víricas, ensamblaje viral, transporte de partículas víricas y liberación del virus5. Esto justifica su uso con el objetivo de recabar información de la eficacia clínica en pacientes en el contexto de ensayos clínicos. Posteriormente se ha observado un efecto sinérgico in vitro de la combinación con azitromicina6.
Tanto la cloroquina como la HCQ tienen la capacidad de prolongar el intervalo QT, lo que puede conducir a una interacción grave cuando se administran junto a otros fármacos que provocan el mismo efecto, entre otros la azitromicina7. Actualmente existe información muy limitada acerca de la seguridad de su administración combinada8, y no se recomienda su uso fuera del contexto de un ensayo clínico3,9.
El uso conjunto de HCQ con azitromicina se basa en los resultados de una mayor negativización de carga viral nasofaríngea, aunque puede provocar alargamiento del intervalo QT, hipoglucemia, efectos neuropsiquiátricos y reacciones de hipersensibilidad idiosincrásicas10, por lo que es necesario valorar la relación beneficio-riesgo en cada paciente y extremar la precaución. En una revisión sistemática11 se concluye que no produce beneficios clínicos, indicando que el uso de HCQ no disminuye la carga viral y aumenta la mortalidad por todas las causas entre los pacientes agudos hospitalizados a los que se ha suministrado este fármaco. En un estudio publicado en pacientes con COVID-19 no hospitalizados con sintomatología temprana, tratados con HCQ, no se observa ninguna reducción de la severidad de los síntomas12. Recientemente, se ha publicado un estudio donde la utilización de HCQ con o sin azitromicina asociada en pacientes ingresados con clínica leve-moderada no ha mejorado el estado clínico tras 15 días, en comparación con el tratamiento estándar, a la vez que presentan elevación y prolongación del intervalo QT y elevación de enzimas hepáticas13. En otro estudio en pacientes hospitalizados con COVID-19 leve-moderada, el uso de HCQ no produjo mayor seroconversión negativa que los pacientes en tratamiento estándar, siendo mayor la tasa de aparición de eventos adveros14.
Actualmente, la Food and Drug Aministration ha revocado la autorización de uso de la HCQ en pacientes con COVID-19, debido al nulo balance beneficio-riesgo que presenta este fármaco en estos pacientes15.
Se ha cuestionado que el uso de antiinflamatorios no esteroideos y el tratamiento con antihipertensivos del tipo inhibidores de la enzima convertidora de angiotensina (IECA) y/o antagonistas receptores de angiotensina II (ARA-II) podría ser un factor de riesgo de gravedad, e incluso de mortalidad para pacientes hospitalizados infectados con la COVID-1916–18. Sin embargo, hasta la fecha no existen datos clínicos que avalen una mayor gravedad en la evolución de la infección en pacientes tratados con estos fármacos antiinflamatorios y antihipertensivos, estando las recomendaciones basadas principalmente en hallazgos experimentales, sin evidencia de un efecto clínico real en seres humanos.
Descartado el efecto beneficioso de la HCQ en pacientes con enfermedad aguda por la COVID-19, el objetivo de este estudio ha sido comprobar el posible efecto protector de la HCQ en la incidencia de la COVID-19 en pacientes consumidores crónicos de HCQ. Al mismo tiempo, se ha evaluado en estos pacientes la influencia que pudieran tener las comorbilidades respiratorias, diabetes, obesidad e hipertensión, así como el consumo concomitante de HCQ con otros fármacos como: IECA, ARA-II y/o antiinflamatorios no esteroideos (AINE).
Pacientes y métodosSe trata de un estudio multicéntrico observacional retrospectivo transversal anonimizado.
La población estudiada fueron todos los pacientes mayores de 18 años que consumían de forma crónica HCQ para las indicaciones aprobadas en ficha técnica y algunas indicaciones off-label, como síndrome antifosfolípido y diferentes afecciones dermatológicas. Los pacientes estudiados (tabla 1) pertenecen a las Gerencias de Atención Integrada de Albacete, Almansa, Hellín, Villarrobledo, Cuenca, Guadalajara, Alcázar de San Juan, Tomelloso, Valdepeñas, Talavera, Toledo, Puertollano, Área de Gestión Sanitaria Jerez, Costa Noroeste y Sierra de Cádiz, Área de Gestión Sanitaria Campo de Gibraltar, Distrito Sanitario Aljarafe y Distrito Sanitario Condado Campiña.
Número de pacientes según áreas de salud
| N.° pacientes | |
|---|---|
| GAI Albacete | 292 |
| GAI Almansa | 46 |
| GAI Hellín | 69 |
| GAI Villarrobledo | 82 |
| GAI Cuenca | 151 |
| GAI Guadalajara | 240 |
| GAI Alcázar de San Juan | 290 |
| GAI Tomelloso | 52 |
| GAI Valdepeñas | 47 |
| GAI Talavera de la Reina | 380 |
| GAI Toledo | 844 |
| GAI Puertollano | 241 |
| Área de Gestión Sanitaria de Jerez, Costa Noroeste y Sierra de Cádiz | 463 |
| Área de Gestión Sanitaria de Campo de Gibraltar | 346 |
| Distrito Sanitario Aljarafe | 175 |
| Distrito Sanitario Condado Campiña | 99 |
GAI: Gerencia de Atención Integrada.
Los pacientes se han seleccionado utilizando los sistemas informáticos de atención primaria y los programas de facturación de receta de los Sistemas de Salud. Cruzando ambas bases de datos se seleccionaron los pacientes que entre el 1 de enero y el 28 de febrero de 2020 habían retirado de la oficina de farmacia envases de HCQ, y se comprobó que el tratamiento con HCQ había tenido una duración de 6 meses como mínimo. La muestra inicial fue de 4.451 pacientes, quedando en 3.817 pacientes la muestra final, una vez excluidos aquellos sujetos que no cumplían algunos de los criterios de inclusión, o que no habían consumido un mínimo de 6 meses el fármaco o fueron exitus por causa ajena a la COVID-19. El periodo estudiado para confirmar si estos pacientes han sufrido la infección por la COVID-19ha sido desde el 1 de marzo al 30 de junio de 2020. Durante este periodo todos los pacientes han seguido consumiendo la HCQ de manera regular, así como el resto de fármacos que han sido objeto de estudio en este trabajo.
Del sistema de explotación de historia clínica de las diferentes áreas participantes se han recogido el número de pacientes con uno de los siguientes códigos CIE o CIAP: V01.82 (exposición coronavirus asociado a síndrome respiratorio agudo severo), 079.82 (síndrome respiratorio agudo severo asociado a coronavirus), 480.3 (neumonía por coronavirus asociado a síndrome respiratorio agudo severo) y A77.01 (infección debida a coronavirus no especificada sin grupo diagnóstico).
Las variables principales del estudio eran:
- •
Diagnóstico de ausencia de infección activa por la COVID-19 por reacción en cadena de la polimerasa (PCR) o test serológicos.
- •
Diagnóstico de ausencia de infección pasada por COVID-19 por test serológicos.
- •
Diagnóstico de ausencia de infección activa por COVID-19 por no aparecer cuadro clínico de infección respiratoria aguda.
- •
Dosis de HCQ.
Se definió como COVID-19 con clínica leve la aparición de síntomas como tos, cansancio y fiebre, mientras que clínica grave era la presencia de disnea, disminución de la saturación y neumonía bilateral confirmada radiológicamente.
Como variables secundarias se han recogido los datos referentes a: edad, sexo, paciente en domicilio o institucionalizado, tratamiento con IECA o ARA-II, tratamiento crónico de al menos 3 meses con AINE, comorbilidades que afectaban al sistema respiratorio (enfermedad pulmonar obstructiva crónica [EPOC], asma, enfisema, etc.), obesidad (índice de masa corporal>30kg/m2), presencia o no de: tabaquismo, diabetes, hipertensión y comorbilidades como infarto agudo de miocardio (IAM), ictus, inmunosupresión y cáncer-quimioterapia.
Con los datos obtenidos se realizó estadístico bivariante de las variables categóricas de la muestra mediante proporciones, y posteriormente un contraste de hipótesis entre proporciones para muestras independientes de carácter no paramétricas (Chi cuadrado).
Los datos han sido introducidos, almacenados y analizados mediante el programa SPSS 22.0.
El estudio fue clasificado como EPA-OD por la Agencia Española de Medicamentos y Productos Sanitarios con el código FTCHID-2020-04 y aprobado por el Comité de Ética de la Investigación con Medicamentos de la Gerencia de Atención Integrada de Albacete, con el código 2020-24 (EPA-OD).
El estudio se llevó a cabo de acuerdo con los principios que emanan de la Declaración de Helsinki (Revisión de Fortaleza, 2013), las normas de buenas prácticas clínicas y según la normativa legal vigente (Ley de investigación Biomédica 14/2007).
Toda la información obtenida de los participantes en el estudio ha sido tratada de manera confidencial, cumpliendo la Ley Orgánica 3/2018, de Protección de Datos de Carácter Personal con su última actualización del 25 de julio de 2019.
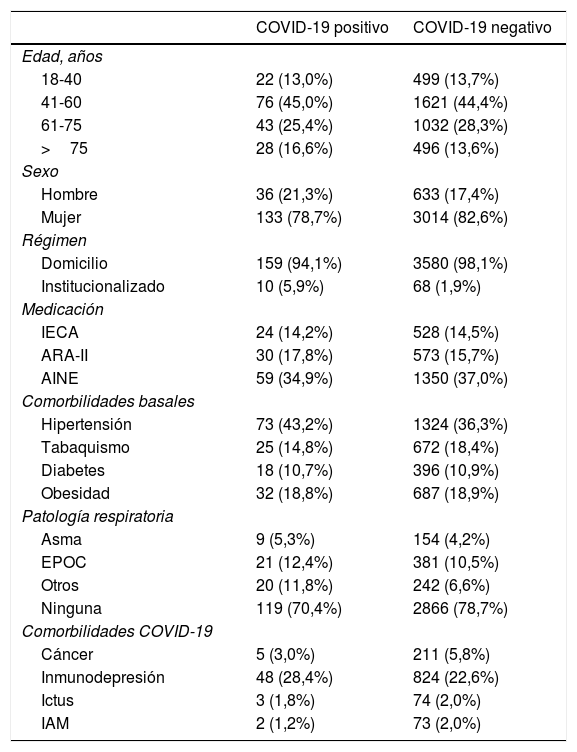
ResultadosDe la muestra final estudiada de 3.817 pacientes (tabla 2) 3.148 (82,5%) eran mujeres y 669 hombres (17,5%). De estos 3.817 pacientes solo 78 (2,0%) se encontraban en régimen institucionalizado. La edad se dividió en 4 rangos: 18-40 años (13,6%), 41-60 años (44,5%), 61-75 años (28,2%) y mayores de 75 años (13,7%).
Características sociodemográficas y clínicas de la población del estudio
| COVID-19 positivo | COVID-19 negativo | |
|---|---|---|
| Edad, años | ||
| 18-40 | 22 (13,0%) | 499 (13,7%) |
| 41-60 | 76 (45,0%) | 1621 (44,4%) |
| 61-75 | 43 (25,4%) | 1032 (28,3%) |
| >75 | 28 (16,6%) | 496 (13,6%) |
| Sexo | ||
| Hombre | 36 (21,3%) | 633 (17,4%) |
| Mujer | 133 (78,7%) | 3014 (82,6%) |
| Régimen | ||
| Domicilio | 159 (94,1%) | 3580 (98,1%) |
| Institucionalizado | 10 (5,9%) | 68 (1,9%) |
| Medicación | ||
| IECA | 24 (14,2%) | 528 (14,5%) |
| ARA-II | 30 (17,8%) | 573 (15,7%) |
| AINE | 59 (34,9%) | 1350 (37,0%) |
| Comorbilidades basales | ||
| Hipertensión | 73 (43,2%) | 1324 (36,3%) |
| Tabaquismo | 25 (14,8%) | 672 (18,4%) |
| Diabetes | 18 (10,7%) | 396 (10,9%) |
| Obesidad | 32 (18,8%) | 687 (18,9%) |
| Patología respiratoria | ||
| Asma | 9 (5,3%) | 154 (4,2%) |
| EPOC | 21 (12,4%) | 381 (10,5%) |
| Otros | 20 (11,8%) | 242 (6,6%) |
| Ninguna | 119 (70,4%) | 2866 (78,7%) |
| Comorbilidades COVID-19 | ||
| Cáncer | 5 (3,0%) | 211 (5,8%) |
| Inmunodepresión | 48 (28,4%) | 824 (22,6%) |
| Ictus | 3 (1,8%) | 74 (2,0%) |
| IAM | 2 (1,2%) | 73 (2,0%) |
AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas de receptores de angiontesina II; COVID-19: enfermedad por coronavirus 19; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; IECA: inhibidores de la enzima de conversión de la angiotensina;
Un 79,6% de los pacientes habían sido tratados con HCQ para las indicaciones descritas en la ficha técnica (42,6% para artritis reumatoide o poliartritis y un 37,0% para lupus eritematoso). El resto, un 20,4% de los pacientes, tomaba la HCQ para indicaciones fuera de la ficha técnica.
La dosis más prescrita de HCQ fue la de 200mg/24h en un 66,4% de pacientes. En la tabla 3 se muestra la distribución de dosis según los diferentes diagnósticos. En la variable otras dosificaciones, que solo representó un 3,5%, se han contabilizado regímenes con descansos de fin de semana, 300mg/24h o días alternos.
En cuanto a las reacciones adversas producidas por el uso crónico de HCQ se han encontrado alteraciones del intervalo QT en 42 pacientes (1,1%), alteraciones oftalmológicas, maculopatía principalmente, en 202 pacientes (5,3%) y otras reacciones adversas en 155 pacientes (4,1%). Al relacionar los efectos adversos oftalmológicos con la dosis de HCQ consumida se encontraron diferencias entre consumir la dosis de 200mg/24h y la aparición de efectos adversos (p<0,05) (58,9% vs. 66,9%).
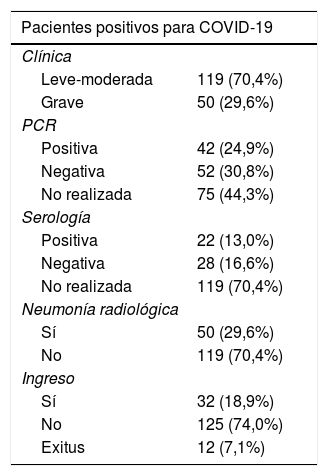
De los 3.817 pacientes 169 (4,45%) fueron diagnosticados como COVID-19, bien en función de criterios clínicos (registro positivo con los códigos CIE y CIAP descritos anteriormente), PCR o serología.
Como se muestra en la tabla 4 de los 169 pacientes diagnosticados un 70,4% presentaron clínica leve-moderada, 42 mostraron un resultado de PCR positivo, mientras que solo 22 presentaron un resultado de análisis serológico positivo y el 29,6% de los pacientes presentó neumonía bilateral por radiografía. El 18,9% de los pacientes requirió de ingreso hospitalario y en 12 pacientes la causa de la muerte fue atribuida a infección por la COVID-19.
Características clínicas de los pacientes con COVID-19
| Pacientes positivos para COVID-19 | |
|---|---|
| Clínica | |
| Leve-moderada | 119 (70,4%) |
| Grave | 50 (29,6%) |
| PCR | |
| Positiva | 42 (24,9%) |
| Negativa | 52 (30,8%) |
| No realizada | 75 (44,3%) |
| Serología | |
| Positiva | 22 (13,0%) |
| Negativa | 28 (16,6%) |
| No realizada | 119 (70,4%) |
| Neumonía radiológica | |
| Sí | 50 (29,6%) |
| No | 119 (70,4%) |
| Ingreso | |
| Sí | 32 (18,9%) |
| No | 125 (74,0%) |
| Exitus | 12 (7,1%) |
COVID-19: enfermedad por coronavirus 19; PCR: reacción en cadena de la polimerasa.
De los pacientes diagnosticados de COVID-19 el 78,7% eran mujeres, el 70,4% se encontraba en la franja de edad entre 40 y 75 años y más del 94% vivía en su domicilio, siendo muy pocos los pacientes que residían en régimen institucionalizado. De los pacientes con COVID-19 fallecidos el 58,3% fueron hombres y el 41,7% mujeres, el 75% tenían más de 75 años, el 16,6% entre 61 y 75 años y el 8,4% entre 41 y 60 años.
En cuanto a los tratamientos farmacológicos consumidos por estos pacientes un 14,2% consumía IECA de manera regular, un 17,8% ARA-II y un 34,9% AINE. Para comprobar la relación beneficio-riesgo de la toma de estos fármacos con la evolución de la enfermedad, se comparó la proporción de consumo de estos tratamientos entre el grupo diagnosticado de COVID-19 y el no diagnosticado, y no se encontró relación entre el consumo de estos fármacos y la infección por la COVID-19, ni entre la clínica leve-moderada y la grave.
Nuestros resultados confirman que la presencia de algún tipo de enfermedad respiratoria crónica está relacionada con la aparición de infección por la COVID-19 (p<0,05) (29,6% vs. 21,3%). Sin embargo, la relación consumir tabaco y presencia de COVID-19 (14,8-18,4%) no mostró diferencias.
Dentro del grupo de enfermos por la COVID-19 el 43,2% presentó hipertensión, el 10,7% diabetes y el 18,8% obesidad. Al comparar con el grupo de pacientes no COVID-19 la hipertensión, la diabetes y la obesidad no se encontró ninguna relación estadísticamente significativa, por lo que en nuestra muestra no se pueden considerar factores de riesgo.
Dentro de las comorbilidades que parece claro que afectarían a un peor pronóstico de la enfermedad por coronavirus, como son ictus, IAM, inmunodepresión y cáncer-quimioterapia, es la inmunodepresión, con un 28,4%, la que apareció más frecuentemente en los pacientes consumidores de HCQ (un 65% de los pacientes no presentó ninguna de estas comorbilidades).
En el periodo comprendido entre el 1 de marzo de 2020 al 31 de julio de 2020) se registraron en las bases de datos de atención primaria del Sescam 73.320 pacientes con los códigos CIE y CIAP de coronavirus. Este dato, referido a 2.032.863 pacientes de Castilla La Mancha (Instituto Nacional de Estadística, enero de 2019) supone un 3,6% de incidencia de COVID-19. De estos 73.320 pacientes se han registrado como exitus un total de 2.440 pacientes, lo que supone un 3,3% de fallecidos. En la muestra estudiada de pacientes consumidores crónicos de HCQ se encontraron 169 pacientes con COVID-19, lo que suponía una incidencia de 4,40%, y de estos fallecieron 12 pacientes, lo que suponía un 7,1%. Comparando la mortalidad en el grupo de pacientes COVID-19 tratados con HCQ frente a los pacientes COVID-19 de población general no se observan diferencias significativas.
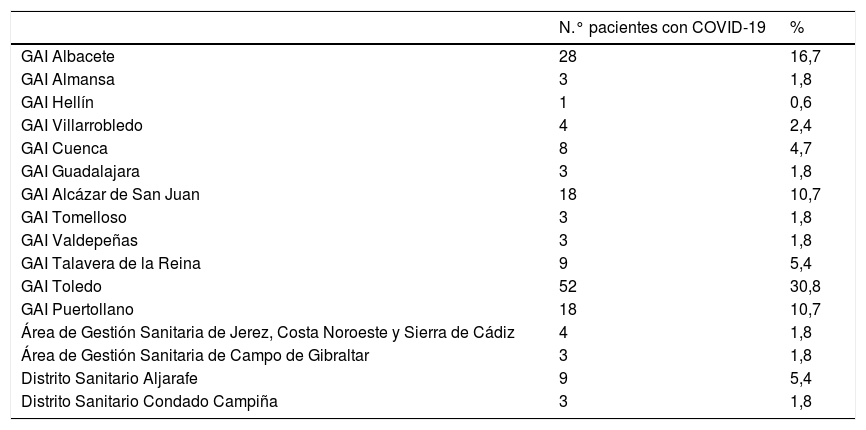
Cuando se estratificaba la muestra en 2 grupos (tabla 5), Castilla La-Mancha (CLM) y Andalucía, la muestra de pacientes de CLM quedaba en 2.734, de los cuales 150 pacientes fueron diagnosticados de COVID-19, y de los 1.083 de la muestra de Andalucía 19 fueron los diagnosticados de COVID-19. Una vez separada la muestra, la incidencia en CLM pasa a ser de 5,49%, mientras que la de Andalucía se queda únicamente en un 1,75%, confirmando este dato las diferencias en cuanto a incidencia que se han observado en los estudios de ámbito nacional.
Número de pacientes con COVID-19 por áreas de salud y distrito sanitario
| N.° pacientes con COVID-19 | % | |
|---|---|---|
| GAI Albacete | 28 | 16,7 |
| GAI Almansa | 3 | 1,8 |
| GAI Hellín | 1 | 0,6 |
| GAI Villarrobledo | 4 | 2,4 |
| GAI Cuenca | 8 | 4,7 |
| GAI Guadalajara | 3 | 1,8 |
| GAI Alcázar de San Juan | 18 | 10,7 |
| GAI Tomelloso | 3 | 1,8 |
| GAI Valdepeñas | 3 | 1,8 |
| GAI Talavera de la Reina | 9 | 5,4 |
| GAI Toledo | 52 | 30,8 |
| GAI Puertollano | 18 | 10,7 |
| Área de Gestión Sanitaria de Jerez, Costa Noroeste y Sierra de Cádiz | 4 | 1,8 |
| Área de Gestión Sanitaria de Campo de Gibraltar | 3 | 1,8 |
| Distrito Sanitario Aljarafe | 9 | 5,4 |
| Distrito Sanitario Condado Campiña | 3 | 1,8 |
GAI: Gerencia de Atención Integrada.
La pandemia de COVID-19ha supuesto todo un reto para los sistemas sanitarios y la investigación biomédica a nivel mundial, estableciéndose una carrera contrarreloj para encontrar un tratamiento ya sea preventivo o curativo, con el fin de paliar los efectos de la enfermedad. Se están investigando fármacos que inhiben la vía de las interleuquinas (tocilizumab), o antivirales como el remdesivir. A día de hoy el ensayo Convacta con tocilizumab ha sido suspendido por no mejorar el estado clínico del paciente, ni por reducir la mortalidad (nota de prensa de Roche del 29 de julio de 2020). Remdesivir, por su parte, no ha ofrecido de momento datos claros sobre su eficacia, ofreciendo únicamente una pequeña reducción en los días de hospitalización19. Existen actualmente numerosas vacunas en desarrollo, unas más prometedoras que otras, pero no olvidemos que en investigación es fundamental el cumplimiento de los plazos, ya que estas vacunas se van a administrar a sujetos sanos, y lo mínimo que se le puede exigir es que demuestre una eficacia real y duradera en el tiempo y, sobre todo, que no presente problemas de seguridad, y claro está, si corremos mucho los problemas de seguridad a largo plazo seguramente pasarán inadvertidos. Otro de los fármacos ampliamente estudiados y utilizados fuera de ficha técnica ha sido la HCQ. Los estudios han demostrado su ineficacia en la fase aguda de la enfermedad y la aparición de problemas de seguridad, sobre todo a nivel cardiaco13. En vista de estos resultados decidimos cambiar el enfoque del problema y estudiar el posible efecto protector que produce la HCQ en pacientes que la consumen de forma crónica para diferentes enfermedades.
Este estudio puede presentar ciertas limitaciones, siendo la principal la ausencia de un grupo control, aunque pensamos que este hecho no invalida los resultados obtenidos en el mismo. Aunque no ha sido el objetivo de este estudio, es importante tener en cuenta cómo los profesionales sanitarios se han enfrentado a los pacientes del estudio con clínica de COVID-19. En el momento del diagnóstico estos pacientes ya se encontraban tomando el fármaco, que era la principal recomendación en esos momentos de la pandemia, por lo que no debe haber sido fácil la aproximación terapéutica en estos pacientes.
La primera conclusión que podemos extraer, a la vista de nuestros datos, es que la HCQ consumida de manera crónica no protege frente a la infección por la COVID-19. En nuestro grupo de estudio la incidencia de coronavirus ha sido del 4,4%, frente al 3,3% de los datos obtenidos de pacientes clasificados con códigos CIE o CIAP, no siendo significativa esta diferencia.
A principios de la pandemia se ha especulado con que el uso de fármacos que inhiben el sistema renina-angiotensina y de AINE podría ser un factor de riesgo para la infección por coronavirus, y de peor pronóstico en el caso de haber sido contagiado. Posteriormente se ha publicado que el consumo de estos fármacos no empeora el curso de la enfermedad18, y no favorecen el contagio, hecho que hemos confirmado en nuestro estudio, ya que no aparecen diferencias entre el grupo que consume estos fármacos y los que no los toman en cuanto a incidencia de infección por COVID-19.
Aunque las comorbilidades como obesidad, diabetes e hipertensión no parecen tener relación con una mayor incidencia o pronóstico de la COVID-19, la hipertensión sí está presente en una mayor proporción de estos pacientes (p=0,08). Al igual ocurre con la inmunodepresión, que sin alcanzar significación estadística aparece en un porcentaje más elevado en pacientes diagnosticados de COVID-19. Estos datos coinciden con los resultados obtenidos en el estudio sobre comorbilidades presentes en pacientes fallecidos por COVID-19 en Aragón20. Las comorbilidades aisladas podrían explicar algunas muertes, pero la presencia de varias comorbilidades y la polifarmacia serían verdaderos factores de riesgo para explicar la letalidad de esta enfermedad.
A partir de nuestros resultados podemos concluir que la presencia de enfermedad respiratoria de base (asma, EPOC, enfisema, etc.), aunque no el tabaquismo, está relacionada con el aumento de incidencia por COVID-19 en nuestro grupo de pacientes. Este dato apoya el uso de mascarillas en el grupo de pacientes respiratorios, cosa que ha estado en entredicho últimamente, acerca de si este tipo de pacientes debería estar exento del uso de mascarilla.
Un aspecto no relacionado con la COVID-19, aunque de suma importancia, es el importante uso de HCQ (hasta un 20% en nuestro grupo de estudio) fuera de ficha técnica, con las implicaciones que esto tiene, ya que este es un fármaco que presenta problemas de seguridad, tanto solo como usado de forma concomitante con otros fármacos que alargan el intervalo QT. Es de destacar el control que sobre estos pacientes consumidores de HCQ se realiza de los efectos adversos oftalmológicos. La maculopatía es la principal manifestación clínica, apareciendo en un 5,2% de los pacientes del estudio, coincidiendo con la bibliografía existente al respecto21.
La muestra proviene de 2 zonas claramente diferenciadas, como son CLM y Andalucía Oeste. Los resultados de incidencia de COVID-19 en nuestra muestra ponen de manifiesto una diferencia entre ambas zonas, 5,49% frente a 1,75%. Estos datos coinciden con los datos de incidencia que se han ido ofreciendo durante todo el periodo de pandemia, en los que CLM ha sido una de las regiones más afectadas por la enfermedad, mientras que Andalucía (y en general el Sur de la península) se ha visto mucho menos afectada por la misma.
En resumen, en este estudio multicéntrico se ha encontrado que el consumo crónico de HCQ no aporta beneficios a los pacientes, lo cual se suma a los numerosos estudios que han confirmado el escaso o nulo beneficio de la HCQ cuando se utiliza como tratamiento en pacientes agudos asociado o no a azitromicina.
Todos estos resultados obtenidos en los estudios comentados suponen un jarro de agua fría para los sistemas de salud, ya que con estos datos será sumamente complicado establecer protocolos de actuación en caso de una nueva oleada de contagios, porque a día de hoy los únicos fármacos que han mostrado un perfil de seguridad y eficacia favorable han sido los corticosteroides22.
AutoríaLas siguientes personas han colaborado en la revisión de los datos: Sonia Martínez Cruz, Julia de Fez Herráiz, Adriana Arcega Baraza, María Teresa González Zarca, Carolina Payá Giner, Ángel Fernández Mistal, María Dolores Pérez Pacheco, Macarena Flores Dorado, Piedad Reguera Martínez, Olga Rojas Corrales, María Isabel Ibarra Lorente, María Elena Carretero Albiñana, María Isabel Tofiño González, Belén de la Hija Díaz, Beatriz de la Calle Riaguas, Juan José Navarro Agüera, Rosario Lara Olivares, Dolores Caniego Rodrigo, Yolanda González Gero, Inmaculada Casa Hidalgo, Aina Tomás Luiz, Eva María García Martínez, Nuria Monteagudo Martínez, Ismael Pérez Alpuente, Francisco Tomás Pagán Núñez, Ana Ramírez Córcoles, Rocío Pardo Sánchez, Palmira Quero González, Rocío Peña Pou, Alejandro Rodríguez Delgado, Francisco M. Ferrer Soler y Alejandro Rodríguez Delgado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.