La evaluación actual de la insuficiencia cardiaca (IC) aguda no permite predecir adecuadamente su evolución. La bioimpedancia eléctrica (BI) permite conocer el estado de volemia, hasta ahora solo con equipos fijos. Hemos desarrollado y validado un dispositivo portátil e inalámbrico para medir la BI en el tobillo (IVOL). El objetivo del estudio es conocer el valor pronóstico a largo plazo de la medición puntual de la BI con IVOL en pacientes con IC aguda.
MétodosEstudio de cohorte prospectivo de pacientes no seleccionados ingresados por IC aguda en un hospital de tercer nivel. Se analizó la asociación entre la BI y diferentes variables (clínicas, analíticas y ecocardiográficos) al ingreso y evolución clínica.
ResultadosSe incluyeron 76 pacientes (edad media 66,1 años, 71,1% varones, 68,4% hipertensos, 34,2% diabéticos, NT-ProBNP medio: 7.103pg/ml). De ellos, el 52,6% con fracción de eyección del ventrículo izquierdo (FEVI) no preservada (<50%) y el 56,6% con disfunción del ventrículo derecho (VD). El 26,3% fallecieron durante un seguimiento medio de 35,8 meses. La supervivencia en pacientes con BI≤21,8Ω fue menor, globalmente, y en los subgrupos de pacientes sin FEVI preservada y con disfunción del VD; p<0,008). En el análisis multivariante una BI≥21,8Ω fue un factor independiente de supervivencia (HR: 0,242; IC 95%: 0,86-0,681; p=0,007).
ConclusionesLos valores de la BI medidos con IVOL pueden ser un predictor independiente de mortalidad a largo plazo en pacientes hospitalizados por IC aguda. Este valor pronóstico se mantiene en pacientes con FEVI no preservada y con disfunción ventricular derecha.
The current evaluation of acute heart failure (HF) does not allow an adequate prediction of its evolution. The electrical bioimpedance (BI) allows knowing the state of blood volume, until now only with fixed equipment. We have developed and validated a portable and wireless device to measure BI at the ankle (IVOL). The objective of the study is to know the long-term prognostic value of the point measurement of BI with IVOL in patients with acute HF.
MethodsA prospective cohort study of unselected patients admitted for acute HF in a tertiary hospital. The association between BI and different clinical, analytical and echocardiographic variables on admission and clinical evolution were analyzed.
Results76 patients were included (mean age 66.1 years, 71.1% men, 68.4% hypertensive, 34.2% diabetic, mean NT-ProBNP: 7,103 pg / ml). Of these, 52.6% with non-preserved left ventricular ejection fraction (LVEF) (<50%) and 56.6% with right ventricular (RV) dysfunction. 26.3% died during a mean follow-up of 35.8 months. Survival in patients with BI≤21,8Ω was lower, globally and in the subgroups of patients without preserved LVEF and with RV dysfunction, P<.008). In the multivariate analysis, a BI≥21.8Ω was an independent survival factor (HR: 0.242; 95% CI: 0.86-0.681; P=.007).
ConclusionsBI values measured with IVOL may be an independent predictor of long-term mortality in patients hospitalized for acute HF. This prognostic value is maintained in patients without preserved LVEF function and with RV dysfunction.
La historia natural de la insuficiencia cardiaca (IC) se caracteriza por la existencia de episodios de IC aguda debidos a la rápida aparición o el empeoramiento de los síntomas y/o signos de una IC crónica ya conocida o como primera manifestación del síndrome1.
En España es la primera causa de hospitalización de los mayores de 65 años, y representa el 3% de todos los ingresos hospitalarios, el 2,5% del coste de la asistencia sanitaria2 y el 51% del coste medio dedicado a los pacientes con IC, estimado en más de 15.000€ anuales3. Por otra parte, los episodios de hospitalización continúan teniendo un gran impacto sobre el curso de la enfermedad, siendo actualmente en España la mortalidad intrahospitalaria del 9,4% y la tasa de reingresos del 9,7%4, con una mortalidad al año en registros recientes de países europeos y mediterráneos del 23,6%5.
Ello se debe, al menos en parte, a que la evaluación estándar de la IC (monitorización de constantes vitales, peso, índice de masa corporal, diuresis, electrocardiograma [ECG], pruebas de imagen y medición de péptidos natriuréticos)1, no predice de forma fiable las descompensaciones de la IC, ni permite monitorizar de forma precisa la resolución de la sobrecarga de volumen durante el ingreso o la evolución clínica tras el alta6.
Estudios previos han demostrado que la espectroscopia de la bioimpedancia eléctrica (BI) permite medir la volemia, especialmente en la insuficiencia renal7 y en la IC8. En la IC, la mayoría de los estudios han utilizados dispositivos invasivos de ubicación intratorácica para detectar la congestión pulmonar9,10, y equipos comerciales no invasivos de medida global de la volemia para detectar la congestión sistémica, que tienen problemas de usabilidad7. Un estudio amplio ha demostrado que la medición de la BI en la pierna permite un diagnóstico precoz de la IC en la población general11, y algunos otros estudios han mostrado de forma preliminar que los valores puntuales de BI durante el ingreso permiten predecir a corto plazo la evolución en la IC aguda12,13.
Nosotros hemos desarrollado un dispositivo de BI portátil, de bajo coste y conexión inalámbrica para medir el espectro de la BI en el tobillo (dispositivo IVOL), que ha sido validado frente a un equipo comercial de altas prestaciones en un estudio piloto14. El objetivo de este estudio es conocer el valor pronóstico a largo plazo de la medición puntual de la BI con el dispositivo portátil IVOL en una cohorte de pacientes hospitalizados por IC aguda.
MétodosPacientesSe incluyeron prospectivamente pacientes adultos no seleccionados hospitalizados por IC aguda en el Hospital U. Virgen del Rocío de Sevilla entre el 1 de marzo de 2015 y el 20 de abril de 2017. Los criterios de inclusión fueron: a) adultos ≥18 años ingresados por IC aguda con diagnóstico confirmado según los criterios de Framingham15 y b) consentimiento informado por escrito. Los criterios de exclusión fueron: a) enfermedad coronaria, b) edema secundario a enfermedad venosa y/o linfedema y c) amputación, úlceras o quemaduras de extremidades inferiores. Al ingreso se realizó una ecocardiografía transtorácica y la medición de la BI, antes de iniciar el tratamiento, con el dispositivo IVOL.
Se elaboró un formulario electrónico estandarizado de datos donde incluyeron prospectivamente durante el ingreso: datos demográficos, comorbilidades, grado de edema16 en el miembro inferior derecho, parámetros ecocardiográficos (fracción de eyección del VI [FEVI], «tricuspid annular plane systolic excursión» [TAPSE] y presión arterial pulmonar [PAP]), biológicos (niveles plasmáticos de hemoglobina, niveles séricos de sodio y de NT-pro-BNP) y el tratamiento diurético realizado (fármaco y dosis diaria).
La variable primaria de resultado fue la mortalidad por cualquiera causa, y las variables secundarias reingresos hospitalarios o en urgencias por reagudización de IC. La evaluación de los resultados se realizó entre el 25 y el 30 de junio de 2021, mediante la consulta de la Historia Digital de Salud de Andalucía-Diraya. Se registró la fecha y estado del último dato disponible.
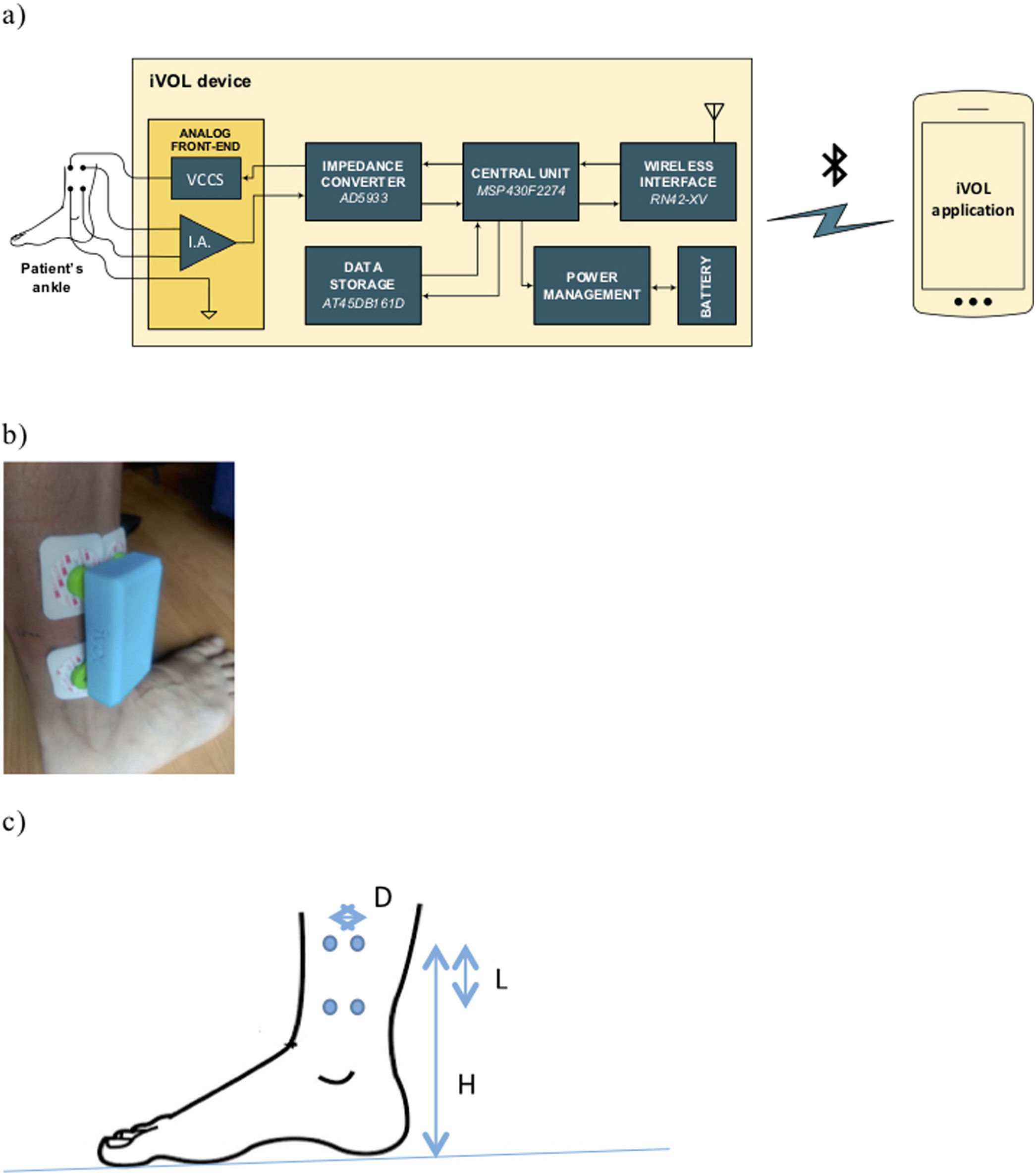
Sistema de medida de bioimpedancia eléctricaEl equipo de medida IVOL (fig. 1)14 se basa en un dispositivo para mediciones de impedancia a 2 hilos (AD5933), al que se la añade una electrónica analógica para pasar a una medida a 4 hilos («front-end»), un microprocesador y un módulo de comunicación «bluetooth». La gestión de datos y representación de resultados se realiza en un teléfono móvil con sistema operativo Android®. El sistema diseñado tiene un rango dinámico de hasta 300 ohmios (Ω), con una resolución de 0,1Ω. Las principales especificaciones del dispositivo son: frecuencias de medida: 5, 10, 20, 50, 100 y 200kHz; rango dinámico: 10 a 300; resolución de 0,1?; exactitud: ±5% (de 10 a 100?); resolución de fase: 0,01 grados; tiempo de medida: 8s para las 6 frecuencias.
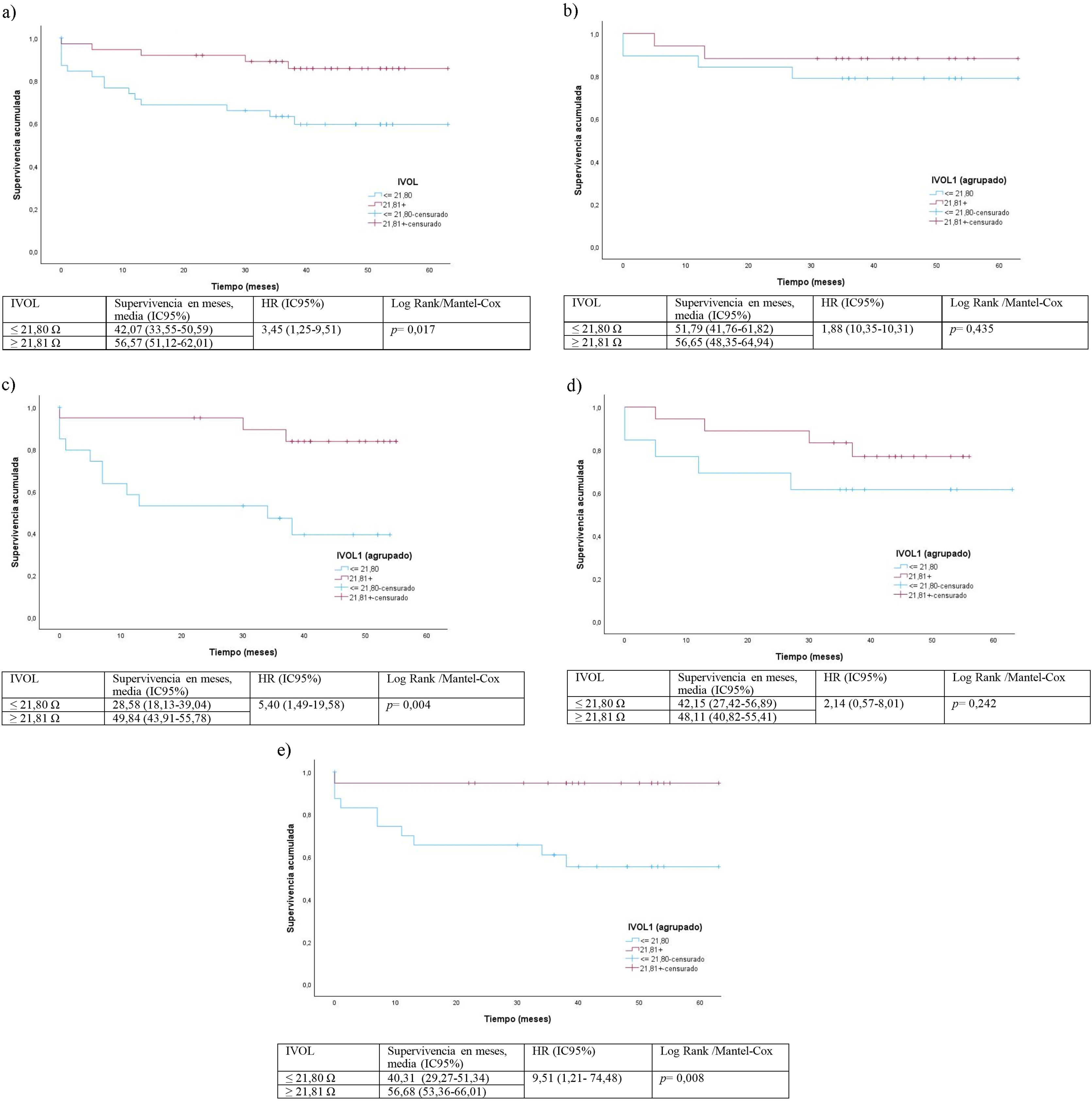
Protocolo de mediciónLa medida de BI localizada se obtuvo en la extremidad inferior derecha con 4 electrodos comerciales del ECG, con una distancia entre los centros de los electrodos de 6 y 3,5cm entre inyectores de corriente y detectores de tensión (figs. 1a y b). La inyección de corriente se realizó de forma longitudinal respecto a la pierna (separación de L). La detección de tensión se realizó en los electrodos que están en paralelo separados a una distancia D y adheridos al paciente en la posición indicada en la figura 1. Las medidas de BI se realizaron por la mañana con el paciente encamado. En el presente estudio solo se utiliza la magnitud de la impedancia a 50kHz y se indica como valor IVOL de la BI en las tablas.
Análisis estadísticoLas variables cualitativas se expresaron como porcentajes y las continuas como medias y desviación estándar (DE). Las diferencias en las variables cualitativas se analizaron mediante la prueba de la Chi-cuadrado o la prueba exacta de Fisher cuando la frecuencia esperada fue menor de 5. Las variables cuantitativas se analizaron mediante la prueba de la t de Student, después de la confirmación de la normalidad de los datos mediante la prueba de Shapiro-Wilk. Los datos distribuidos de forma no normal se analizaron mediante la prueba U de Mann-Whitney.
Por otra parte, para obtener el valor de corte de la BI se realizó un análisis de sensibilidad con curvas Receiver Operating Characteristics (ROC) y, posteriormente, se comparó la mortalidad en función de los valores obtenidos de la BI utilizando curvas de Kaplan-Meier (test Mantel-Cox). Finalmente, se realizó un análisis multivariante de Cox, en el que se incluyeron las variables con asociación estadística en el análisis bivariado. Se calcularon los cocientes de riesgo (hazard ratio [HR]) con su intervalo de confianza del 95% (IC 95%). El análisis se realizó con el paquete estadístico IBM SPSS® Statistics 21 (IBM Corporation, Armonk, NY, EE. UU.).
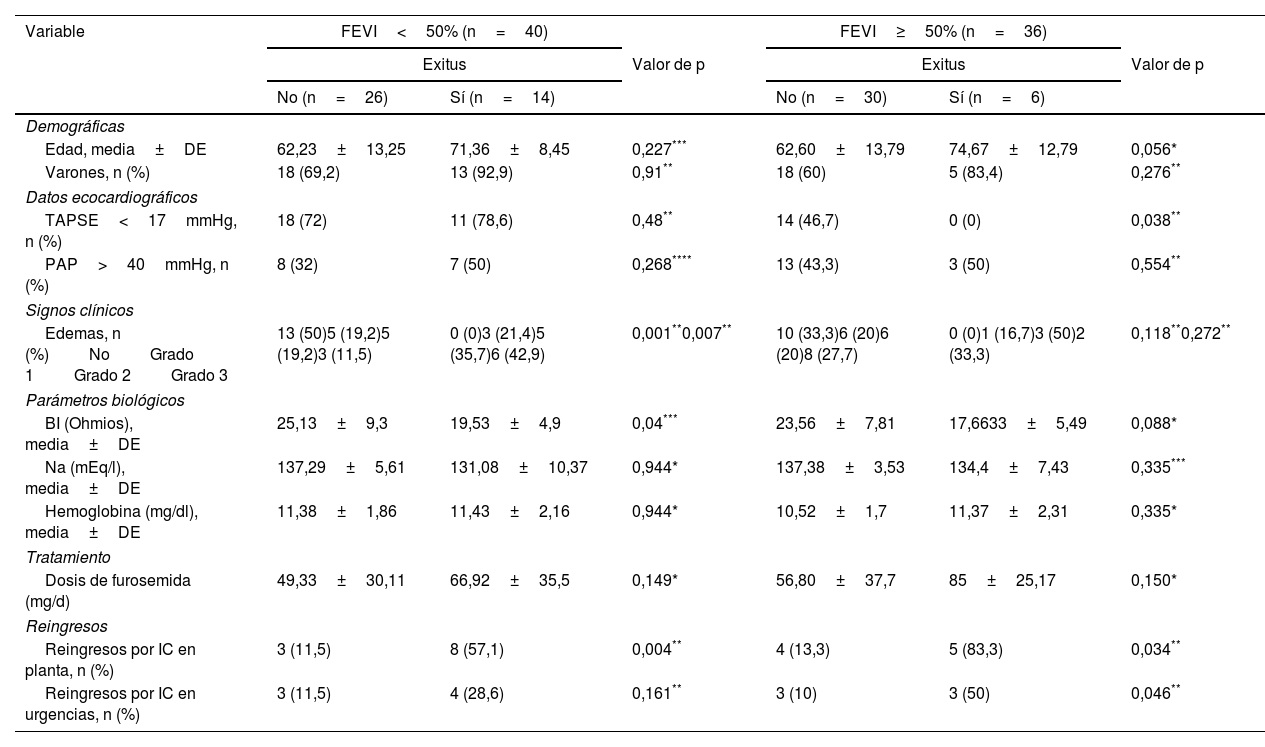
ResultadosSe incluyeron un total de 76 pacientes con una edad media de 66,07±13,09 años, el 71,1% eran varones. De ellos, el 52,6% tenía una IC con FEVI no preservada (<50%), y el 56,6% disfunción del ventrículo derecho (VD). El resto de las características de los pacientes evaluados se presentan en la tabla 1. Los pacientes fueron seguidos durante una media de 36,83 meses. Durante el seguimiento el 18,4% tuvieron reingresos en planta de hospitalización y el 26,3% fallecieron.
Características basales de la población de estudio, global y según evolución
| Variables | Global (n=76) | Según evolución: exitus | Valor de p | |
|---|---|---|---|---|
| No (n=56) | Sí (n=20) | |||
| Demográficas | ||||
| Edad (años), media±DE | 66,07±13,09 | 53,82±12,48 | 72,35±9,71 | 0,011* |
| Varones, n (%) | 54 (71,1) | 36 (64,3) | 18 (90) | 0,043** |
| Comorbilidad | ||||
| Hipertensión arterial, n (%) | 52 (68,4) | 36 (64,2) | 16 (80) | 0,226*** |
| Diabetes mellitus, n (%) | 26 (34,2) | 16 (28,6) | 10 (50) | 0,103** |
| Dislipemia, n (%) | 38 (50) | 27 (48,2) | 11 (55) | 0,795** |
| IMC (kg/m2)>30, n (%) | 32 (42,1) | 24 (42,8) | 8 (40) | 0,787** |
| Enfermedad renal crónica, n (%) | 25 (32,9) | 15 (26,8) | 10 (50) | 0,160** |
| Portador de marcapasos, n (%) | 11 (14,5) | 7 (12,5) | 4 (20) | 0,446*** |
| Fibrilación auricular, n (%) | 40 (52,6) | 27 (48,2) | 13 (65) | 0,197** |
| Datos ecocardiográficos | ||||
| FEVI<50%, n (%) | 40 (52,6) | 26 (46,4) | 14 (70) | 0,07** |
| TAPSE<17mmHg, n (%) | 43 (56,6) | 32 (58,2) | 11 (55) | 0,805** |
| PAP>40mmHg, n (%) | 31 (40,8) | 21 (38,2) | 10 (50) | 0,358** |
| Signos clínicos | ||||
| Edemas, n (%)NoGrado 1Grado 2Grado 3 | 23 (30,3)15 (19,7)19 (25)19 (25) | 23 (30,3)11 (19,7)11 (25)11 (25) | 0 (0)4 (20)8 (40)8 (40) | <0,0001***0,004*** |
| Parámetros biológicos | ||||
| BI (Ohmios), media±DE | 24,3±8,5 | 19±5 | 0,011**** | |
| Na (mEq/l), media±DE | 136±6,6 | 137,40±4,5 | 132,1±9,5 | 0,013**** |
| Hemoglobina (mg/dl), media±DE | 11,03±1,9 | 10,89±1,8 | 11,41±2,1 | 0,313* |
| Nt-pro-BNP (pg/ml), media±DE | 7.103,8±8.931,5a | 5.669,1±9.694,8b | 9.176,2±7.761,7c | 0,03**** |
| Tratamiento | ||||
| Tratados con furosemida, n (%) | 53 (69,7) | 37 (66,1) | 16 (80) | 0,395*** |
| Dosis de furosemida (mg/d) | 64,81±29,67 | 54±33,95 | 71,18±31,2 | 0,031**** |
| Reingresos | ||||
| Reingresos por IC en planta, n (%) | 14 (18,4) | 5 (8,9) | 9 (45) | <0,0001** |
| Reingresos por IC en urgencias, n(%) | 13 (17,1) | 6 (10,7) | 7 (35) | 0,033** |
BI: bioimpedancia eléctrica medida con IVOL; DE: desviación estándar; IC: insuficiencia cardiaca; IMC: índice de masa corporal; FEVI: fracción de eyección del ventrículo izquierdo; Na: sodio plasmático; Nt-pro-BNP: porción N-terminal del pro-péptido natriurético tipo B; PAP: presión arterial pulmonar; TAPSE: tricuspid annular plane systolic excursion (excursión sistólica del anillo tricúspide).
Entre los pacientes que fallecieron fueron más elevados la proporción de varones, edad media, porcentaje de sujetos con edemas y los valores medios de Nt-pro-BNP, siendo más bajos los valores de sodio plasmático y de BI medida por IVOL (tabla 1).
Al analizar la evolución de los pacientes según la FEVI (tabla 2), los que fallecieron en el subgrupo con FEVI<50% habían tenido al ingreso una mayor proporción de edemas y valores más bajos de BI, y en el subgrupo con FEVI preservada (≥50%) habían tenido una mayor edad media y niveles plasmáticos de NT-pro-BNP más elevados y valores de más bajos de BI.
Características basales y evolución según FEVI
| Variable | FEVI<50% (n=40) | FEVI≥50% (n=36) | ||||
|---|---|---|---|---|---|---|
| Exitus | Valor de p | Exitus | Valor de p | |||
| No (n=26) | Sí (n=14) | No (n=30) | Sí (n=6) | |||
| Demográficas | ||||||
| Edad, media±DE | 62,23±13,25 | 71,36±8,45 | 0,227*** | 62,60±13,79 | 74,67±12,79 | 0,056* |
| Varones, n (%) | 18 (69,2) | 13 (92,9) | 0,91** | 18 (60) | 5 (83,4) | 0,276** |
| Datos ecocardiográficos | ||||||
| TAPSE<17mmHg, n (%) | 18 (72) | 11 (78,6) | 0,48** | 14 (46,7) | 0 (0) | 0,038** |
| PAP>40mmHg, n (%) | 8 (32) | 7 (50) | 0,268**** | 13 (43,3) | 3 (50) | 0,554** |
| Signos clínicos | ||||||
| Edemas, n (%)NoGrado 1Grado 2Grado 3 | 13 (50)5 (19,2)5 (19,2)3 (11,5) | 0 (0)3 (21,4)5 (35,7)6 (42,9) | 0,001**0,007** | 10 (33,3)6 (20)6 (20)8 (27,7) | 0 (0)1 (16,7)3 (50)2 (33,3) | 0,118**0,272** |
| Parámetros biológicos | ||||||
| BI (Ohmios), media±DE | 25,13±9,3 | 19,53±4,9 | 0,04*** | 23,56±7,81 | 17,6633±5,49 | 0,088* |
| Na (mEq/l), media±DE | 137,29±5,61 | 131,08±10,37 | 0,944* | 137,38±3,53 | 134,4±7,43 | 0,335*** |
| Hemoglobina (mg/dl), media±DE | 11,38±1,86 | 11,43±2,16 | 0,944* | 10,52±1,7 | 11,37±2,31 | 0,335* |
| Tratamiento | ||||||
| Dosis de furosemida (mg/d) | 49,33±30,11 | 66,92±35,5 | 0,149* | 56,80±37,7 | 85±25,17 | 0,150* |
| Reingresos | ||||||
| Reingresos por IC en planta, n (%) | 3 (11,5) | 8 (57,1) | 0,004** | 4 (13,3) | 5 (83,3) | 0,034** |
| Reingresos por IC en urgencias, n (%) | 3 (11,5) | 4 (28,6) | 0,161** | 3 (10) | 3 (50) | 0,046** |
BI: bioimpedancia eléctrica medida con IVOL; DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; Na: sodio plasmático; Nt-pro-BNP: porción N-terminal del pro-péptido natriurético tipo B; PAP: presión arterial pulmonar; TAPSE: tricuspid annular plane systolic excursion (excursión sistólica del anillo tricúspide).
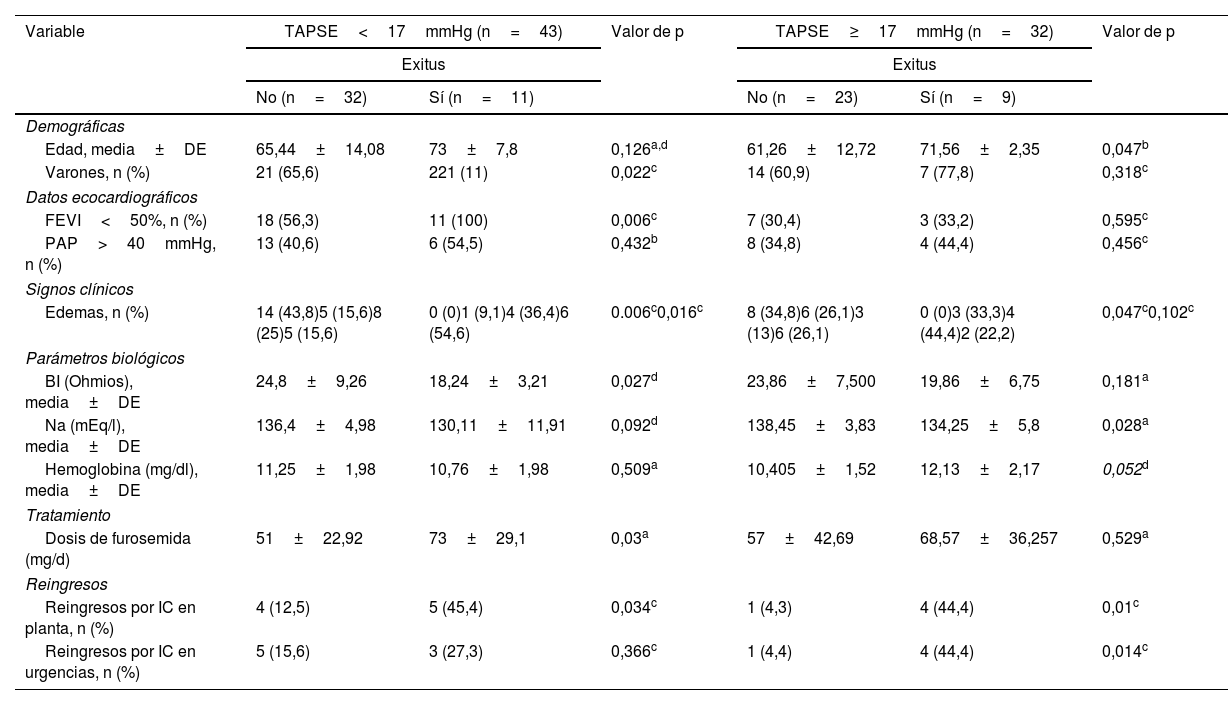
Cuando se analizó la evolución de los pacientes según la disfunción del VD (tabla 3), entre los que fallecieron en el subgrupo con TAPSE<17mmHg la proporción de sujetos con disfunción ventricular izquierda fue mayor y los valores de BI menores y en el subgrupo con TAPSE≥17mmHg presentaron valores más bajos de sodio plasmático, no existiendo diferencias significativas en los valores de BI.
Características basales y evolución según TAPSE del VD
| Variable | TAPSE<17mmHg (n=43) | Valor de p | TAPSE≥17mmHg (n=32) | Valor de p | ||
|---|---|---|---|---|---|---|
| Exitus | Exitus | |||||
| No (n=32) | Sí (n=11) | No (n=23) | Sí (n=9) | |||
| Demográficas | ||||||
| Edad, media±DE | 65,44±14,08 | 73±7,8 | 0,126a,d | 61,26±12,72 | 71,56±2,35 | 0,047b |
| Varones, n (%) | 21 (65,6) | 221 (11) | 0,022c | 14 (60,9) | 7 (77,8) | 0,318c |
| Datos ecocardiográficos | ||||||
| FEVI<50%, n (%) | 18 (56,3) | 11 (100) | 0,006c | 7 (30,4) | 3 (33,2) | 0,595c |
| PAP>40mmHg, n (%) | 13 (40,6) | 6 (54,5) | 0,432b | 8 (34,8) | 4 (44,4) | 0,456c |
| Signos clínicos | ||||||
| Edemas, n (%) | 14 (43,8)5 (15,6)8 (25)5 (15,6) | 0 (0)1 (9,1)4 (36,4)6 (54,6) | 0.006c0,016c | 8 (34,8)6 (26,1)3 (13)6 (26,1) | 0 (0)3 (33,3)4 (44,4)2 (22,2) | 0,047c0,102c |
| Parámetros biológicos | ||||||
| BI (Ohmios), media±DE | 24,8±9,26 | 18,24±3,21 | 0,027d | 23,86±7,500 | 19,86±6,75 | 0,181a |
| Na (mEq/l), media±DE | 136,4±4,98 | 130,11±11,91 | 0,092d | 138,45±3,83 | 134,25±5,8 | 0,028a |
| Hemoglobina (mg/dl), media±DE | 11,25±1,98 | 10,76±1,98 | 0,509a | 10,405±1,52 | 12,13±2,17 | 0,052d |
| Tratamiento | ||||||
| Dosis de furosemida (mg/d) | 51±22,92 | 73±29,1 | 0,03a | 57±42,69 | 68,57±36,257 | 0,529a |
| Reingresos | ||||||
| Reingresos por IC en planta, n (%) | 4 (12,5) | 5 (45,4) | 0,034c | 1 (4,3) | 4 (44,4) | 0,01c |
| Reingresos por IC en urgencias, n (%) | 5 (15,6) | 3 (27,3) | 0,366c | 1 (4,4) | 4 (44,4) | 0,014c |
BI: bioimpedancia eléctrica medida con IVOL; DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; Na: sodio plasmático; Nt-pro-BNP: porción N-terminal del pro-péptido natriurético tipo B; PAP: presión arterial pulmonar; TAPSE: tricuspid annular plane systolic excursion (excursión sistólica del anillo tricúspide).
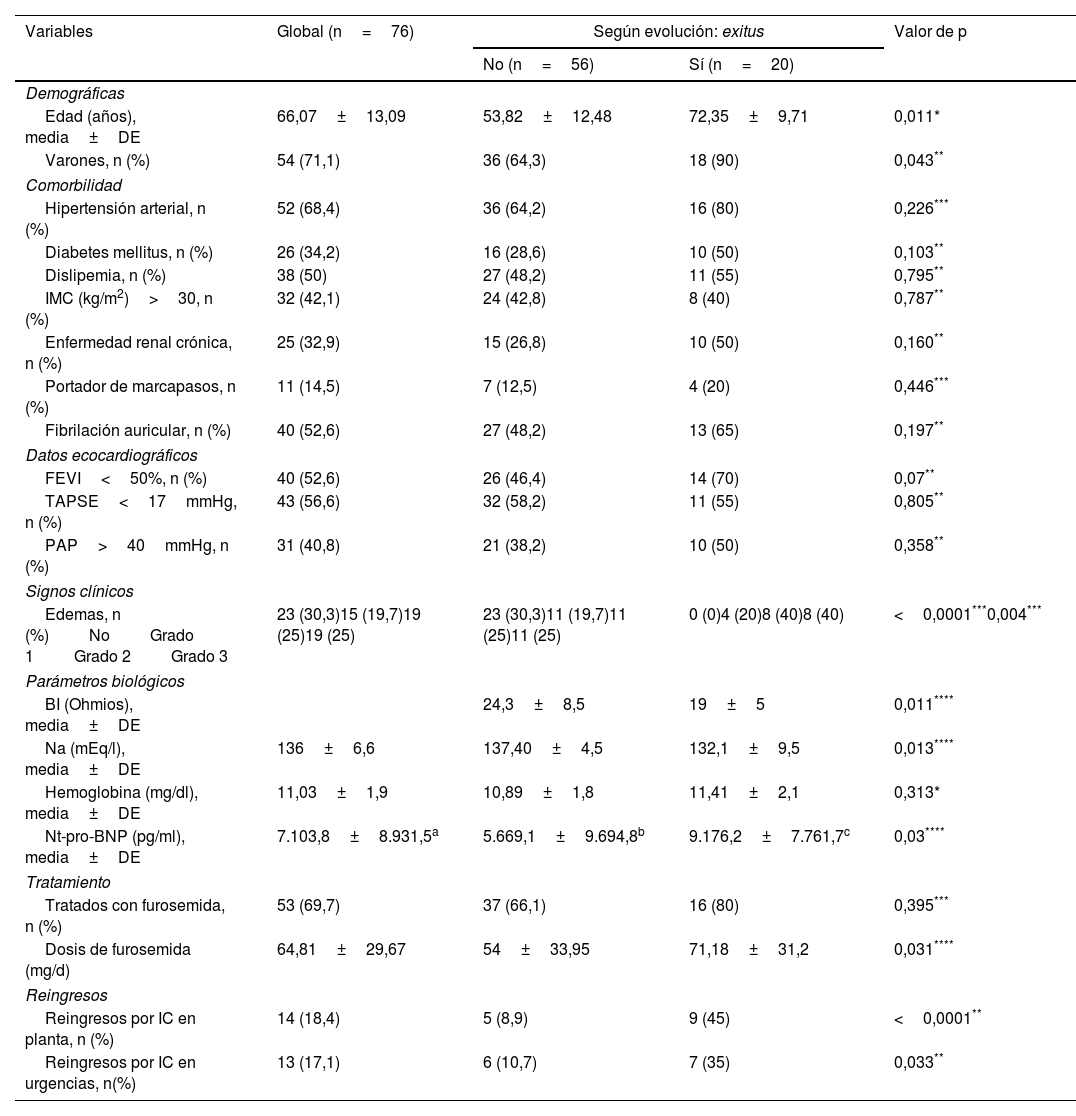
Las curvas de supervivencia dicotomizadas según el valor de BI obtenido en las curvas ROC mostraron una menor supervivencia de los pacientes con BI≤21,80Ω (42,07 vs. 56,57 meses, log rank/Mantel-Cox; p=0,017) (fig. 2a). Para los diferentes subgrupos (con o sin FEVI≥50% y con o sin disfunción del VD), la supervivencia en los pacientes con BI≤21,80Ω fue menor solo en los subgrupos con FEVI<50 (fig. 2c) y TAPSE<17mmHg (fig. 2e).
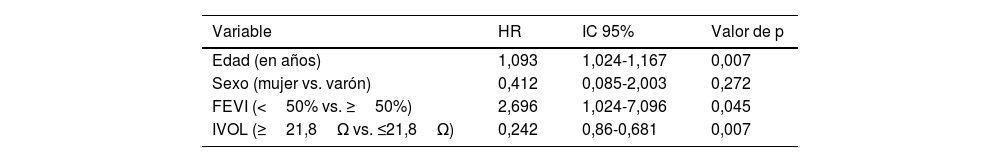
Finalmente, en el análisis multivariante, en el que se incluyeron las variables edad, sexo, FEVI y BI, los únicos factores asociados con mortalidad en la población del estudio fueron edad (HR: 1,067; IC 95%: 0,996-1,143; p=0,064) y BI<20Ω (HR: 3,169; IC 95%: 1,001-9,96; p=0,048). La BI fue un factor independiente de supervivencia en la población de estudio (BI≥21,8Ω; HR: 0,242; IC 95%: 0,86-0,681; p=0,007) junto con la edad y la FEVI (tabla 4).
Impacto de diferentes variables sobre la supervivencia. Análisis multivariante de Cox con índices de riesgo ajustados
| Variable | HR | IC 95% | Valor de p |
|---|---|---|---|
| Edad (en años) | 1,093 | 1,024-1,167 | 0,007 |
| Sexo (mujer vs. varón) | 0,412 | 0,085-2,003 | 0,272 |
| FEVI (<50% vs. ≥50%) | 2,696 | 1,024-7,096 | 0,045 |
| IVOL (≥21,8Ω vs. ≤21,8Ω) | 0,242 | 0,86-0,681 | 0,007 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: harzard ratio; IC 95%; intervalo de confianza al 95%; IVOL: bioimpedancia eléctrica media con el dispositivo IVOL; Ω; ohmio.
El presente estudio ha explorado el valor pronóstico de la medida de la BI en la IC aguda mediante el uso de un nuevo dispositivo portátil. Este dispositivo, validado en un estudio previo frente a un equipo comercial de uso clínico14, es el primero que permite la medida inalámbrica de la BI en la pierna a múltiples frecuencias, por lo que podría emplearse como marcador subrogado de congestión para detectar congestión subclínica, en correlación o con otros marcadores ecocardiográficos (p. ej., diámetro de la cava) y biológicos (p. ej., CA-125), y guiar precozmente el tratamiento.
En cuanto a los resultados obtenidos habría que destacar algunos hallazgos. En primer lugar, los resultados indican que la BI es un marcador pronóstico independiente de mortalidad en pacientes con IC, y que su valor pronóstico se mantiene en pacientes con FEVI no preservada (<50%), y en aquellos con disfunción del VD (TAPSE<17mmHg). En este sentido, valores bajos BI (≤21,8Ω) en el análisis de supervivencia, se asocian a una supervivencia significativamente menor, tanto en el conjunto total de sujetos evaluados como en los subgrupos de pacientes con FEVI no conservada y con disfunción del VD.
En el análisis bivariado los valores medios de BI son más bajos en los pacientes que fallecen en el global de la población, y en los subgrupos con IC con FEVI no preservada y con disfunción diastólica del VD, si bien en el subgrupo con IC con FEVI preservada las diferencias son cercanas a la significación estadística (p=0,088). Estos últimos hallazgos sugieren que la capacidad predictiva de la BI es menor en pacientes sin disfunción ventricular derecha, lo que es concordante con el hecho de que la BI sea un marcador del grado de edema periférico, que aparece con menos frecuencia en pacientes con función ventricular derecha conservada17.
Finalmente, en nuestro estudio la medida puntual de los valores de BI medidos con IVOL en pacientes hospitalizados son un marcador de riesgo independiente de supervivencia a largo plazo (media de seguimiento: 35,8 meses, rango de 0 a 60 meses).
Otro dato a destacar en el estudio es que durante el seguimiento reingresaron el 35,5% de los pacientes, 17,1% en urgencias y 18,4% en planta, lo que indica que casi la mitad de los pacientes pudieron resolverse en urgencias sin precisar un nuevo ingreso hospitalario.
En la actualidad, se han descrito más de 150 modelos pronósticos para la IC18,19, siendo los predictores más potentes el nitrógeno ureico en sangre y el sodio18, aunque una revisión sistemática indica que las estudios realizados para su desarrollo adolecen de sesgos importantes19, porque no han sido calibrados adecuadamente19,20, y un metaanálisis indica además, que la precisión de los modelos es moderada para predecir la mortalidad y aún más pobre para predecir la hospitalización18, como hemos demostrado en un estudio de calibración de escalas pronósticas20.
Los estudios clínicos de BI se basan en la relación inversa entre la impedancia y el volumen corporal7, permitiendo estimar el estado de volemia total del organismo o de algunas áreas específicas (principalmente intratorácicas colocando los electrodos sobre el área correspondiente21).
La BI intratorácica solo ha sido testada en pacientes con IC con FEVI reducida, utilizando sensores incorporados en dispositivos de resincronización o desfibriladores implantables22, y los resultados de 2 ensayos clínicos más recientes cuestionan su utilidad23,24.
Los métodos no invasivos para evaluar la impedancia corporal total incluyen el análisis de BI de cuerpo entero (BIA) y análisis de vector de impedancia bioeléctrica (BIVA)25. En el estudio de la IC el valor de la BIA es limitado, ya que los algoritmos para estimar el volumen corporal total se han establecido a partir de poblaciones de sujetos sanos, por lo que cuando el grado de retención hídrica de los diferentes tejidos es variable, como ocurre en la IC, se produce estimaciones inexactas para los compartimentos corporales específicos25.
La BIVA detecta edema periférico antes de que sea aparente, y puede ser útil para evaluar el líquido en pacientes con hipervolemia26,27. Su medida no precisa ser normalizada en poblaciones de referencia como la BIA26, y permite estimar la composición corporal total y de compartimentos específicos21,26.
En la IC las mediciones de volumen corporal total por BIVA han demostrado ser útiles para aumentar la precisión en el diagnóstico de la enfermedad27,28.
Solo hay 3 estudios que han evaluado el papel pronóstico de estas medidas de BIVA en la IC aguda13,29,30. En el primero, la eliminación de volumen guiada por evaluaciones seriadas de BIVA durante la hospitalización se asoció a un aumento de la supervivencia a los 90 días del alta13. Los 2 últimos son estudios unicéntricos donde los valores de BIVA se asocian de forma independiente al riesgo de reingreso29 o muerte29,30.
En cuanto a las mediciones de volumen en la pierna mediante BIVA, solo hay un estudio amplio que demuestra que en la población general los valores puntuales de BIVA medida en pierna están inversamente asociados al riesgo de IC11.
Nuestro estudio tiene algunas limitaciones. La principal es el tamaño y la heterogeneidad de la muestra evaluada que incluye pacientes con todo el espectro clínico de IC, lo que podría comprometer la potencia del análisis. Sin embargo, como en otros estudios con muestras de tamaño similar o inferior a la nuestra27,28, a pesar de estos factores se ha podido demostrar el valor pronóstico de este marcador, globalmente, y en todos los subgrupos evaluados, lo que sugiere que este parámetro tiene un valor predictivo elevado. Por otra parte, la disponibilidad de péptidos natriuréticos durante el ingreso en los pacientes de nuestra cohorte ha sido limitada y el uso de los criterios de Framingham ha podido limitar la precisión diagnóstica en los pacientes con FEVI preservada. Sin embargo, existían alteraciones estructurales cardiacas (hipertrofia del ventrículo izquierdo o dilatación de la aurícula izquierda) o datos de disfunción diastólica en 35 (92%) de los 38 pacientes con IC con FEVI>50% y en los 3 restantes casos los valores de NT-pro-BNP fueron >1.000pg/ml. Finalmente, se trata de un estudio unicéntrico, lo que limita la validez externa de los resultados obtenidos.
Sin embargo, el seguimiento de la cohorte ha sido prolongado y la consistencia de los resultados obtenidos con diversas aproximaciones metodológicas (análisis bivariado, de supervivencia y regresión logística múltiple) aporta solidez a las conclusiones obtenidas.
ConclusionesLos valores de bioimpedancia eléctrica en el tobillo medidos con el dispositivo inalámbrico y portátil IVOL pueden ser un predictor independiente de mortalidad a largo plazo en pacientes hospitalizados por IC aguda. Este valor pronóstico se mantiene en la IC con FEVI no preservada y en pacientes con disfunción del VD.
La medición simple, no invasiva de la BI con el dispositivo propuesta podría en el futuro permitir la monitorización continua ambulatoria de la evolución de los pacientes con IC, y ayudar a identificar muy precozmente las descompensaciones de los pacientes, aspectos que están siendo actualmente evaluados en un ensayo clínico, cuyos resultados preliminares del estudio piloto han sido recientemente publicados31,32.
Aspectos éticosEl protocolo de estudio fue aprobado por el Comité de Ética de la Investigación de los Hospitales Virgen Macarena y Virgen del Rocío de Sevilla. Los datos recogidos fueron anonimizados según las recomendaciones de la Ley de Protección de Datos. Los pacientes firmaron el consentimiento informado.
Contribución de los autoresE. Gutiérrez-Carretero, A.M. Campos y A. Peña fueron las responsables de la inclusión de pacientes y recogida de datos. J. Rossel desarrolló y realizó las mediciones con el equipo IVOL. F. Medrano y J.M. Praena realizaron el análisis estadístico. F.J. Medrano, E. Gutierrez y A. Ordoñez redactaron el borrador del manuscrito. Todos los autores participaron en la concepción y diseño del estudio, y llevaron a cabo la interpretación de los datos y la revisión y aprobación del manuscrito.
FinanciaciónEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III (becas DTS19/00137 y DTS19/00134).
Conflicto de interesesTodos los autores declaran no tener relaciones de intereses en relación con el contenido de este artículo.