Innovation in Respiratory Diseases
More infoEl desarrollo de gemelos digitales (GD) pulmonares representa un avance significativo en la medicina personalizada, proporcionando un marco virtual que replica la estructura, la función y la patología del sistema respiratorio de manera individualizada. Los GD integran datos clínicos, imágenes de alta resolución y modelos matemáticos para simular la mecánica respiratoria, la difusión de gases y la dinámica de fluidos. Esta tecnología mejora el diagnóstico, la planificación de tratamientos y la monitorización de la progresión de enfermedades. Una de las aplicaciones clave de los GD pulmonares es la capacidad de simular la respuesta específica de cada paciente a los tratamientos y predecir los resultados, permitiendo personalizar las terapias. A pesar de los avances, la implementación de los GD en la práctica clínica enfrenta desafíos relacionados con la integración de datos, la eficiencia computacional y consideraciones éticas sobre la privacidad de la información. No obstante, los GD pulmonares ofrecen una promesa clara para mejorar la medicina de precisión, optimizar la atención al paciente y mejorar los resultados clínicos.
The development of lung digital twins (DTs) represents a significant advance in personalized medicine, providing a virtual framework that replicates the structure, function, and pathology of the respiratory system in an individualized manner. DTs integrate clinical data, high-resolution images, and mathematical models to simulate respiratory mechanics, gas diffusion, and fluid dynamics in real time. This technology improves diagnosis, treatment planning, and disease progression monitoring. One of the key applications of lung DTs is the ability to simulate patient-specific response to treatments and predict outcomes, allowing for personalized therapies. Despite advances, the implementation of DTs in clinical practice faces challenges related to data integration, computational efficiency, and ethical considerations regarding data privacy. Nevertheless, lung DTs offer clear promise for improving precision medicine, optimizing patient care, and improving clinical outcomes.
En las últimas décadas la medicina ha experimentado una transformación radical impulsada por los avances en la tecnología digital. Uno de los conceptos emergentes que promete revolucionar el diagnóstico, el tratamiento y la monitorización de enfermedades es el de los gemelos digitales (GD). El término fue acuñado a principios del sigloxxi en el ámbito de la ingeniería para hacer referencia a una réplica virtual de un objeto, proceso o sistema físico, que permita simular su comportamiento en diferentes escenarios1. Esta representación se basa en datos provenientes del objeto físico, así como en modelos computacionales que replican sus características físicas, mecánicas y funcionales. Los GD no solo reflejan el estado actual del objeto, sino que también pueden predecir su futuro comportamiento mediante simulaciones basadas en datos históricos y análisis predictivos. Aplicado al campo de la salud, un GD de un órgano humano puede recrear virtualmente su estructura y su función, y la terminología más aceptada es virtual human twin.
Desde las anotaciones del cuerpo humano realizadas por Leonardo da Vinci en 1543 en su tratado De humani corporis fabrica hasta el primer implante permanente de un corazón realizado por Jarvik en 1982, la ingeniería se ha convertido en una condición sine qua non de la práctica médica, difuminándose la línea divisoria entre la ingeniería y la biología. El mapeo digital de la salud y la enfermedad humanas anuncia el nacimiento de la medicina de precisión con el objetivo final de crear un GD para cada ser humano que pueda pronosticar la salud y el bienestar de una manera no invasiva. El GD permitirá analizar y tratar patologías antes de su implementación en el paciente2. El avance en el poder de procesamiento computacional, la inteligencia artificial (IA) y una de sus ramas, el machine learning (ML), así como la disponibilidad de grandes volúmenes de datos (el llamado Big Data), han sido cruciales para el desarrollo de GD cada vez más precisos y útiles, capaces de adaptarse a la complejidad biológica y fisiológica de los seres humanos.
La medicina ha sido testigo de una rápida digitalización en los últimos años, que abarca desde la implementación de registros electrónicos de salud hasta el uso de IA en el diagnóstico y el tratamiento de enfermedades. En este contexto, la creación de GD para órganos humanos ha supuesto un importante hito. Estos GD se han desarrollado a partir de la combinación de datos clínicos, imágenes médicas, información de dispositivos portátiles (por ejemplo, relojes inteligentes) y modelos biomecánicos. Los avances en el modelado matemático y las simulaciones computacionales han permitido que estos modelos sean lo suficientemente precisos como para replicar el comportamiento de órganos complejos en diferentes patologías, así como su respuesta a los posibles tratamientos.
Las aplicaciones actuales de los GD se centran en órganos y sistemas aún no acoplados entre ellos. Uno de los modelos más avanzados hasta ahora es el virtual human twin cardiaco, como lo demuestra la spin-off creada desde el Centro Nacional de Supercomputación, ELEM biotech (http://elem.bio/). También se han desarrollado modelos de hígado, cerebro y riñones, además del pulmón, del que se tratará a fondo en esta revisión. Existen numerosos proyectos de investigación y consorcios internacionales que están avanzando en este campo, tales como la iniciativa Avicenna, centrada en la simulación computacional en medicina, con un enfoque particular en el desarrollo de GD de órganos para ensayos clínicos virtuales (https://www.avicenna-alliance.com/), o Virtual Human Twin (VHT), un consorcio europeo que busca desarrollar un GD humano completo para personalizar el tratamiento médico (www.virtualhumantwins.eu/, https://www.edith-csa.eu/).
El desarrollo de GD del sistema respiratorio ha captado el interés de la comunidad científica en los últimos años, debido a su enorme potencial para abordar algunos de los desafíos más complejos en el manejo de las enfermedades pulmonares. Muchas patologías respiratorias presentan una gran variabilidad en su presentación clínica y en la respuesta a los tratamientos, lo que dificulta su manejo con enfoques tradicionales. Los GD pulmonares permiten una comprensión más profunda de la fisiopatología individual, facilitando la personalización de los tratamientos y mejorando los resultados clínicos3.
El propósito de este artículo es explorar el concepto de GD pulmonares, analizar sus aplicaciones actuales y futuras en la medicina respiratoria, y discutir los desafíos que enfrentan para su implementación en la práctica clínica.
Desarrollo de GD en la neumologíaEl desarrollo de GD pulmonares se ha visto impulsado por la creciente demanda de soluciones que permitan una medicina más personalizada. La capacidad de los GD para integrar grandes volúmenes de datos anatómicos, genéticos y fisiológicos permite la creación de modelos más precisos y adaptados a las características de cada paciente. Un GD pulmonar debe ser capaz de replicar la mecánica respiratoria, la difusión de gases, la dinámica de los fluidos dentro de las vías aéreas y los procesos patológicos.
Para construir un GD pulmonar se requiere la integración de datos provenientes de múltiples fuentes. Cuanto más exhaustiva sea esta información, mayor precisión alcanzará el modelo de humano virtual, ayudando a tomar decisiones clínicas. Un buen modelo del pulmón debe nutrirse de la información de imágenes radiológicas de alta resolución que capturen la anatomía pulmonar con detalle, datos funcionales que reflejen la capacidad respiratoria (espirometría, medición de volúmenes pulmonares y capacidad de difusión, ergoespirometría…), la distribución del flujo sanguíneo, y datos moleculares que permiten simular procesos patológicos a nivel celular. Como vemos en la figura 1, todo ello se integra computacionalmente junto con modelos matemáticos que describen los mecanismos físicos del funcionamiento del pulmón, a nivel de órgano y a nivel celular. La capacidad de los GD para simular y analizar estos datos ofrece una herramienta sin precedentes para el diagnóstico y el tratamiento de las enfermedades pulmonares, que se desarrolla gracias a un equipo transdisciplinar.
En un primer nivel, la aplicación de modelos predictivos y simulaciones en los GD permite prever cómo responderá un determinado paciente a diferentes tratamientos, ajustar su dosis, planificar intervenciones quirúrgicas o monitorizar la progresión de la enfermedad de manera no invasiva. En un segundo nivel, encontramos una de las características más poderosas de los GD, su capacidad para interactuar con modelos predictivos basados en IA y ML. Estos modelos pueden analizar grandes cantidades de datos y encontrar patrones que serían imposibles de identificar mediante métodos tradicionales. Un GD puede no solo replicar la anatomía y la fisiología del pulmón, sino también prever la evolución de la enfermedad, identificar factores de riesgo específicos y sugerir intervenciones personalizadas.
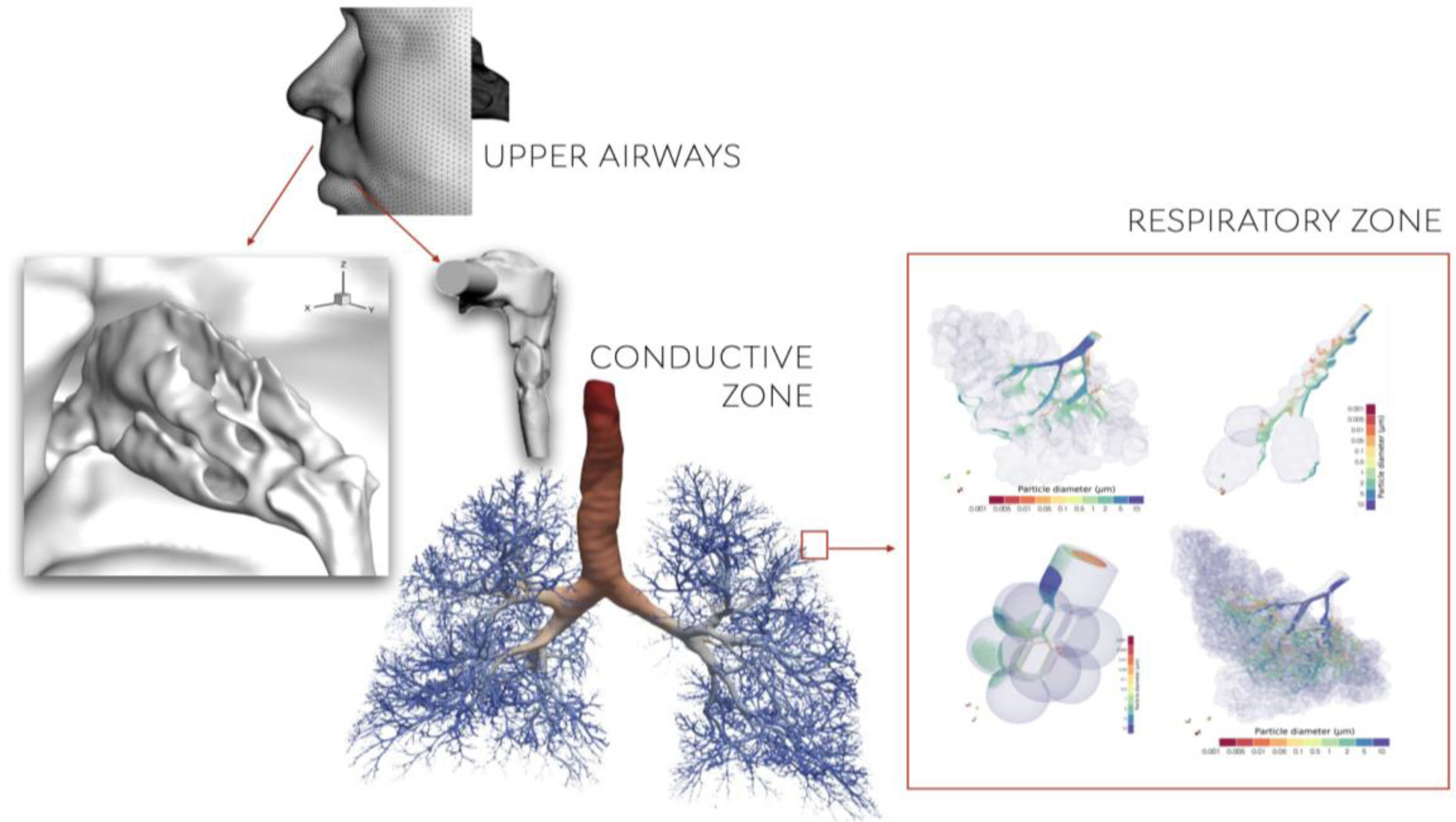
Por el momento, una de las grandes limitaciones en el desarrollo de los GD es poder generar un modelo que incluya todas las vías respiratorias para ser resueltas de forma única. Como se ilustra en la figura 2, tradicionalmente se han abordado los estudios centrándose de forma separada en las vías altas, en la zona conductiva o la zona respiratoria de intercambio gaseoso, según la cuestión de interés a estudiar.
Aplicaciones de los gemelos digitales a las patologías respiratoriasVisualización de patologíasLos GD permiten visualizar la extensión y la localización de nódulos, atelectasias, fibrosis o infiltrados infecciosos. Ahmed et al.4 establecieron un sistema de atención sanitaria inteligente basado en GD combinado con dispositivos médicos para recopilar información sobre el estado de salud actual. Este sistema analizaba radiografías de tórax utilizando un modelo de aprendizaje automático, para detectar infección por COVID-19. El modelo fue entrenado con imágenes de radiografía y utilizaba un proceso de varias etapas para refinar la detección de áreas infectadas, con el objetivo de reducir los falsos positivos y mejorar la precisión. El sistema demostró una alta precisión en la detección de infecciones por COVID-19, logrando una tasa de precisión promedio de 0,94. Esta capacidad de los GD sería especialmente valiosa en el diagnóstico del cáncer de pulmón, donde la detección temprana de lesiones malignas es crucial. Además, sería posible simular cómo una lesión crecería y se diseminaría bajo diferentes condiciones.
Evaluación funcional respiratoriaLos GD pueden simular la función pulmonar. Esto es particularmente útil en patologías obstructivas como la EPOC o el asma. La simulación permite evaluar cómo una obstrucción afecta la distribución del aire en los pulmones. Fernández et al.5 desarrollaron un modelo de pulmón diseñado para simular el flujo de aire hasta los alveolos en condiciones de salud normal y de bronquitis crónica. El modelo fue validado utilizando datos de espirometrías reales y luego se empleó para predecir el comportamiento del pulmón en casos de bronquitis, induciendo una reducción generalizada del diámetro de la vía aérea. El pulmón con bronquitis mostró una disminución del 13% en el volumen de aire en comparación con un pulmón sano. Los valores del FEV1/FVC fueron de alrededor del 71% para el pulmón sano y del 67% para el pulmón con bronquitis. A diferencia de los métodos experimentales tradicionales como la espirometría, este modelo permite visualizar el flujo en cualquier parte del pulmón, proporcionando una descripción detallada del campo de flujo.
En las vías altas, el GD permite evaluar el flujo de aire, la resistencia, la obstrucción y su funcionalidad de forma no invasiva. En la literatura se pueden encontrar numerosos estudios de simulación computacional de la dinámica del flujo de aire en la cavidad nasal, como los trabajos de Calmet et al.6-8.
Predicción de la progresión de enfermedadesLos GD pueden ayudarnos a predecir la evolución de distintas patologías mediante la integración de datos históricos del paciente, modelos fisiopatológicos y algoritmos de ML que analicen patrones complejos en la evolución de la enfermedad.
Joslyn et al.9 desarrollaron un modelo computacional completo del huésped, llamado HostSim, para simular la respuesta inmune en infecciones por Mycobacterium tuberculosis. Este modelo permite predecir cómo los primeros eventos inmunológicos pueden influir en los resultados de la infección. HostSim integra datos sobre la dinámica celular y molecular en diferentes compartimentos fisiológicos (los ganglios linfáticos, la sangre y los pulmones), y fue calibrado utilizando datos de estudios en primates. HostSim predijo que la diferenciación y la proliferación de célulasT en los ganglios linfáticos son factores clave para determinar si la infección progresará a tuberculosis activa o latente, y que los macrófagos, por su papel central en la respuesta inmune contra Mycobacterium tuberculosis, podrían ser una diana para futuros tratamientos en la tuberculosis.
En la revisión sistemática de Smith et al.10 se analizó la capacidad de modelos de ML y deep learning, una rama del ML, para predecir resultados a largo plazo en pacientes con EPOC. Fueron incluidos estudios que utilizaron modelos de ML o deep learning para predecir resultados de mortalidad, exacerbación o deterioro de la función pulmonar en pacientes con EPOC. Tanto los modelos de ML como los de deep learning mostraron un área bajo la curva de aproximadamente 0,77 para la predicción de mortalidad, lo que indica una capacidad predictiva moderada. El área bajo la curva para la predicción del riesgo de exacerbación también fue alrededor de 0,77, pero con una variabilidad significativa entre los estudios. Respecto a la función pulmonar, los datos eran limitados para predecir el su deterioro, con solo dos estudios incluidos.
Personalización del pronósticoA diferencia de los modelos tradicionales, basados en datos poblacionales, los GD podrían analizar la progresión de la enfermedad en función de las características individuales del paciente, como la genética, el estilo de vida, la exposición a factores de riesgo y la respuesta a tratamientos previos.
González et al.11 utilizaron una red neuronal convolucional de tres capas en TC de tórax de las cohortes COPDGene y ECLIPSE para determinar si esta metodología podía detectar y estadificar la EPOC, así como predecir eventos respiratorios agudos y mortalidad entre fumadores. El entrenamiento se realizó en 7.983 sujetos de COPDGene, y las pruebas y la replicación se llevaron a cabo en 1.000 y 1.672 participantes de COPDGene y ECLIPSE, respectivamente. Utilizando un montaje de cuatro cortes de TC en diferentes niveles anatómicos, la red neuronal podía predecir el estadio GOLD con un 74% de precisión. Respecto a la predicción de mortalidad y exacerbaciones agudas, mostró una capacidad moderada de predicción, con un índiceC de 0,72, y 0,61, respectivamente. Este desempeño, aunque apenas es superior al del índice BODE, resalta el poder de las redes neuronales para estimar el pronóstico basándose en características significativas de las imágenes de TC del paciente.
El proyecto INSPIRE (https://www.upf.edu/web/inspire) se centra en la predicción de las respuestas terapéuticas gracias a modelos computacionales de inflamación pulmonar, así como en la integración de tales predicciones en la práctica clínica.
Simulación de condiciones críticasEn situaciones críticas, como el síndrome de distrés respiratorio agudo, los GD podrían simular cómo el pulmón de un paciente respondería a diferentes niveles de soporte ventilatorio. Esta simulación puede ayudar a ajustar de manera precisa los parámetros de ventilación mecánica, minimizando el riesgo de barotrauma o volutrauma.
Weaver et al.12 llevaron a cabo un estudio para valorar el éxito o fracaso de la ventilación mecánica no invasiva (VMNI) en pacientes con insuficiencia respiratoria hipoxémica aguda. Para ello, crearon GD basados en modelos computacionales de pacientes con insuficiencia respiratoria hipoxémica aguda. Estos GD permitían evaluar la mecánica pulmonar y cuantificar el esfuerzo respiratorio del paciente y el soporte ventilatorio, para analizar las causas del éxito o fracaso de la VMNI. Se utilizó información de 30 pacientes con insuficiencia respiratoria hipoxémica aguda moderada a grave con fracaso en el tratamiento con gafas nasales de alto flujo, y que posteriormente recibieron tratamiento con VMNI. En los GD de pacientes que tuvieron éxito con la VMNI hubo una mejora en la mecánica pulmonar, incluyendo una reducción del esfuerzo respiratorio y de los índices asociados a la lesión pulmonar. El éxito de la VMNI se asoció con niveles adecuados de presión positiva inspiratoria, que mejoraron la distensibilidad del pulmón y redujeron el esfuerzo respiratorio. La VMNI falló en pacientes a los que solo se les podían aplicar niveles bajos de soporte de presión inspiratoria positiva sin correr el riesgo de que el paciente se autoinfligiera una lesión pulmonar debido a volúmenes corrientes excesivos. Los GD demostraron ser útiles para predecir y analizar el éxito o fracaso de la VMNI, proporcionando una manera de evaluar parámetros no medibles en pacientes respirando espontáneamente.
Planificación quirúrgica personalizadaLos GD pueden reconstruir virtualmente el pulmón de un paciente a partir de imágenes radiológicas, facilitando a los cirujanos planificar procedimientos complejos. Los GD permitirían simular la cirugía en un entorno virtual antes de la intervención real, ayudando a identificar la mejor estrategia quirúrgica y a predecir posibles complicaciones postoperatorias.
Tai et al.13 desarrollaron una metodología para gestionar cirugías, mejorando la precisión, la inmersión y la predicción en casos complejos de cáncer de pulmón con embolia pulmonar. Para ello, elaboraron un sistema de Internet of Medical Things (IoMT) habilitado por GD para simulación telemédica, integrado con realidad mixta (combinación de realidad virtual con realidad aumentada), y una red generativa adversarial para mejorar la precisión del diagnóstico de embolia pulmonar en el cáncer de pulmón. Recopilaron datos de 90 pacientes con cáncer de pulmón con embolia pulmonar y 1.372 pacientes con cáncer de pulmón sin embolia pulmonar. La red generativa adversarial demostró tener una alta capacidad para distinguir los pacientes con embolismo pulmonar de los que no lo tenían, con un área bajo la curva de 0,92 y 0,93. Para mejorar la precisión durante la cirugía, el sistema proyectaba en tiempo real imágenes de navegación quirúrgica a los cascos de los cirujanos mediante realidad mixta y la guía del GD.
Estudio de riesgos asociados a la inhalación de contaminantesLa modelización del transporte, del depósito y de la translocación de materia particulada (PM) desde el sistema respiratorio a la circulación sistémica puede ayudar a predecir los riesgos derivados de su presencia en la salud del individuo. Las partículas en suspensión en el aire, especialmente aquellas con diámetros inferiores a 2,5μm (PM2,5), han supuesto una preocupación sanitaria desde hace décadas, dada su relación con diversas patologías respiratorias, cáncer e incluso enfermedades neurológicas14,15. Los GD pueden proporcionar una información novedosa y ayudar en el conocimiento de cómo actúan los aerosoles inhalados. Al analizar los datos que nos ofrecen las simulaciones computacionales, se pueden extraer nuevas ideas sobre el comportamiento de los aerosoles dentro del sistema respiratorio, mejorando la comprensión de la dinámica de los aerosoles. Para ello es necesario realizar análisis de sensibilidad paramétricos, con el objetivo de comprender los mecanismos fundamentales de la dinámica de transporte y de translocación de aerosoles y encontrar soluciones para minimizar los riesgos para la salud16-21. En este campo, los modelos de ML están siendo explorados para desarrollar una herramienta innovadora que prediga con precisión el comportamiento del transporte y reduzca el tiempo de cálculo computacional22,23.
Desarrollo y validación de nuevas terapiasLos GD permiten ensayar nuevos tratamientos en un entorno controlado, acelerando el proceso de desarrollo y aumentando la precisión en la predicción de su eficacia y su seguridad. El uso de IA en GD permitiría, por ejemplo, predecir la respuesta de un paciente a un tratamiento específico para el cáncer de pulmón, basado en datos de otros pacientes con características similares. Tao y Qi1 realizaron un ensayo clínico virtual para valorar la efectividad de continuar, o no, el tratamiento con pembrolizumab en pacientes con cáncer de pulmón de célula no pequeña en progresión, en los que las terapias de rescate son limitadas. Varios estudios retrospectivos sugieren que un subconjunto de pacientes podrían beneficiarse del pembrolizumab a pesar de la progresión; sin embargo, estos resultados no se han validado en un estudio prospectivo. Los autores construyeron GD de pacientes y simularon ensayos clínicos para predecir la mejor terapia de rescate después de la enfermedad progresiva con pembrolizumab. La respuesta al tratamiento se evaluó midiendo el tamaño de las distintas lesiones de cada paciente. Realizaron más de 25.000 mediciones de lesiones radiográficas en más de 500 pacientes, simularon las respuestas a pembrolizumab y a la quimioterapia de segunda línea y valoraron la progresión de la enfermedad. Observaron que continuar con pembrolizumab, más allá de la progresión, brindaba resultados similares o mejores, en particular para pacientes con tipos específicos de progresión.
Educación y formación médicaAl proporcionar simulaciones realistas de procedimientos médicos y la evolución de enfermedades, los GD podrían convertirse en una herramienta educativa invaluable. Pueden ayudar a comprender mejor la fisiopatología de las enfermedades pulmonares, observando cómo los cambios a nivel celular y tisular se traducen en síntomas clínicos. Los GD también podrían emplearse para practicar procedimientos invasivos, como la broncoscopia o la colocación de drenajes torácicos, en un entorno virtual.
Retos actuales y limitacionesA pesar de los grandes avances de los últimos años, existen algunos retos clave para la implantación de los GD. Los órganos humanos son sistemas multi-escala altamente complejos, y la precisión de los GD depende de la calidad de los modelos y de la capacidad de incorporar todos los factores fisiológicos relevantes. Además, los GD requieren la integración de datos procedentes de diferentes fuentes (imágenes, sensores, datos genéticos), lo que plantea desafíos en términos de interoperabilidad y calidad de los datos.
Otro aspecto a tener en cuenta es que el desarrollo y el mantenimiento de un GD puede ser costoso, lo que limita su acceso en sistemas de salud con recursos limitados. Además, la creación de GD involucra el uso masivo de datos médicos personales, lo que plantea preocupaciones sobre la privacidad y el uso ético de esta información.
ConclusionesEl desarrollo de GD pulmonares representa un avance significativo en la medicina personalizada, proporcionando un marco digital capaz de replicar la estructura, la función y la patología del sistema respiratorio de manera individualizada. Estos modelos ofrecen nuevas oportunidades para predecir la progresión de enfermedades respiratorias, personalizar tratamientos y mejorar la planificación quirúrgica, a través de la integración de grandes volúmenes de datos clínicos, imágenes de alta resolución y modelos matemáticos avanzados. Los GD han demostrado ser útiles en la visualización de enfermedades y en el manejo de patologías, y permiten una mejor comprensión de las respuestas a intervenciones terapéuticas. No obstante, su éxito depende de la mejora en la calidad y disponibilidad de los datos, la superación de los retos en la integración de fuentes diversas y el abordaje de las preocupaciones éticas relacionadas con la privacidad de los datos. Además, es necesario seguir avanzando en la eficiencia computacional para que los GD puedan ser una herramienta accesible y factible en la práctica clínica diaria. Aunque aún existen retos técnicos y operativos por superar, los GD pulmonares tienen el potencial de transformar la medicina respiratoria.
FinanciaciónNo se ha recibido financiación de ninguna fuente pública, privada o comercial para la elaboración de este manuscrito.
Contribuciones de los autoresAna Fernández-Tena: responsable de la conceptualización y desarrollo inicial del manuscrito; estructuró el contenido y escribió la primera versión del artículo.
Carlos Arnedo: encargado de la elaboración de las imágenes que complementan el artículo; contribuyó significativamente en la revisión del manuscrito.
Guillaume Houzeaux: colaboró en las correcciones del artículo, aportando comentarios críticos para mejorar su precisión y su claridad.
Beatriz Eguzkitza: participó en la revisión detallada y en la estructuración del manuscrito, añadiendo información relevante y garantizando la coherencia del texto, ajustándolo a los estándares de presentación requeridos por la revista.
Conflictos de interesesLos autores declaran no tener conflictos de intereses relacionados con el contenido del artículo.