Clásicamente el papel de la infección pulmonar en el paciente con enfermedad pulmonar obstructiva crónica (EPOC) se ha centrado en los periodos de agudización. Sin embargo, en fase de estabilidad clínica, se ha prestado poca atención al papel que pueden jugar la presencia de microorganismos potencialmente patógenos (MPP) (en especial de forma repetida, lo que se conoce como infección bronquial crónica [IBC]) en la patogenia, pronóstico y tratamiento de la enfermedad. En los últimos años, sin embargo, se han ido acumulando algunas evidencias sobre el efecto deletéreo de esta situación. La IBC en EPOC se ha asociado a una mayor inflamación local, mayor gravedad de la enfermedad, peor calidad de vida relacionada con la salud, mayor número y gravedad de agudizaciones y eventos cardiovasculares, la presencia de bronquiectasias, una pérdida acelerada de función pulmonar e incluso mayor mortalidad (en especial cuando es Pseudomonas aeruginosa (PA) el microorganismo causante de la infección). No se conoce, sin embargo, cuál es el papel que el tratamiento antiinflamatorio o antibiótico de esta infección pueda tener. La presente revisión repasa la evidencia científica existente sobre la IBC en la EPOC estable, desde su propia definición hasta los posibles tratamientos. Asimismo se abordarán los numerosos retos futuros que genera, en especial el desarrollo en el conocimiento del microbioma pulmonar, sus alteraciones y sus consecuencias.
Classically, the role of pulmonary infection in patients with chronic obstructive pulmonary disease (COPD) has focused on periods of exacerbation. However, in a clinically stable situation, little attention has been paid to the role play by the presence of potentially pathogenic micro-organisms (especially when they are repeatedly isolated, which is known as chronic bronchial infection [CBI]) in the pathogenesis, prognosis and disease treatment. In recent years, however, some evidence has been published on the deleterious effect of CBI in COPD since it has been associated to greater local inflammation, greater disease severity, poorer health-related quality of life, greater number and severity of exacerbations and cardiovascular events, presence of bronchiectasis, rapid decline of lung function, and even higher mortality (especially related to Pseudomonas aeruginosa infection). It is not known, however, what is the role of anti-inflammatory or antibiotic treatments on CBI in stable COPD patients. This review focused on the scientific evidence on this topic that exists up to now, from the very definition of IBC in COPD to the possible treatments that this situation entails, as well as the numerous future challenges it generates, especially the development of knowledge of the pulmonary microbiome, its alterations and its consequences.
A pesar de las distintas campañas de concienciación antitabaco y medioambientales, la enfermedad pulmonar obstructiva crónica (EPOC) sigue, y posiblemente seguirá siendo, una de las principales causas de morbilidad y mortalidad del mundo1. La inflamación crónica y en ocasiones progresiva en la vía aérea producida tanto por el humo del tabaco como por otras sustancias o gases tóxicos provoca un daño de las vías aéreas con posterior remodelación de la pared bronquial y la consecuente obstrucción no reversible al flujo aéreo que define la enfermedad2.
La historia natural de la EPOC no solo se ve influenciada por el grado de exposición presente o pasado a los gases tóxicos procedentes del tabaco u otros orígenes, sino también a otra serie de circunstancias, tanto intrínsecas como extrínsecas, de las que solo algunas son tratables (treatable traits). Como ejemplos de circunstancias no tratables (al menos hoy en día) estarían, entre otras, la edad, el sexo o la predisposición genética3. Sin embargo, existen otras causas potencialmente tratables de enorme importancia de entre las que destacan las agudizaciones. Esta circunstancia, que suele ser desencadenada en la mayoría de las ocasiones por una infección bacteriana, vírica o por la coexistencia de ambas se ha relacionado con un empeoramiento en el pronóstico de la enfermedad4. Ello hace que muchos de los ensayos clínicos realizados en EPOC hasta la fecha vayan encaminados hacia una reducción de las mismas.
Por lo tanto, hasta el momento, la mayoría de las guías de práctica clínica (GPC) nacionales e internacionales se han centrado en establecer recomendaciones para el óptimo manejo de los síntomas del paciente con EPOC estable (especialmente mediante el uso de broncodilatadores y corticoides inhalados (CSI) en algunos casos), y del paciente agudizado3,5. Pero ¿qué ocurre con aquellos pacientes con EPOC que, a pesar de encontrarse fuera de un periodo de agudización, siguen presentando el aislamiento (en especial de forma repetida, lo que se denomina infección bronquial crónica [IBC])6 de microorganismos potencialmente patógenos (MPP) en la vía aérea?, ¿es esta una circunstancia a la que debe prestarse atención?, ¿es extrapolable a individuos con EPOC el diagnóstico y manejo que se realiza de la IBC en pacientes con bronquiectasias o fibrosis quística (FQ) (en las que sí se ha demostrado que produce un daño importante y debe de ser tratada)7,8? Durante los últimos años se han ido acumulando algunas evidencias científicas que concurren en señalar la importancia del aislamiento de MPP en pacientes con EPOC estable, al menos bajo determinadas circunstancias.
En el presente manuscrito se revisará la evidencia al respecto, desde los conceptos microbiológicos que definen la IBC, su epidemiologia, factores de riesgo e impacto sobre la evolución de pacientes con EPOC en fase estable, hasta la posible existencia de un fenotipo infeccioso especial de EPOC o la consideración de la IBC en la EPOC estable como un posible rasgo tratable de la enfermedad.
Definición, epidemiología y factores de riesgo de la IBC en EPOCDefiniciónHasta hace pocos años, la vía aérea y el parénquima pulmonar se consideraban zonas estériles. Sin embargo, técnicas de secuenciación masiva del ácido desoxirribonucleico (ADN) han permitido identificar distintas comunidades de gérmenes, incluso en ausencia de infección9. Los microorganismos que forman parte de esta microbiota «normal» están presentes en bajas concentraciones, generalmente no son cultivables en los medios de cultivo convencionales, y se encuentran en un fino equilibrio entre sí, constituyendo un medio protector para el huésped, con efectos inmunomoduladores9,10. Sin embargo, bajo determinadas circunstancias, se producen desequilibrios (disbiosis), con sobrecrecimiento de unas comunidades frente a otras. Es entonces cuando, empleando métodos tradicionales, se pueden aislar diversos microorganismos en las secreciones respiratorias, algunos de los cuales se consideran MPP.
Tradicionalmente este tipo de aislamientos, fuera de un periodo de agudización, se describían como «colonizaciones». Sin embargo, diferentes estudios indican que estos MPP contribuyen a una mayor inflamación local y sistémica, incrementan el riesgo de agudización, y aceleran la progresión de la enfermedad11,12, por lo que actualmente se considera más apropiado emplear el término IBC. Por tanto, conceptualmente la IBC se definiría como la presencia de MPP en secreciones respiratorias que causa una reacción inflamatoria anómala13. Esta definición implica documentar la coexistencia del aislamiento de MPP y la presencia asociada de un daño pulmonar. En la práctica este último aspecto no es fácil de demostrar, aunque se puede asumir en presencia de aislamientos repetidos de MPP y consecuencias clínicas derivadas de esta circunstancia. En este sentido, un documento de consenso español reciente define la IBC en el paciente estable como la identificación de tres o más cultivos positivos para el mismo MPP durante un año, separados al menos un mes entre sí6. Esta definición se basa en la evidencia procedente de estudios realizados en pacientes con bronquiectasias, donde se sugiere que las consecuencias clínicas de la IBC pueden diferir en casos que presentan un simple aislamiento frente a los que lo presentan de forma recurrente14,15. Algunos datos indirectos recientes sugieren que algo parecido podría suceder en la EPOC16,17. La tabla 1 recoge las principales definiciones vinculadas a la IBC.
Principales definiciones relacionadas con la infección bronquial crónica
| Microbiota pulmonar | Comunidad microbiana pulmonar, que consiste en una variedad de microorganismos que se encuentran en el tracto respiratorio inferior. |
| Primoinfección | Primer aislamiento de un determinado microorganismo potencialmente patógeno (MPP) en una muestra respiratoria, durante la fase estable de la enfermedad |
| Infección bronquial crónica | El crecimiento de un mismo MPP en al menos tres cultivos en un año, separados entre sí, al menos un mes. |
| Erradicación | Cuando no se aísla el MPP responsable de la IBC en al menos tres cultivos consecutivos durante un año, separados al menos un mes. |
Entre 30-50% de los pacientes con EPOC presentan a lo largo de su historia natural al menos un aislamiento de algún MPP (tabla 2)13,18,19. Sin embargo, se desconoce con precisión cuál es la prevalencia de la IBC. La proporción de cultivos positivos en paciente con EPOC estable varía dependiendo de la secreción respiratoria evaluada y los puntos de corte empleados. En estudios con cultivos positivos para MPP, el esputo ha identificado entre 38-74% de muestras positivas13. Con cepillado bronquial protegido el aislamiento de MPP es algo menor, entre 22-83%13. De forma parecida en el lavado broncoalveolar se han identificado entre 33-43% de MPP13. Uno de los microrganismos con más repercusión clínica, es Pseudomonas aeruginosa (PA). Distintos estudios transversales indican que este germen sería el responsable de 4-15% de todos los MPP capaces de inducir una IBC13,18.
Listado de microorganismos potencialmente patógenos en la EPOC
| Haemophilus influenzaeStreptococcus pneumoniaeMoraxella catarrhalisPseudomonas aeruginosaOtros bacilos gram-negativos no fermentadores:Achromobacter xylosoxidansAcinetobacter baumanniiAlcaligenes faecalisStenotrophomonas maltophiliaPseudomonassppKlebsiella pneumoniaeOtras enterobacteriasEscherichia coliKlebsiella aerogenesEnterobacter cloacaeSerratia marcescensProteus sppProvidencia sppCitrobacter sppStaphylococcus aureus, incluyendo meticilina-resistentesPasteurella multocida |
Los factores de riesgo más comúnmente identificados para la presencia de una IBC en pacientes con EPOC son el tabaquismo9–22, la peor función pulmonar21,22, las comorbilidades20, el incremento de agudizaciones previas y la presencia de bronquiectasias13,20,23,24. La presencia de un esputo purulento y un mayor grado de disnea, también son predictores clínicos de aislamiento de MPP en pacientes con EPOC estable20.
Para el caso concreto de la adquisición de PA, el uso de múltiples tandas de antibióticos o corticoides sistémicos, la enfermedad avanzada, las bronquiectasias, el tabaquismo activo o la estancia previa en la unidad de cuidados intensivos también han sido implicados como factores de riesgo10,13,18,19,25–28.
Consecuencias clínicas de la IBC en la EPOC estableLejos de ser una situación inocua, tanto el aislamiento de algunos MPP como la presencia de una IBC (aislamientos repetidos) en pacientes con EPOC (aun fuera de una fase de agudización) se han asociado a diferentes circunstancias negativas de la enfermedad como una mayor inflamación bronquial29, una mayor gravedad clínica30, peor calidad de vida relacionada con la salud31, mayor número y gravedad de las agudizaciones23, presencia de bronquiectasias24, mayor consumo de fármacos26, mayor número de eventos cardiovasculares17, e incluso mayor mortalidad28. Sin embargo, esta relación no se establece de forma constante ya que depende fundamentalmente del tipo de MPP del que se trate, siendo hasta el momento la infección por PA la mejor documentada10.
Pseudomonas aeruginosaPA es uno de los MPP más virulentos, por varias razones:1 forma biopelículas que impiden la acción de los antibióticos,2 frecuentemente desarrolla resistencia a los antimicrobianos,3 persiste en la mucosa bronquial y4 normalmente se asocia con un peor pronóstico en otras enfermedades inflamatorias crónicas de las vías respiratorias como la FQ o las bronquiectasias, lo que explica que las guías nacionales e internacionales de ambas enfermedades aconsejen un tratamiento precoz y contundente incluso tras la primera aparición (primoinfección) de PA en las muestras respiratorias ya que, una vez se establece la IBC, este microorganismo rara vez se consigue erradicar por un periodo prolongado de tiempo32.
Sin embargo, la relación entre el aislamiento de PA y un impacto negativo en pacientes con EPOC permanece más discutida. Así, Rosell et al., tras agrupar los resultados de seis estudios en los que se obtuvieron muestras microbiológicas mediante cepillo protegido, observaron que PA se asociaba a un mayor número y gravedad de agudizaciones, independientemente de la carga bacteriana18. Sin embargo, Murphy concluye, en un estudio prospectivo de 10 años, que solo la adquisición de una nueva cepa de PA (y no todos los cultivos positivos) se asociaba con una mayor incidencia de agudizaciones25. Más recientemente, Eklöf et al. realizaron un estudio epidemiológico en 22.053 individuos con EPOC, de los cuales 4,2% presentaba al menos un cultivo positivo para PA y encontraron que esta circunstancia predecía de una forma contundente un mayor riesgo de hospitalización33.
De la misma forma, con relación en la mortalidad no todos los estudios arrojan las mismas conclusiones. Jacobs et al. estudiaron prospectivamente a 181 personas con EPOC, 40% de las cuales presentaba aislamiento de PA. Tanto el primer aislamiento como los aislamientos múltiples de PA se relacionaron con una mayor mortalidad34. Estos datos fueron similares a los encontrados por Eklöf et al., en el estudio anteriormente descrito33. Por el contrario, Boutou et al. concluyeron que el aislamiento único de PA no está asociado con una mayor mortalidad en pacientes con EPOC35. Finalmente, Martinez-Garcia et al. observaron que un primer aislamiento de PA no se asociaba en pacientes con EPOC con un mayor riesgo ajustado de muerte tras 84 meses de seguimiento (HR 1,25, IC 95%: 0,79-1,97, p = 0,34), sin embargo este riesgo si fue significativo cuando la situación microbiológica era la de IBC (HR 3,06, IC 95%: 1,8-5,2, p = 0,001)28, por lo que la recomendación de tratamiento precoz, tal y como el consenso español de IBC en EPOC establece, se veía reforzado6.
Recientemente, un metaanálisis sobre el impacto del aislamiento de PA en pacientes con EPOC fuera de un proceso de agudización realizado con los datos de ocho estudios en 23,228 individuos concluyó que el riesgo ajustado de muerte fue doble en el grupo con EPOC en los que se aisló PA (HR 1,95, IC 95%, 1,34-2,84), tres veces mayor de padecer un nuevo ingreso precoz (HR 3,60, IC 95%, 3,60-12,03), y más de dos veces de muerte u hospitalización a los dos años del aislamiento (HR 2,80, IC 95%, 2,20-3,56)36. Ello ha hecho que la última actualización de la Guía GOLD (2023) ya incorpore que la IBC por PA se relaciona con una caída acelerada de la función pulmonar independientemente de la existencia de bronquiectasias3.
Uno de los debates más interesantes en este momento es si PA es un marcador de gravedad de la enfermedad o es causa de un mayor número o gravedad de agudizaciones, así como de un rápido deterioro en personas con EPOC. Aunque todavía no hay una respuesta clara a esta pregunta, Martínez-Solano et al. han proporcionado alguna evidencia que respalda la última hipótesis después de observar patrones de infección y desarrollo de PA en la EPOC que se asemejan a los encontrados en la FQ37. Una vez más, sin embargo, la falta de acuerdo sobre este tema se ilustra en otro estudio, realizado por Rakhimova et al., que mostró que la PA que se encuentra en la EPOC tiene una renovación frecuente de diferentes clones distintos de los que se encuentran en la FQ (que generalmente son portadores crónicos de la misma PA), siendo la forma mucoide la más frecuente38.
Una mejor comprensión de la influencia de la infección por PA en la morbilidad y mortalidad por EPOC en pacientes ambulatorios, y la experiencia adquirida en el tratamiento de las bronquiectasias y la FQ, ayudaría a implementar terapias específicas y nuevos procedimientos para la prevención, diagnóstico y tratamiento de la infección por PA en pacientes con EPOC.
Haemophilus influenzae (HI)En términos de prevalencia, HI es probablemente el MPP más frecuente en el microbioma pulmonar de pacientes con EPOC y el más aislado en muestras respiratorias de pacientes con EPOC estable, si bien sus consecuencias clínicas han sido menos estudiadas39. Se acepta que su aislamiento produce un efecto menos deletéreo que el de PA en individuos con EPOC, pero de igual forma, también produce un exceso en la inflamación local y un deterioro de las defensas locales frente a algunos MPP40, asociándose a una peor calidad de vida relacionada con la salud y una disminución de la función pulmonar41,42. En cuanto a su relación con otros MPP se ha observado que las infecciones virales previas predisponen a la vía aérea a la sobreinfección por HI43. Por otro lado, Jacobs et al. observaron que la infección por Streptococcus pneumoniae se asociaba a la infección por HI (OR 2,79; IC 95%: 2,03-3,73) pero dificultaba la infección por PA (OR, 0,15; IC 95%, 0,10-0,22)34. Dada su gran frecuencia, el estudio del impacto clínico de la IBC por HI es de gran importancia en pacientes con EPOC
Otros microorganismosOtros MPP cuyas consecuencias clínicas han sido menos estudiadas son: Moraxella catarrhalis (MC) que aunque se ha asociado también a una mayor inflamación local suele producir infecciones de corta duración por la rápida y eficaz acción del sistema inmune local19. Así, Jacobs et al. observaron una relación inversa entre la infección por MC y PA (OR, 0,51; IC 95%, 0,35-0,75)34. Por el contrario, Streptococcus pneumoniae presenta una cápsula polisacárica que reduce la efectividad de las defensas locales produciendo una prolongada infección que se ha relacionado con un mayor número de agudizaciones y neumonías19. Su cápsula polisacárida reduce la efectividad de los mecanismos de defensa del huésped facilitando la persistencia y colonización de la vía aérea, lo que lleva a más agudizaciones y neumonías19. Finalmente, Chlamydophila pneumoniae también se ha asociado (aunque existen controversias al respecto), a través de un incremento en la inflamación local, a una EPOC más grave, caída acelerada de la función pulmonar y mayor número de agudizaciones19.
¿Existe un fenotipo infeccioso de la EPOC?Es conocido que algunos individuos presentan cierta predisposición genética para una mayor susceptibilidad a las infecciones, o que aquellos pacientes con EPOC e infección bronquial presentan un mayor grado de inflamación bronquial tanto neutrofílica como eosinofílica, y que esta situación se asocia a situaciones clínicas adversas10.
Si bien no existe una definición globalmente aceptada de «fenotipo clínico», en términos prácticos se podría adoptar la propuesta de Han et al. publicada hace algo más de una década como aquel grupo de pacientes con EPOC con características clínicas, pronósticas o de respuesta al tratamiento propias44.
En este sentido, como ya ha sido comentado en el punto anterior, el aislamiento de algunos MPP en la mucosa bronquial de pacientes con EPOC aun fuera de un proceso de agudización, lleva consigo consecuencias clínicas (mayor gravedad clínica y número de agudizaciones), consecuencias pronósticas (mayor mortalidad) y un posible tratamiento específico (antiinflamatorio o antibiótico)10. Sin embargo, la evidencia científica para cada uno de estos tres puntos dista mucho de ser la adecuada, al menos en comparación con la existente en otras enfermedades inflamatorias crónicas de la vía aérea como las bronquiectasias o la FQ7,8, en las que, por ejemplo, el fenotipo clínico generado por una IBC por PA está claramente establecido.
Sin embargo, esta falta (por ahora) de evidencia científica no es evidencia de la no existencia de este fenotipo, sino de una falta de estudios al respecto, en especial en el paciente con EPOC sin bronquiectasias. De los tres aspectos que se han establecido como definitorios de fenotipo, quizá el más estudiado haya sido el impacto clínico de la IBC en el paciente con EPOC estable, menos estudiado ha sido el impacto pronóstico, y apenas, como se verá en el próximo punto, la respuesta y las posibilidades terapéuticas. Sin embargo, una pregunta aparece de forma repetida en aquellos clínicos que siguen a pacientes con EPOC: a pesar de una falta actual de evidencia (ni a favor ni en contra) ¿se debería tratar la presencia (sobre todo cuando es en forma de IBC) de MPP en un paciente con mala evolución al igual que se hace en un paciente con bronquiectasias?, ¿es lícito y lógico (mientras la evidencia científica llega) intentar la erradicación o disminución de la carga bacteriana en este paciente mediante un tratamiento antibiótico (preferente inhalado) o antiinflamatorio (macrólidos) prolongado?
Tratamientos actuales y futuros: Ventajas y desventajasCSILos CSI son fármacos ampliamente utilizados en la EPOC. Diversos estudios demuestran que, combinados con broncodilatadores de acción prolongada, los CSI reducen la frecuencia de agudizaciones, mejoran la calidad de vida relacionada con la salud e incluso podrían reducir la mortalidad, especialmente en pacientes con agudizaciones de repetición e inflamación eosinofílica45–47. Por todo ello, las principales GPC recomiendan su uso en pacientes de alto riesgo con repetidas agudizaciones, especialmente con recuento elevado de eosinófilos en sangre periférica (≥ 300 eosinófilos/mL)48,49. Este último biomarcador es relevante, ya que con recuentos bajos de eosinófilos (< 100 células/μL) el efecto de los CSI no existe o es bajo50. Entre los 100-300 eosinófilos/μL, la respuesta clínica comienza a ser favorable, aunque en estos casos se recomienda balancear los beneficios frente a los potenciales riesgos. Este último aspecto no es menor, puesto que el uso de CSI se asocia a alteraciones de la respuesta inmunitaria e incremento del riesgo de infección, entre los que se incluye la neumonía51,52 o la tuberculosis53,54, lo que plantea una cierta paradoja: los CSI reducen las agudizaciones de la EPOC (quizá por su potente efecto antiinflamatorio) y aumentan el riesgo de neumonía (quizá por su potente efecto inmunosupresor). Sin embargo, la agudización se considera actualmente un síndrome que incluye diferentes subtipos inflamatorios de agudización55–57, entre los que destaca un fenotipo eosinofílico, con mejor respuesta a los CSI, y otro fenotipo neutrofílico, donde el CSI podría incrementar el riesgo de infección, tanto aguda como crónica58.
Contoli et al.59, en un ensayo clínico donde se comparaban los efectos de la combinación salmeterol/ fluticasona (SFC) (50/500 μg cada 12 horas) frente a salmeterol (50 μg cada 12 horas) sobre la carga microbiana en pacientes con EPOC, observaron que el tratamiento durante un año de SFC a dosis altas modifico la composición microbiana del esputo y aumentó la carga bacteriana de MPP.
Por lo tanto, y dado ese conocido carácter inmunosupresor de los CSI que incrementa el riesgo de neumonía, ¿qué pautas se deberían establecer en aquellos pacientes con EPOC e IBC por MPP? Eklöf et al.60, han evaluado recientemente el impacto de los CSI sobre el aislamiento de PA en 21.408 pacientes ambulatorios con EPOC. El uso de los CSI se asoció con un incremento del riesgo de aislamiento para PA en cultivos de vía aérea inferior, con un marcado efecto dosis-respuesta, a mayor dosis, mayor riesgo. Resultados similares han sido observados en otro estudio español realizado sobre pacientes graves61. De los 358 pacientes evaluados, 173 (48,3%) presentaron al menos un cultivo positivo para PA. En ellos la dosis de CSI fue significativamente superior y la evolución clínica peor, con mayor número de agudizaciones y mayor mortalidad61.
Algo parecido sucede con el aislamiento de HI en la EPOC estable. Recientemente Mohsin et al.62, han observado un incremento de 56% en el riesgo de aislamiento de HI en muestras respiratorias (HR: 1,56, IC 95%: 1,29-1,89) de pacientes tratados con CSI. El riesgo también fue dosis-dependiente, con un incremento de 90% del riesgo para pacientes con dosis altas. El número de pacientes con uso de CSI para obtener una muestra positiva para HI fue de 60.
En líneas generales, estos resultados sugieren que el empleo de CSI no es inocuo y se debe tener precaución en su indicación, puesto que favorece la aparición tanto de infecciones agudas, como crónicas. Las guías recomiendan su uso en los agudizadores eosinofílicos o en aquellos casos con solapamiento entre asma y EPOC, siendo además aconsejable el empleo de dosis bajas. En el caso de agudizaciones repetidas con recuento de eosinófilos entre 100-300 células/μL se recomienda individualizar en función del riesgo48.
MacrólidosLos macrólidos (especialmente la azitromicina), administrados de forma prolongada y a dosis bajas han demostrado reducir de forma significativa el número de agudizaciones, en pacientes estables con EPOC y agudizaciones de repetición63–65. Un reciente metaanálisis señala que los macrólidos reducen 33% el riego de agudización comparado con placebo (HR: 0,67, IC 95%: 0,60-0,75)66. Aunque reducen ligeramente la carga bacteriana64,67,68 y modifican el microbioma69, probablemente su principal efecto es debido a que modulan la inflamación bronquial neutrofílica70. Este aspecto se insinuó hace años al observar efectos beneficiosos en infecciones macrólido-resistentes, como la infección por PA y porque las dosis empleadas se encuentran por debajo del umbral antibacteriano70. Las pautas utilizadas han sido: azitromicina (500 mg/día tres días por semana o 250 mg/día durante un año) o eritromicina (250 mg/12 horas durante un año). Sin embargo, la generalización de este tipo de tratamiento debe realizarse con cautela, especialmente por la aparición de resistencias a largo plazo (con especial mención a algunas micobacterias no tuberculosas) y un ligero aumento de problemas auditivos o prolongación del intervalo QTc en los pacientes tratados con azitromicina65. Para la guía española de la EPOC (GesEPOC), los candidatos serían los pacientes de alto riesgo, con al menos tres agudizaciones en el año previo, a pesar de un tratamiento inhalado adecuado5.
Antibioterapia inhaladaLos antibióticos inhalados (AI) han sido utilizados con éxito desde hace años en el tratamiento de la IBC en pacientes con bronquiectasias y FQ71,72. Su indicación más establecida es la de IBC por PA, dado que es el microorganismo que se ha mostrado más decisivo en ambas enfermedades, en relación con una mala evolución de la misma7,8,14. Sin embargo, actualmente también se utilizan para el tratamiento con intención erradicadora de la primoinfección por PA e incluso para el tratamiento de la IBC por otros MPP que provocan en el paciente un deterioro clínico evidente7. En la actualidad, el grado de evidencia científica sobre la efectividad de este tratamiento es mayor en FQ que en bronquiectasias8. En esta última enfermedad, los resultados en los ensayos clínicos realizados han resultado dispares si bien la experiencia clínica ha sido bastante uniforme hacia una efectividad manifiesta del mismo en las indicaciones establecidas por las diferentes guías nacionales e internacionales7,14. En la actualidad existen cuatro formulaciones de AI en el mercado, todas ellas con capacidad antipseudomónica (colistimetato de sodio, tobramicina, aztreonam y levofloxacino), si bien se están desarrollando otros como ciprofloxacino, ceftazidima e incluso dirigidos además a grampositivos como Staphylococcus aureus meticilina-resistente (SAMR), como la vancomicina73.
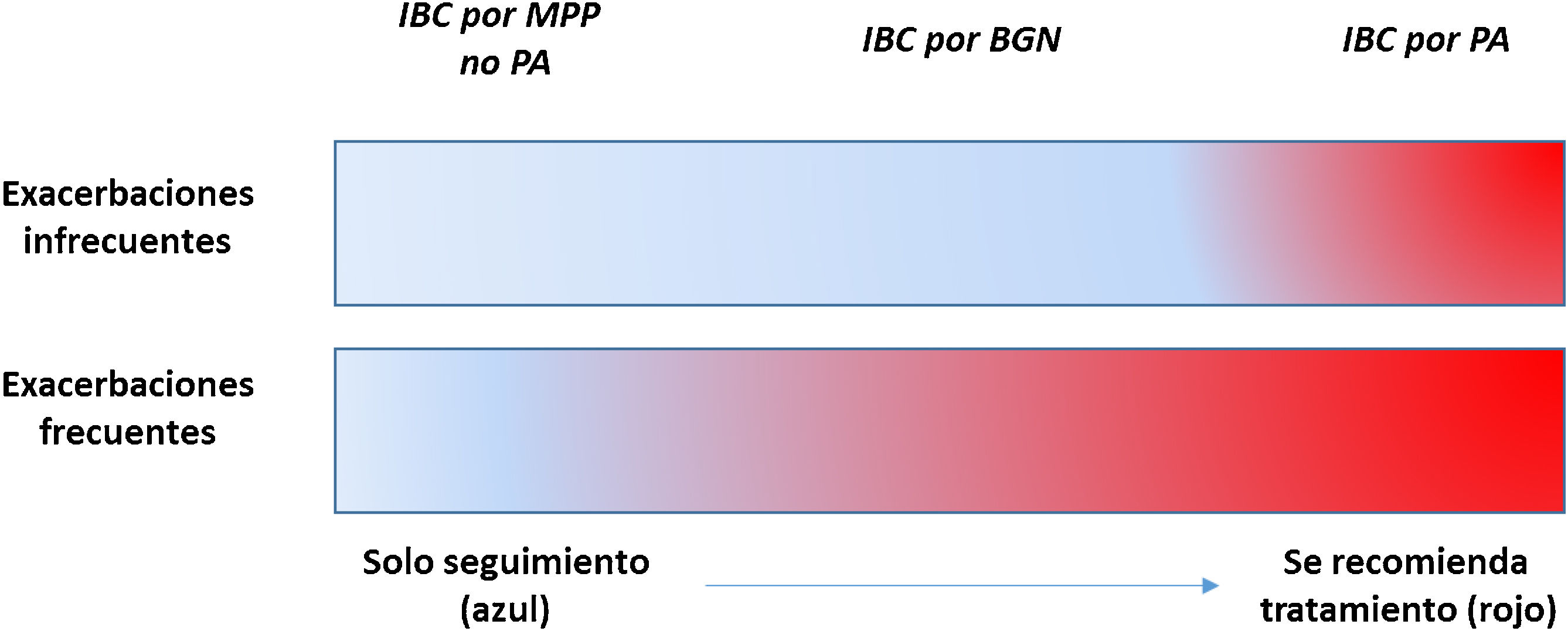
Ciertamente ante un paciente con EPOC e IBC por algún MPP, en especial PA, y que además presente bronquiectasias, la pauta a seguir (en lo que se refiere al tratamiento con AI) viene marcada claramente por las guías de bronquiectasias, que recomiendan el tratamiento de esta situación7,14. Sin embargo, ¿qué ocurre con un paciente con EPOC, sin bronquiectasias, pero con IBC por MPP (en especial PA)?74. Una reciente revisión sobre el tema muestra un gráfico de colores que, más allá de la evidencia científica existente, refuerza los aspectos lógicos de un posible tratamiento de estos pacientes basado en el tipo de MPP y el impacto del mismo (sobre todo incremento en el número de agudizaciones) que provoca en el paciente (fig. 1)75.
Aproximación al tratamiento de la IBC en pacientes con EPOC dependiendo del tipo de MPP y del número de agudizaciones
EPOC: enfermedad pulmonar obstructiva crónica; IBC: infección bronquial crónica; MPP: microorganismos potencialmente patógenos; BGN: bacilos gran negativos; PA: Pseudomona aeruginosa.
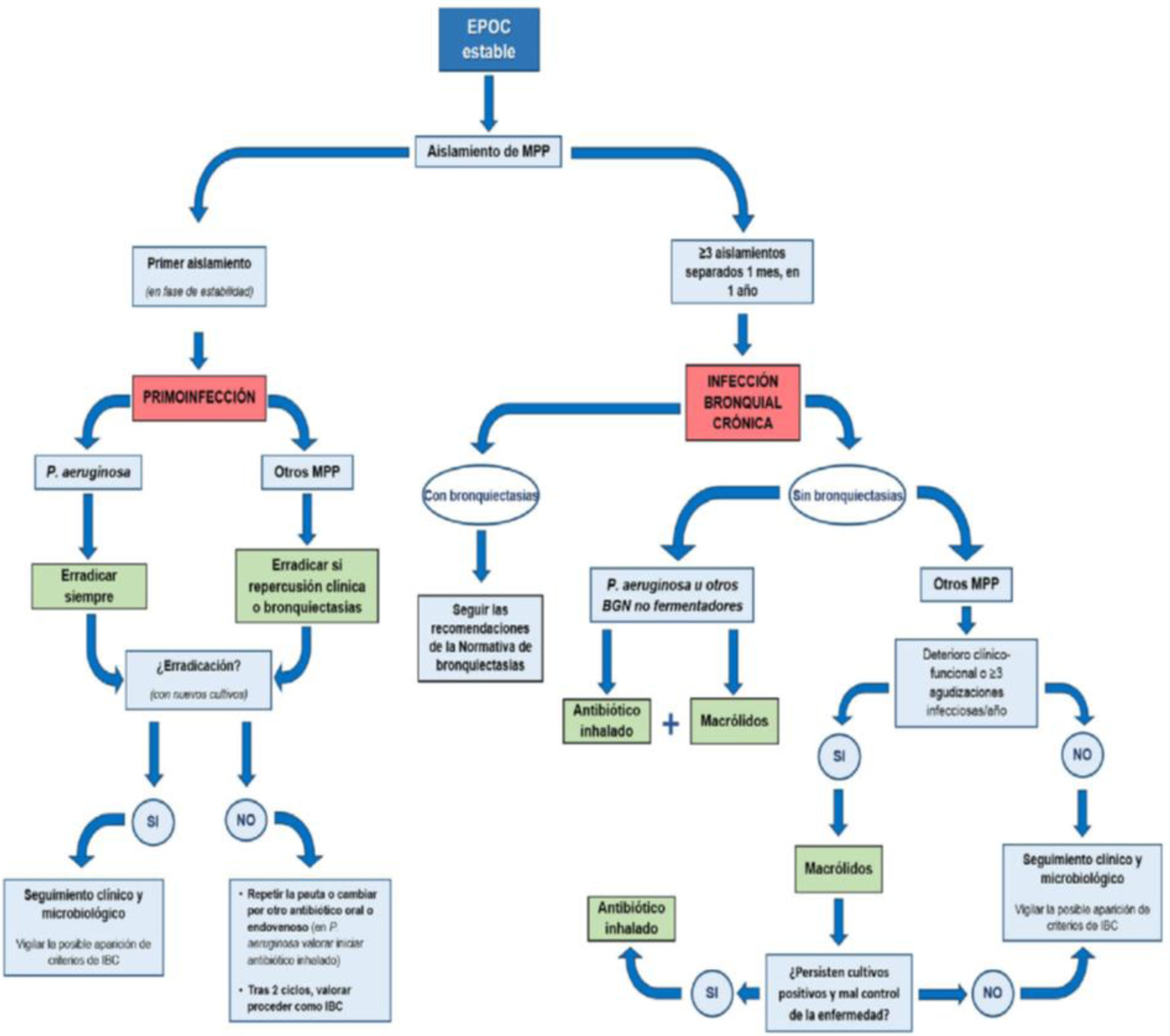
Teniendo en cuenta que los macrólidos no tienen efecto sobre la infección por PA (microorganismo más virulento) aunque sí sobre la inflamación que la misma provoca (fundamentalmente de perfil neutrofílico), quizá el tipo de paciente potencialmente más susceptible de tratamiento con AI sería el de una EPOC con IBC por PA y consecuencias clínicas (en especial un incremento en el número o gravedad de las agudizaciones)6,75. Si bien es cierto que la evidencia clínica es muy escasa, un estudio multicéntrico observacional del grupo español sobre 693 pacientes con EPOC que recibieron al menos una dosis de AI por cualquier indicación, concluyó que este tratamiento redujo en 33% el número de agudizaciones y en 26% el de hospitalizaciones tras un año de tratamiento (y se mantuvo durante los dos años de estudio). Un dato importante fue que la efectividad resultó ser similar en el subgrupo de pacientes sin bronquiectasias (29,3%). Finalmente, aunque el tratamiento con AI fue efectivo ante la presencia de una IBC por cualquier MPP, esta efectividad fue significativamente superior en el subgrupo de pacientes con IBC por PA (46,6%). El tratamiento resultó seguro ya que, si bien un cuarto de los pacientes presentó efectos adversos, la gran mayoría fueron transitorios y locales76. Estos datos hicieron que un reciente consenso publicado por la SEPAR recomendara, habida cuenta de las consecuencias negativas del aislamiento y sobre todo de la IBC por PA y bacilos gramnegativos no fermentadores aun en ausencia de bronquiectasias en pacientes con EPOC, el tratamiento con AI incluso con intención erradicadora como muestra el siguiente gráfico, así como el de la IBC por MPP no PA si producen un deterioro en el paciente, utilizando una combinación paralela o secuencial de macrólidos y AI dependiendo de la respuesta terapéutica según muestra el siguiente esquema6 (fig. 2).
Otros tratamientosLa presencia de IBC en la EPOC se asocia a otros fenotipos o subgrupos de pacientes como aquellos agudizadores o con un exceso de producción de secreciones bronquiales. Por ello, algunos tratamientos farmacológicos como los inhibidores de la fosfodiesterasa 4, los mucolíticos o el suero salino hipertónico podrían tener cabida en el arsenal terapéutico de estos pacientes en situaciones seleccionadas.
El suero salino hipertónico ha demostrado ser efectivo y seguro en la reducción de exacerbaciones en pacientes con bronquiectasias con o sin IBC7. De forma semejante, un reciente ensayo clínico concluyó que la inhalación de suero salino hipertónico es segura y superior a la de suero salino hipotónico produciendo una mayor mejoría sintomatológica, de la calidad de vida, y de la función pulmonar en pacientes con EPOC con bronquitis crónica con o sin bronquiectasias o IBC, en el subgrupo de pacientes con función mucociliar menos alterada. Aunque estos datos hacen sospechar que la efectividad será semejante en pacientes EPOC con IBC (habitualmente con un exceso de expectoración), son necesarios ensayos clínicos en este grupo especial de pacientes77.
Conclusiones y retos futurosParece evidente que el aislamiento de MPP en la mucosa bronquial de pacientes con EPOC no es una situación banal, al menos en ciertas ocasiones, si bien tradicionalmente se le ha prestado muy poca atención. La evidencia científica que va acumulándose indica un efecto deletéreo de la IBC en pacientes con EPOC y de una posible implicación de las bacterias incluso en la patogénesis de la enfermedad.
Se podría decir que los retos futuros son todos, porque poco se sabe de forma concluyente sobre el tema, pero quizá algunos de ellos son especialmente importantes como:
- 1.
La valoración del impacto de la presencia de IBC sobre el pronóstico vital
- 2.
Estudios enfocados en los MPP más frecuentes, en especial HI y Streptococcus pneumoniae.
- 3.
Ensayos clínicos sobre el efecto de los diferentes tratamientos (en especial macrólidos, AI o su combinación) sobre los desenlaces clínicos determinantes en pacientes con IBC y EPOC, como el número y gravedad de agudizaciones o la calidad de vida relacionada con la salud.
- 4.
Desarrollo, incremento de la aplicabilidad clínica y accesibilidad de las nuevas formas de estudio del microbioma pulmonar y de su modificación (disbiosis) por los tratamientos como los CSI.
PARI Pharma Iberia, S.L. no ha intervenido en ninguna de las fases de preparación, escritura, edición ni publicación del manuscrito.
Contribuciones de los autoresDiseño: MAMG y JJSC. Escritura del manuscrito: MAMG y JJSC. Todos los autores revisaron y aprobaron la version final del manuscrito.
Conflictos de interesesJJ Soler ha recibido becas y/o pagos por consultoría u otras actividades de Astra Zeneca, Bial, Boehringer, Chiesi y GlaxoSmithKline. Miguel Angel Martinez ha recibido becas y/o pagos por consultorías u otras actividades de Vitalaire, Zambon, TEVA, Astra Zeneca, PARI Pharma Ibera, Chiesi y Philips Healthcare. Miguel A Martinez-Garcia forma parte del Comité Editorial de Open Respiratory Archives y declara que se ha mantenido al margen del proceso de evaluación y toma de decisiones con relación en este artículo.